一个含氮配体铜配合物的合成、结构及荧光性质
2023-11-08范博文
关 磊, 范博文, 王 莹, 王 欣
(辽宁石油化工大学 石油化工学院,辽宁 抚顺 113001)
配合物是金属离子和配体通过配位键结合形成的化合物。因其可调的拓扑结构以及诸多的优异性质,在催化、荧光材料、单分子磁体、吸附和检测等领域具有潜在的应用前景,所以配合物的设计与合成已经成为研究者们关注的热点之一[1-7]。配合物结构分为单核、多核、一维、二维和三维等[8-10]。磺酸基配体通常被认为具有相对较弱的配位能力,很少被用来构筑配合物杂化材料。已经报道的磺酸基配合物大都是在含氮配体辅助下合成得到的,金属离子的选取主要集中在碱金属和碱土金属[11-13]。近十几年来,磺酸基配体逐渐受到研究者们的青睐,利用其结构特点设计和构筑功能配合物。被认为弱连接的磺酸基配体具有配位模式灵活、结构灵活多样、结构转变和化学键重排等优点[14-16]。此外,磺酸基团容易与氢供体形成氢键,构筑高维和稳定的超分子结构。选用的磺酸基配体往往需要其他官能团(胺基、羟基、羧基以及膦酸基)的辅助,它们之间协同配位的能力有助于增加与金属离子的配位点和配位方式,得到结构更复杂多样的目标配合物[17-20]。Z.M.SUN 等[20]在2,2′-联吡啶(2,2′-bipy)的辅助下,以5-磺基间苯二甲酸钠(NaH2sip)为配体,通过与Cd2+的水热反应合成了配合物[Cd3(sip)2(2,2′-bipy)4(H2O)2]·2H2O。该配合物具有层状结构,磺酸基-羧基配体为五齿配体,桥连三个Cd2+。磺酸基单齿配位一个Cd2+,两个羧基分别采用双齿的配位方式螯合两个Cd2+。
本文利用磺酸基-酚羟基有机化合物为配体,在4,4′-bipy含氮配体的辅助下,与Cu2+合成得到了配合物Cu0.5(4,4′-bipy)(H2O)·L·0.5(4,4′-bipy)·2H2O;利用X-射线单晶线衍、元素分析和红外光谱测试了其结构和组成,并且考察了其热稳定性和荧光发射性质。
1 实验部分
1.1 试剂与仪器
试剂:实验所用试剂均为分析纯,购买于百灵威科技有限公司,未经纯化及其他处理直接使用。
仪器:Smart Apex-ⅡCCD 单晶X-射线衍射仪、D8 ADVANCE 型X-射线衍射仪,德国Bruker 公司;2400 型元素分析仪,美国Perkin-Elmer 公司;Q600 型热重分析仪,美国TA 公司;100 型傅里叶转换红外光谱仪(KBr 压片,4 000~400 cm-1),美国Perkin-Elmer 公司;F-4500 型稳态/瞬态荧光光谱仪,日本Hitachi 公司。
1.2 合成方法
将24.2 mg(0.1 mmol)Cu(NO3)2·3H2O 和15.6 mg(0.1 mmol)4,4′-bipy 溶于10 mL 乙醇溶剂中,向溶液中加入19.5 mg(0.1 mmol)NaL,搅拌1 h 形成混合溶液。将其封装在15 mL 聚四氟乙烯内衬的反应釜中,120 ℃加热7 d,之后冷却至室温,得到蓝色块状单晶。元素分析,C21H23N3O7SCu0.5(质量分数,%):理论值C 51.14,H 4.70,N 8.52;实测值C 51.19,H 4.75,N 8.65。红外光谱(KBr 压片,cm-1):3 304(νO-H),1 619(νC=C),1 595(νC=C),1 485(νC=N),1 442(νC=N),1 400(νS=O),1 176(νS=O),1 095(νS=O),1 066(νS=O),1 019(νS=O),919(γC-H),857(γC-H),757(γC-H),657(δS-O),600(δS-O)[21]。
1.3 晶体测试
挑选尺寸和形状合适的化合物1 蓝色块状单晶。在单晶X-射线衍射仪上,123 K 条件下使用石墨单色化Mo-Kα射线收集化合物1 的单晶数据(ω扫描方式)。数据经过吸收校正后,采用直接法,SHELXT 2015 程序解析出化合物1 的结构,使用SHELXL 2015 程序全矩阵最小二乘法进行结构精修[22-23]。所有非氢原子均进行各向异性精修。表1 为化合物1的晶体学数据。表2 和表3 分别为化合物1 的键长和键角。表4 为化合物1 的氢键键长和键角。

表1 化合物1 的晶体学数据
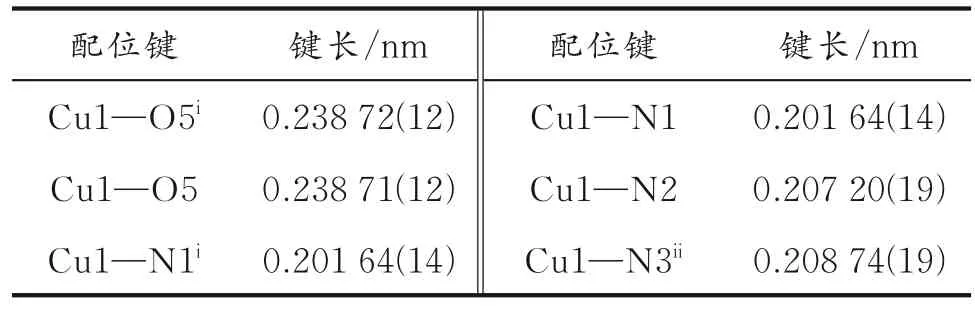
表2 化合物1 的键长

表3 化合物1 的键角
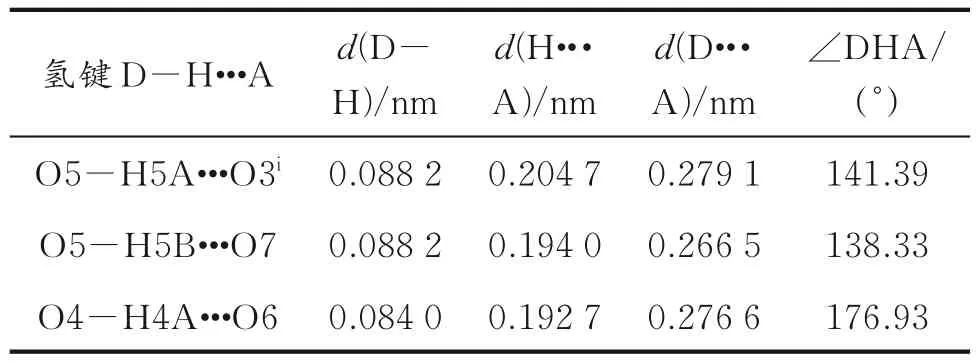
表4 化合物1 的氢键键长和键角
2 结果与讨论
2.1 晶体结构
化合物1 晶体结晶于单斜晶系,C2/c空间群(见表1),其分子结构如图1(a)所示,化学式为Cu0.5(4,4′-bipy)(H2O)·L·0.5(4,4′-bipy)·2H2O。一个非对称结构单元包含0.5 个Cu2+、一个配位的4,4′-bipy分子、一个配位的H2O 分子、一个游离的L-、0.5 个游离的4,4′-bipy 分子、两个游离的H2O 分子。每个Cu2+均为六配位,呈扭曲的八面体配位构型(见图1(b)),其六个配位点分别被四个4,4′-bipy 分子的氮原子(N1、N1i、N2 和N3)以及两个H2O 分子的氧原子(O5 和O5i)占据。Cu-O 键长分别为0.238 72(12) nm 和0.238 71(12) nm,Cu-N 键长为0.201 64(14)~0.208 74(19) nm(见表2)。N-Cu-N 和NCu-O 键角分别为89.79(4)°~180.00°和87.07(3)°~92.93(3)°(见表3)。文献[24-25]报道的Cu 配合物键长以及键角均与表2 的数值接近。L-配体没有与Cu2+配位,其磺酸基上的Na+解离,羟基是质子化的,显示-1 价,Cu2+的原子占有率为0.5,显示+1价。因此,化合物1 分子呈电中性。H2O 分子的氧原子采用单齿配位的方式与Cu2+配位。

图1 化合物1 的分子结构和Cu2+的配位构型
化合物1 中,4,4′-bipy 分子与Cu2+通过配位键形成Cu(4,4′-bipy)22+方格形二维的层状结构,与Cu2+配位的还有两个H2O 分子(见图2(a)),其氧原子(O5)与磺酸基、结晶水分子之间形成氢键,如O5-H5A···O3i和O5-H5B···O7;羟基氧原子(O4)与游离H2O 分子之间形成氢键,如O4-H4A···O6(见表4)。这些氢键增强了化合物1 中H2O 分子的热稳定性。
2.2 粉末衍射
通过X-射线衍射分析了化合物1 的纯度,结果见图3。从图3 可以看出,衍射峰的位置与单晶结构数据模拟的图形一致,表明产品是纯相的。
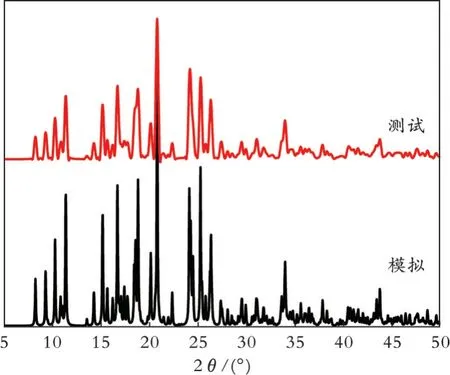
图3 配合物1 的模拟和测试粉末X-射线衍射
2.3 热重分析
在升温速率为10 ℃/min、N2气氛的条件下,测试了化合物1 在25~900 ℃的热重曲线,结果见图4。
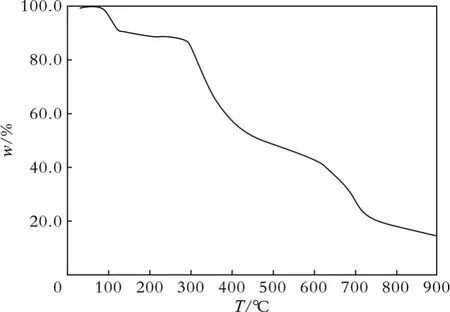
图4 化合物1 的热重曲线
从图4 可以看出,化合物1 在25~174 ℃存在一个失重台阶,失重率为10.89%,是分解一个配位和两个结晶H2O 分子造成的(理论值为10.95%)。化合物1 中的H2O 分子之间以及与配体羟基氧原子之间形成氢键(见表4),提高了H2O 分子的热稳定性,因此失去H2O 分子的温度高达174 ℃。从图4 还可以看出,在174~605 ℃存在第二个失重台阶,失重率为47.13%,对应失去一个配位的以及0.5 个自由的4,4′-bipy 分子(理论值为47.50%);当温度升至900 ℃时,剩余的L-配体仍有继续热分解的趋势,其最终热解的产物可能为CuO 和CuS 的混合物。
2.4 荧光性质
过渡金属离子固有的电子特性使其配合物具有特别的发光性质,因此需要测试过渡金属配合物的荧光发射光谱,进而研究其荧光发射性质。图5为室温条件下配体NaL以及化合物1 的荧光发射光谱。从图5 可以看出,配体NaL在306 nm 激发时,375 nm 处出现较强的荧光发射峰,其原因是配体内电荷的n-π*和π-π*跃迁[26];化合物1 在360 nm 激发时,409 nm 处出现类似的荧光发射峰,归因于配体内电荷的n-π*和π-π*跃迁;化合物1 的荧光发射峰红移了34 nm,其原因是金属与配体之间的电荷转移。
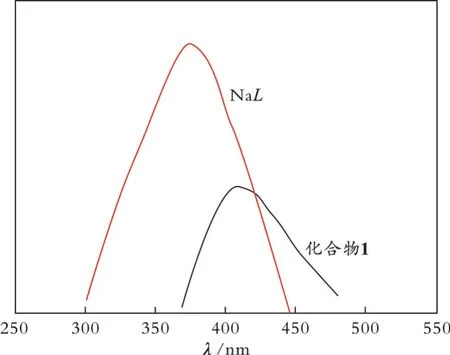
图5 室温条件下配体NaL 以及化合物1 的荧光发射光谱
3 结 论
利用水热法合成得到一个含氮配体的单核Cu配合物。中心金属Cu2+是六配位的,呈扭曲的八面体配位构型,L-配体平衡分子内的电荷。分子内存在两类氢键,将Cu(4,4′-bipy)22+方格与游离的结晶水和L-连接在一起,提高H2O 分子的稳定程度,使其失去H2O 分子的温度高于100 ℃。化合物1 的荧光发射峰在409 nm,其位置相比于配体NaL红移了34 nm,是金属与配体之间的电荷转移所致。
