血清CXCL9和SFRP1在AECOPD合并肺栓塞患者中的表达及对预后的影响
2023-11-08苏振磊杨万春韩天龙
苏振磊 杨万春 韩天龙
摘要:目的 探讨血清CXC趋化因子配体9(CXCL9)和分泌型卷曲相关蛋白1(SFRP1)在慢性阻塞性肺疾病急性加重期(AECOPD)合并肺栓塞(PE)患者中的表达水平及其对预后的预测价值。方法 56例AECOPD合并PE患者为病例组,并收集同期的80例单纯AECOPD患者为对照组。采用酶联免疫吸附试验检测各组血清CXCL9、SFRP1水平。采用Logistic回归模型分析AECOPD发生PE的影响因素,绘制受试者工作特征(ROC)曲线评估血清CXCL9、SFRP1对AECOPD患者PE的预测价值,采用COX比例风险回归模型分析血清CXCL9、SFRP1对不良预后的影响。结果 与对照组比较,病例组AECOPD病程较长,血清CXCL9、SFRP1水平升高(P<0.05)。较长AECOPD病程(OR=1.420,95%CI:1.246~1.620)和较高CXCL9(OR=1.835,95%CI:1.502~2.241)、SFRP1(OR=1.608,95%CI:1.351~1.914)水平是AECOPD患者发生PE的独立危险因素。血清CXCL9、SFRP1均可预测AECOPD患者PE发生风险,指标联合预测价值更大。血清CXCL9、SFRP1与PESI分级呈正相关(rs分别为0.752和0.716,P<0.05)。較高水平的血清CXCL9(HR=1.374,95%CI:1.184~1.595)以及SFRP1(HR=1.186,95%CI:1.329~1.542)是PE患者死亡的独立危险因素。结论 血清CXCL9、SFRP1异常升高是AECOPD患者发生PE的危险因素,并且与PE病情严重程度以及预后密切相关。
关键词:肺疾病,慢性阻塞性;急性病;肺栓塞;CXC趋化因子配体9;分泌型卷曲相关蛋白1
中图分类号:R563.5文献标志码:ADOI:10.11958/20221267
Expression of serum levels of CXCL9 and SFRP1 in patients with AECOPD complicated with pulmonary embolism and their influence on prognosis
SU Zhenlei, YANG Wanchun, HAN Tianlong
Department of Emergency, Red Star Hospital of the 13th Division of Xinjiang Production and
Construction Corps, Hami 839000, China
Abstract: Objective To explore expression levels of serum C-X-C chemokine ligand 9 (CXCL9) and secretory frizzled-associated protein 1 (SFRP1) in patients with acute exacerbation of chronic obstructive pulmonary disease (AECOPD) complicated with pulmonary embolism (PE) and their prognostic value. Methods Fifty-six AECOPD patients with PE were collected as the case group, and 80 patients with AECOPD in the same period were selected as the control group. The serum CXCL9 and SFRP1 levels were detected by enzyme-linked immunosorbent assay. Logistic regression model was used to analyze the influencing factors of PE in AECOPD patients, and the receiver operating characteristic (ROC) curve was drawn to evaluate the predictive value of serum CXCL9 and SFRP1 on PE in AECOPD patients. COX proportional risk regression model was used to analyze the influencing factors of serum CXCL9 and SFRP1 on poor prognosis. Results The course of AECOPD was longer in the case group than that in the control group, and the serum CXCL9 and SFRP1 levels were higher than those in the control group (P<0.05). Long AECOPD course (OR=1.420,95%CI:1.246-1.620), higher CXCL9 (OR=1.835,95%CI:1.502-2.241) and SFRP1 (OR=1.608,95%CI:1.351-1.914) were independent risk factors for PE in AECOPD patients. Serum levels of CXCL9 and SFRP1 can predict the risk of PE in AECOPD patients, and the predictive value of combination of two indicators was more better. Serum CXCL9 and SFRP1 levels were positively associated with PESI grade (rs=0.752, 0.716; P<0.05). Higher serum levels of CXCL9 (HR=1.374, 95%CI:1.184-1.595) and SFRP1 (HR=1.186,95%CI:1.329-1.542) were independent risk factors for death in AECOPD patients with PE. Conclusion The abnormal increased serum levels of CXCL9 and SFRP1 are risk factors for PE in AECOPD patients, which is closely related to the severity and prognosis of PE.
Key words: pulmonary disease, chronic obstructive; acute disease; pulmonary embolism; CXC chemokine ligand 9; secretory crimp-associated protein 1
肺栓塞(pulmonary embolism,PE)是内外源性栓子堵塞肺动脉分支所致,病死率高、预后差[1]。慢性阻塞性肺疾病急性加重期(acute exacerbation of chronic obstructive pulmonary disease,AECOPD)因全身炎症反应和(或)其他共存疾病极易并发PE[2-3]。炎症反应激活内皮凝固系统,从而诱发凝血功能障碍,这是血栓的重要形成机制[4]。CXC趋化因子配体9(C-X-C chemokine ligand 9,CXCL9)主要由内皮细胞、单核细胞等分泌,与趋化因子受体CXCR3特异性结合后可趋化巨噬细胞、淋巴细胞等聚集到炎症部位,从而诱发并加剧炎症反应[5]。研究认为,CXCL9通过介导炎症反应促进了慢性阻塞性肺疾病(COPD)[6]、类风湿性关节炎[7]等疾病的发生、发展。分泌型卷曲相关蛋白1(secretory frizzled-associated protein 1,SFRP1)是一种炎症因子,可以激活ERK信号通路进而上调基质金属蛋白酶(matrix metalloproteinase,MMP)1和MMP9表达,加速肺泡上皮的炎症反应,加重COPD呼吸道症状[8]。另有研究显示,SFRP1通过抑制Wnt3a蛋白表达,从而介导了牙周炎发病[9]。然而,有关CXCL9、SFRP1与AECOPD合并PE的关系研究鲜见。本研究就此进行探讨,旨在为临床制定改善预后的诊疗方案提供参考。
1 对象与方法
1.1 研究对象 选取2016年1月—2018年12月于新疆生产建设兵团第十三师红星医院呼吸科收治的AECOPD合并PE患者(病例组)56例。AECOPD符合《慢性阻塞性肺疾病诊治指南(2013年修订版)》诊断标准;PE符合《急性肺栓塞诊断与治疗中国专家共识(2015)》诊断标准。同期随机抽取于我院就诊的单纯AECOPD患者80例为对照组。纳入标准:所有患者均接受CXCL9、SFRP1检测;临床资料完整,且所有患者均有随访结局。排除标准:纳入研究前3个月内接受过免疫抑制剂、抗凝等药物治疗者,因心力衰竭或心房颤动住院者;孕产妇及哺乳期;心脏功能不全及肝、肾功能障碍者;急慢性炎症性疾病及自身免疫性疾病者;合并支氣管哮喘、间质性肺疾病、原发性支气管扩张性疾病等胸肺部疾病者;膝关节置换术或者髋关节置换术、严重创伤者;既往有静脉血栓栓塞症病史者;恶性肿瘤及精神疾病患者;合并其他可能影响本研究结果的疾病患者。本研究符合《赫尔辛基宣言》,研究对象或家属在知情同意书上签字。
1.2 PE严重程度分级 采用肺栓塞严重指数(pulmonary embolism severity index,PESI)[10]评分对病例组患者PE病情严重程度进行分级。1级:评分≤65分;2级:评分66~85分;3级:86~105分;4级:106~125分;5级:≥126分。其中1级18例,2级13例,3级10例,4级9例,5级6例。
1.3 酶联免疫吸附试验检测血清CXCL9、SFRP1水平 收集2组患者入院时空腹肘静脉血5 mL,室温下静置2 h后以3 500 r/min离心15 min,离心半径12 cm,留取血清保存在-80 ℃冰箱中。参照试剂盒和仪器操作说明书检测血清CXCL9、SFRP1,试剂盒购自武汉博士德生物工程有限公司。
1.4 随访 对所有病例组患者出院后定期进行随访3年,采用电话或者门诊的方式,第1年每3个月随访1次,第2年每6个月随访1次,第3年随访1次。随访终点为患者死亡或者随访截止日期为2021年12月30日。
1.5 统计学方法 采用SAS 9.4软件进行数据分析。符合正态分布的定量资料以x±s表示,2组间比较用t检验,多组间比较用单因素方差分析,组间多重比较用Dunnett-t检验。非正态分布以中位数与四分位数M(P25,P75)表示,组间比较用Mann-Whitney U检验。计数资料以例或例(%)表示,组间比较采用χ2检验。影响因素分析用Logistic回归,预后分析用Cox比例风险回归模型,预测预后的价值通过绘制受试者工作特征(ROC)曲线,相关性采用Spearman秩相关。P<0.05为差异有统计学意义。
2 结果
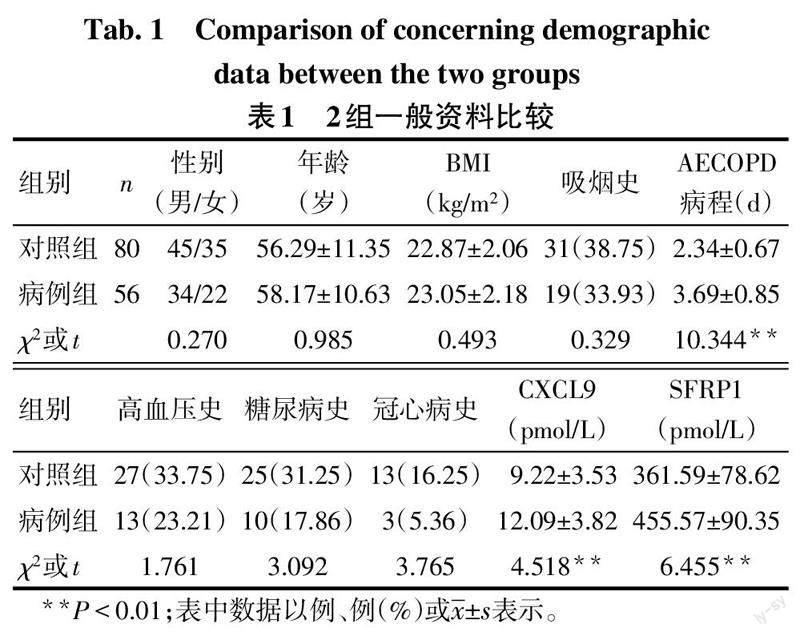
2.1 2组一般资料比较 2组性别、年龄、体质量指数(BMI)、吸烟史(每天吸烟>1支,连续吸烟≥1年)及基础疾病史等比较,差异无统计学意义。与对照组比较,病例组AECOPD病程较长,血清CXCL9、SFRP1水平升高(P<0.05),见表1。
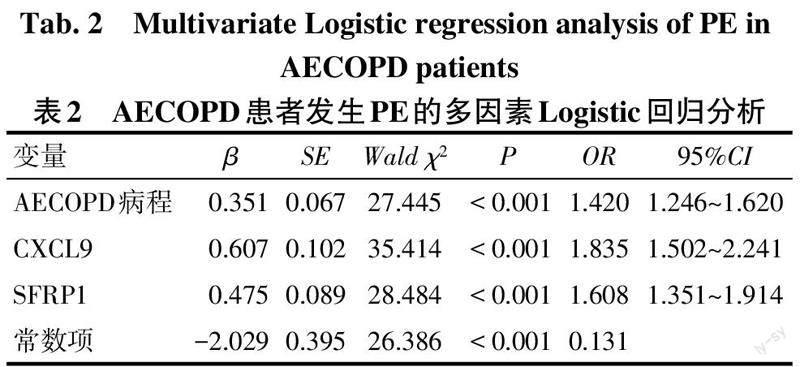
2.2 AECOPD患者发生PE影响因素分析 以AECOPD患者是否发生PE为因变量(发生=1,不发生=0),AECOPD病程、CXCL9、SFRP1水平为自变量,多因素Logistic回归分析显示,较长AECOPD病程、较高CXCL9和SFRP1水平是AECOPD患者发生PE的独立危险因素,见表2。
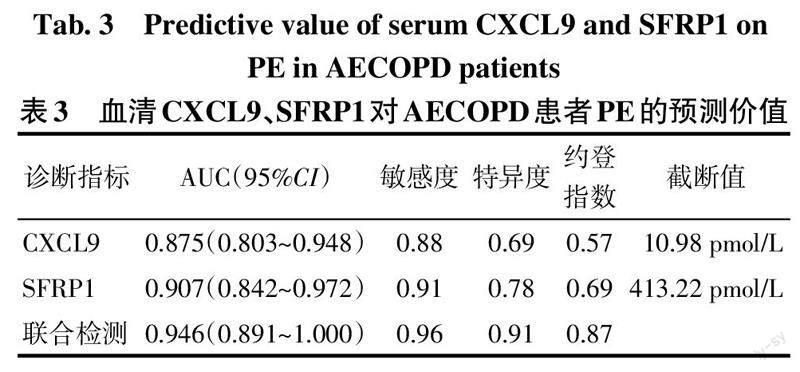
2.3 血清CXCL9、SFRP1对AECOPD患者PE的预测价值 CXCL9、SFRP1联合检测方程为logit(Y)=-2.029+0.351×(AECOPD病程)+0.607×(CXCL9)+0.475×(SFRP1)。联合检测的诊断效能优于各单独指标,见表3、图1。
2.4 不同PE分级患者血清CXCL9、SFRP1水平比较 随着PESI分级升高,CXCL9、SFRP1水平呈依次升高趋势(P<0.05),见表4。血清CXCL9、SFRP1与PESI分级呈正相关性(rs分别为0.752和0.716,P<0.05)。
2.5 血清CXCL9、SFRP1对PE患者预后的影响 AECOPD合并PE患者出院后均定期完成随访,随访时间1~3年,平均随访时间(2.05±0.76)年,出院后第1、2、3年,PE患者病死率分别为5.36%(3/56)、14.29%(8/56)、26.79%(15/56)。以3年内患者是否死亡为因变量(死亡=1,未死亡=0),单因素分析显示,AECOPD病程、血清CXCL9及SFRP1是AECOPD合并PE患者死亡的影响因素;多因素Cox回归分析显示,较高水平的血清CXCL9、SFRP1是PE患者死亡的独立危险因素(P<0.05),见表5、6。
3 讨论
COPD是PE的独立危险因素,与非COPD患者相比,COPD患者PE发生风险增加4倍,AECOPD是COPD病情加重后的结果,AECOPD患者PE发生率远高于COPD患者[11]。AECOPD患者PE发生率3.3%~29.1%[3]。在我国,COPD患病率约为8.6%,20岁以上成年人中COPD患者近1億人[12]。由此可见,罹患PE的AECOPD人群基数庞大。PE治疗不及时可致30%的AECOPD患者死亡,而经充分治疗后病死率可下降至2%~8%[13]。由于AECOPD合并PE发生率和病死率增加,提前预测AECOPD患者PE发生风险并及时干预,可以减少PE发生率,对于已经合并PE的患者,早期预测患者死亡风险,对采取有效措施降低病死率至关重要。研究表明,内皮损伤、高凝状态以及血液淤滞是血栓栓塞的重要因素,而炎症反应可以通过多种途径损伤内皮功能,引发机体高凝状态[14]。由此推测,炎症反应与PE密切相关。
CXCL9是在干扰素-γ诱导下由单核细胞、内皮细胞等分泌的趋化因子,基因位于人第4号染色体上,与其受体CXCR3,通过G蛋白耦联结合后,可将单核/巨噬细胞趋化募集到炎症部位,同时活化炎症细胞释放促炎因子诱发炎症反应[15]。在类风湿性关节炎发病过程中,CXCL9与CXCR3结合后趋化Th1细胞向滑膜液迁移可致滑膜炎,同时聚集单核细胞和T细胞加重炎症反应[16]。CXCL9与炎性细胞因子构成炎症调控网络,通过与肿瘤坏死因子-α协同作用增强炎症反应而加重COPD,是反映COPD病情严重程度的标志物[6]。本研究中,AECOPD合并PE患者血清CXCL9水平高于单纯AECOPD患者,较高水平CXCL9是PE的独立危险因素,考虑可能原因为AECOPD患者存在明显的全身炎症反应,机体的多种促炎因子会刺激单核细胞及巨噬细胞不断释放CXCL9,而CXCL9不断募集并激活促炎细胞释放炎性因子加重全身炎症反应,并通过上调内皮细胞表面组织因子表达而激活凝血途径,导致PE。
SFRP1是分泌型糖蛋白,在结构上与Wnt信号通路的特异性受体卷曲蛋白有同源的半胱氨酸富含区域,因此,其是Wnt的拮抗剂。SFRP1通过竞争性结合细胞膜上的FZD并形成无活性的复合物,可以抑制Wnt信号通路传导,而Wnt信号通路通过阻止白细胞活化以及细胞因子生存,可以抑制炎症反应[17-18]。研究显示,SFRP1在肺组织周围间质中以及远端上皮表达上调,敲除SFRP1基因后,可以减少小鼠肺组织中肺间质并扩张肺泡管[19]。SFRP1还可通过抑制E-钙黏素的表达促进气道上皮-间质转化,加速气道重塑而加重COPD气流受限[8]。本研究结果亦显示,合并PE的AECOPD患者血清SFRP1表达明显上调,较高水平SFRP1是PE的独立危险因素,其机制可总结为以下两点:(1)SFRP1激活ERK信号通路后促进MMP1和MMP9表达上调,加速肺泡上皮炎症损伤,炎症反应加重会促进促炎因子大量释放,形成炎症级联反应,进而损伤血管内皮细胞致血管栓塞,同时引起血管高凝状态。(2)SFRP1抑制Wnt信号通路传导,加速气道重塑而加重AECOPD病情,而AECOPD本身就是PE发生的危险因素。另外,本研究中ROC曲线结果显示,血清CXCL9和SFRP1均可预测AECOPD患者PE发生风险,但敏感度和特异度相对较低,说明分别采用2种标志物辅助临床预测PE发生风险可能出现漏诊和误诊,影响临床诊疗决策,两指标联合可以提高对PE发生风险的预测价值,尤其是敏感度,而血清CXCL9和SFRP1与PE病情严重程度亦呈正相关,提示血清CXCL9和SFRP1可作为判断PE病情严重性的重要指标。PE患者病死率较高,如能找到患者死亡的影响因素并提前干预,可以有效降低病死率,改善患者预后。本研究发现,较高水平的CXCL9、SFRP1是PE患者死亡的独立风险因素,再次证实患者入院后及时检测上述指标,不仅可以评估PE病情严重性,还可预测患者死亡风险。
综上所述,血清CXCL9和SFRP1表达上调参与了AECOPD患者PE发病过程,并且与PE病情严重性密切相关。早期检测不仅可以预测AECOPD患者PE发生风险,还可判断病情严重性和预测患者死亡风险,但本研究为单中心回顾性研究,样本量相对较少,还需开展多中心、前瞻性队列研究进一步验证。
参考文献
[1] ESSIEN E O,RALI P,MATHAI S C. Pulmonary embolism[J]. Med Clin North Am,2019,103(3):549-564. doi:10.1016/j.mcna.2018.12.013.
[2] YANG R,LIU G,DENG C. Pulmonary embolism with chronic obstructive pulmonary disease[J]. Chronic Dis Transl Med,2021,7(3):149-156. doi:10.1016/j.cdtm.2021.04.001.
[3] POURMAND A,ROBINSON H,MAZER-AMIRSHAHI M,et al. Pulmonary embolism among patients with acute exacerbation of chronic obstructive pulmonary disease:implications for emergency medicine[J]. J Emerg Med,2018,55(3):339-346. doi:10.1016/j.jemermed.2018.05.026.
[4] BOYUK F. The role of the multi-inflammatory index as a novel inflammation-related index in the differential diagnosis of massive and non-massive pulmonary embolism[J]. Int J Clin Pract,2021,75(12):e14966. doi:10.1111/ijcp.14966.
[5] VASSILAKOPOULOS T P,LEVIDOU G,MILIONIS V,et al. Thioredoxin-1, chemokine (C-X-C motif) ligand-9 and interferon-γ expression in the neoplastic cells and macrophages of Hodgkin lymphoma:clinicopathologic correlations and potential prognostic implications[J]. Leuk Lymphoma,2017,58(9):1-13. doi:10.1080/10428194.2017.1289520.
[6] 杨罡,赵峻,张云辉. CXC型趋化因子及其受体轴在慢性阻塞性肺疾病中的研究进展[J]. 中国呼吸与危重监护杂志,2021,20(10):748-752. YANG G,ZHAO J,ZHANG Y H. Advances in the study of CXC-type chemokines and their receptor axis in chronic obstructive pulmonary disease[J]. Chinese Journal of Respiratory and Critical Care Medicine,2021,20(10):748-752. doi:10.7507/1671-6205.202102043.
[7] 钟华,徐丽玲,白明欣,等. 类风湿关节炎患者趋化因子CXCL9和CXCL10在骨侵蚀中的作用[J]. 北京大学学报(医学版),2021,53(6):1026-1031. ZHON H,XU L L,BAI M X,et al. Role of chemokines CXCL9 and CXCL10 in bone erosion in patients with rheumatoid arthritis[J]. Journal of Peking University (Health Sciences),2021,53(6):1026-1031. doi:10.19723/j.issn.1671-167X.2021.06.003.
[8] 韓香,吴魏芹,赵红梅. 血清SFRP1水平与慢性阻塞性肺疾病急性加重期患者炎症反应及肺功能的关系[J]. 河北医学,2021,27(8):1304-1308. HAN X,WU W Q,ZHAO H M. Relationship between serum SFRP1 levels and inflammatory response and lung function in patients with acute exacerbation of chronic obstructive pulmonary disease[J]. Hebei Medicine,2021,27(8):1304-1308.
[9] 赵芳,黄婷,李娟. Wnt3a、SFRP1、NLRP3及IL-1β联合检测对慢性牙周炎感染的诊断价值分析[J]. 实验与检验医学,2019,37(2):273-275. ZHAO F,HUANG T,LI J. Diagnostic value of combined Wnt3a, SFRP1, NLRP3 and IL-1β assay for chronic periodontitis infection[J]. Experimental and Laboratory Medicine,2019,37(2):273-275. doi:10.3969/j.issn.1674-1129.2019.02.035.
[10] SANDAL A,KORKMAZ E T,AKSU F,et al. Performance of pulmonary embolism severity index in predicting long-term mortality after acute pulmonary embolism[J]. Anatol J Cardiol, 2021,25(8):544-554. doi:10.5152/AnatolJCardiol.2021.
[11] 何建国,黄丽. 肺动脉高压靶向药物治疗进展[J]. 中国循环杂志,2017,32(12):1145-1148. HE J G,HUANG L. Advances in targeted drug therapy for pulmonary arterial hypertension[J]. Chinese Circulation Journal,2017,32(12):1145-1148. doi:10.3969/j.issn.1000-3614.2017.12.001.
[12] 李娜,朱宏霞,朱丹,等. 血清鸢尾素和热休克蛋白27及D-二聚体水平对慢性阻塞性肺疾病急性加重期合并肺栓塞的鉴别价值及其与预后的关系探讨[J]. 临床急诊杂志,2022,23(5):337-342,347. LI N,ZHU H X,ZHU D,et al. The differential value of serum irisin and heat shock protein 27 and D-dimer levels in the acute exacerbation of chronic obstructive pulmonary disease combined with pulmonary embolism and its relationship with prognosis[J]. Journal of Clinical Emergency,2022,23(5):337-342,347. doi:10.13201/j.issn.1009-5918.2022.05.008.
[13] 陈保安,黄慧,马景耀,等. 慢性阻塞性肺疾病合并肺栓塞的研究进展[J]. 海南醫学,2019,30(16):2146-2150. CHEN B A,HUANG H,MA J Y,et al. Progress in the study of pulmonary embolism in combination with chronic obstruction pulmonary disease[J]. Hainan Medicine,2019,30(16):2146-2150. doi:10.3969/j.issn.1003-6350.2019.16.032.
[14] FU X,ZHONG Y,XU W,et al. The prevalence and clinical features of pulmonary embolism in patients with AE-COPD:A meta-analysis and systematic review[J]. PLoS One,2021,16(9):e0256480. doi:10.1371/journal.pone.0256480.
[15] KOPER O M,KAMINSKA J,SAWICKI K,et al. CXCL9, CXCL10, CXCL11, and their receptor (CXCR3) in neuroinflammation and neurodegeneration[J]. Adv Clin Exp Med,2018,27(6):849-856. doi:10.17219/acem/68846.
[16] YU X,SONG Z,RAO L,et al. Synergistic induction of CCL5, CXCL9 and CXCL10 by IFN-γ and NLRs ligands on human fibroblast-like synoviocytes-A potential immunopathological mechanism for joint inflammation in rheumatoid arthritis[J]. Int Immunopharmacol,2020,82:106356. doi:10.1016/j.intimp.2020.106356.
[17] 张辉,吴秋歌,伍冬冬,等. 慢性阻塞性肺疾病急性加重期患者血清SFRP1水平的变化[J]. 郑州大学学报(医学版),2020,55(6):835-839. ZHANG H,WU Q G,WU D D,et al. Changes in serum SFRP1 levels in patients with acute exacerbation of chronic obstructive pulmonary disease[J]. Journal of Zhengzhou University(Medical Sciences),2020,55(6):835-839. doi:10.13705/j.issn.1671-6825.2019.12.165.
[18] 马峰,朱文丽. 稳定期慢性阻塞性肺疾病患者血清血管黏附蛋白-1、分泌型卷曲相关蛋白1水平与气流受限和生活质量的相关性[J]. 中国临床保健杂志,2019,22(1):32-36. MA F,ZHU W L. Correlation of serum vascular adhesion protein-1 and secretory coiled-coil-associated protein-1 levels with airflow limitation and quality of life in patients with stable chronic obstructive pulmonary disease[J]. Chinese Journal of Clinical healthcare,2019,22(1):32-36. doi:10.3969/j.issn.1672-6790.2019.01.010.
[19] BARTAK B K,KALMAR A,PETERFIA B,et al. Colorectal adenoma and cancer detection based on altered methylation pattern of SFRP1,SFRP2,SDC2,and PRIMA1 in plasma samples[J]. Epigenetics,2017,12(9):751-763. doi:10.1080/15592294.
(2022-08-15收稿 2022-12-03修回)
(本文编辑 陆荣展)
