丙泊酚麻醉损伤工作记忆编码海马-前额叶皮质网络信息传递的研究
2023-11-08郭东勇李宝玲白文文刘迢迢徐新宇
郭东勇 李宝玲 白文文 刘迢迢 徐新宇


摘要:目的 研究丙泊酚麻醉是否損伤大鼠工作记忆编码阶段海马到前额叶皮质神经通路的信息传递。方法 12只大鼠中选取可用于研究分析的6只SD大鼠(3月龄),将16通道微电极阵列分别植入大鼠腹侧海马(vHPC)和内侧前额叶皮质(mPFC)。使用Cerebus信息采集系统记录每只大鼠在接受150 mg/kg丙泊酚麻醉前,麻醉后12、24 h执行工作记忆编码阶段任务时,其mPFC和vHPC这两个责任脑区的多通道局部场电位(LFPs)信号,建立vHPC-mFPC网络,分别计算vHPC和mPFC网络的定向传递函数(DTF)和vHPC-mPFC神经通路信息流,定量表征大鼠麻醉前后vHPC-mPFC神经通路信息传递。结果 麻醉后12 h大鼠vHPC和mPFC的平均网络连接强度及vHPC-mPFC信息流均低于麻醉前,而麻醉后24 h vHPC和mPFC的平均网络连接强度及vHPC-mPFC信息流较麻醉前差异均无统计学意义。结论 丙泊酚麻醉短暂损伤工作记忆编码vHPC和mPFC网络连接强度和vHPC-mPFC信息传递。
关键词:二异丙酚;海马;大脑皮质;额叶;脑电描记术;工作记忆编码
中图分类号:R318文献标志码:ADOI:10.11958/20230307
A study of information transmission in HPC-PFC network during working memory encoding
induced by propofol anesthesia
GUO Dongyong LI Baoling BAI WenwenLIU TiaotiaoXU Xinyu
1 Department of Anesthesiology, Tianjin Medical University Cancer Institute and Hospital, Tianjin 300060, China;
2 School of Biomedical Engineering and Technology, Tianjin Medical University
Corresponding Author E-mail: xuxinyu@tmu.edu.cn
Abstract: Objective To figure out whether propofol anesthesia impairs information transmission from hippocampal to prefrontal cortex (HPC-PFC) neural pathways during the coding phase of working memory in rats. Methods Among 12 rats, 6 SD rats (3 months old) were selected for research analysis, and 16-channel microelectrode arrays were implanted into the medial prefrontal cortex (mPFC) and the ventral hippocampus (vHPC) of rats, respectively. The Cerebus information acquisition system was used to record the working memory coding stage tasks of each rat before and 12 and 24 hours after anesthesia with 150 mg/kg propofol. The multichannel local field potential (LFPs) signals of mPFC and vHPC, two responsible brain regions, were used to establish the vHPC-mFPC network. The directional transfer function (DTF) and the information flow of vHPC-mPFC neural pathway in vHPC and mPFC networks were calculated respectively, and the information transmission of vHPC-mPFC neural pathway before and after anesthesia was quantitatively characterized. Results During working memory encoding, information flow from vHPC to mPFC was significantly reduced 12 h after propofol anesthesia comparison with before propofol anesthesia, but it recovered at 24 h after propofol injection. There were no significant differences in the average vHPC and mPFC network connection strength and vHPC-mPFC information flow of rats between before anesthesia and 24 h after anesthesia. Conclusion These results indicated that working memory impairment induced by propofol may result from disrupting information transmission in vHPC-mPFC network during working memory encoding.
Key words: propofol; hippocampus; cerebral cortex; frontal lobe; electroencephalography; working memory encoding
工作记忆是暂时维持和存储信息的有限系统,是高级认知的基础[1]。工作记忆通常分为3个阶段:编码、存储和提取。编码阶段是工作记忆最初的信息处理步骤[2],对工作记忆存储和提取起着决定性作用。最新神经科学已证实,腹侧海马(ventral hippocampus,vHPC)和内侧前额叶皮质(medial prefrontal cortex,mPFC)是工作记忆编码的责任脑区[3-4],vHPC-mPFC神经通路是工作记忆编码的责任神经通路[5]。丙泊酚是临床常用的麻醉剂[6]。研究发现丙泊酚麻醉会造成工作记忆损伤[7],但其机制仍不清楚。现有研究表明,丙泊酚能抑制海马和前额叶皮质神经元的活动,影响神经元的突触可塑性[8]。本研究旨在探讨丙泊酚麻醉是否损伤大鼠工作记忆编码阶段海马到前额叶皮质神经通路的信息传递。
1 材料与方法
1.1 材料
1.1.1 实验动物 清洁级健康雄性3月龄SD大鼠12只,体质量300~350 g,购自中国军事医学科学院实验动物中心,动物生产许可证号:SCXK-(军)2007-004。由天津医科大学动物实验中心饲养,饲养环境为:温度(24±2)℃、湿度50%±5%,12 h昼夜交替光照,自由饮水摄食。大鼠在电极植入手术前分笼饲养(每笼2~3只),手术后单笼饲养,以防电极被损坏。本研究涉及的所有动物实验均符合实验动物的伦理学要求,通过天津医科大学动物伦理委员会核准(批准号:TJYKDX2022031)。
1.1.2 主要试剂与仪器 丙泊酚(Fresenius Kabi Austria GmbH);仿生型自凝牙托粉和牙托水(上海张江生物材料公司);多聚甲醛(美国Sigma公司)。erebus-128神经信号采集系统(美国Cyberkinetics公司);16通道微型Headstage(美国Cyberkinetics公司);ALPHA-1501冷光源(上海精密仪器仪表有限公司);Lab StandardTM手术立体定位仪(美国Stoelting公司);YZ20P5手术显微镜(上海光学仪器进出口有限公司);MH145电动颅骨钻(美国Stoelting公司);B0172气动式电极植入设备(美国Cyberkinetics公司);PF5-1油压式微电极推进器(日本Narishge Scientific公司);Vibratome 3000振动切片机(美国Vibratome 公司);IX71光学显微镜(日本Olympus公司)。
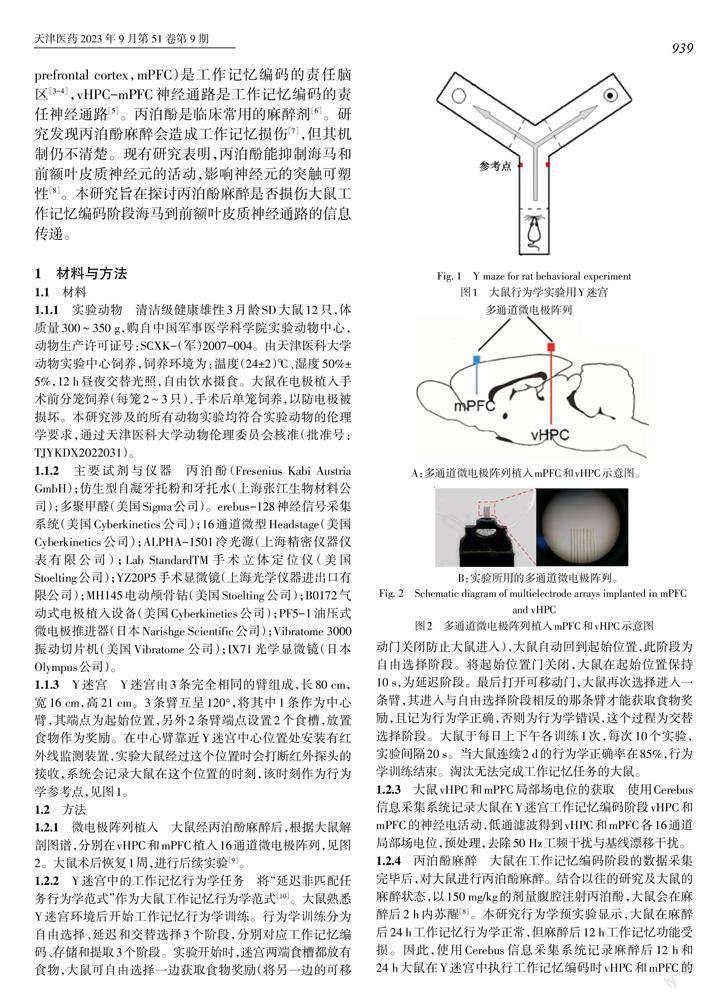
1.1.3 Y迷宫 Y迷宫由3条完全相同的臂组成,长80 cm,宽16 cm,高21 cm。3条臂互呈120°,将其中1条作为中心臂,其端点为起始位置,另外2条臂端点设置2个食槽,放置食物作为奖励。在中心臂靠近Y迷宫中心位置处安装有红外线监测装置,实验大鼠经过这个位置时会打断红外探头的接收,系统会记录大鼠在这个位置的时刻,该时刻作为行为学参考点,见图1。
1.2 方法
1.2.1 微电极阵列植入 大鼠经丙泊酚麻醉后,根据大鼠解剖图谱,分别在vHPC和mPFC植入16通道微电极阵列,见图2。大鼠术后恢复1周,进行后续实验[9]。
1.2.2 Y迷宫中的工作记忆行为学任务 将“延迟非匹配任务行为学范式”作为大鼠工作记忆行为学范式[10]。大鼠熟悉Y迷宫环境后开始工作记忆行为学训练。行为学训练分为自由选择、延迟和交替选择3个阶段,分别对应工作记忆编码、存储和提取3个阶段。实验开始时,迷宫两端食槽都放有食物,大鼠可自由选择一边获取食物奖励(将另一边的可移动门关闭防止大鼠进入),大鼠自动回到起始位置,此阶段为自由选择阶段。将起始位置门关闭,大鼠在起始位置保持10 s,为延迟阶段。最后打开可移动门,大鼠再次选择进入一条臂,其进入与自由选择阶段相反的那条臂才能获取食物奖励,且记为行为学正确,否则为行为学错误,这个过程为交替选择阶段。大鼠于每日上下午各训练1次,每次10个实验,实验间隔20 s。当大鼠連续2 d的行为学正确率在85%,行为学训练结束。淘汰无法完成工作记忆任务的大鼠。
1.2.3 大鼠vHPC和mPFC局部场电位的获取 使用Cerebus信息采集系统记录大鼠在Y迷宫工作记忆编码阶段vHPC和mPFC的神经电活动,低通滤波得到vHPC和mPFC各16通道局部场电位,预处理,去除50 Hz工频干扰与基线漂移干扰。
1.2.4 丙泊酚麻醉 大鼠在工作记忆编码阶段的数据采集完毕后,对大鼠进行丙泊酚麻醉。结合以往的研究及大鼠的麻醉状态,以150 mg/kg的剂量腹腔注射丙泊酚,大鼠会在麻醉后2 h内苏醒[8]。本研究行为学预实验显示,大鼠在麻醉后24 h工作记忆行为学正常,但麻醉后12 h工作记忆功能受损。因此,使用Cerebus信息采集系统记录麻醉后12 h和24 h大鼠在Y迷宫中执行工作记忆编码时vHPC和mPFC的局部场电位(local field potentials,LFPs)信号。淘汰16通道中有效通道数少于12通道的大鼠。
1.2.5 组织学检验 所有数据记录完毕后,给予大鼠4%甲醛灌注后断颈处死,取脑,使用振动切片机对目标脑区进行冠状切片,脑组织切片厚度为150 μm。脑组织切片在光学显微镜下进行组织学分析,确认电极丝的位置并拍照。将其与标准大鼠脑图谱对照,判断电极是否准确植入vHPC和mPFC。
1.2.6 利用局部场电位信号,计算vHPC至mPFC神经通路信息流 利用所记录的vHPC和mPFC脑区的LFPs信号,基于格兰杰因果分析原理,可以计算LFPs网络的定向传递函数(directed transfer function,DTF)。在DTF的基础上计算vHPC至mPFC神经通路信息流。具体计算过程如下所示[11]:
1.3 统计学方法 使用SPSS 22.0软件进行数据分析,计量资料以x±s表示,多组间比较采用单因素方差分析,组间多重比较采用Bonferroni检验。通过Pearson相关系数进行相关性分析。以P<0.05为差异有统计学意义。
2 结果
2.1 组织学检验 淘汰无效的大鼠后,用于结果分析的大鼠为6只。大鼠目标脑区进行脑组织切片并在光学显微镜下观察确定电极位置。电极阵列位置与大鼠脑图谱对比,确认植入的微电极阵列在mPFC和vHPC目标脑区,见图3。组织学检查确认电极所在位置为目标脑区能为后续分析提供保证。
2.2 预处理后的大鼠vHPC和mPFC局部场电位信号 经过预处理后,得到vHPC和mPFC局部场电位信号如图4所示。预处理后的LFPs信号变得相对平缓,且全部16通道均为有效数据,可用于后续分析。
2.3 vHPC和mPFC的平均网络连接强度 vHPC脑区局部场电位的平均DTF值,在麻醉后12 h低于麻醉前(F=28.167,P<0.01);麻醉后24 h与麻醉前比较差异无统计学意义(P>0.05)。
mPFC脑区局部场电位的平均DTF值,在麻醉后12 h低于麻醉前(F=38.986,P<0.01),麻醉后24 h与麻醉前比较差异无统计学意义(P>0.05),见图5。
2.4 vHPC至mPFC的信息流结果 从vHPC至mPFC的信息流,在麻醉后12 h低于麻醉前(F=39.839,P<0.01),麻醉后24 h与麻醉前比较差异无统计学意义(P>0.05),见图6。
2.5 网络连接强度和信息流与大鼠在Y迷宫执行工作记忆任务时运动速度的相关性 麻醉前后vHPC和mPFC网络连接强度与运动速度无关(vHPC:r麻醉前=0.226,r麻醉后=-0.162;mPFC:r麻醉前=0.164,r麻醉后=0.154,均P>0.05)。麻醉前后vHPC-mPFC信息流与运动速度无关(r麻醉前=0.130,r麻醉后=-0.236,均P>0.05)。
3 讨论
本研究结果表明,大鼠经丙泊酚麻醉后12 h,其工作记忆编码从vHPC到mPFC的信息流降低。同时,工作记忆编码过程中vHPC和mPFC的平均网络连接强度降低。这些结果提示丙泊酚引起的工作记忆功能障碍可能是与工作记忆编码功能的损害有关。
认知功能障碍是丙泊酚研究最广泛的神经退行性后果之一,实验结果表明,从vHPC至mPFC神经通路信息传递在麻醉后12 h明显减弱,但在麻醉后24 h可以恢复至麻醉前,提示该剂量丙泊酚麻醉对大鼠工作记忆的抑制是可逆的,本研究结论与现有研究结果相符[7-10]。已有研究表明,丙泊酚对学习和记忆会有影响,但该影响程度与麻醉剂量有关[12-13]。Cho等[14]研究表明,单次腹腔注射丙泊酚(375 mg/kg)只会导致短暂性记忆障碍。Liu等[15]对大鼠采用低剂量丙泊酚(25 mg/kg)腹腔注射麻醉10 min后进行Morris水迷宫任务,结果发现丙泊酚损害空间记忆提取,但该损伤可恢复。此外,本研究团队前期工作也证实,高剂量丙泊酚(静脉滴注0.9 mg·kg-1·min-1,2 h)麻醉会造成大鼠72 h的工作记忆功能损伤[16]。因此,麻醉剂量的选择非常重要。姚新梅等[17]研究丙泊酚麻醉梯度对大鼠神经递质的影响后发现,大鼠腹腔注射丙泊酚200 mg/kg后,翻正反射消失时间为(3.78±0.25)min,维持时间为(150±20)min;注射丙泊酚100 mg/kg后,翻正反射消失时间为(6.1±0.5)min,维持时间为(60±25)min,而注射丙泊酚50 mg/kg时的大鼠仅表现行动迟缓,翻正反射未消失,与对照组比较无变化。本文选用为3月龄大鼠,相当于人类青年阶段,再结合上述文献,以大鼠翻正反射消失至恢复的时间为依据,采用150 mg/kg丙泊酚对大鼠腹腔注射麻醉,大鼠麻醉后12 h开始Y迷宫试验,研究丙泊酚损伤工作记忆编码的可能机制。
vHPC-mPFC是工作记忆编码的主要信息传输途径[17]。解剖学研究表明,HPC-PFC直接通路是指從vHPC CA1区向mPFC的单突触单向投射[18]。Bazaz等[19]将HPC和PFC神经活动失活,从而破坏两者之间的联系,结果表明HPC和PFC之间的通路对大鼠成功执行工作记忆任务至关重要。临床研究表明,vHPC-mPFC的功能连接和突触可塑性损伤与精神分裂症、阿尔茨海默病等神经退行性疾病有实质性的因果关系[20]。Bolkan等[21]发现在工作记忆编码阶段,抑制vHPC向mPFC的传入神经会降低工作记忆任务的执行准确率,抑制相反方向对工作记忆任务的执行没有影响,提示vHPC-mPFC的直接传入神经是工作记忆编码的主要神经通路。
工作记忆任务的正确率可以反映工作记忆的损伤,但是不能确定工作记忆编码失败。工作记忆编码受损,工作记忆任务必定失败。对于行为学错误而编码无损伤的情况可能是工作记忆存储和提取阶段受损,这将在后续的研究中进行探索。
参考文献
[1] XIE Y,HU P,LI J,et al. Geometry of sequence working memory in macaque prefrontal cortex[J]. Science,375(6581):632-639. doi:10.1126/science.abm0204.
[2] GROGAN J P,RANDHAWA G,KIM M,et al. Motivation improves working memory by two processes:Prioritisation and retrieval thresholds[J]. Cogn Psychol,135:101472. doi:10.1016/j.cogpsych. 2022.101472.
[3] CARPENTER A F,BAUD-BOVY G,GEORGOPOULOS A P,et al. Encoding of serial order in working memory:Neuronal activity in motor,premotor,and prefrontal cortex during a memory scanning task[J]. J Neurosci,2018,38(21):4912-4933. doi:10.1523/JNEUROSCI.3294-17.2018.
[4] YANG Y,MAILMAN R B. Strategic neuronal encoding in medial prefrontal cortex of spatial working memory in the T-maze[J]. Behav Brain Res,2018,343:50-60. doi:10.1016/j.bbr.2018.01.020.
[5] SPELLMAN T,RIGOTTI M,AHMARI S E,et al. Hippocampal-prefrontal input supports spatial encoding in working memory[J]. Nature,2015,522(7556):309-314. doi:10.1038/nature14445.
[6] SECOR T,SAFADI A O,GUNDERSON S. Propofol Toxicity[M]. Treasure Island:Stat Pearls Publishing,2023:2-8.
[7] ZHAO X,HUANG Z Q. Does propofol ameliorate occurrence of postoperative cognitive dysfunction after general anaesthesia? A protocol of systematic review[J]. Syst Rev,2021,10(1):79. doi:10.1186/s13643-021-01610-y.
[8] LI M,ZHANG X,WU A,et al. Propofol-induced age-different hypocampal long-term potentiation is associated with F-actin polymerization in rats[J]. Cell Biochem Biophys,2015,71(2):1059-1066. doi:10.1007/s12013-014-0309-6.
[9] XU X,TIAN Y,LI S,et al. Inhibition of propofol anesthesia on functional connectivity between LFPs in PFC during rat working memory task[J]. PLoS One,2013,8(12):e83653. doi:10.1371/journal.pone.0083653.
[10] ZLATANOVA H I,GEORGIEVA-KOTETAROVA M T,VILMOSH N B,et al. Evaluation of the effect of cariprazine on memory and cognition in experimental rodent models[J]. Int J Environ Res Public Health,2022,19(22):14748. doi:10.3390/ijerph192214748.
[11] TANK A,COVERT I,FOTI N,et al. Neural granger causality[J]. IEEE Trans Pattern Anal Mach Intell,2022,44(8):4267-4279. doi:10.1109/TPAMI.2021.3065601.
[12] ZHAO A,JIN H,FAN G,et al. Inhibition of the expression of rgs-3 alleviates propofol-induced decline in learning and memory in Caenorhabditis elegans[J]. CNS Neurosci Ther,2023,29(1):306-316. doi:10.1111/cns.14004.
[13] XU Z L,CHEN G,LIU X,et al. Effects of ginsenosides on memory impairment in propofol-anesthetized rats[J]. Bioengineered,2022,13(1):617-623. doi:10.1080/21655979.2021.2012407.
[14] CHO S,JUNG Y J,SUH E C,et al. The recovery from transient cognitive dysfunction induced by propofol was associated with enhanced autophagic flux in normal healthy adult mice[J]. Brain Res,1700:99-108. doi:10.1016/j.brainres.2018.07.007.
[15] LIU H,WANG T,DAI W,et al. Subhypnotic doses of propofol impair spatial memory retrieval in rats[J]. Neural Regen Res,2016,11(12):1956-1961. doi:10.4103/1673-5374.197137.
[16] XU X,TIAN Y,WANG G,et al. Inhibition of propofol on single neuron and neuronal ensemble activity in prefrontal cortex of rats during working memory task[J]. Behav Brain Res,2014,270:270-276. doi:10.1016/j.bbr.2014.05.034.
[17] 姚新梅,李树人,王元身. 不同剂量丙泊酚对大鼠脑内血红素氧化酶-2活性的影响[J]. 中国新药与临床杂志,2002,21(1):30-32. YAO X M,LI S R,WANG Y S. Effects of different dosage propofol on he me oxygenase-2activity i n rat brain[J]. Chin J New Drugs Clin Rem,2002,21(1):30-32. doi:10.3969/j.issn.1007-7669.2002.01.012.
[18] XIA M,LIU T,BAI W,et al. Information transmission in HPC-PFC network for spatial working memory in rat[J]. Behav Brain Res,2019,356:170-178. doi:10.1016/j.bbr.2018.08.024.
[19] BAZAZ A,GHANBARI A,VAFAFI A A. Oxytocin in dorsal hippocampus facilitates auditory fear memory extinction in rats[J]. Neuropharmacology,2022,202:108844. doi:10.1016/j.neuropharm.2021.108844.
[20] CARDOSO-CRUZ H,PAIVA P,MONTEIRO C,at al. Bidirectional optogenetic modulation of prefrontal-hippocampal connectivity in pain-related working memory deficits[J]. Sci Rep,2019,9(1):10980. doi:10.1038/s41598-019-47555-0.
[21] BOLKAN S S,STUJENSKE J M,PARNAUDEAU S,et al. Thalamic projections sustain prefrontal activity during working memory maintenance[J]. Nat Neurosci,2017,20(7):987-996. doi:10.1038/nn.4568.
(2023-03-06收稿 2023-05-17修回)
(本文編辑 魏杰)
