猪繁殖与呼吸综合征病毒GP5蛋白特异性纳米抗体的原核表达及鉴定
2023-11-08张洪亮秦志华郑乾坤董绍明杨瑞梅曲光刚
王 鑫,张洪亮,秦志华,郑乾坤,黄 娟,董绍明,杨瑞梅,曲光刚,单 虎
(1.山东省预防兽医学重点实验室,青岛农业大学动物医学院,山东青岛 266109;2.山东省滨州畜牧兽医研究院,山东滨州 256600;3.得利斯集团有限公司,山东潍坊 262216)
1987年猪繁殖与呼吸综合征(porcine reproductive and respiratory syndrome,PRRS)在美国首次暴发,随后在许多生猪生产国家广泛传播,对全球养猪业造成了巨大经济损失。PRRS症状较为复杂,主要表现为妊娠母猪呼吸困难、体重减轻、生长状态差、繁殖障碍以及各日龄仔猪的呼吸系统症状[1]。我国于1991年在台湾地区发现该病。郭宝清等[2]在1996年首次从国内发病猪群中分离出猪繁殖与呼吸综合征病毒(porcine reproductive and respiratory syndrome virus,PRRSV)。PRRSV是一种囊膜正链RNA病毒,属于动脉炎病毒科动脉炎病毒属,同属病毒还包括马动脉炎病毒、小鼠乳酸脱氢酶升高病毒和猴出血热病毒。GP5是PRRSV主要的衣壳糖蛋白,其相对分子质量约为25 kDa,在PRRSV感染和组装过程中发挥着重要作用。该蛋白由1个N-末端信号肽(SP)、2个胞外结构域、2个跨膜结构域(TMS)和1个C-末端细胞质结构域组成,在2个胞外域之间存在1个高变区,与病毒识别靶细胞受体有关[3-5]。GP5是PRRSV最重要的免疫原性蛋白,具有中和表位,且PRRSV感染后康复猪体内中和抗体主要针对GP5[6]。纳米抗体(nanobody)天然缺失轻链,相对分子质量小,仅约15 kDa,是目前最小的功能抗体片段。与传统单克隆抗体相比,纳米抗体拥有更小的体积以及更简单的结构,成本也相对较低,有更广阔的应用前景。纳米抗体具有更高的特异性和结合活性,能耐酸、碱、表面活性剂等化学试剂,易于改造,在微生物、哺乳动物细胞系和植物中的表达水平很高[7]。近几年来,纳米抗体在体外诊断、治疗性抗体药物研发、细胞递送和肿瘤研究等领域均获得了广泛应用[8-10]。
目前,养殖场主要通过合理的疫苗免疫程序来防控PRRS。由于PRRSV极易发生变异,现有弱毒疫苗无法提供完全保护,且弱毒疫苗免疫猪场后存在毒力返强风险。灭活疫苗虽然免疫效果较弱毒疫苗差,但无散毒风险,在我国养猪场得到了广泛使用[11]。本研究利用大肠杆菌原核表达系统对本实验室前期淘洗获得的PRRSV GP5蛋白特异性纳米抗体序列(VHHGP5)进行表达,并对所制备的特异性纳米抗体进行活性鉴定,以期为PRRS检测和治疗提供新思路。
1 材料与方法
1.1 试验材料
克隆宿主菌E.coliTOP10、表达宿主菌E.coliBL21(DE3)、pCold-SUMO-FLAG载体,均由滨州畜牧兽医研究院提供;T4 DNA连接酶、限制性内切酶,购自NEB公司;T4 DNA连接酶、DL 2 000 DNA Marker、核酸染料,购自Takara公司;质粒小量提取试剂盒和胶回收试剂盒,购自Omega Bio-Tek公司;2×TaqPlus Master Mix(Dye Plus),购自南京诺唯赞公司;Unstained Protein MW Marker,购自赛默飞世尔公司;抗FLAG鼠源单抗、HRP标记的羊抗鼠IgG、氨苄青霉素(ampicillin),为SIGMA公司产品;Ni-NTA亲和层析柱,购自常州天地人和生物科技有限公司;异丙基硫代半乳糖苷(IPTG)、BCA蛋白定量试剂盒,购自北京索莱宝科技有限公司;ImMobilon-P醋酸纤维素膜(PVDF),购自Merck公司;PRRSV GP5蛋白、传染性法氏囊病毒特异性纳米抗体VHHIBDV,由山东绿都生物科技有限公司制备。其他常规试剂均为国产分析纯。

图1 VHHGP5基因PCR扩增结果
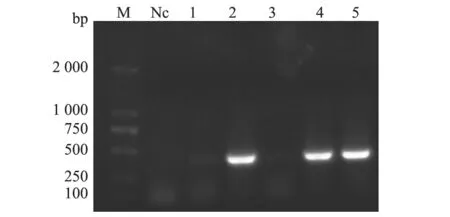
图2 菌液PCR鉴定结果
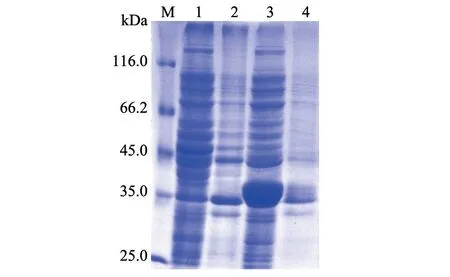
图3 VHHGP5纳米抗体重组蛋白表达形式鉴定结果
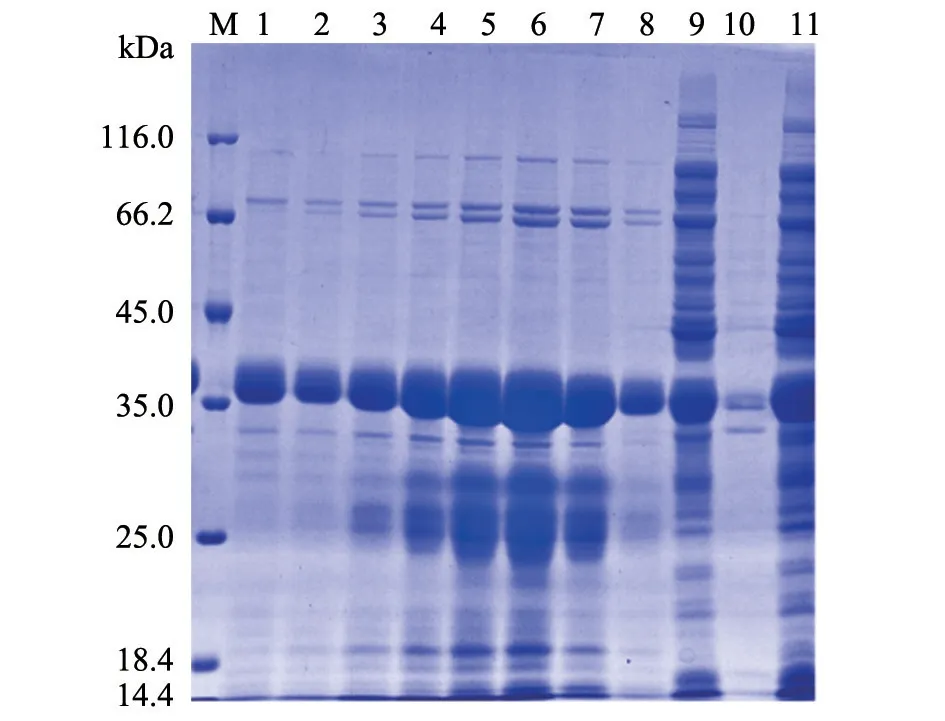
图4 纯化后VHHGP5蛋白SDS-PAGE凝胶电泳分析结果

图5 Western blot分析结果
1.2 VHHGP5基因片段扩增
根据前期本实验室通过噬菌体展示技术得到的PRRSV GP5特异性纳米抗体基因序列,设计1对特异性扩增引物(F:5'-CGGGATCCATGGAGGTGCAGCTGGTGGAG-3';R:5'-CCCAAGCTTATGAGGAGACGGTGACCAGGGTC-3')。引物含有BamHI 和HindIII酶切位点,用于将纳米抗体基因片段扩增克隆到pCold-SUMO-FLAG载体上,由上海捷瑞生物工程有限公司合成。
以本实验室前期保存的PRRSV GP5特异性纳米抗体基因扩增后的胶回收产物作为模板,利用上述合成的引物对VHHGP5基因进行PCR扩增。PCR反应体系25.0 μL:VHHGP5基因模板1.0 μL,上下游引物(10 μmol/L)各1.0 μL,10×PCR Buffer 2.5 μL,dNTP(2.5 mmol/L)2.0 μL,ddH2O 17.5 μL。PCR反应程序:95 ℃ 5 min;95 ℃ 35 s,67 ℃ 35 s,72 ℃ 35 s,30个循环;72 ℃ 10 min。PCR反应结束后,将扩增产物在120 V 25 min条件下进行琼脂糖凝胶电泳。电泳结束后,400 bp大小的电泳条带即目的条带,切除目的条带并进行胶回收。
1.3 纳米抗体重组表达载体构建
使用BamHI和HindIII限制性内切酶,分别对VHHGP5胶回收产物和pCold-SUMO-FLAG重组质粒进行双酶切,回收并纯化酶切产物,以T4 DNA连接酶连接后,将连接产物转化至E.coliTOP10感受态细胞,最后涂布于LB平板,置于37 ℃温箱过夜培养。挑取单菌落进行PCR鉴定,对鉴定为阳性的菌液提取质粒,并送至生工生物工程有限公司进行测序,若测序结果正确即证明重组质粒VHHGP5-pCold-SUMO-FLAG构建成功。
1.4 VHHGP5纳米抗体诱导表达
将重组质粒VHHGP5-pCold-SUMO-FLAG转入E.coliBL21(DE3)感受态细胞,随后涂布于平板,倒置于37 ℃温箱中过夜培养。挑取单菌落于LB液体培养基过夜培养,取50 μL过夜培养的菌液接种至5 mL LB液体培养基中,待培养至OD600nm约为0.6时,加入5 μL IPTG(1 mol/L),在22 ℃160 r/min条件下诱导表达7 h,同时将未添加IPTG的菌液作为阴性对照;诱导表达完成后,10 000 r/min离心1 min收集菌体沉淀,使用500 μL PBS溶液重悬后进行超声破碎,4 ℃10 000 r/min离心10 min,分离上清及沉淀;以SDS-PAGE凝胶电泳分析重组蛋白表达情况,将表达后的纳米抗体重组蛋白命名为VHHGP5。
1.5 VHHGP5纳米抗体纯化
由于构建的重组质粒载体含有6×His标签,因此使用Ni-NTA亲和层析柱对VHHGP5蛋白进行纯化。对VHHGP5进行大量诱导表达:将5 mL重组菌液接种至500 mL LB液体培养基,诱导表达条件同1.4;诱导表达完成后,10 000 r/min离心10 min收集菌体沉淀,重悬后进行超声破碎,对破碎后产物离心并收集上清;参照Ni-NTA亲和层析柱产品说明书步骤,对上清中的VHHGP5蛋白进行纯化,将获得的纯化蛋白进行SDS-PAGE凝胶电泳,并按照BCA试剂盒说明书测定纯化后的VHHGP5蛋白浓度。
1.6 VHHGP5纳米抗体ELISA效价分析
以PRRSV GP5蛋白作为抗原(包被质量浓度为10 μg/mL)包被96孔酶标板,4 ℃过夜;使用3%脱脂奶粉进行封闭,洗涤后依次加入6个梯度稀释(1:100、1:1 000、1:10 000、1:50 000、1:100 000和1:200 000)的VHHGP5重组蛋白,同时以未诱导的VHHGP5-pCold-SUMO-FLAG菌液超声后的上清(稀释50倍)作为阴性对照,37 ℃孵育1 h;PBS洗涤后,以抗FLAG鼠源单抗作为一抗,HRP标记的羊抗鼠IgG作为二抗进行孵育;用TMB溶液显色15 min后终止显色,使用酶标仪读取OD450nm值。
1.7 VHHGP5纳米抗体Western blot分析
为验证获得的纳米抗体VHHGP5与PRRSV GP5蛋白能否特异性结合,以Western blot试验对表达的纳米抗体重组蛋白进行鉴定。对GP5蛋白进行SDS-PAGE凝胶电泳,电泳结束后将蛋白转移至醋酸纤维素膜,置于封闭液中封闭1 h,加入不同稀释度(1:100、1:1 000、1:2 000)的VHHGP5重组蛋白孵育,同时以本实验室保存的VHHIBDV纳米抗体重组蛋白作为阴性对照;以抗FLAG鼠源单抗作为一抗,HRP标记的羊抗鼠IgG作为二抗进行孵育,使用ECL化学发光显色液避光显色2 min并拍照观察结果。
2 结果
2.1 VHHGP5目的基因扩增
以前期筛选得到的PRRSV GP5蛋白特异性VHH基因的胶回收产物为模板,使用特异性引物进行PCR扩增,对PCR产物进行1%琼脂糖凝胶电泳。结果(图1)显示,扩增出大小约为400 bp的目的条带,与预期条带大小一致。
2.2 纳米抗体重组表达载体构建
菌液PCR鉴定结果(图2)显示,挑选的单克隆中,有3个菌液成功扩增出大小约400 bp的目的条带。对阳性菌液提取质粒并送测序,发现阳性菌液质粒测序正确,表明重组表达载体VHHGP5-pCold-SUMO-FLAG构建成功。
2.3 VHHGP5纳米抗体表达及纯化
使用IPTG作为诱导剂对目的蛋白进行诱导表达,并通过SDS-PAGE凝胶电泳检测蛋白表达形式。结果(图3)显示,重组载体VHHGP5-pCold-SUMO-FLAG在诱导后表达出一条约36 kDa的蛋白条带,且VHHGP5蛋白为可溶性表达,主要存在于超声后菌体上清中,而沉淀及未诱导的菌液则条带不明显。随后,按照诱导表达条件对VHHGP5纳米抗体重组蛋白进行大量表达并通过Ni-NTA亲和层析柱进行纯化,获得了纯化蛋白(图4),经BCA方法测定,纯化后的VHHGP5纳米抗体重组蛋白质量浓度为2 mg/mL。
2.4 VHHGP5纳米抗体活性测定
将纯化后的VHHGP5纳米抗体进行倍比稀释,并与固相包被的GP5蛋白进行间接ELISA试验,以试验孔OD450nm大于阴性对照孔3倍以上作为阳性判定标准。结果(表1)显示,纯化后的VHHGP5纳米抗体重组蛋白ELISA效价为1:50 000,效价较高。

表1 间接ELISA效价检测结果
2.5 Western blot鉴定
VHHGP5纳米抗体重组蛋白Western blot分析结果(图5)显示,该纳米抗体能够与PRRSV GP5蛋白发生特异性反应,表明所制备的纳米抗体可特异性识别GP5蛋白,具有良好的反应性。
3 讨论
PRRS发病率及死亡率高、传播迅速,给我国养猪业带来了较大经济损失。GP5是PRRSV的主要结构蛋白,具有多个中和位点,被认为是获得中和抗体的理想蛋白。市面上已有通过包被GP5蛋白来检测PRRSV的商品化试剂盒。传统的单克隆抗体在诊断中发挥着重要作用,但它们的生产在技术上要求很高,而且昂贵。单克隆抗体的大尺寸(150 kDa)使其进行重组成为一个挑战。纳米抗体仅由两条重链组成,天然缺失轻链,有相对分子质量小、稳定性强、易于制备以及更容易进行基因工程改造等特点[12]。目前纳米抗体已被广泛应用于疾病诊断和治疗中[13-14]。Ma等[15]利用制备的特异性纳米抗体构建了检测猪流行性腹泻病毒的阻断ELISA方法,检测效果与商品化检测试剂盒相当。由此可见,纳米抗体作为新兴分子生物学工具正应用于动物疫病防控中。
本研究利用大肠杆菌原核表达系统,成功制备了针对PRRSV GP5蛋白的特异性纳米抗体。该纳米抗体在大肠杆菌中呈可溶性表达,间接ELISA检测显示其结合效价可达1:50 000。此外,本试验使用的原核表达系统大大降低了蛋白制备成本,纯化蛋白的步骤也较为简便,适合进行大批量生产。在后续研究中,VHHGP5纳米抗体可用于构建ELISA、胶体金等检测方法以及探究PRRSV感染机制。综上,本研究制备了针对PRRSV GP5蛋白的纳米抗体,其可特异性识别GP5蛋白,为PRRS检测用及治疗用新型抗体开发奠定了基础。
