猪繁殖与呼吸综合征病毒荧光微球抗体检测方法的建立
2023-11-08刘明瑞殷笑丹杨晓帆吕园园
刘明瑞,殷笑丹,杨晓帆,吕园园
(禾旭(郑州)生物技术有限公司,河南郑州 450000)
猪繁殖与呼吸综合征(porcine reproductive and respiratory syndrome,PRRS)是一种以母猪繁殖障碍和各生长阶段猪发生呼吸道疾病为特征的严重影响全球养猪业的病毒性传染病,在我国俗称“蓝耳病”。PRRS的病原猪繁殖与呼吸综合征病毒(porcine reproductive and respiratory syndrome virus,PRRSV)可长期存在于猪群中,其主要传播途径是接触传播,还可通过空气和精液传播[1]。
时间分辨荧光免疫层析技术(time-resolved fluorescence immunochromatography,TRFIA)是20世纪80年代初在传统荧光免疫分析基础上创立的一种新型非放射性标记免疫分析技术。与传统荧光素标记不同,它所用的示踪物是具有独特荧光特性的镧系元素及其螯合物,可以有效排除待检样品自然荧光干扰,具有灵敏度高、特异性强、稳定性好以及无放射性污染等优点,在临床免疫检验和科学研究中应用越来越广泛。人血清降钙素原快速定量检测方法[2]、甲胎蛋白荧光微球TRFIA定量检测方法[3]等多种人体疾病诊断产品均基于TRFIA并已商品化生产销售。应用荧光微球建立的禽白血病病毒抗原检测技术也取得了良好的应用效果[4]。目前国内外市场上暂无此类产品应用于PRRSV抗体检测的报道。
本研究以PRRSV重组N蛋白为包被蛋白,建立了检测PRRSV抗体的荧光微球免疫层析方法,为PRRS血清学诊断、免疫抗体检测及流行病学调查提供了简便、快速的手段,具有较好的应用前景。
1 材料与方法
1.1 主要试剂和耗材
大肠杆菌原核表达系统表达的PRRSV重组N蛋白,由禾旭(郑州)生物技术有限公司制备和保存;PRRSV抗体阳性/阴性血清,以及猪伪狂犬病病毒(PRV)、猪瘟病毒(CSFV)、猪细小病毒(PPV)和猪圆环病毒2型(PCV2)阳性血清,由禾旭(郑州)生物技术有限公司采集和鉴定;荧光微球,购自辉质生物公司;羊抗猪二抗、兔抗羊二抗,购自美国Jackson公司;硝酸纤维素膜,购自美国Millipore公司;玻璃纤维素膜,购自通成纸制品公司。其他试剂,均为国产分析纯。
1.2 荧光微球试纸制备
将荧光微球活化后与羊抗猪二抗共价偶联,制备荧光微球标记的羊抗猪二抗,将该标记物喷涂于玻璃纤维素膜上,干燥后置于4~30 ℃密封保存,即为荧光微球垫;将兔抗羊二抗和PRRSV重组N蛋白喷涂于硝酸纤维素膜上,干燥后置于4~30 ℃密封保存,即为印膜;采用样品垫处理液浸透玻璃纤维素膜,干燥后置于4~30 ℃密封保存,即为样品垫;依次将印膜、吸水垫、荧光微球垫和样品垫粘贴至PVC底板上(图1),用切条机裁切为3.0 mm宽的试纸,装入卡壳并密封包装。

图1 荧光微球试纸示意图
1.3 最佳反应条件筛选
1.3.1 检测线(T线)和质控线(C线)包被质量浓度 取若干条硝酸纤维素膜分别编号,将兔抗羊二抗分别稀释至终质量浓度为0.5、1.0、1.5和2.0 mg/mL,用于包被C线;同时在每个C线质量浓度下,分别将重组N蛋白稀释至终质量浓度为0.4、0.8、1.2和1.6 mg/mL,用于包被T线。以0.8 μL/cm的喷涂量,将不同质量浓度的兔抗羊二抗和重组N蛋白溶液喷涂于对应编号的硝酸纤维素膜上,并保证T线和C线间距为5~6 mm,(37±2)℃干燥2~3 h;与其他组分分别配对后,以阳性和阴性血清对每个质量浓度组合进行检测,根据阳性和阴性血清的检测结果比值(P/N)筛选T线和C线的包被质量浓度。
1.3.2 羊抗猪二抗包被浓度 以500 μL硼酸盐缓冲液(0.05 mol/L,pH 8.5)重悬已活化的荧光微球,吹打混匀后离心收集沉淀,再用500 μL标记缓冲液复溶;将羊抗猪二抗加入含有500 μL微球液的离心管中,使抗体终质量浓度分别为10、20、50和100 μg/mL,吹打混匀,于室温(15~25 ℃)避光反应1.5 h;控制其他条件一致,采用PRRSV阳性和阴性血清对各质量浓度进行检测,比较阳性和阴性血清的检测结果比值(P/N),确定羊抗猪二抗的最适质量浓度。
1.3.3 加样量 为获得准确的检测结果,用微量移液器分别取不同加样量(30、50、80、100和120 μL)的PRRSV阳性血清进行重复试验,记录荧光反应结果,选取最适加样体系。
1.3.4 血清稀释倍数 为降低血清检测结果的背景值,用血清稀释液将PRRSV阳性和阴性血清分别作1、10、20和40倍稀释,各取等量血清进行检测,根据检测结果确定血清最佳稀释倍数。
1.3.5 反应时间 在室温(15~25 ℃)及湿度≤30%环境中,按上述优化后的反应条件,分别加入PRRSV阳性和阴性血清后,每间隔2 min检测1次。将试纸放入便携式荧光检测设备的插卡口,运行仪器并读取T/C值,以确定最佳反应时间。
1.3.6 临界值 根据PRRSV荧光微球检测方法对285份已知背景血清(132份阳性血清,153份阴性血清)的检测结果,采用ROC曲线[5](receiver operating characteristic curve)确定该试纸的阴阳判定临界值。
1.4 敏感性试验
采用人工免疫PRRSV(NVDC-JXA1株)灭活疫苗的方式制备阳性血清,经美国爱德士试剂盒检测,血清抗体效价为1:64。用血清稀释液按1:2、1:4、1:8、1:16、1:32、1:64对该阳性血清进行稀释,以本研究建立的方法对上述稀释后的血清进行检测,确定检测为阳性的最高血清稀释度。
1.5 特异性试验
以本研究建立的方法对PRV、CSFV、PPV和PCV2阳性血清进行检测,评价本方法对常见猪病毒抗体的特异性。
1.6 重复性试验
取10份不同效价的PRRSV阳性血清和5份阴性血清,采用PRRSV荧光微球检测方法进行5次平行试验,计算变异系数。
1.7 符合率试验
从郑州市某养殖场采集184份猪血清,采用美国爱德士试剂盒检测血清背景,同时以优化后的PRRSV荧光微球抗体检测方法检测,比对二者的符合率。
2 结果
2.1 最佳反应条件筛选
2.1.1 T线和C线包被质量浓度 将T线和C线设定为不同的包被质量浓度,统计阴性和阳性血清的检测结果(表1)。在C线兔抗羊二抗质量浓度为1.5 mg/mL,且T线重组N蛋白质量浓度为1.2 mg/mL时,P/N达到最大(33.90),因此C线和T线的最佳包被质量浓度分别为1.5和1.2 mg/mL。
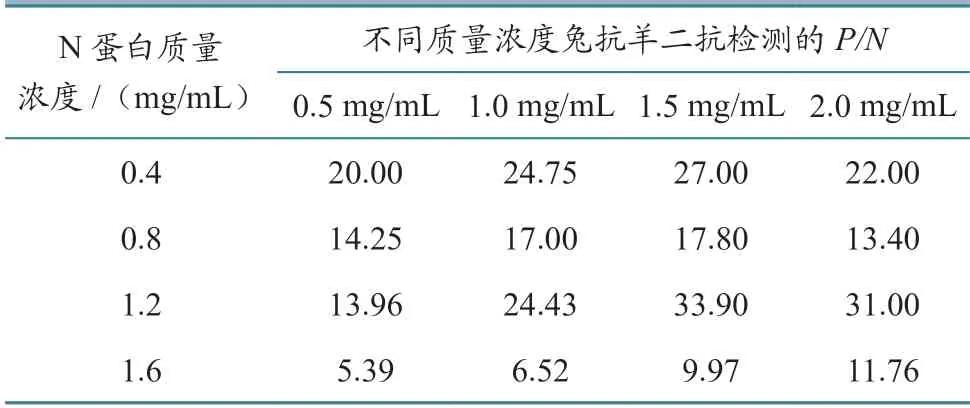
表1 T线和C线包被质量浓度筛选结果
2.1.2 羊抗猪二抗包被质量浓度 将不同量的羊抗猪二抗分别加入微球悬浮液,采用PRRSV阳性和阴性血清对各质量浓度进行检测,记录T线、C线荧光值和T/C。结果(表2)显示,随着羊抗猪二抗标记量的增加,T线的荧光值逐渐增加,在标记量高于50 μg/mL时,荧光值趋于平稳状态,同时P/N达到高峰(30.45),表明荧光微球共价结合的蛋白量已达到饱和,因此最佳羊抗猪二抗的标记质量浓度为50 μg/mL。

表2 羊抗猪二抗包被质量浓度筛选结果
2.1.3 加样量 不同加样量对荧光微球标记物的释放效果(图2)显示:当加样量低于80 μL时,硝酸纤维素膜上的T线和C线位置无荧光条带,荧光反应堆积于荧光微球垫;当加样量为80~100 μL时,荧光微球垫无明显荧光微球残留,荧光亮线呈规则状,且T线和C线荧光强度清晰可见;当加样量增加至120 μL时,样品垫处有明显的液体积留。因此确定加样量为80~100 μL(相当于一次性吸管2~3滴的量)。

图2 不同加样量对检测结果的影响
2.1.4 血清稀释倍数 用血清稀释液将PRRSV阳性和阴性血清分别作1、10、20和40倍稀释,各取100 μL血清上样检测。结果(表3)显示,当血清稀释比例为1:10时,P/N达到最大(35.47)。

表3 血清稀释倍数确定结果
2.1.5 检测时间 以PRRSV阳性和阴性血清为测试样品,观察T/C随时间的变化趋势。结果(图3)显示,在30 min内,阳性和阴性血清的T线、C线荧光强度均呈现上升趋势,计算各时间点阳性和阴性血清的T/C,发现其在15 min后趋于平稳,并能在检测时间内保持稳定状态。因此,确定反应15 min后开始检测T/C。

图3 不同反应时间的检测结果
2.1.6 临界值 以真阳性率(敏感性)为纵坐标,假阳性率(100 -特异性)为横坐标,根据PRRSV荧光微球检测方法对285份血清的检测结果绘制ROC曲线(图4),发现所对应的曲线下面积值[6]为0.949,表明该方法具有较高的准确性。对于曲线上每个T/C对应的约登指数(敏感性与特异性之和减1),选择约登指数最大值(0.785)对应的T/C(0.1)作为本方法的临界值,此时对应的敏感性为87.88%,特异性为90.62%。因此,确定本方法的判定标准:T/C≥0.1,判定为PRRSV抗体阳性;T/C<0.1,判定为PRRSV抗体阴性。
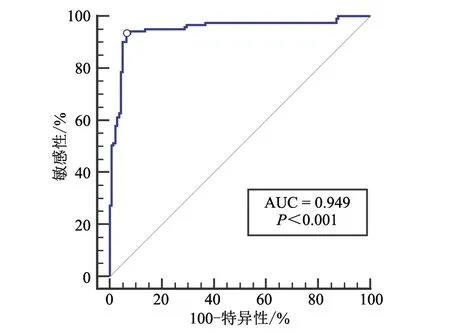
图4 ROC曲线
2.2 敏感性试验
以美国爱德士试剂盒检测抗体效价为1:64的阳性血清为测试血清,将其按1:2、1:4、1:8、1:16、1:32、1:64比例稀释,用建立的PRRSV荧光微球检测方法检测。结果(表4)显示,检测为阳性的最大稀释度为1:32,说明本方法的敏感性较美国爱德士试剂盒低1个滴度。

表4 敏感性试验结果
2.3 特异性试验
采用PRRSV荧光微球检测方法对4种阳性血清的检测结果显示(表5),PRV、CSFV、PPV和PCV2阳性血清的检测结果均为阴性。结果表明PRRSV荧光微球检测方法的特异性良好。
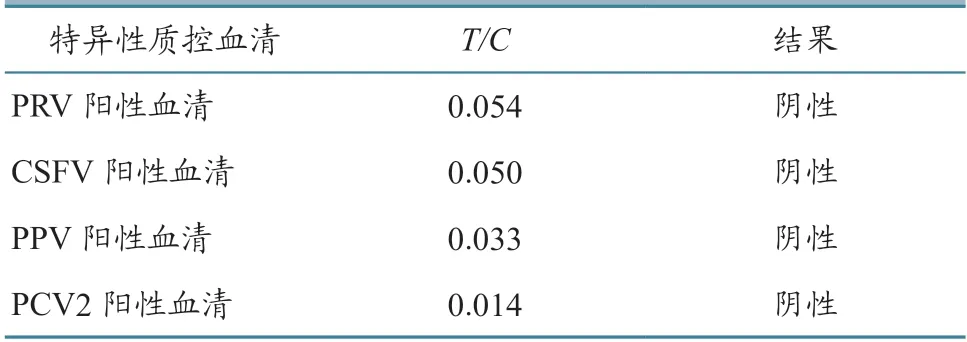
表5 特异性试验结果
2.4 重复性试验
采用PRRSV荧光微球检测方法重复检测10份阳性血清和5份阴性血清。结果(表6)显示,变异系数为3.71%~8.99%,低于10%。结果表明PRRSV荧光微球检测方法稳定,具有良好的重复性。

表6 重复性试验结果
2.5 符合率试验
以美国爱德士试剂盒和PRRSV荧光微球检测方法同时检测184份血清。结果(表7)显示,两种方法的阳性符合率为91.43%(128/140),阴性符合率为90.91%(40/44),总符合率为91.30%(168/184)。结果表明,两种方法具有较高的一致性。
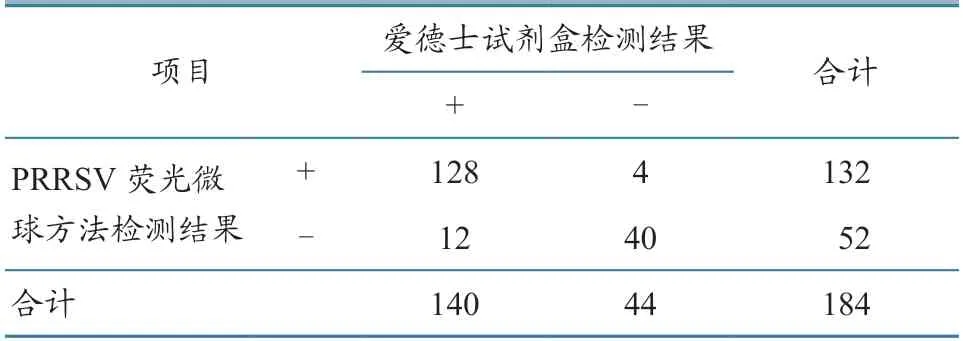
表7 符合率试验结果 单位:份
3 讨论
目前PRRS诊断首先是基于流行病学、临床症状和病理变化等作出初步判断,然后根据实验室检测结果进行最终确诊。已应用的实验室诊断技术有病毒分离与鉴定、免疫过氧化物酶单层试验(immunoperoxidase monolayer assay,IPMA)、间接免疫荧光试验(indirect immunofluorescence assay,IFA)、间接酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)[7]和血清中和试验(serum neutralization,SN)等。病毒分离和鉴定多用于急性病例确诊和新疫区确定,其余4种方法主要用于检测PRRSV抗体。IPMA需要肉眼判定,主观性较强,操作过程复杂,批次间差异大,不适用于大规模抗体检测;IFA敏感性较IPMA高,但同IPMA一样,需要事先在敏感细胞上进行PRRSV增殖,结果判定受检测人员技术水平的影响较大;与前两者相比,间接ELISA更为敏感、特异、快速,且易于标准化,是PRRSV抗体常规监测和疫病诊断的最佳选择,但其特异性、敏感性主要取决于包被抗原的免疫原性和纯度以及临界值的确定;SN具有明显的抗原型别差异,中和抗体在感染后1~2个月才产生,不适用于早期诊断。
将TRFIA应用于PRRSV抗体检测,对检测人员技术要求低,无需大型仪器设备,适用于现场检测。与传统胶体金层析技术相比,结合荧光微球作为示踪物的免疫层析技术具有更高的灵敏度,同时荧光分析仪检测结果判定能消除检测人员的主观因素影响,并将结果数字化,有利于检测数据的整理分析及数据库的建立。与ELISA方法相比,PRRSV荧光微球抗体检测方法更加快速、便捷,更适用于PRRS的现场检测,因而在兽医诊断方面的发展潜力更为可观,市场应用广泛,可为PRRSV抗体快速检测提供新的思路。
本研究以高度保守的PRRSV重组N蛋白作为检测抗原[8],通过对C线和T线包被质量浓度等优化,采用ROC曲线确定以0.1(T/C)为本方法的临界值。进而对建立的PRRSV荧光微球抗体检测方法进行系列验证,发现该方法能够检测出1:32稀释的PRRSV阳性血清,而对PRV、CSFV、PPV和PCV2阳性血清检测结果均为阴性,重复检测15份血清样品的变异系数为3.71%~8.99%,与美国爱德士试剂盒的符合率为91.30%,说明该方法虽然敏感性略低,但特异性和重复性均良好,与进口试剂盒具有较高的一致性。然而该方法的可行性需要进一步对临床感染样本进行验证,同时与基于NSP7蛋白建立的荧光微球方法相比较[9],以提高方法的敏感性,从而提高其在PRRS防控和疫苗监测方面的效率。
