血液学指标在地中海贫血表型筛查中的应用及其注意事项
2023-11-08王星敏商璇
王星敏, 商璇
南方医科大学基础医学院医学遗传学教研室(广东广州 510515)
地中海贫血(简称地贫)属于血红蛋白病,是一种全球广泛分布的遗传性血液病。长江以南的省份是我国的地贫高发区,尤以广西、广东及海南的发病率最高[1]。地贫发病是由于珠蛋白基因点突变或缺失导致珠蛋白合成受阻,引发红细胞内珠蛋白链比例失衡,进而引起溶血、无效造血和铁过载等一系列病理生理变化。根据减少的珠蛋白类型,地贫可以分为α-地贫和β-地贫[2-3]。地贫个体临床表型严重程度与其基因型相关,地贫携带者无明显临床症状,而重型地贫患者若未能进行规范治疗可能在胎儿期或儿童期死亡[4]。既往研究显示[5],全世界每年可能有超过56 000例新生儿患有地贫,因此地贫的预防是世界范围内的公共卫生问题。目前临床大多数地贫患者仍采用规律输血和祛铁的常规治疗手段。但此类常规疗法需终身进行,花费较高,给受影响家庭带来沉重经济负担。所以对育龄人群进行婚检或通过产前筛查发现同型地贫携带者的高风险夫妇,再结合产前诊断预防地贫患儿出生是高发区较为通用的公共卫生政策。现行地贫的一线筛查是血液学表型分析,主要包括红细胞指标测定和血红蛋白(Hb)分析,必要时结合铁代谢水平的检测分析[6]。医务人员根据筛查结果指导夫妇是否需要进一步进行地贫基因检测。本文将对地贫表型筛查的相关指标的影响因素进行系统的归纳和总结,希望能使医务人员对地贫筛查指标有更深刻的认识和理解,从而更准确地解读筛查结果和进行下一步的基因检测。
1 血液学表型筛查是目前地贫人群筛查的一线方案
地贫人群筛查的目的是为了提早发现同为地贫携带者有孕育严重地贫患儿风险的夫妇并为其提供关于如何避免这样一种不利事件的有效选择。高发区地贫人群筛查根据策略可以分为基于临床血液学指标的表型筛查和基于遗传学基因检测的分子筛查两种。由于基因检测的仪器、试剂和人力成本高,在基层医疗机构较难普及。所以结合我国实际情况,目前高发区的地贫人群筛查主要采用表型筛查策略。地贫个体的外周血红细胞呈现大小不均、并有异形红细胞出现、网织红细胞增多现象,具有典型的小细胞低色素性变化。这些血液学表型改变是我们在人群筛查中发现地贫携带者个体的参考依据。
地贫血液学表型分析主要包括红细胞指标的测定和血红蛋白组成分析,必要时辅以铁代谢状态的分析。血液学表型分析的准确度是指导后续采用DNA诊断方法鉴定地贫个体基因型的基本前提。目前用于红细胞指标测定的血细胞自动分析仪和用于血红蛋白分析的全自动血红蛋白分析仪均为高通量自动化设备,可满足大人群地贫携带者筛查的需要。在上述血液学表型分析结果的指导下,借助分别针对不同类型地贫的DNA诊断技术,可以准确、快速地确认地贫基因携带者个体。
2 血液学表型筛查的主要指标
地贫的血液学特征是小细胞[平均红细胞体积(MCV)]低色素[平均红细胞血红蛋白含量(MCH)],伴有Hb A2和胎儿血红蛋白(Hb F)的含量发生变化,有些携带特殊地贫突变的个体还出现特征性的异常血红蛋白如血红蛋白Constant Spring(Hb CS)和血红蛋白E(Hb E)等。因此血液学表型筛查的主要指标是包括红细胞参数(MCV和MCH)的测定和血红蛋白组成分析(异常血红蛋白检测、Hb A2和Hb F定量)。红细胞指标测定一般采用血细胞自动分析仪(即当前常规使用的三分类或五分类全自动血液分析仪),操作为采集EDTA抗凝血,按仪器说明上机,自动输出检测值。血红蛋白分析主要采用两种方法:高效液相色谱分析和毛细管电泳。两种方法均以EDTA抗凝全血为检测标本,可由相应高通量自动化仪器完成。前者的代表是Bio-Rad公司的VARIANTTM Ⅱ分析系统,根据不同血红蛋白在色谱柱中洗脱时间的差异进行种类定性。后者的代表是Sebia公司的CAPILLARYS系统,根据不同血红蛋白等电点、分子大小和形状不同,从而在电场中移动速率不同进行种类定性。
MCV代表平均红细胞体积,成人MCV的正常范围是80~100 fL;MCH代表红细胞的平均血红蛋白含量,MCH的正常范围是27~31 pg[7]。地贫的检测结果一般显示MCV<80 fL和(或)MCH<27 pg,这是常规地贫指南建议的筛查临界值。个体出现上述结果提示有患地贫或缺铁性贫血的可能,因此可辅助检测血清铁蛋白等指标,用于评估铁代谢状态从而进一步鉴别诊断[8-9]。此外,红细胞参数中的红细胞分布宽度(RDW)值也有一定作用。RDW反映红细胞大小变异程度,可辅助地贫和缺铁性贫血的鉴别诊断,但是不能作为单独鉴别地贫的指标。一般情况下,地贫表现为大小较均一的小红细胞,RDW正常或稍高,而需与之鉴别的缺铁性贫血则表现为红细胞大小不一,RDW数值升高[3,8]。
血红蛋白组分分析主要检测外周血样本中Hb A、Hb A2、Hb F和异常血红蛋白等水平。正常成人体内有3种血红蛋白,包括Hb A(α2β2)、Hb A2(α2δ2)和Hb F(α2γ2)。Hb A是血红蛋白的主要成分,占总量的96%以上。其次是Hb A2,占总量的2.5%~3.5%,Hb F(α2γ2)不到1%。Hb A2,即成人次要血红蛋白,它是一种由2条α肽链和2条δ肽链构成的四聚体结构。α2δ2四聚体的合成约开始于妊娠第30周的胎儿,在出生时,该四聚体占总血红蛋白的0.5%,之后持续增加,直到出生后6个月,达到成人水平,并维持在2.5%~3.5%之间[2]。虽然Hb A2的生物学功能未知,但是Hb A2水平可用于指导地贫分型。针对采用的具体检测技术,Hb A2正常范围的参考值可能会有变化,以仪器条件为准。Hb F,即胎儿血红蛋白,是一种由2条α肽链和2条γ肽链构成的四聚体结构,主要在胎儿期表达,通常在出生2岁后低于1%,对于Hb F>2%的成人应接受进一步检查[6]。Hb F的升高可能与特异性δβ或γδβ基因缺失、遗传性胎儿血红蛋白持续存在综合征(HPFH)、Gγ或Aγ基因启动子上的点突变、红细胞生成应激反应、使用特定细胞毒性药物(如羟基脲)治疗、骨髓恶性肿瘤、再生障碍性贫血或妊娠有关[10]。在MCH≤27 pg的情况下,Hb F升高(>5%)提示δβ-地贫的可能;在MCH正常的情况下,应考虑HPFH的存在[11]。临床上Hb F水平升高可用于缓解中重度地贫患者表型,因此大量研究致力于发现调控Hb F升高的因子[10]。
红细胞参数和血红蛋白分析二项检测的不同结果组合可大致划分出不同类型的血红蛋白病,见表1。值得注意的是,在少数特殊类型珠蛋白基因突变的携带者,或地贫个体合并其他疾病时,可使上述检测结果发生变化,此时单纯依靠筛查结果易于发生漏诊或误诊。对于疑难病例需要应用基因分子检测技术进一步明确诊断。
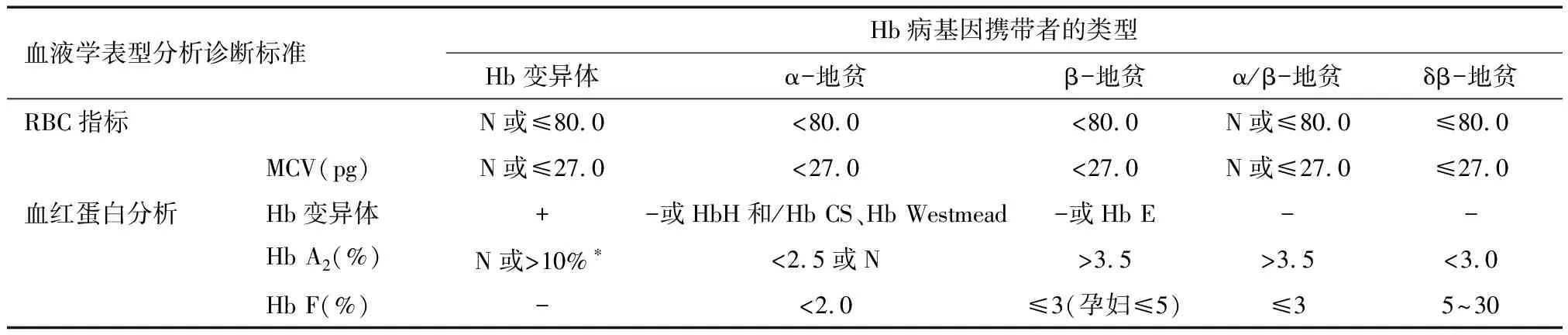
表1 各类型血红蛋白病基因携带者血液学表型分析诊断标准
3 MCV、MCH和Hb A2的应用及影响因素
3.1 MCV和MCH MCV是最常用的地贫筛查血液学指标之一。根据MCV值,可将贫血类型分为小细胞性贫血(MCV<80 fL)、正细胞性贫血(MCV在80~100 fL间)以及大细胞性贫血(MCV>100 fL)[12]。由于长期慢性贫血和无效造血,地贫个体的红细胞体积缩小,呈小细胞样改变,所以地贫筛查中MCV阳性的界定参考值一般为80 fL。但是,地贫具有高度的临床表型异质性,很多α+-地贫突变(如-α3.7和-α4.2)携带者的MCV值接近临界值[7]。因此在某些地贫高发地区,为了尽可能纳入地贫携带者,MCV筛查的临界值可提高到82 fL[1]。一项香港地区的地贫携带者的群体调查显示,在1 727例受试者中,95例的MCV值处于80~85 fL之间,其中32例携带α+-地贫突变(23例携带-α3.7突变,8例携带-α4.2突变,1例携带Hb CS突变),3例携带β-地贫突变(均为Hb E)[13]。这一结果显示,即使将MCV筛查的临界值提高到82 fL,仍有一定可能漏检。事实上,既往研究[7]表明,许多α+-地贫杂合子不会出现明显的红细胞参数改变;而α0-地贫杂合子通常表现明显的MCV降低。所以,仅依靠MCV值进行地贫携带者筛查,容易漏检α+-地贫杂合子,可能会导致部分HbH病患儿出生。此外,在地贫高发区,存在一定数量的α+-地贫合并β-地贫的双重杂合子,此类个体如果由于MCV值高于参考值而不进行下一步的基因检测,也有可能导致中间型或重型β地贫患儿的出生。医务人员在进行筛查时应对此类情况的发生有风险预期。
另外,红细胞体积受到多重因素的影响,以下的特殊情况可能造成个体的红细胞体积发生变化,影响MCV的测定,从而干扰地贫筛查结果,需要额外警惕。常用的肿瘤药物之一酪氨酸激酶抑制剂(如舒尼替尼、伊马替尼等)可影响服药个体的MCV水平[14-15]。一项对接受舒尼替尼治疗的179例成人和21例儿童实体瘤患者进行的回顾性研究发现,无论在成人组还是儿童组,接受20周左右的舒尼替尼治疗后,个体的MCV值均出现明显提高[16]。该项研究并指出,MCV升高可以作为评估舒尼替尼疗效的指征。因此,若地贫携带者使用该类药物,可能会导致个体的MCV值变化,影响筛查结果。外周血样本中红细胞碎片增多同样会影响MCV检测。在一个巨幼红细胞增多症的英国病例中,患者的MCV检测值为81.5 fL,但外周血涂片显示存在大量红细胞碎片和椭圆形大细胞。进一步诊断确定其患有巨幼红增多症,MCV值实际为106 fL[17]。可见,随着红细胞碎裂增加,采用仪器测定的MCV值不一定准确。接受抗逆转录病毒治疗也会影响个体的MCV值,接受此类治疗后个体的MCV值会升高,这可能显著影响地贫筛查。一项接受高效抗逆转录病毒治疗的台湾人群的队列研究中,包括74例地贫携带者孕妇和58例非地贫携带者孕妇;当未接受抗逆转录病毒治疗治疗时,以MCV<80 fL筛查地中海贫血携带者,筛查敏感度为83.3%,当接受治疗后,筛查敏感度降为33.3%,假阴性率为66.7%;若使用MCV<80 fL作为筛查地贫的临界值,2/3接受治疗4周的地贫携带者将表现为假阴性。所以,接受抗逆转录病毒治疗期间的MCV值也不能用于地贫筛查[18]。
MCH亦是一项常用的地贫筛查血液学指标,当MCH<27 pg时,称为低色素症,临床常见于地贫和缺铁性贫血。因MCH数值稳定性更高,且不易受到外界环境影响,MCH值在地贫诊断上比MCV值更可靠[6]。尽管MCV和MCH与疾病表型严重程度有一定相关性,但是MCH和MCV的数值变化并不一定与疾病严重程度成正比,因此不能单纯的依据MCV和MCH水平来判断地贫表型严重程度[6]。研究表明,MCV和MCH作为单一标志物,具有显著优于Hb A2的敏感度、特异度和诊断准确性[19]。MCV+MCH联合筛查是整体初筛最佳的策略,MCV+MCH联合筛查在保持较高敏感度的情况下,还显著提高了筛查特异度,减少漏诊。MCV+MCH+Hb A2是目前使用最广泛的策略,对于β-地贫来说是目前综合效益最优的筛查策略[19]。
3.2 Hb A2Hb A2含量是一项鉴别α-地贫和β-地贫的特异性筛查指标。近年来,高效液相色谱(HPLC)和毛细管电泳(CE)技术已被广泛用于临床实验室中Hb A2的定量测量。α-地贫由于α-珠蛋白链合成减少,一般表现为Hb A2降低,通常以Hb A2<2.5%作为可疑α-地贫的参考值;β-地贫则由于β-珠蛋白链合成减少导致Hb A2增高,一般以Hb A2>3.5%作为可疑β地贫的参考值[19]。然而,既往研究表明,Hb A2>3.5%作为β-地贫的筛查截断值有较高的敏感度和特异度,而Hb A2<2.5%作为α-地贫筛查的界值结果并不理想,即使调整界值后,检测敏感度改变不大,但是特异度却明显降低[19-20]。在一项对1 178对孕前检查夫妇进行的地贫筛查研究中,以Hb A2>3.5%为界,可筛查出91.3%的β0-地贫杂合子和94.74%的β+-地贫杂合子;而以Hb A2<2.5%为界仅能筛查出30.19%的静止型α-地贫个体和66.07%的标准型α-地贫个体[20]。该研究中,使用Hb A2>3.5%,β-地贫的检测敏感度94.17%,其特异度、阳性和阴性预测值均>80%;但Hb A2含量用于α-地贫筛查的敏感度极低,因为47%的α-地贫携带者的Hb A2介于2.5%~3.5%[20]。另一项对11 428例福建地区疑似地贫个体的筛查研究中[21],中间型α-地贫的Hb A2最佳阈值为1.75%,其特异度及敏感度均较高,而静止型α-地贫和标准型α-地贫的Hb A2最佳阈值分别为2.95 %和2.55%,此时虽然筛查的敏感度较高,分别为96.3%和87.7%,但是特异度较低,不能作为临床筛查的界值。以上人群评价的结果[19-22]显示,可以使用Hb A2>3.5%作为界值进行β-地贫个体筛查,但Hb A2定量检测并不适用于进行α-地贫筛查。
Hb A2水平同样受到多重因素的影响,以下的特殊情况可能造成个体的Hb A2水平发生变化,影响Hb A2的测定,从而干扰地贫筛查结果。可造成红细胞内Hb A2水平减低的因素包括:(1)铁缺乏可降低Hb A2水平。当机体铁缺乏时,α-珠蛋白肽链与β-珠蛋白肽链的结合趋势高于δ-珠蛋白肽链,或者低水平的铁会抑制δ-珠蛋白合成,因此重度缺铁性贫血可显著降低Hb A2水平,最高可下降0.5%[11,23]。(2)个体患有血液系统恶性肿瘤如青少年慢性髓系白血病、急性髓系白血病[24]。一项关于青少年慢性髓系白血病的案例研究中,记录了9例婴幼儿患者的Hb A2数据,其中,8例患儿Hb A2显著降低,均低于1%,1例患儿Hb A2处于正常低值水平(2.4%~3.1%)[25]。升高Hb A2水平的因素包括:(1)接受抗逆转录病毒治疗。一项对HIV阳性夫妇进行抗逆转录病毒治疗的研究发现,接受治疗后男性个体的MCV和MCH均处于正常水平,而Hb A2水平升高至4%[26]。另一项研究对印度地区HIV阳性成年人的地贫筛查数据进行了回顾性分析[27]。该研究包括78例HIV阳性的成年人,产前女性70例和男性8例。55例接受抗逆转录病毒药物治疗的患者中有14例Hb A2水平达到β-地贫筛查阳性界值(平均3.7%);应用抗逆转录病毒药物齐多夫定和司他夫定的HIV阳性患者,MCV、MCH和Hb A2水平均升高,这点在前文MCV升高的影响因素中也有阐述。(2)个体携带其他基因突变。例如KLF1和SUPT5H。在一项对145例意大利撒丁岛人Hb A2水平的调查研究中,这145例受试者均表现为Hb A2水平处于β-地贫筛查阳性界值,但MCV和MCH正常,进行KLF1突变基因分型后发现,其中52例受试者携带KLF1突变,即在不存在β地贫突变的前提下,个体单独携带KLF1突变也可导致Hb A2水平升高[28]。一项关于中国人群KLF1变异携带频率的β地贫大样本队列研究,其中有16例携带KLF1突变的非地贫携带者Hb A2水平处于临界高值,均值为(3.28±0.45)%,48例携带KLF1突变的β地贫患者队列Hb A2水平升高,均值为(6.51±0.81)%[29-30]。另一项1 468例中国α-地贫人群KLF1变异携带频率的研究表明,有72例伴KLF1突变的α-地贫个体,Hb A2水平较无KLF1突变携带的个体升高,均值为(3.3±0.40)%[30-31]。因此,建议对临界升高的Hb A2病例,尤其是伴有Hb F升高的,进行KLF1测序,并将此作为地贫筛查计划的一部分。
SUPT5H是近年来新发现的一个可影响Hb A2水平的基因。来自荷兰、希腊和法国的5个家系的26例SUPT5H变异携带者研究表明,SUPT5H变异携带者Hb A2范围为4.7%~12.4%,SUPT5H变异携带者伴有Hb A2升高,但是MCV和MCH可表现为显著降低,亦可表现为处于正常水平。这些特殊家系案例提示SUPT5H可作为一种潜在的δ-珠蛋白链调节基因的作用[32-33]。一项47 336例东莞地区受试者血液学表型与基因型关联的研究中[34],有38例无HBB基因或KLF1变异伴Hb A2升高的可疑受试者,其中有7例携带SUPT5H变异,这一发现强调综合分子诊断对预防地贫出生缺陷的重要性。另外,遗传性球形红细胞症、巨成红细胞性贫血和甲状腺机能亢进等多种因素亦可影响Hb A2水平,干扰地贫筛查的结果,医务人员进行地贫诊断时需予以鉴别排除[24]。
综上所述,地贫筛查是预防地贫发生的关键,常用的血细胞分析和血红蛋白电泳检测操作简便,易于推广,针对不同的人群和不同地贫筛查的目的,应根据具体情况选择不同的筛查策略,目前有大量的临床研究致力于寻找适合区域特性的最佳筛查策略,试图尽量减少地贫的遗漏或误诊。针对高发地区应加强地贫筛查的力度和推动产前诊断技术的发展,进而从根本上减少重型地贫患儿的出生。本文通过归纳总结地贫筛查指标的临床情况,希望能使同道们更全面地了解地贫筛查并对各项筛查参数有更深的理解,从而更好地指导临床诊断和提供遗传咨询。
利益相关声明:论文内容不涉及相关利益冲突,该研究未涉及任何厂家及相关雇主或其他经济组织直接或间接的经济或利益的赞助。
作者贡献说明:商璇负责组织起草论文框架,提供写作思路和参考文献,并对论文内容进行审阅及修订;王星敏负责文献查阅和整理,论文撰写。
