卵巢上皮性癌转移的关键基因筛选与功能分析*
2023-11-08吴巧铃陈雨微
吴巧铃,姜 山,2**,陈雨微,孙 阳***
(1.福建省肿瘤医院妇科 福建医科大学肿瘤临床医学院,福州 350014;2.福建中医药大学中西医结合学院,福州 350122)
卵巢癌死亡率居于妇科恶性肿瘤首位,由于临床表现隐匿、早期症状不典型且缺乏有效的筛查手段,大多数患者确诊时已为晚期[1-2]。卵巢癌亚型复杂,具有不同的分子生物学特征,即使采用外科手术辅以全身化疗这一首选治疗方案,几乎所有患者都会复发[3-4]。进一步深入研究卵巢癌转移机制,并在此基础上寻找新的治疗靶点具有重要意义。PXN作为一种蛋白质编码基因,编码细胞骨架蛋白——桩蛋白(paxillin),该蛋白联合VCL(vinculin)和ZYX(zyxin)蛋白通过LC3参与细胞和黏着斑(FAs)位点的黏附过程,影响癌细胞的迁移和侵袭[5-7]。本研究挖掘卵巢癌中高表达的迁移侵袭相关基因PXN并验证其生物学功能,以期为晚期卵巢癌转移机制提供新的理论依据和治疗新靶点。
1 材料与方法
1.1 细胞系与试剂 卵巢癌细胞系SKOV3细胞由福建医科大学基础医学院赠送。McCoy's 5A培养基购自上海源培生物科技公司;新生胎牛血清购自德国PAN公司;兔抗人PXN单克隆抗体购自英国Abcam公司;兔抗人GAPDH单克隆抗体购自美国CST公司;HRP标记的羊抗兔第二抗体购自北京中杉金桥公司;ECL化学发光试剂购自大连美仑生物公司;RNA提取试剂盒购自美国Promega公司;逆转录试剂盒购自Roche公司;Transwell透明小室及Matrigel基质胶购自美国Corning公司;PXN稳定敲减慢病毒载体购自上海吉凯基因公司。
1.2 筛选、分析卵巢上皮性癌(卵巢癌)转移的关键基因
1.2.1 卵巢癌公共测序数据获取及处理 通过UCSC Xena(University Of Cingifornia Sisha Cruz,加州大学圣克鲁兹分校)门户下载来自于TCGA(The Cancer Genome Atlas,癌症基因组图谱)数据库的卵巢癌组织测序数据作为训练集,以及来自GTEx(Genotype-Tissue Expression Project,基因型-组织表达数据库)的正常卵巢组织测序数据,并通过TCGA数据库补充训练集缺失的临床信息[8]。通过GEO(Gene Expression Omnibus,基因表达综合)数据库下载卵巢癌基因芯片数据及临床信息GSE26712作为验证集[9]。所有数据利用软件R进行基因注释,并处理为log2(TPM+1)进行后续分析,删除缺失值,相同基因取平均值去重。
1.2.2 迁移侵袭能力相关基因的获取 在GeneCards(人类基因数据库,https://www.genecards.org/)综合数据库中分别输入搜索词“migration”和“invasion”,从该数据库下载迁移侵袭相关基因,以相关分数“Relevance score”>7为条件,筛选出与细胞迁移侵袭能力相关性较高的基因。
1.2.3 差异表达分析 利用R 4.2.2及limma算法联合TCGA与GTEx数据库进行差异表达分析,对比迁移侵袭相关基因在卵巢癌组织与正常卵巢组织中的表达水平。以差异表达倍数logFC>1和adj.P<0.001为筛选条件,寻找在卵巢癌组织中高表达的迁移侵袭相关基因。应用“ggplot2”R包绘制火山图对差异表达分析结果进行可视化。
1.2.4 生存分析 根据迁移侵袭相关基因表达中位值将全部卵巢癌样本分为高低表达两组,应用“survival”R包计算高低表达两组之间生存差异。通过交集获取在训练集TCGA队列及验证集GSE26712队列都具有统计学意义(P<0.05)的迁移侵袭相关基因,应用“survminer”R包进行生存曲线可视化。
1.2.5 GO/KEGG功能富集分析 基于TCGA卵巢癌数据集以“cortest”函数进行相关性分析,以|R|>0.7及P<0.05为筛选标准,获得与迁移侵袭基因显著相关的基因群,应用“clusterProfiler”R包对基因群进行功能富集分析,“GOplot”R包进行富集结果可视化,富集分析结果以adjP<0.05为标准过滤。
1.3 药物IC50值预测 依据TCGA-OV队列相应的临床信息,利用GDSC(癌症药物敏感性基因组学)数据库预测了每个样本的化疗反应。预测过程由R包pRRophetic实现,其中样品的半数最大抑制浓度(IC50)通过岭回归估计,所有参数均按默认值设置,使用“combat”的批次效应和“all”的组织类型,并将重复基因表达总结为平均值。
1.4 细胞实验方法
1.4.1 细胞培养 将SKOV3细胞置于含10%胎牛血清、1%青霉素-链霉素溶液的McCoy's 5A培养基中,置于37℃、5%CO2培养箱中常规培养,细胞密度达80%时,进行传代培养。
1.4.2PXN稳定敲减卵巢癌细胞系的构建PXN稳定敲减慢病毒载体(GV493-PXN-EGFP)由上海吉凯基因公司设计并合成,感染敲减慢病毒的组别为实验组(shPXN),以不转染病毒作为空白对照(Mock)、转染空载病毒(Ctrl)作为对照。具体方法:除去多余培养基,分别加病毒、培养基及相应感染增强液,轻柔混匀,常规培养。12h后除去多余培养基,用PBS轻柔清洗2次,加常规培养基。采用嘌呤霉素筛选稳定感染细胞株,若荧光显微镜下感染效率>80%,表明嘌呤霉素筛选出稳定感染细胞株,可收集细胞扩大培养并进行后续实验。
1.4.3 实时荧光定量聚合酶链式反应(RT-qPCR) 取各组SKOV3细胞样本,按试剂盒说明书提取总RNA。逆转录的反应程序:55℃反应30min,85℃反应5min,4℃反应至结束;qPCR反应程序:95℃预变性10min,95℃变性15s,60℃反应1min,共30个循环。PXN基因引物序列,上游:5'-CAATGGCACAATCCTTGACC-3',下游:5'-GTGATGAGGACTGAGGCTG-3';GAPDH基因为内参照,其引物序列,上游:5'-ACAACTTTGGTATCGTGGAAGG-3',下游:5'-GCCATCACGCCACAGTTTC-3'。采用2-ΔΔCt方法计算PXNmRNA表达水平,其中Ct表示循环阈值。
1.4.4 蛋白免疫电泳(Western blot) 取各组SKOV3细胞样本,加细胞裂解液,提取总蛋白,进行十二烷基硫酸钠(sodium dodecyl sulfate,SDS)-聚丙烯酰胺凝胶电泳(polyacrylamide gel electrophoresis,PAGE)电泳,聚偏二氟乙烯(polyvinylidene difluoride,PVDF)转膜,5%脱脂奶粉封闭2h,加稀释后的一抗(PXN按1∶1000稀释,GAPDH按1∶5000稀释),4℃摇床过夜。洗膜,加二抗,37℃摇床孵育60min。取强化学发光(enhanced chemiluminescence,ECL)试剂A、B液按体积1∶1混合,加至PVDF膜,用蛋白曝光仪对目的蛋白条带进行曝光、扫描、照相。
1.4.5 细胞划痕实验 将实验组、阴性对照组和空白对照组细胞分别按2×105细胞/孔接种于6孔板,置37℃、5%CO2培养箱孵育过夜,观察细胞融合率达90%以上并在6孔板底部形成单层细胞。除去多余培养基,采用无菌枪头垂直于板底进行划痕,加无血清培养基,分别培养0、24h,显微镜下观察、测量划痕的宽度,并拍照,采用Image J软件分析划痕面积,计算细胞迁移率以评估细胞的迁移能力,细胞迁移率(%)=(0h的划痕面积-24h的划痕面积)/0h的划痕面积×100%。
1.4.6 Transwell迁移侵袭实验 在Transwell小室(24孔板)上室加稀释后(稀释倍数1∶5)的Matrigel基质胶70μL(迁移实验则无需)。取对数生长期SKOV3细胞,用无血清培养基重悬,按1×105/孔细胞加入Transwell小室的上室,在下室中加含10%胎牛血清的McCoy's 5A培养基,随后置于37℃、5%CO2培养箱培养24h。经甲醛固定、结晶紫染色,显微镜下观察、拍照,Image J软件计数穿膜细胞数,以此反映细胞的迁移侵袭能力。
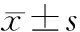
2 结 果
2.1 影响卵巢癌迁移侵袭能力的预后相关基因
2.1.1 筛选在卵巢癌组织中高表达的迁移侵袭相关基因 从GeneCard数据库分别下载影响细胞迁移与侵袭能力的基因,以相关分数(Relevance score)>7为条件,筛选出与迁移侵袭相关性均较高的基因55个。联合TCGA和GTEx数据库,基于R语言“limma”算法对筛选出的55个基因进行差异表达分析,火山图用于可视化。以logFC(差异倍数)>1和adj.P(统计学方法校正后的P)<0.001为筛选条件,发现36个迁移侵袭相关基因在卵巢癌组织高表达,1个迁移侵袭相关基因在卵巢癌组织低表达(图1)。
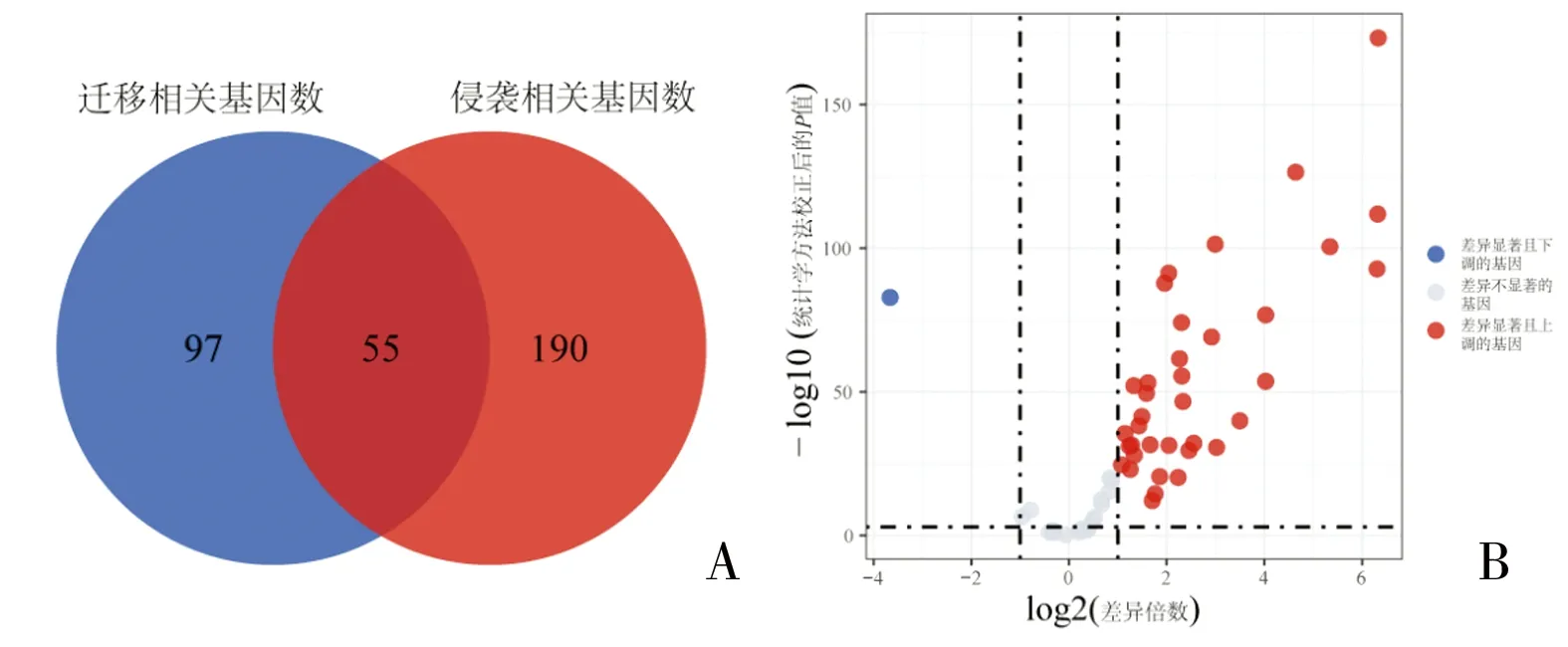
图1 筛选在卵巢癌组织中高表达的迁移侵袭相关基因A:Genecards数据库中迁移与侵袭相关基因的集合情况;B:火山图展示迁移侵袭相关基因在卵巢癌组织与正常卵巢癌组织中的表达差异
2.1.2 各队列生存预后相关基因情况 基于TCGA-OV队列(训练集)和GEO数据库中的GSE26712数据集(验证集),依据基因表达的中位数将样本分为高低表达组,利用R语言和Kaplan-Meier生存曲线对36个高表达基因进行生存分析后取交集,发现1个迁移侵袭相关基因具有生存预后意义(P<0.05),该基因为PXN。见图2。
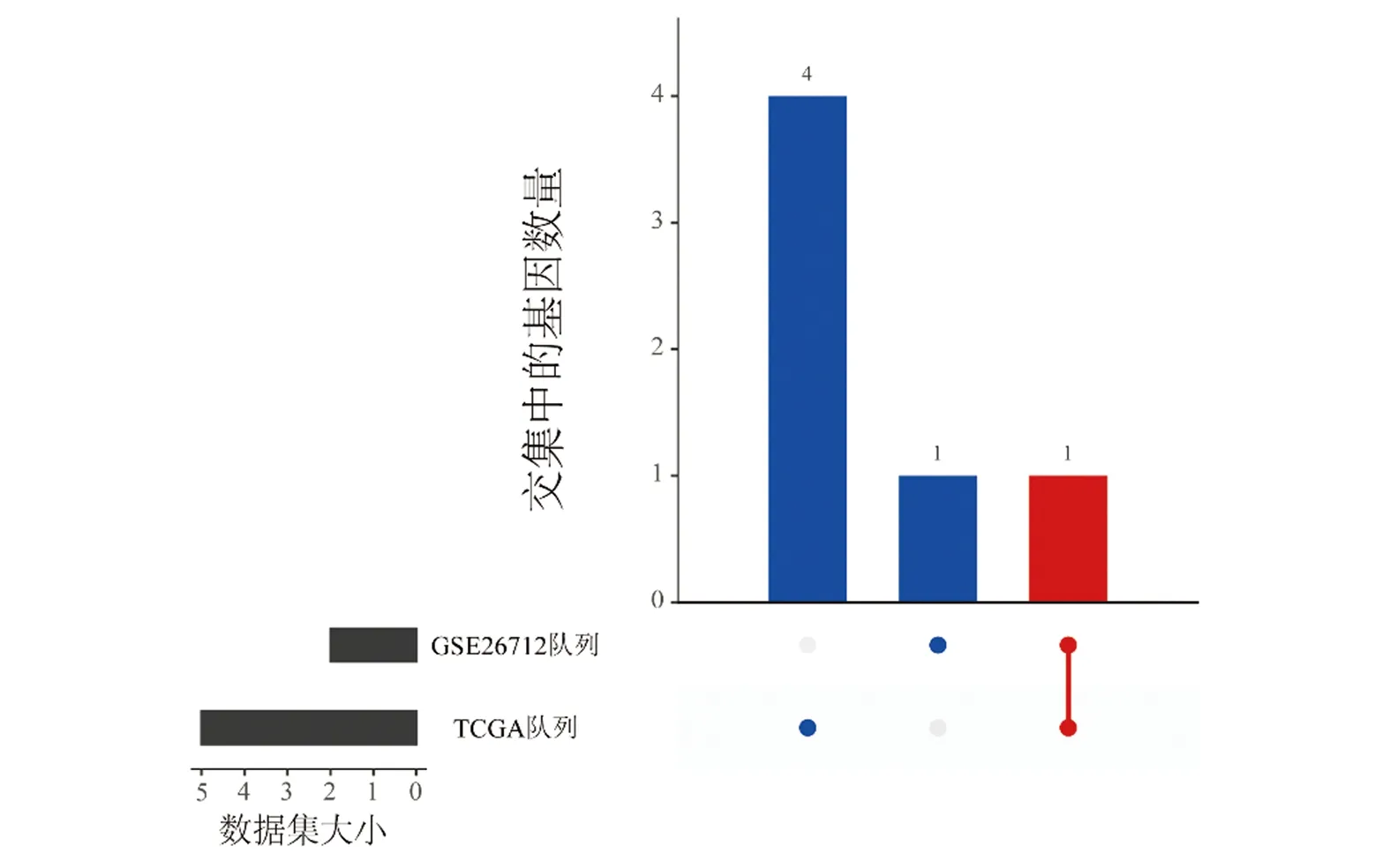
图2 各队列生存预后相关基因情况
利用Kaplan-Meier生存曲线对36个高表达基因进行生存分析后取交集,GSE26712队列中有1个基因具有预后意义,TCGA-OV队中有4个基因具有预后意义,在两个队列中均有预后意义的基因有1个
2.1.3PXN基因对卵巢癌患者总生存期的影响 进一步对交集中的PXN基因进行生存曲线可视化,发现其与卵巢癌患者不良预后相关,随着基因表达量增加,患者的总生存期明显缩短,差异有统计学意义(P<0.05),见图3。

图3 PXN基因对卵巢癌患者总生存期的影响A:利用TCGA数据库探讨PXN基因对卵巢癌患者总生存期的影响;B:利用GSE26712数据集探讨PXN基因对卵巢癌患者总生存期的影响
2.1.4PXN基因GO功能富集分析结果 通过GO/KEGG功能富集分析探索PXN参与的生物过程(biological process,BP)。结果表明PXN的功能与组蛋白修饰、染色质共价修饰、赖氨酸肽基修饰、蛋白质去泛素化、通过去除小蛋白进行蛋白质修饰、组蛋白去泛素化及组蛋白H3-K4三甲基化等相关(P<0.05),见图4。
图4 PXN基因GO功能富集分析结果
2.2 敲减PXN基因对卵巢癌细胞迁移侵袭能力的影响
2.2.1 成功敲减PXN基因 利用敲减慢病毒载体感染卵巢癌细胞SKOV3后,Western blot检测结果示,PXN敲减组(shPXN)的paxillin蛋白表达水平明显低于空白对照组(Mock)和阴性对照组(Ctrl)(P<0.0001);RT-qPCR检测结果示,PXN敲减组(shPXN)的PXNmRNA表达水平明显低于空白对照组(Mock)和阴性对照组(Ctrl)(P<0.01)。表明慢病毒已成功感染卵巢癌细胞,并干扰PXN基因的转录及翻译。见图5。
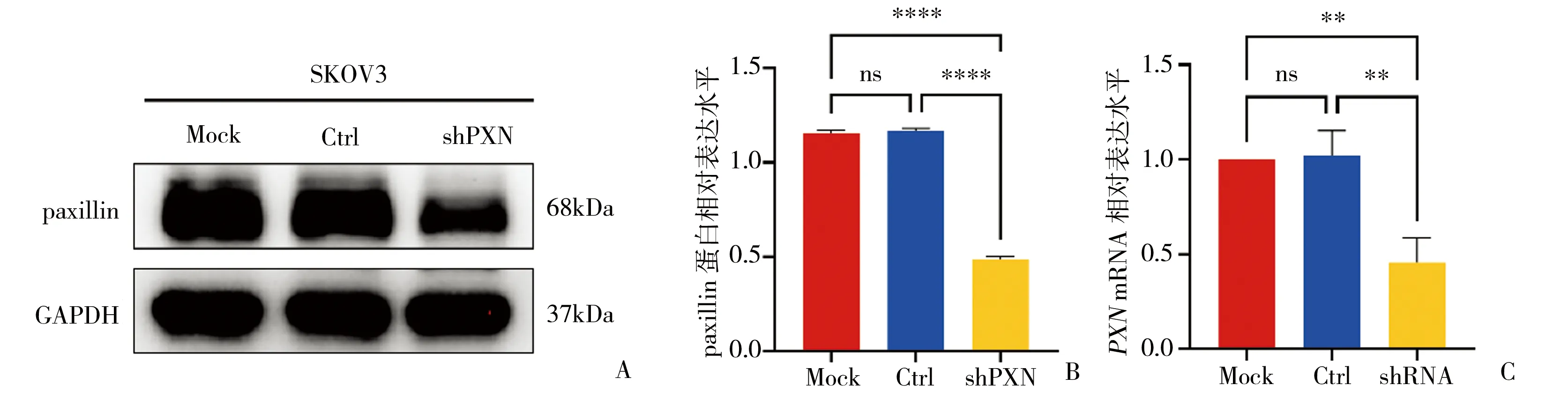
图5 验证PXN基因敲减效果A、B:Western blot检测各组细胞paxillin蛋白表达;C:RT-qPCR检测各组细胞PXN mRNA表达;Mock:空白对照组,Ctrl:阴性对照组,shPXN:PXN敲减组,**P<0.01,****P<0.0001
2.2.2 敲减PXN基因抑制卵巢癌细胞SKOV3的迁移侵袭能力 划痕实验进行到24h时,PXN敲减组(shPXN)的划痕愈合面积明显少于空白对照组(Mock)和阴性对照组(Ctrl),差异有统计学意义(P<0.001)(图6A)。表明敲减PXN基因抑制卵巢癌细胞SKOV3细胞愈合能力、迁移能力。

图6 各组SKOV3细胞迁移侵袭能力A:细胞划痕实验检测;B:PXN敲减后SKOV3细胞迁移数改变;C:PXN敲减后SKOV3细胞侵袭数改变;Mock:空白对照组;Ctrl:阴性对照组;shPXN:PXN敲减组,**P<0.01,***P<0.001,****P<0.0001
Transwell实验检测结果显示,与空白对照组(Mock)和阴性对照组(Ctrl)比较,PXN敲减组(shPXN)穿膜细胞数明显减少,差异有统计学意义(P<0.01)(图6B、C)。表明敲减PXN基因可抑制卵巢癌细胞SKOV3体外迁移侵袭能力。
2.3PXN基因对卵巢癌化疗耐药的潜在影响PXN高表达组中顺铂及紫杉醇的IC50值明显高于PXN低表达组(P<0.001),而吉西他滨及多柔比星的IC50值明显低于PXN低表达组(P<0.0001)。肿瘤细胞(PXN高表达组及PXN低表达组)中紫杉醇IC50明显低于正常卵巢细胞(P<0.0001),吉西他滨及多柔比星的IC50值高于正常卵巢细胞(P<0.0001)。见图7。
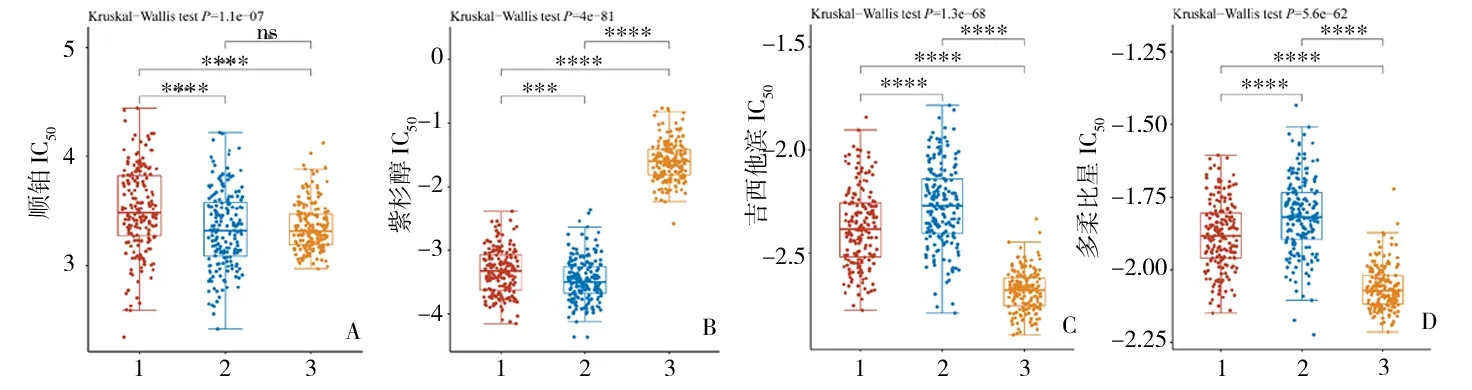
图7 PXN基因表达水平对药物IC50的影响A:不同组别顺铂的IC50;B:不同组别紫杉醇的IC50;C:不同组别吉西他滨的IC50;D:不同组别多柔比星的IC50;1:PXN高表达;2:PXN低表达;3:正常卵巢组织***P<0.001,****P<0.0001
3 讨 论
大多数卵巢癌患者确诊时已为晚期,且70%的晚期上皮性卵巢癌患者会出现癌症复发、生存率极低,因此肿瘤转移的分子机制越来越引起研究者的重视[10]。本研究发现,36个迁移侵袭相关基因(Relevance score>7)在卵巢癌中高表达(logFC>1和adj.P<0.001),它们可能是潜在的致癌基因,通过编码相关蛋白促进卵巢癌的转移。为进一步将基础研究与临床特征相关联,探索迁移侵袭相关基因的高表达与卵巢癌患者总生存时间是否存在联系,对卵巢癌中高表达的36个迁移侵袭相关基因进行了多队列生存分析,结果发现在不同队列中PXN基因高表达都与患者不良预后相关(P<0.05)。GO/KEGG功能富集分析结果提示,PXN基因与染色质的修饰调控相关,PXN基因可能通过干预转录参与细胞的恶性化过程。
PXN基因编码的paxillin蛋白分子量大小为68kDa,是整合素调节信号传导的重要组成部分,能将肌动蛋白连接到富含整合素的细胞黏附位点,在细胞-基质和细胞-细胞黏附之间起重要作用[11]。多项研究已表明,PXN基因能调节肿瘤细胞的生物学功能,如PXN基因能通过维持细胞间黏附连接完整性来促进乳腺肿瘤细胞侵袭;通过增加Src表达促进NF-κB的活化,促进卵巢癌血管生成;降低PXN基因表达,抑制ERK信号通路抑制直肠癌的转移和上皮-间充质转化[12-14]。PXN作为迁移侵袭相关基因在卵巢癌中的作用机制尚不清楚,既往研究提示PXN基因可能作为致癌因子促进卵巢癌的转移。
本研究结果显示,PXN敲减抑制卵巢癌SKOV3细胞的愈合及体外迁移侵袭能力。PXN基因的生物学功能在其他肿瘤中也得到相应的验证,敲减PXN基因抑制胃癌细胞、头颈部鳞状细胞癌细胞及非小细胞肺癌细胞的迁移侵袭[15-17];通过调控细胞凋亡抑制宫颈癌细胞增殖与黏附[18];抑制裸鼠体内结直肠癌的生长[19]。提示PXN基因能促进卵巢癌细胞侵袭转移。这与本研究生物信息分析结果相吻合。PXN基因是卵巢癌治疗的潜在靶点,可能通过调控细胞黏附影响细胞的迁移侵袭能力,其促癌能力或许是卵巢癌患者不良预后的因素之一。
本研究结果显示,PXN高表达降低卵巢癌细胞对顺铂和紫杉醇的敏感性,而吉西他滨和多柔比星或许是更具潜力的备选药物。但总体来说,紫杉醇仍是最优选择,因肿瘤细胞中紫杉醇IC50明显低于正常卵巢细胞,或许能最大程度地降低化疗药物对卵巢癌患者的伤害。
综上所述,PXN作为迁移侵袭相关基因在卵巢癌中呈相对高表达,且与患者不良预后及对化疗药物的敏感性相关,敲减PXN能抑制卵巢癌细胞SKOV3的迁移侵袭,可能是潜在的转移预测标志物。PXN基因调控卵巢癌迁移侵袭的机制及临床转化应用尚待进一步研究,本课题组将在后续的研究中为晚期卵巢癌的靶向治疗寻找更多的理论依据和实验基础。
