胎盘WNT5A表达异常通过影响滋养细胞侵袭参与子痫前期发生*
2023-11-08孙凤萱赵洪进邓建业
郭 玲,孙凤萱**,赵洪进,邓建业,宋 坤,杜 鹏,李 艳***
(1.山东大学生殖医学研究中心,济南 250012;2.山东第一医科大学附属省立医院,济南 250021;3.山东大学齐鲁医院妇产科,济南 250012;4.北京大学生命科学学院,北京 100871)
子痫前期(preeclampsia,PE)是一种妊娠期高血压疾病,多于妊娠20周后出现,常伴有多系统受累和损害,发病率约为2%~8%[1-2]。PE常引起孕产妇HELLP综合征、胎儿宫内生长受限(intrauterine growth retardation,IUGR)、早产等严重并发症,并可增加患者及子代远期心血管疾病风险[3-4]。胎盘形成过程中滋养细胞浸润过浅与PE的发生发展密切相关,但其具体分子机制尚未明确,缺乏有效的早期诊断和治疗方法[1]。因此,深入阐明PE的发病机制并鉴定有效靶标分子有助于针对PE及其他胎盘功能障碍相关妊娠疾病的精准诊疗体系的建立。
WNT/β-catenin信号通路在滋养细胞融合、分化、增殖、侵袭和迁移等过程中均发挥着重要作用[5]。WNT家族成员5A(WNT5A)是一种分泌蛋白,属于β-catenin非依赖WNT通路的经典配体,可调节细胞增殖、侵袭、迁移、极性以及分化等,在胚胎发育和器官稳态中发挥重要作用[6]。目前,WNT5A在PE患者胎盘组织中的表达及其对人滋养细胞侵袭的调节作用仍存较大争议[7-9]。骨形态发生蛋白2(bone morphogenetic protein-2,BMP2)属于转化生长因子-β超家族中一员,已被确定为人类子宫内膜蜕膜化的生物标志物,可通过激活经典的SMAD1/5/9-SMAD4信号通路,进而调节下游基因的表达发挥其生物学作用[10]。但BMP2对WNT信号通路的影响及其与PE的关系目前鲜少研究。本研究旨在评估胎盘WNT5A表达水平与PE严重程度的相关性,并探讨BMP2对WNT5A表达的调控作用及PE发生的潜在分子机制,以期为PE的早期诊疗提供新思路。
1 资料与方法
1.1 实验材料
1.1.1 研究对象 选择2020年5月至2020年12月于山东第一医科大学附属省立医院产科行剖宫产终止妊娠的27例PE孕妇(PE组)和38例血压正常的健康孕妇(对照组),收集所有研究对象的胎盘组织。PE组纳入标准:(1)妊娠20周后新发高血压伴蛋白尿(≥0.3mg尿蛋白/24h);(2)单胎妊娠;(3)未使用辅助生殖技术。排除标准:(1)先前存在继发性/原发性高血压、妊娠期糖尿病及心血管疾病;(2)患有慢性自身免疫性疾病(如系统性红斑狼疮、甲状腺自身免疫或抗磷脂综合征等);(3)有不良孕产史或其他妊娠合并症等。对照组为同期因臀位、子宫瘢痕和社会因素等选择剖宫产终止妊娠的血压正常且无其他妊娠合并症的健康孕妇。本研究已获得山东大学附属生殖医院医学伦理委员会批准,所有受试者均签署知情同意书。
1.1.2 细胞系和细胞培养 永生化人绒毛滋养层细胞系HTR8/SVneo购自美国ATCC公司,细胞培养使用含10%胎牛血清(FBS)和1%双抗(青霉素-链霉素)的DMEM/高糖培养基。置37℃、5% CO2和95%湿度细胞培养箱孵育,培养基每隔一天更换一次。重组蛋白添加前,将细胞维持在含0.1% FBS和1%双抗(青霉素-链霉素)的DMEM/高糖培养基中饥饿处理24h。
1.1.3 人类原代绒毛外滋养细胞(extravillous trophoblasts,EVT)分离和培养 人类原代EVT于人类孕早期(妊娠6~9周)的新鲜绒毛组织中机械分离得到[11-12]。分离纯化的人类原代EVT细胞使用含10% FBS和1%双抗(青霉素-链霉素)的DMEM/F-12培养基培养。
1.1.4 主要试剂 DMEM/高糖培养基、DMEM/F-12培养基、FBS均购自美国Thermo Fisher公司;青霉素-链霉素、胰蛋白酶均购自美国GE Hyclone公司;人重组BMP2和WNT5A蛋白均购自美国R&D公司;WNT5A Taqman引物购自美国Thermo Fisher公司;α-Tubulin抗体购自美国Santa Cruz公司;WNT5A、β-catenin抗体购自美国CST公司;Matrigel基质胶购自美国BD Biosciences公司;8μm Transwell培养板购自美国Corning公司。
1.2 实验方法
1.2.1 Transwell细胞侵袭实验 去生长因子的Matrigel基质胶与无血清培养基按1∶8稀释混匀,50μL/孔覆盖Transwell小室,37℃温箱,静置2h。每个小室中用250μL含0.1% FBS的DMEM培养基种植5×104个细胞,小室下方加750μL含10% FBS的DMEM培养基。于培养箱中静置孵育36h,棉签擦去小室膜内侧未侵袭的细胞,用预冷的甲醇固定细胞20min,PBS冲洗,Hoechst33258染细胞核30min。在荧光显微镜下拍照,每个小室随机选取5个视野,计算细胞数后取平均值。
1.2.2 实时荧光定量PCR(RT-qPCR) 使用Trizol Reagent提取胎盘组织和细胞总RNA,检测RNA浓度和纯度。使用Prime Script RT reagent Kit进行RNA反转录合成cDNA,并将制备好的cDNA进行PCR扩增。每个样品做3个复孔重复检验,GAPDH为参照,采用2-ΔΔCt计算mRNA表达量相对值。引物序列:WNT5A-F:CCTGAAGGAGAAGTACGACAG,WNT5A-R:CCTGAAGGAGAAGTACGACAG;GAPDH-F:GAGTCAACGGATTTGGTCGT,GAPDH-R:GACAAGCTTCCCGTTCTCAG。
1.2.3 蛋白免疫印迹 使用含适量蛋白酶抑制剂的RIPA裂解缓冲液提取细胞总蛋白。使用BCA试剂盒按说明书检测蛋白浓度后进行SDS-PAGE凝胶电泳。湿转法将目的蛋白转移至PVDF膜,5%脱脂奶粉封闭1h,加一抗4℃过夜孵育,TBST洗膜,加相应二抗,室温摇床孵育1h,用ECL法化学发光后采集图像。
1.2.4 RNA-seq测序 将经空白对照和外源性BMP2处理24h后的HTR8/SVneo细胞,干冰冷冻寄送生物公司进行RNA-seq测序。提取mRNA,PCR扩增,2%琼脂糖凝胶回收目的条带,定量后按比例混合上机。桥式PCR扩增生成clusters,Illumina Hiseq测序平台测序。数据进行差异基因注释和富集,筛选Cut offP≤0.05,fold change≥2的基因进行共表达网络分析。
2 结 果
2.1 正常组与PE组患者的一般资料比较 PE组分娩时体重、体质量指数(body mass index,BMI)、收缩压(systolic blood pressure,SBP)、舒张压(diastolic blood pressure,DBP)、平均动脉压、早产率及小于孕龄儿(small for gestational age infant,SGA)比例均高于正常对照组,而分娩孕周和新生儿出生体重均低于正常对照组,差异均有统计学意义(P<0.05)(表1)。

表1 PE组与Control组患者一般资料比较
2.2 WNT5A在PE胎盘中表达降低 RT-qPCR结果显示,与正常对照组相比,PE组胎盘组织中WNT5A表达水平明显降低(P<0.0001)(图1)。
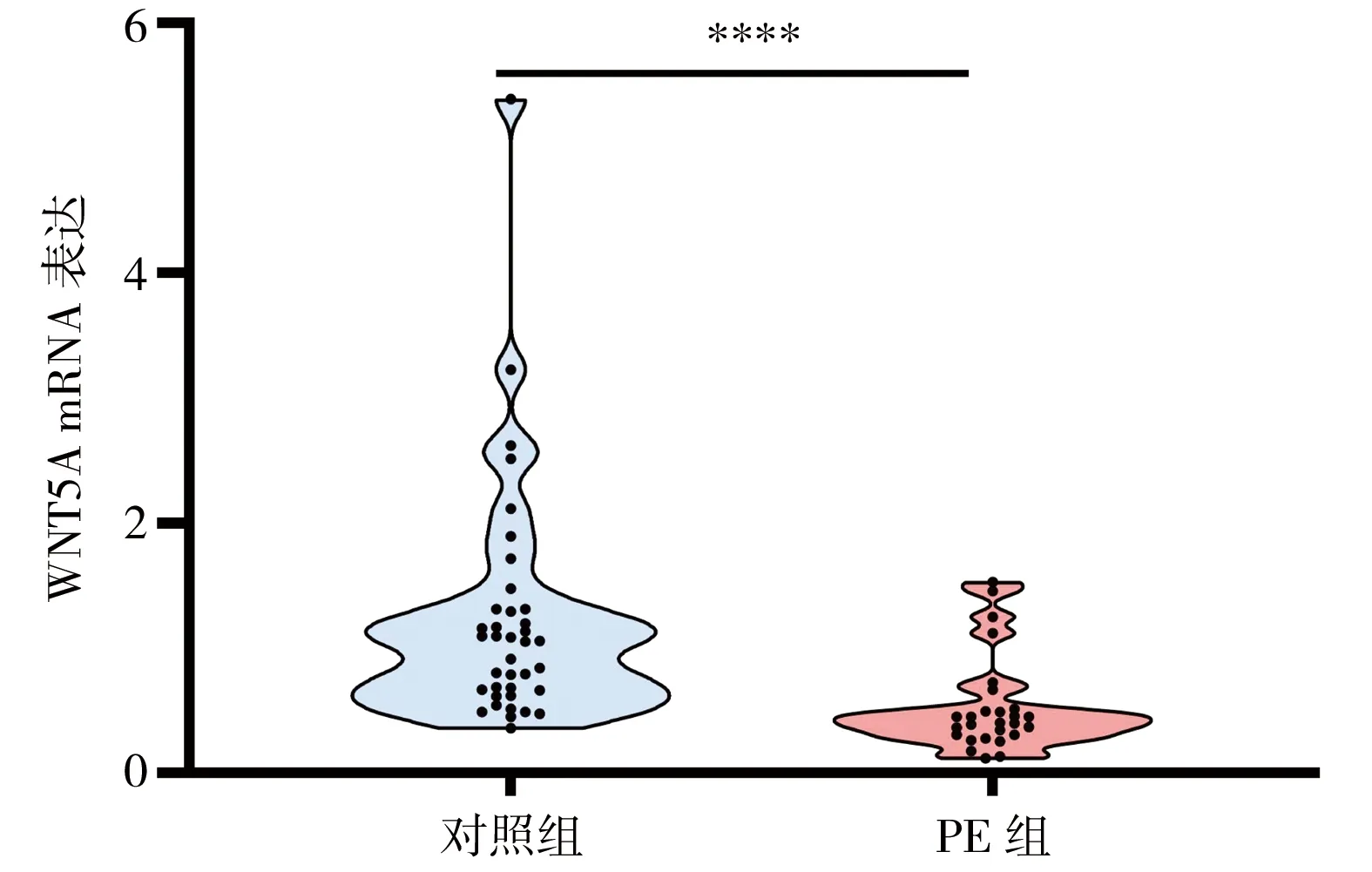
图1 WNT5A在PE胎盘组织中表达水平****P<0.001
2.3 胎盘WNT5A mRNA水平与PE严重程度相关 与对照组相比,PE组血清肌酐(creatinine,Cr)、尿素氮(blood urea nitrogen,BUN)、谷丙转氨酶(alanine aminotransferase,ALT)、谷草转氨酶(aspartate amintransferase,AST)、乳酸脱氢酶(lactate dehydrogenase,LDH)水平均显著升高,差异有统计学意义(P<0.05),但各项指标均在临床正常值范围内(表2)。胎盘WNT5A可较好地用于评估PE严重程度,曲线下面积(area under curve,AUC)为0.844(95%CI为0.74~0.95,P<0.001)(图2)。
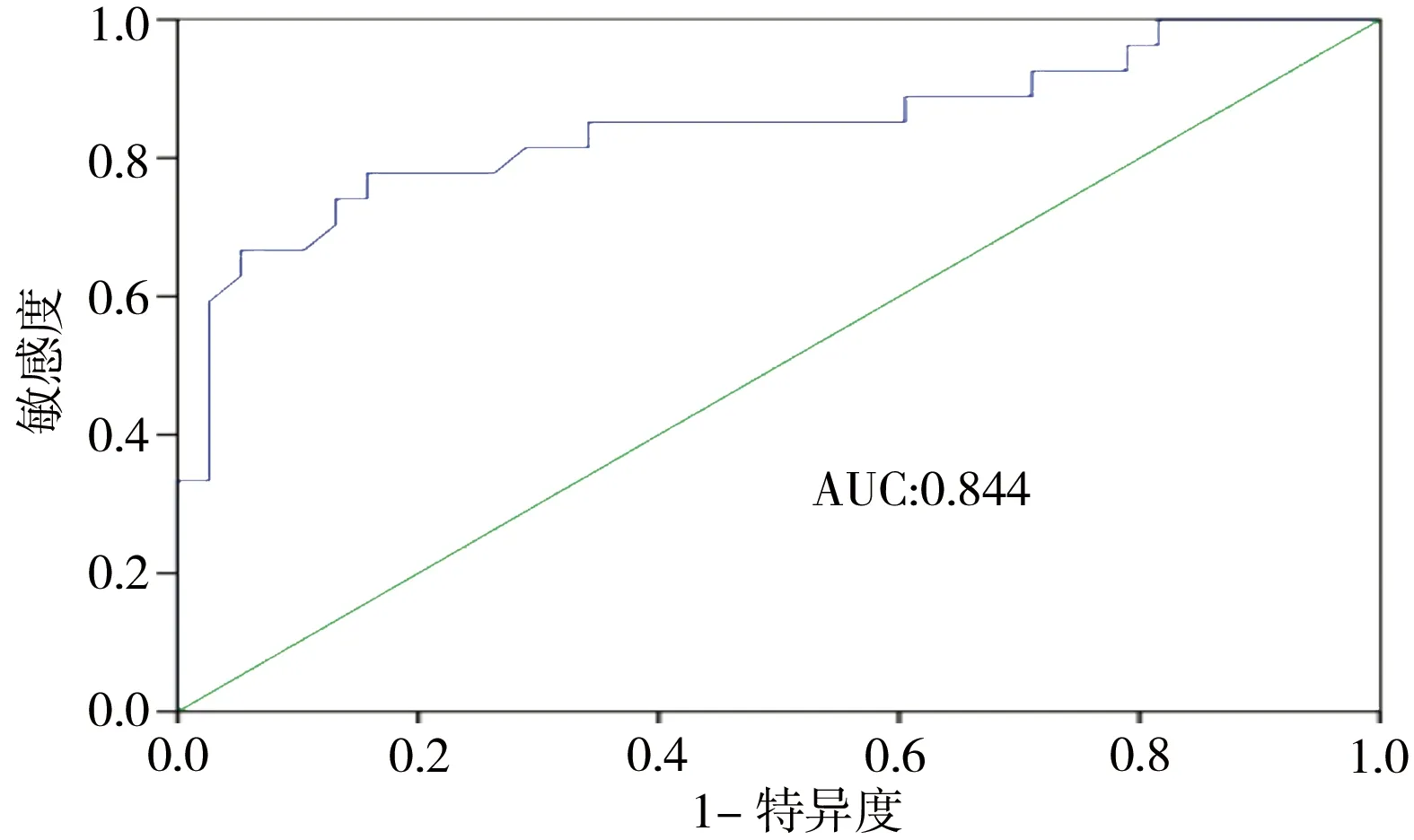
图2 胎盘WNT5A水平与PE严重程度相关
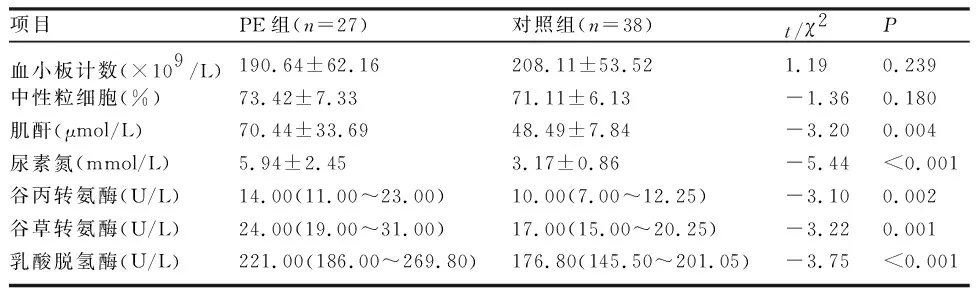
表2 PE组与Control组患者相关实验室指标比较
2.4 WNT5A促进滋养细胞侵袭并抑制β-catenin活性 HTR8/SVneo细胞暴露于含人重组WNT5A蛋白(200ng/mL)的DMEM培养基中并进行Transwell侵袭力测定,结果显示,WNT5A处理组侵袭细胞数显著增多(P<0.01)(图3A)。人原代EVT细胞中,Western blot法结果显示,与空白对照相比,WNT5A处理组降低活化β-catenin蛋白的表达,差异有统计学意义(P<0.05)(图3B)。
2.5 BMP2下调WNT5A表达 HTR8/SVneo细胞经人重组BMP2蛋白(25ng/mL)处理24h后,转录组测序(RNAseq)结果火山图显示WNT5A mRNA水平显著降低(图4A);差异显著的基因主要富集于“TGF-β信号通路”、“WNT信号通路”和“细胞黏附”等相关的信号通路中(图4B)。
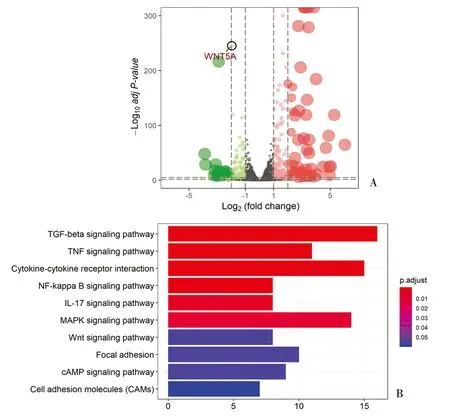
图4 BMP2处理人滋养细胞系HTR8/SVneo细胞后转录谱测序分析A:BMP2和空白对照处理后(n=3)差异表达基因的火山图;B:差异表达基因所在的信号通路富集分析结果
为了进一步验证RNAseq结果,使用25ng/mL人重组BMP2蛋白分别处理HTR8/SVneo和人类原代EVT细胞,同时设置3、6、12、24h时间梯度,RT-qPCR结果表明BMP2降低了HTR8/SVneo细胞和人类原代EVT细胞中WNT5A mRNA水平(图5A、B)。Western blot法结果显示,BMP2降低了WNT5A蛋白表达水平,但增加了细胞内活化的β-catenin蛋白水平(图5C~H)。
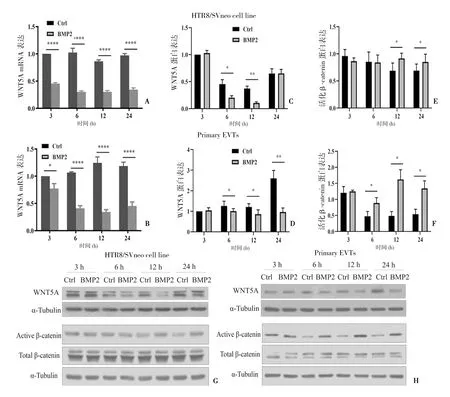
图5 BMP2对滋养细胞WNT5A和β-catenin表达的影响A、B:RT-qPCR检测WNT5A mRNA表达;C~H:Western blot法检测WNT5A和β-catenin蛋白表达;*P<0.05,**P<0.01,****P<0.01
2.6 BMP2通过激活SMAD1/5/9-SMAD4通路负调控WNT5A表达 HTR8/SVneo细胞先用DMSO或BMP2受体抑制剂DMH-1预处理1h,经人重组BMP2蛋白(25ng/mL)或空白对照处理24h,RT-qPCR结果显示BMP2受体抑制剂DMH-1预处理可阻断BMP2对WNT5A mRNA水平的下调(图6A)。Western blot法结果显示BMP2可上调磷酸化的SMAD1/5/9蛋白的表达(图6B),并且DMH-1预处理可消除BMP2介导的这一作用(图6C)。
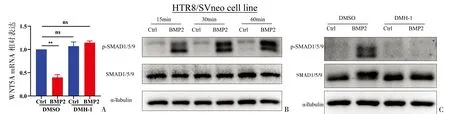
图6 BMP2受体抑制剂DMH-1阻断BMP2激活SMAD1/5/9通路介导的WNT5A下调A:RT-qPCR测定WNT5A mRNA表达;B:Western blot法检测SMAD1/5/9蛋白表达;C:Western blot法检测磷酸化SMAD1/5/9蛋白表达
2.7 WNT5A参与PE发生的作用模式图 母胎界面WNT5A表达不足通过影响滋养细胞侵袭过程,引起胎盘发育异常,导致PE发生(图7)。
3 讨 论
PE是妊娠期常见的胎盘源性疾病,严重影响母胎健康,是孕产妇和围产期胎儿死亡的主要原因之一[13]。目前主流观点认为,妊娠早期滋养细胞侵袭受损和胎盘螺旋动脉重塑不足是PE发生发展中的重要事件,而蜕膜化异常在PE发生过程中的作用亦得到越来越多的关注[14]。在胎盘形成和母胎界面建立的过程中,人类滋养细胞浸润子宫内膜这一过程受到多种分子的精确调控。已有研究报道WNT5A在调节滋养细胞侵袭力参与PE发生过程中的作用,但BMP2信号通路与WNT5A抑制的Wnt/β-catenin信号通路之间的相互作用及其在PE发生机制中的作用尚未明确。
WNT信号通路在细胞增殖分化、组织再生和器官稳态中发挥关键作用,与母胎界面建立以及妊娠维持密切相关[15-17]。WNT通路包括经典β-catenin依赖通路和非经典非β-catenin依赖通路。经典WNT信号通路分子如WNT2、WNT4、β-catenin等在胎盘多种细胞中表达,可通过调控蜕膜细胞或滋养细胞生物学行为参与PE的发生发展[18-20]。然而非经典WNT通路分子在调控滋养细胞行为及PE进程中的作用目前仍存争议。WNT5A是非经典WNT信号通路的重要配体,并且能通过抑制或促进其他WNT配体的表达影响经典WNT通路。WNT5A在多种肿瘤的上皮间质转化(epithelial-mesenchymal transition,EMT)和侵袭转移过程中发挥重要作用,但其作用存在较大异质性,如在卵巢癌中WNT5A可促进肿瘤细胞EMT和侵袭过程;而在乳腺癌中WNT5A被认为可抑制肿瘤细胞的EMT和侵袭[21]。在女性生殖系统中,WNT5A存在胎盘成纤维细胞、胎盘巨噬细胞和多种滋养细胞亚型中[22-23],但其对滋养细胞侵袭的影响及其分子作用机制亟待进一步明确。Chen等研究发现,WNT5A可抑制滋养细胞侵袭[24]。本研究发现,外源性补充人重组WNT5A蛋白可促进滋养细胞侵袭,这与Takahashi等研究结果一致[7,9,25]。本研究发现,WNT5A处理后β-catenin的活性被抑制,这与先前在人类绒毛膜癌中的研究结果相一致[26]。本研究还发现,PE患者胎盘组织中WNT5A表达水平显著下调,提示WNT5A表达受损可介导滋养细胞侵袭不足,从而参与PE发生。
TGF-β超家族成员BMP2在子宫内膜基质细胞、蜕膜细胞和滋养细胞的多种亚型中均有表达,已被认为是子宫内膜蜕膜化的关键调节因子[27]。蜕膜化过程异常能导致胚胎着床时期的子宫微环境发生改变,影响随后的滋养细胞分化及胎盘发育[28]。既往研究表明,在成骨分化过程中,BMP2与WNT信号通路关系密切[29]。骨分化与滋养细胞分化有一定相似性,本研究基于外源性人重组BMP2蛋白处理的人滋养细胞系的转录图谱结果,并在人滋养细胞系和原代EVT细胞中进行了相关体外实验验证,发现BMP2可显著下调WNT5A表达,上调细胞内活化β-catenin水平。随后对BMP2调控下游基因表达的经典SMAD信号通路检测,发现BMP2可激活经典SMAD1/5/9通路负调控WNT5A的表达,并且这一作用可被BMP2受体抑制剂所阻断。以上发现提示,BMP2可通过激活经典的SMAD1/5/9通路抑制WNT5A表达,从而降低了WNT5A对于经典WNT/β-catenin信号通路的抑制,进而影响PE病理进程。
综上所述,WNT5A在PE患者胎盘组织中表达降低,其表达受到BMP2及激活的SMAD1/5/9信号通路调控。母胎界面WNT5A表达不足通过影响滋养细胞侵袭过程,引起胎盘发育异常,导致PE发生。本研究为后续揭示WNT5A在PE发生发展中潜在作用的研究提供了创新性的实验基础,但由于PE病因的复杂性和疾病分类的多样性,本研究未对WNT5A在特定临床背景下对PE的调控作用进行探究,如早发型PE和晚发型PE之间胎盘病变存在的差异等,且研究纳入的样本量相对较少,未来仍有待进一步的深入研究。
