miR-27b-3p通过靶向Wnt3a调控Wnt/β-Catenin信号通路抑制肝星状细胞活化
2023-11-07陈爱方田霞韩峥朱庆曦刘蒙谭洁
陈爱方 田霞 韩峥 朱庆曦 刘蒙 谭洁
(武汉市第三医院消化内科,湖北 武汉 430060)
肝纤维化是一个病理生理过程,其主要特征表现为细胞外基质(ECM)过度沉积和肝脏小叶结构紊乱,长期持续的肝纤维化可发展为肝硬化和肝癌〔1〕。肝星状细胞(HSC)作为肝纤维化的主要细胞,其被激活后产生大量 ECM,在肝纤维化的进展过程中发挥着重要作用〔2,3〕。因此,抑制HSC活化成为抗纤维化治疗的有吸引力的策略。MicroRNAs(miRNAs)是含有20~25个核苷酸的小RNA,其可以与 mRNA 的 3′-非翻译区 (UTR) 结合,参与转录后基因调控〔4〕。证据表明miRNA的失调参与了HSC活化及肝纤维化过程〔5〕。miR-27b-3p被认为是一种抗纤维化的 miRNA,已有研究报道过表达miR-27b-3p 通过抑制信号转导及转录激活蛋白(STAT)1抑制肾纤维化的进展〔6〕。但miR-27b-3p对HSC活化的影响未见报道。本研究通过生物信息学预测发现Wnt3a为miR-27b-3p的靶基因,但miR-27b-3p能否靶向Wnt3a调控HSC活化尚不明确,因此,本研究主要探究miR-27b-3p对HSC活化的影响及其相关作用机制。
1 材料与方法
1.1细胞来源 人HSC LX-2购自武汉普诺赛生命科技有限公司。
1.2主要试剂与仪器 miR-27b-3p模拟物(miR-27b-3p mimics)及其阴性对照(mimics NC)、Wnt3a过表达质粒(pcDNA3.1-Wnt3a)及其阴性对照(pcDNA3.1)、Wnt3a小干扰RNA(si-Wnt3a)及其阴性对照(si-NC)均购自上海美轩生物科技有限公司;转化生长因子(TGF)-β1购自广州源生医药科技有限公司;胎牛血清(FBS)、杜尔伯科改良伊格尔培养基(DMEM)、二喹啉甲酸(BCA)试剂盒、电化学发光(ECL)试剂盒、双荧光素酶报告基因检测试剂盒均购自上海碧云天生物有限公司;miRNA cDNA Synthesis Kit购自宝生物工程(大连)有限公司 ;miRNA荧光定量聚合酶链反应(PCR)检测试剂盒购自北京百奥莱博科技有限公司;LipofectamineTM2000转染试剂盒购自上海恒斐生物科技有限公司;α-平滑肌肌动蛋白(SMA)抗体购自Cell Signaling Technology公司;Wnt3a、β-catenin、c-myc、磷酸甘油醛脱氢酶(GAPDH)兔多克隆抗体及辣根过氧化物酶(HRP)标记的羊抗兔二抗均购自索莱宝生物科技有限公司;胶原蛋白(Collagen)Ⅰ、Collagen Ⅲ、基质金属蛋白酶组织抑制剂(TIMP)-1、细胞周期素(Cyclin)D1兔多克隆抗体均购自美国Abcam公司;荧光定量PCR仪购自上海蕴策生物科技有限公司;CO2培养箱购自北京宏达恒业科技有限公司。
1.3细胞培养与转染 使用含有10%FBS、100 U/ml链霉素和100 U/ml青霉素的DMEM培养基培养LX-2细胞,培养条件为:37 ℃、5%CO2。取生长良好的LX-2细胞,利用10 ng/ml TGF-β1〔7〕处理24 h以诱导活化,并命名为LX-2-A细胞。利用LipofectamineTM2000转染试剂盒对LX-2-A细胞进行转染,并分为7组:空白组(正常培养的LX-2-A细胞)、mimics NC组(转染mimics NC)、miR-27b-3p mimics组(转染miR-27b-3p mimics)、si-NC组(转染si-NC)、si-Wnt3a组(si-Wnt3a)、miR-27b-3p mimics+pcDNA3.1组(共转染miR-27b-3p mimics和pcDNA3.1)、miR-27b-3p mimics+Wnt3a组(共转染miR-27b-3p mimics和pcDNA3.1-Wnt3a),在37 ℃、含有 5%CO2的培养箱中进行转染。
1.4qRT-PCR检测细胞中miR-27b-3p表达 使用Trizol试剂提取总RNA,并使用Nanodrop2000测量总RNA浓度。使用miRNA cDNA Synthesis Kit将500 ng RNA逆转录成 cDNA,然后利用miRNA荧光定量PCR检测试剂盒进行扩增反应,以U6为内参,通过2-ΔΔCt法计算miR-27b-3p的相对表达水平。引物序列为:U6正向引物:5′-GCACCTTAGGCTGAACA-3,反向:5′-AGCTTATGCCGAGCTCTTGT-3′;miR-27b-3p正向引物:5′-CTC-TCTAACAAGGTGCAGAG-CT-3′,反向:5′-TTCTCTTCAGGTGCAGAACTTAG-3′。
1.5细胞对数试剂盒(CCK)-8法检测细胞增殖 收集各组细胞悬液,以2×104个/孔的密度加入 96 孔板中,分别在细胞转染的0、24、48 h向每孔加入10 μl CCK-8溶液,37 ℃孵育2 h,利用酶标仪检测450 nm处吸光度(OD)值。
1.6免疫荧光染色法观察细胞中α-SMA表达 将各组细胞以2×104个/孔的密度接种到Millicell EZ SLIDE培养板中,孵育24 h后,用磷酸盐缓冲液(PBS)洗3次,每次3 min;用4%多聚甲醛溶液固定10 min,用PBS洗涤3次,每次3 min,然后用0.5% Triton X-100冰上处理20 min;PBS洗3次,每次3 min,用3%牛血清白蛋白(BSA)在室温下封闭1 h;加入一抗α-SMA(1∶500)在4 ℃下孵育过夜。 第二天,加入荧光二抗并在37 ℃下孵育1 h。用4′,6-二脒基-2-苯基吲哚(DAPI)复染5 min,再用 PBS洗3次,每次3 min。 每孔随机选取3个视野利用荧光显微镜观察并拍照。
1.7Western印迹检测蛋白表达 将各组细胞在RIPA缓冲液中裂解以提取细胞总蛋白。使用BCA试剂盒测量细胞裂解物中的蛋白质浓度。使用10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离50 μg蛋白质。将分离的等量蛋白质转移到聚偏氟乙烯(PVDF)膜上。将膜在5%脱脂奶粉中室温封闭1 h。然后加入一抗Wnt3a(1∶1 000)、Collagen Ⅰ(1∶2 000)、Collagen Ⅲ(1∶1 000)、TIMP-1(1∶1 000)、β-连环蛋白(catenin,1∶2 000)、c-myc(1∶2 000)、细胞周期素(Cyclin)D1(1∶1 000)、GAPDH(1∶1 000)在4 ℃下孵育过夜,次日,用Tris盐酸缓冲液吐温(TBST)洗涤3次后,加入HRP标记的羊抗兔二抗(1∶500)在室温下孵育1 h。使用ECL溶液观察蛋白质条带,使用Image J 软件分析蛋白质条带的灰度值。
1.8双荧光素酶报告基因实验 分别构建Wnt3a野生型和突变型 3′-UTR 区质粒,并命名为WT-Wnt3a、MUT-Wnt3a。严格按照LipofectamineTM2000转染试剂盒操作说明书将WT-Wnt3a和MUT-Wnt3a 分别与mimics NC或miR-27b-3p mimics共转染到 LX-2 细胞中。转染48 h后,采用双荧光素酶报告基因检测系统评估荧光素酶活性。
1.9统计学分析 采用SPSS25.0软件和GraphPad Prism进行统计分析,单因素方差分析用于多组间比较,进一步两两比较采用SNK-q检验。
2 结 果
2.1miR-27b-3p在LX-2及LX-2-A细胞中的表达 与LX-2细胞比较,LX-2-A细胞绿色荧光强度显著升高,表示α-SMA蛋白表达水平升高,提示TGF-β1诱导LX-2细胞活化成功,见图1,与LX-2细胞(1.00±0.00)比较,LX-2-A细胞中miR-27b-3p表达水平(0.32±0.02)显著降低(P<0.05)。

图1 免疫荧光法观察细胞中α-SMA表达(×1000)
2.2各组LX-2-A细胞中miR-27b-3p及Wnt3a蛋白表达 与空白组、mimics NC组比较,miR-27b-3p mimics组miR-27b-3p表达水平显著升高,Wnt3a蛋白表达水平显著降低(P<0.05);与空白组、si-NC组比较,si-Wnt3a组miR-27b-3p表达水平无显著变化(P>0.05),Wnt3a蛋白表达水平显著降低(P<0.05);与miR-27b-3p mimics组、miR-27b-3p mimics+pcDNA3.1组比较,miR-27b-3p mimics+Wnt3a组miR-27b-3p表达水平无显著变化(P>0.05),Wnt3a蛋白表达水平显著升高(P<0.05),见图2和表1。
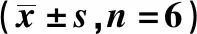
表1 各组LX-2-A细胞增殖能力及miR-27b-3p、Wnt3a蛋白表达
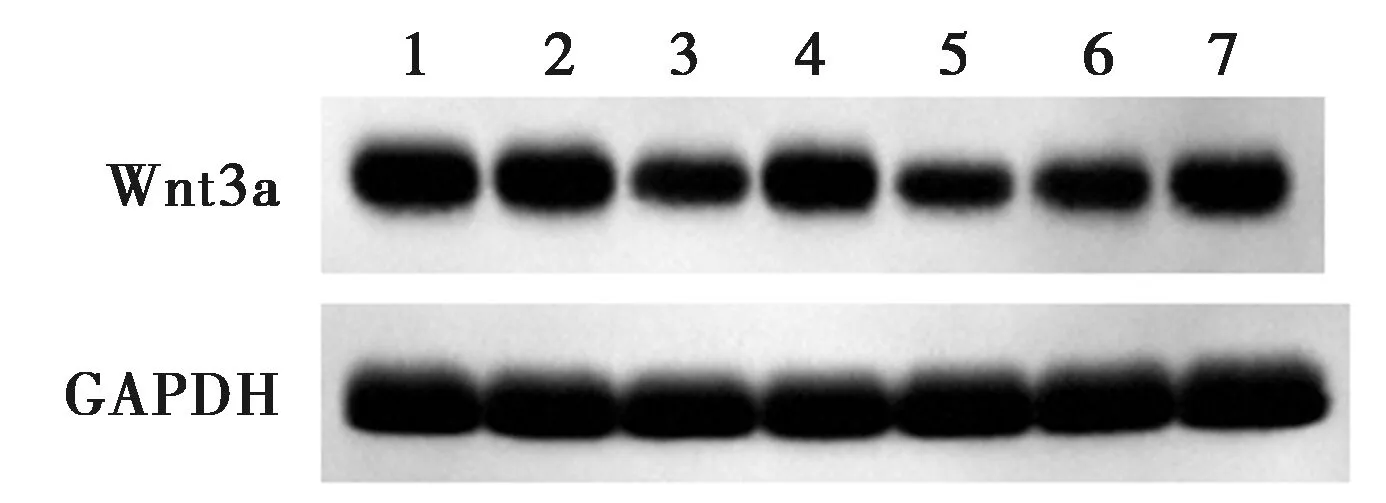
1~7:空白组、mimics NC组、miR-27b-3p mimics组、si-NC组、si-Wnt3a组、miR-27b-3p mimics+pcDNA3.1组、miR-27b-3p mimics+Wnt3a组,图4、5同图2 Western印迹检测各组Wnt3a蛋白表达
2.3各组LX-2-A细胞增殖能力比较 与空白组、mimics NC组比较,miR-27b-3p mimics组LX-2-A细胞在24、48 h的OD值显著降低(P<0.05);与空白组、si-NC组比较,si-Wnt3a组LX-2-A细胞在24、48 h的OD值显著降低(P<0.05);与miR-27b-3p mimics组、miR-27b-3p mimics+pcDNA3.1组比较,miR-27b-3p mimics+Wnt3a组LX-2-A细胞在24、48 h的OD值显著升高(P<0.05),见表1。
2.4各组LX-2-A细胞中α-SMA表达 免疫荧光结果显示,与空白组、mimics NC组比较,miR-27b-3p mimics组LX-2-A细胞绿色荧光强度显著降低,表示α-SMA蛋白表达水平降低;与空白组、si-NC组比较,si-Wnt3a组LX-2-A细胞绿色荧光强度明显降低,表示α-SMA蛋白表达水平降低;与miR-27b-3p mimics组、miR-27b-3p mimics+pcDNA3.1组比较,miR-27b-3p mimics+Wnt3a组LX-2-A细胞绿色荧光强度明显增强,表示α-SMA蛋白表达水平升高,见图3。

图3 免疫荧光法观察LX-2-A细胞中α-SMA表达(×1000)
2.5各组LX-2-A细胞活化相关蛋白表达 与空白组、mimics NC组比较,miR-27b-3p mimics组Collagen Ⅰ、Collagen Ⅲ、TIMP-1蛋白表达水平显著降低(P<0.05);与空白组、si-NC组比较,si-Wnt3a组Collagen Ⅰ、Collagen Ⅲ、TIMP-1蛋白表达水平显著降低(P<0.05);与miR-27b-3p mimics组、miR-27b-3p mimics+pcDNA3.1组比较,miR-27b-3p mimics+Wnt3a组Collagen Ⅰ、Collagen Ⅲ、TIMP-1蛋白表达水平显著升高(P<0.05),见图4和表2。
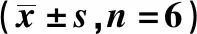
表2 各组LX-2-A细胞中Collagen Ⅰ、Collagen Ⅲ、TIMP-1、β-catenin、c-myc、CyclinD1蛋白表达
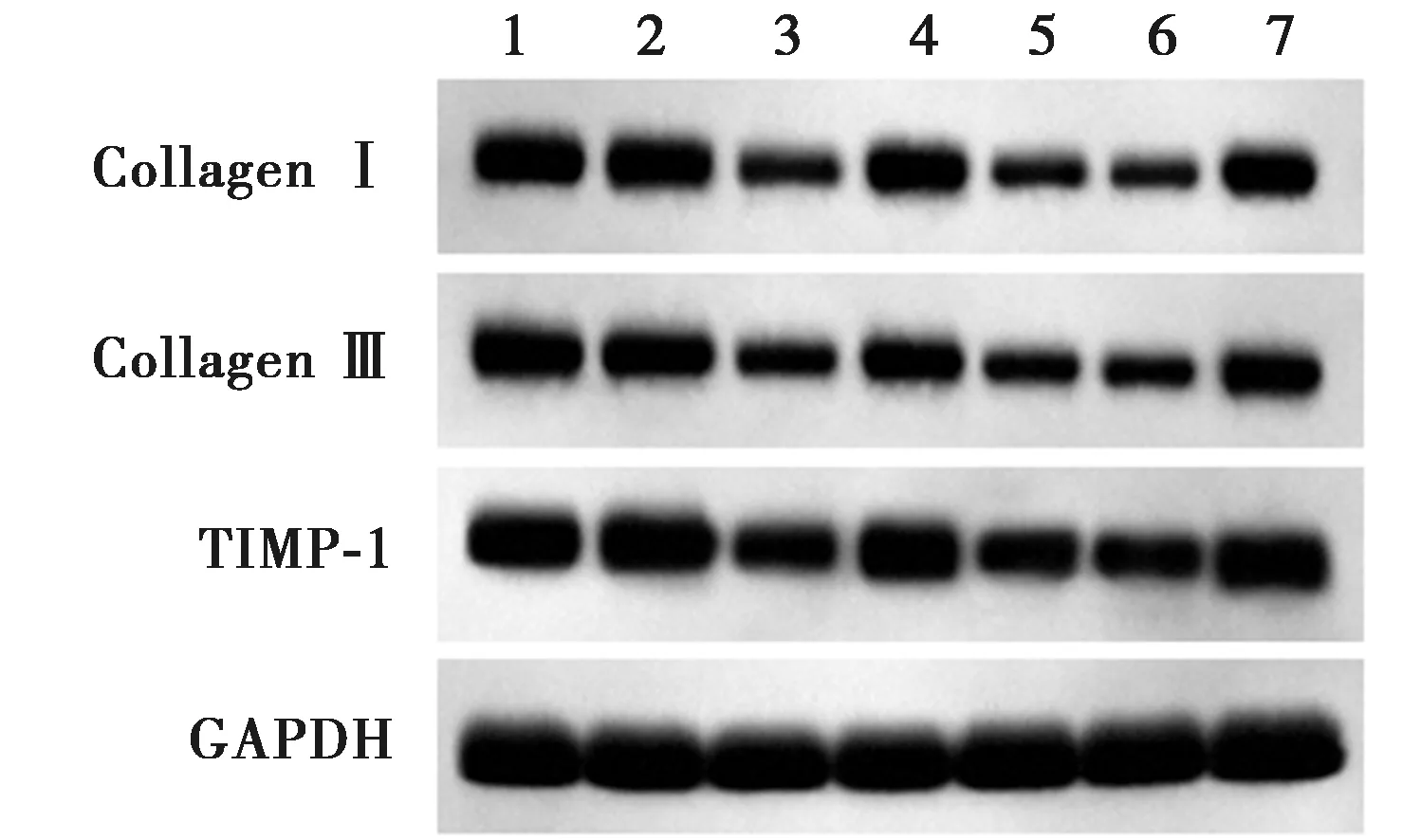
图4 Western印迹检测Collagen Ⅰ、Collagen Ⅲ、TIMP-1蛋白表达
2.6各组LX-2-A细胞中Wnt/β-catenin通路相关蛋白表达 与空白组、mimics NC组比较,miR-27b-3p mimics组β-catenin、c-myc、CyclinD1蛋白表达水平显著降低(P<0.05);与空白组、si-NC组比较,si-Wnt3a组β-catenin、c-myc、CyclinD1蛋白表达水平显著降低(P<0.05);与miR-27b-3p mimics组、miR-27b-3p mimics+pcDNA3.1组比较,miR-27b-3p mimics+Wnt3a组β-catenin、c-myc、CyclinD1蛋白表达水平显著升高(P<0.05),见表2和图5。

图5 Western印迹检测β-catenin、c-myc、Cyclin D1蛋白表达
2.7双荧光素酶报告基因实验 通过Targetscan网站预测发现miR-27b-3p与Wnt3a存在结合位点,见图6。双荧光素酶报告基因结果显示,与mimics NC和WT-Wnt3a共转染组比较,miR-27b-3p mimics和WT-Wnt3a共转染组LX-2细胞荧光素酶活性显著降低(P<0.05);与mimics NC和MUT-Wnt3a共转染组比较,miR-27b-3p mimics和MUT-Wnt3a共转染组LX-2细胞荧光素酶活性无显著性变化(P>0.05),见表3。
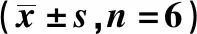
表3 LX-2细胞中荧光素酶活性比较

图6 miR-27b-3p与Wnt3a的结合位点
3 讨 论
在正常肝脏中,HSC 处于静止状态,然而,在受损的肝脏中,HSC被激活并转分化为表达α-SMA标记的成肌纤维细胞〔8〕。活化的HSC合成并分泌Collagen Ⅰ、Collagen Ⅲ、TIMP-1等多种ECM,造成肝脏组织内ECM过度沉积,最终导致肝纤维化〔9〕。TGF-β1 是一种重要的促纤维化因子和肝纤维化发病机制中的主要介质,可导致 HSC 活化,从而加剧 ECM 的积累〔10〕。本研究结果提示,10 ng/ml TGF-β1诱导的LX-2细胞活化模型构建成功。
研究表明,miRNAs对于HSC 的活化、肝纤维化发挥重要的调节作用〔11〕。徐静等〔12〕报道过表达miR-373通过抑制TGF-βⅡ型受体表达抑制HSC活化;武彦虎等〔13〕表明miR-519d-3p具有抑制HSC活化,促进HSC凋亡,抑制肝纤维的作用。本研究结果提示,过表达miR-27b-3p可抑制LX-2-A细胞活化。
Wnt/β-catenin信号通路参与了肝纤维化进程〔14〕。如白灵芝提取物通过抑制Wnt/β-catenin信号通路的激活抑制HSC的增殖与活化〔15〕;松芪水合物通过抑制 Wnt/β-catenin 通路抑制HSC活化〔16〕;CD73沉默抑制了HSC活化并促进活化HSC的凋亡,该机制与抑制Wnt/β-catenin 通路有关〔17〕。本研究结果提示,过表达miR-27b-3p可抑制LX-2-A细胞活化,可能与抑制Wnt/β-catenin 通路有关。已有研究报道,Wnt3a能够促进子宫内膜基质细胞纤维化〔18〕;过表达miR-27a-3p通过下调Wnt3a表达抑制肺成纤维细胞中Collagen Ⅰ、Collagen Ⅲ表达〔19〕。本研究结果提示,过表达miR-27b-3p可能靶向抑制Wnt3a表达,阻断Wnt/β-catenin 通路,进而抑制LX-2-A细胞活化。为了验证该推测,本研究利用Wnt3a过表达物进行干预miR-27b-3p mimics,结果发现,上调Wnt3a表达逆转了过表达miR-27b-3p对LX-2-A细胞活化的抑制作用,以上结果说明过表达miR-27b-3p通过靶向下调Wnt3a表达,抑制Wnt/β-catenin通路激活,进而抑制LX-2-A细胞活化。Lv等〔20〕研究表明过表达miR-27b-3p通过靶向下调Wnt3a表达,抑制Wnt/β-catenin信号通路进而减轻心房颤动大鼠心房纤维化。本研究与其研究结果一致。
综上所述,过表达miR-27b-3p通过靶向下调Wnt3a表达,抑制Wnt/β-catenin通路激活,进而抑制LX-2-A细胞活化。
