超声功率对小麦醇溶蛋白-膳食多酚共价复合物结构及功能性质的影响
2023-11-07曹佳兴朱海兰王君荣张健豪张国治
曹佳兴,朱海兰,王君荣,张健豪,张国治,4,*
(1.河南工业大学粮油食品学院,河南 郑州 450001;2.郑州科技学院食品科学与工程学院,河南 郑州 450001;3.上海交通大学农业与生物学院,上海 201100;4.河南省面制主食工程技术研究中心,河南 郑州 450001)
为了维持动物蛋白与植物蛋白的消费平衡,提高食品生产的可持续性,近年来植物蛋白的研究备受关注,开发具有优良加工特性的植物蛋白成为现阶段的一大研究热点[1]。麸质蛋白是存在于小麦、黑麦、大麦、黑小麦以及燕麦等谷物中的贮藏蛋白,它对谷物类食品的品质有较大影响[2]。小麦中含有丰富的蛋白质资源,麸质蛋白质量占小麦籽粒干质量的10%~15%,其中醇溶蛋白(gliadin,GL)相对含量为50%~60%[3]。小麦GL是一种三维单肽链蛋白,分子质量集中在25~100 kDa,分子内通过氢键、疏水相互作用以及静电相互作用连接[4]。GL具有两亲性和表面活性,可作为活性分子的载体或稳定乳液[5];由于GL溶解度较低,消化性和抗氧化性较差,限制了其在工业生产中的应用。此外,GL中含有大量的谷氨酰胺和脯氨酸,其结构序列中包含大量抗原表位,这增加了接触/摄入而引发小麦不耐受症状的风险[6]。因此,GL的改性对于拓展麸质蛋白的应用具有重要意义。
在食品工业中,通常使用烘焙、湿蒸、高压和超声等加工方法来改善蛋白质的功能性质,但这些方法都存在一定的局限性,甚至可能导致蛋白质的加工性质劣变[7]。膳食多酚是存在于植物中的一种天然活性分子,具有良好的抗氧化性能和药理作用,常用于蛋白质功能特性的修饰。表没食子儿茶素没食子酸脂((-)-epigallocatechin 3-gallate,EGCG)是绿茶中含量最高、活性最强的儿茶素单体,由3 个苯环、1 个吡喃环和8 个酚羟基组成;这种独特的化学结构使EGCG具有比其他多酚更为优越的功能特性[8]。在碱性、自由基和酶促氧化环境中,EGCG可与蛋白质中的氨基、巯基、酪氨酸、脯氨酸等活性位点形成共价键。
EGCG的共价修饰能有效改善蛋白质的理化特性,但传统共价反应(包括碱法、自由基法和酶促反应)效率较低、条件苛刻,使蛋白-多酚共价修饰在生产应用中存在较大的局限性。有研究发现,超声波(ultrasound,US)能使水分子解离产生OH-,从而诱导蛋白质与多酚共价反应[9-10]。此外,US能促进GL空间结构的展开[11],这为共价反应提供了有利的条件。然而,US所提供的自由基氧化是瞬时的,并且受环境因素影响。此外,US处理功率与蛋白质空间构象以及分子间交联程度密切相关。因此,研究不同功率的US对共价反应产生的强化效果具有重要意义。
本研究以H2O2/抗坏血酸作为诱发体系,诱导GL与EGCG共价反应,比较不同功率的超声环境中EGCG对GL的修饰强度;通过多光谱联用分析GL的结构变化,并对其功能特性进行表征,旨在寻找更高效的蛋白-多酚共价修饰方法。
1 材料与方法
1.1 材料与试剂
小麦由河南省农业科学院提供。
EGCG、2,2’-联氮-双-3-乙基苯并噻唑啉-6-磺酸(2,2’-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picryl-hydrazyl radical,DPPH)上海麦克林生化科技有限公司;牛血清白蛋白 上海源叶生物科技有限公司;聚丙烯酰胺凝胶电泳(polyacrylamide gel electrophoresis,PAGE)试剂盒、上样缓冲液 上海雅酶生物医药科技有限公司;胃蛋白酶、胰蛋白酶 美国Sigma公司。其他试剂均为分析纯。
1.2 仪器与设备
凯氏定氮仪 山东还能科技仪器有限公司;F-4500荧光光谱仪 日本日立株式会社;圆二色光谱(circular dichroism,CD)仪 美国Thermo Fisher公司;高效液相色谱(high-performance liquid chromatography,HPLC)仪美国Agilent公司;UV-2600紫外-可见分光光度计 日本岛津公司;蛋白垂直电泳仪、GS-900凝胶电泳成像系统美国Bio-Rad公司。
1.3 方法
1.3.1 GL的分离与制备
将小麦粉和乙醚按照1∶ 3(m/V)的比例混合,室温下磁力搅拌4 h以去除脂肪,10 000 r/min离心10 min,弃上清液,重复上述操作3 次。将脱脂小麦粉和65%(体积分数,下同)乙醇溶液按照1∶10(m/V)的比例混匀,在室温下机械搅拌提取24 h以上,然后10 000 r/min离心15 min取上清液。对收集的上清液进行旋转蒸发处理,在-20 ℃冰箱静置后冻干。利用全自动凯氏定氮仪测定GL含量。
1.3.2 共价复合物制备
参照Xu Haoxie等[12]的方法,将抗坏血酸和H2O2溶于由6 5%乙醇溶液溶解的G L 溶液,室温下搅拌(600 r/min、30 min)。然后将45.3 mg EGCG加入混合物中进行自由基反应,同时对反应体系进行超声处理(25 ℃、2 h),US功率分别为0 W及240、360、480、600 W,分别记作GE及GE-US(GE240、GE360、GE480、GE600);对照组(GL)不进行超声以及共价反应。反应结束后使用截留分子质量为8 000 Da的透析袋透析72 h除去未反应的EGCG。所有样品30 ℃减压浓缩后冻干处理,将制备的共价复合物于-40 ℃冰箱中保存。
1.3.3 十二烷基硫酸钠-PAGE分析
十二烷基硫酸钠(sodium dodecyl sulfate,SDS)-PAGE参照Liu Xiangju等[13]的方法稍作修改。浓缩胶和分离胶质量分数分别为12.5%和5%,凝胶厚度为1.5 cm。使用超纯水溶解蛋白质样品,取适量样品溶液与4×还原上样缓冲液/5×非还原上样缓冲液混合,煮沸8 min使蛋白质变性,10 000 r/min离心5 min后收集上清液上样。上样量为每孔15 μL,调整电压80 V,待溴酚蓝指示剂移至分离胶,调整电压为120 V至电泳结束。电泳结束后使用考马斯亮蓝R-250进行染色,脱色后使用GS-900凝胶成像系统扫描分析。
1.3.4 HPLC分析
根据Ma Ling等[14]的方法进行HPLC分析。样品使用SDS溶液溶解后过0.45 μm滤膜,过滤后注入2 mL样品瓶中。使用含0.1%三氟乙酸(trifluoroacetic acid,TFA)的乙腈溶液(体积分数为20%)洗脱,流速为0.5 mL/min,检测波长设定为280 nm。
1.3.5 多酚结合率测定
参照金花等[15]的方法测定样品的多酚结合率,取0.5 mL样品溶液与2.5 mL Folin-Ciocalteu试剂混合,避光反应5 min。加入2 mL 75 mg/mL Na2CO3溶液继续避光反应2 h,测定760 nm波长处的吸光度。以不同质量浓度的EGCG溶液绘制标准曲线,按照公式(1)计算多酚结合率。
1.3.6 游离巯基/酪氨酸含量测定
使用Tris-Gly缓冲液溶解样品,得到5 mg/mL溶液。取3 mL样品溶液与0.03 mL ELLMA试剂(8 mg 5,5-二硫代-双-(2-硝基苯甲酸)(5,5’-dithiobis(2-nitrobenzoic acid),DTNB)溶解于2 mL Tris缓冲液中)迅速混匀,避光反应30 min,测定412 nm波长处的吸光度。按照公式(2)计算游离巯基含量。
式中:D为稀释系数;ρ为样品质量浓度/(mg/mL)。
酪氨酸含量的测定参照Liu Fuguo等[16]的方法。将1 mL样品溶液(1 mg/mL)与1 mL硝酸混合,50 ℃水浴加热15 min。冷却后加入4 mL无水乙醇和4 mL NaOH溶液(5 mol/L)混匀,分别测定360 nm和430 nm波长处吸光度。按照公式(3)计算酪氨酸含量。
1.3.7 CD分析
使用磷酸盐缓冲液(pH 7)溶解样品,使样品质量浓度为0.2 mg/mL。取适量样品溶液置于光程为0.5 mm的比色皿中,于190~260 nm波长范围内在25 ℃、通氮气的条件下扫描CD图谱。设置条件为:步长1 nm,单次扫描时间2 s,平行测定3 次。
1.3.8 紫外光谱分析
参考吕思瑶等[17]的方法,使用UV-2600紫外-可见分光光度计对样品进行紫外光谱采集。样品质量浓度为0.25 mg/mL。设置波长检测范围为255~285 nm。以65%乙醇溶液作为参比溶液,平行采集3 次。
1.3.9 溶解度测定
准确称量100 mg样品,与5 mL超纯水混合,通过涡旋搅拌使样品分散均匀。在恒温水浴摇床中振荡30 min后,10 000×g离心收集上清液。取0.1 mL上清液加入5 mL考马斯亮蓝试剂,充分振荡混合,避光反应10 min后测定595 nm波长处的吸光度。以牛血清白蛋白绘制标准曲线,计算可溶性蛋白质量浓度,按式(4)计算水溶性。
1.3.10 表面疏水性测定
参考王启明[18]的方法,使用溴酚蓝结合法测定样品的表面疏水性,溴酚蓝结合量越高,样品的表面疏水性越好。用超纯水溶解样品,取1 mL样品溶液(2.5 mg/mL)与1 mL磷酸盐缓冲液(pH 7)和200 μL溴酚蓝溶液充分混合均匀,离心取上清液,测定595 nm波长处的吸光度。按照公式(5)计算溴酚蓝结合量。
式中:A0和A分别为磷酸盐缓冲液和样品的吸光度。
1.3.11 抗氧化性测定
1.3.11.1 ABTS阳离子自由基清除能力
将5 mL ABTS溶液(7.44 mmol/L)与88 μL过硫酸钾溶液(2.6 mmol/L)混合均匀,静置18 h,作为ABTS阳离子自由基储备液。将储备液根据需要稀释,取2 mL样品溶液(2 mg/mL)与4 mL稀释后的ABTS阳离子自由基溶液避光反应10 min,测定734 nm波长处吸光度。以样品与过硫酸钾混合液作为空白对照,ABTS阳离子自由基清除率按照公式(6)计算。
式中:A0为ABTS工作液的吸光度;A为反应液的吸光度;Aw为空白对照的吸光度。
1.3.11.2 DPPH自由基清除能力
使用95%乙醇溶液配制DPPH工作液(1 mmol/L),然后将3 mL样品溶液(2 mg/mL)与3 mL DPPH工作液溶液混合,避光反应30 min后测定517 nm波长处的吸光度。以95%乙醇与样品的混合溶液(1∶1,V/V)作为空白对照,DPPH自由基清除率按照公式(7)计算。
式中:A0为DPPH工作液的吸光度;A为反应液的吸光度;Aw为空白对照的吸光度。
1.3.11.3 铁离子还原能力
将醋酸钠溶液(0.3 mol/L、pH 3.6)、10 mmol/L三吡啶基三嗪(tripyridyltriazine,TPTZ)、FeCl3(20 mmol/L)按照10∶1∶1的体积比混匀,37 ℃避光水浴2 h,作为铁离子还原能力(ferric ion reducing antioxidant power,FRAP)工作液。将10 μL样品溶液(2 mg/mL)与300 μL FRAP工作液混匀,37 ℃水浴反应30 min,测定593 nm波长处吸光度。
1.3.12 消化性测定
模拟消化参照Li Tanghao等[19]的方法并进行修改,使用45 mmol/L NaCl溶液溶解样品,使样品质量浓度为2 mg/mL。将样品溶液与胃蛋白酶置于37 ℃恒温水浴锅中稳定30 min,然后将胃蛋白酶加入样品溶液中(m(胃蛋白酶)∶m(样品)=0.03∶1.00)。分别于胃蛋白酶反应60 min和120 min时收集反应产物,立即加入20 μL 2 mol/L NaHCO3溶液终止反应。胃消化120 min时使用NaHCO3调节至pH 7,然后加入模拟肠液(V(模拟肠液)∶V(样品溶液)=0.025∶1.000;模拟肠液为2.5 g胰蛋白酶和10 mg胆汁提取物混合,使用NaHCO3溶液定容至25 mL)继续进行消化反应。分别于胰蛋白酶消化30 min和60 min时收集消化产物,并立即100 ℃水浴灭酶。所收集的样品使用BCA试剂盒检测蛋白质量浓度,按照公式(8)计算蛋白质消化率。
式中:ρ0和ρ分别表示未消化和消化后的蛋白质量浓度/(g/mL)。
1.4 数据统计与分析
采用Image Lab软件分析电泳图像;使用SPSS 26.0软件进行数据的单因素方差分析,以P<0.05表示差异显著。使用Origin 2022软件绘图。
2 结果与分析
2.1 超声功率对GL-EGCG共价复合物分子亚基的影响
通过SDS-PAGE观察蛋白质分子的亚基迁移速率以及聚集程度。根据迁移速率差异,GL亚基主要包括α-/β-亚基、γ-亚基以及ω-亚基。如图1所示,相较于GL,GE以及GE-US的亚基分布无明显变化,说明共价反应后无小分子亚基产生,也未出现大分子聚集;但共价复合物的亚基均出现明显偏移,蛋白质条带在凝胶上的迁移速率变慢,这是由于GL与EGCG共价结合后相对分子质量增加导致的[20]。超声环境下形成的共价复合物在凝胶上的迁移速率进一步变慢,其中GE360和GE480亚基明显偏移;因此推测在360 W和480 W超声环境中EGCG对蛋白质的修饰效果较强。非还原SDS-PAGE中,GE和GE-US在35 kDa处出现新的条带c,此外,大于180 kDa处的条带颜色加深。由于非还原SDS-PAGE过程中保留了二硫键,推测共价反应促进了蛋白质之间二硫键的交联,从而使亚基发生聚合[21]。此外,GE600的条带a以及条带c颜色略有加深,且在还原SDS-PAGE中,GE600条带偏移效果与GE无明显差异,说明600 W处理时共价复合物的聚合效果明显,这可能是由于高功率的US促进了巯基的氧化以及链内二硫键的形成,增加了蛋白质分子结构的稳定性[22],从而限制了空化剪切以及EGCG的进一步修饰。
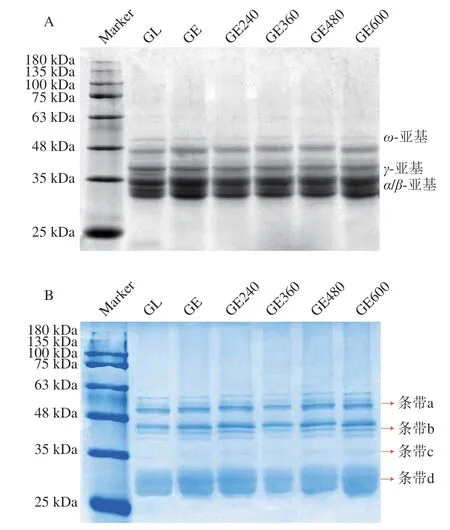
图1 不同功率下共价复合物的还原SDS-PAGE(A)和非还原SDS-PAGE(B)图Fig.1 SDS-PAGE (A) and non-reducing SDS-PAGE (B) diagrams covalent complexes at different power
2.2 超声功率对GL-EGCG共价复合物分子质量的影响
如图2所示,GL的保留时间为24.15 min,而GE的保留时间缩短至24.06 min,由此可知GL与EGCG的共价反应形成了相对分子质量更大的复合物,这与Zhang Kangyi等[23]的报道一致。相比于GE,GE-US的保留时间均出现不同程度的缩短,其中GE480的保留时间缩短至23.91 min,说明GE-US共价复合物的相对分子质量更大,这与SDS-PAGE分析结果相印证。

图2 不同功率下共价复合物的HPLC图Fig.2 HPLC chromatograms of covalent complexes at different power levels
2.3 超声功率对GL-EGCG共价复合物多酚结合率的影响
如表1所示,GE反应体系中多酚结合率为22.78%。随着超声功率的增加,多酚结合率先升高后降低,并在480 W时达到最高(33.75%),可见超声环境更有利于共价反应的进行。US产生强烈的剪切力和空化效应,能有效减弱蛋白质分子之间的弱聚集效应,这在牛血清白蛋白(500 W、0~30 min、20 kHz、0~4 ℃)和对虾蛋白(300 W、0~35 min、20 kHz、20 ℃)中得到证实[24-25];此外,空化效应和剪切力能够破坏分子内的氢键相互作用,引起蛋白质去卷曲化,这有利于蛋白质空间构象的舒展[26]。在该过程中,蛋白质的结构变化可能暴露出新的反应位点,更有利于被多酚识别。有研究表明,超声环境促进了水分子和H2O2的解离,增加了反应体系中羟自由基的含量;这些自由基可氧化蛋白质的部分侧链基团,从而促进共价反应的进行。当功率增至600 W时多酚结合率下降,这与SDS-PAGE和HPLC的分析结果相印证,说明高强度的超声环境对EGCG与GL共价反应的增强效果有限;推测高强度超声产生的空化效应加剧了蛋白质的氧化,促进了分子内二硫键的形成以及蛋白质分子的重新聚集[27],从而限制了共价反应。

表1 多酚结合率及蛋白质二级结构相对含量Table 1 Polyphenol-binding ratio and protein secondary structure contents
2.4 超声功率对GL-EGCG共价复合物游离巯基和酪氨酸含量的影响
蛋白质侧链氨基酸容易被自由基氧化进而与多酚发生亲核加成反应,因此通过检测游离巯基和酪氨酸含量的变化可分析EGCG与GL的相互作用。如图3所示,相较于GL,GE的游离巯基和酪氨酸含量显著降低,这是由于这些氨基酸残基被自由基氧化形成反应位点,与EGCG通过共价键连接。相较于GE,GE-US的游离巯基和酪氨酸含量减少,这可能是由于在空化效应和EGCG修饰的共同作用下,GL的空间结构发生了更剧烈的改变,使部分基团被重新包裹。Zhang Kangyi等[11]对小麦醇溶蛋白进行超声预处理,发现蛋白质内游离巯基含量增加。推测超声环境下的共价反应消耗了更多的游离巯基。当超声功率为600 W时,共价复合物中酪氨酸含量增加,这可能是由于高强度的空化效应导致部分巯基被氧化成二硫键,限制了共价反应对酪氨酸的消耗。
2.5 超声功率对GL-EGCG共价复合物二级结构的影响
通过对CD进行拟合计算分析蛋白质的二级结构变化。如表1和图4所示,GL的α-螺旋、β-折叠、β-转角和无规卷曲相对含量分别为20.98%、40.57%、19.78%、18.67%,其中β-折叠为GL的主要二级结构。与GL相比,GE中的α-螺旋和无规卷曲结构相对含量降低,而β-折叠和β-转角相对含量增加,可见共价相互作用改变了GL侧链以及分子内的氢键作用;此外,EGCG与GL共价结合的过程可能促进了氨基酸侧链对极性基团的吸附,从而使β-转角的相对含量增加[28]。而GE-US中α-螺旋相对含量进一步降低,说明超声环境下的共价反应对蛋白质的有序结构破坏更剧烈。这是因为US能够抑制共价复合物之间的氢键相互作用,促进α-螺旋无序化[29],从而更有利于蛋白质结构的展开。这种松散结构对共价反应的进行更有利。但超声功率增强至360 W以上时,复合物的α-螺旋相对含量降低不明显,这可能是由于蛋白质分子间的二硫键交联限制了空化效应和共价作用对其有序结构的破坏。

图4 不同功率下共价复合物的CD图谱Fig.4 CD spectra of covalent complexes at different power levels
2.6 超声功率对GL-EGCG共价复合物三级结构的影响
蛋白质中的芳香族氨基酸使蛋白质在270~280 nm波长处存在特有的紫外吸收,通过对吸收峰强度的分析可判断共价相互作用程度,而最大吸收/发射波长的分析可用于判断蛋白质三级结构变化。如图5所示,GL的吸收峰集中在260~290 nm波长处,这对应于GL中酪氨酸、色氨酸和苯丙氨酸残基的π-π*越迁[30]。与EGCG共价结合后,GE的紫外吸收明显增强,并且伴随蓝移;说明GL的空间结构发生改变,芳香族氨基酸的空间位置转移,暴露于周围的溶剂中[31]。此外,相较于GE,GE-US的紫外吸收增强,并且随着超声功率的增大吸光度增加。这可能是由于超声环境中EGCG的修饰作用更强烈,导致GL的空间结构进一步改变。

图5 不同功率下共价复合物的紫外光谱Fig.5 Ultraviolet spectra of covalent complexes at different power levels
2.7 超声功率对GL-EGCG共价复合物水溶性的影响
蛋白质的水溶性决定了其加工性能,较差的水溶性通常会限制蛋白质在工业生产中的应用。如图6所示,天然的GL水溶性仅为33.23%,而GE的水溶性显著提高,这是由于EGCG中的羟自由基更容易与水分子发生氢键相互作用,从而增强了共价复合物的水化作用。相较于GE,GE-US的水溶性得到进一步改善,其中GE240的水溶性分别比GL和GE提高了27.89 个百分点和10.97 个百分点。GE-US共价复合物溶解度提升的原因主要是超声空化效应、剪切力和EGCG共价修饰的协同效应;较高的酚羟基含量使这些复合物更容易与水分子发生相互作用。有研究表明EGCG的共价修饰能够减小蛋白质粒径[32],使蛋白质的比表面积增大,从而有利于蛋白质与水分子接触[33]。然而,随着超声功率的进一步增大,共价复合物的水溶性降低,这可能时由于高强度超声促使蛋白质形成不稳定的聚合体,减小蛋白质比表面积的同时掩盖了部分亲水基团,不利于蛋白质与水分子之间的相互作用。
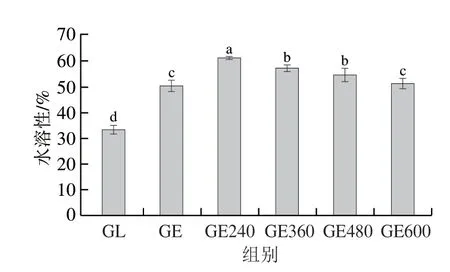
图6 不同功率对共价复合物水溶性的影响Fig.6 Effect of ultrasonic power on the water solubility of covalent complexes
2.8 超声功率对GL-EGCG共价复合物表面疏水性的影响
表面疏水性可用于判断GL结构的舒展程度。如图7所示,共价反应后,GL的溴酚蓝结合量由104.86 μg提高至110.71 μg,由此可知在EGCG的共价修饰下蛋白质的空间结构展开,疏水区域暴露,从而使其溴酚蓝结合量增加。在超声环境中共价复合物的表面疏水性显著降低,这可能是由于蛋白质的部分疏水基团作为反应位点参与EGCG的共价反应,使GL表面疏水基团减少。此外,GE-US共价复合物中的酚含量较高;有研究认为,多酚中的苯环和酚羟基能促进蛋白质与多酚之间的非共价相互作用,间接限制蛋白质空间结构的扩张[34];同时,高强度的超声还能促进共价复合物之间二硫键的交联,这也可能限制疏水基团在反应过程中的转移。当超声功率增大时,共价复合物的表面疏水性呈现上升趋势,但仍低于GL和GE,这可能是由于高强度的超声所提供的剪切力能够打破由EGCG带来的空间位阻[35],从而增加疏水基团的暴露量。

图7 不同功率对共价复合物表面疏水性的影响Fig.7 Effect of ultrasonic power on the surface hydrophobicity of covalent complexes
2.9 超声功率对GL-EGCG共价复合物抗氧化性的影响
通过DPPH自由基和ABTS阳离子自由基清除实验结合FRAP分析共价复合物的抗氧化性能差异。如图8所示,天然的GL抗氧化性能较差,而共价复合物的抗氧化活性均明显增强。有研究表明膳食多酚能有效改善食品的抗氧化性能,这主要与其化学结构中所含酚羟基的数量有关[36]。每个EGCG分子含有8 个酚羟基;自由基诱导共价反应通过羟自由基氧化蛋白质产生大分子自由基,与酚羟基的邻位和对位形成共价键,这一过程中EGCG的自由基清除能力最大程度地被保留。GE-US共价复合物的抗氧化性随着超声功率的增大先增加后降低,至360、480 W时,DPPH自由基和ABTS阳离子自由基清除能力及FRAP最强,这一结果与2.3节中多酚结合率的变化趋势相似。Chen Yichun等[37]通过研究不同浓度膳食多酚对蛋白质-多酚复合物抗氧化性的影响,发现复合物中多酚的浓度决定了其抗氧化性。根据对侧链基团、二级结构和三级结构的分析,推测GE-US抗氧化性的改善与超声-共价反应产生的协同效应密切相关。相较于GE,超声处理使GL表面出现更多的识别位点,更有利于蛋白质与多酚之间形成共价连接;但超声功率增大至600 W时GE600的抗氧化性大幅降低,这可能是因为600 W的超声环境不利于GL与EGCG的共价反应。

图8 共价复合物抗氧化性能分析热图Fig.8 Heatmap analysis of antioxidant properties of covalent complexes
2.10 超声功率对GL-EGCG共价复合物消化性的影响
如图9所示,在胃消化60 min时共价复合物的消化率远高于GL,由此可知,与EGCG共价结合后GL的消化率显著提高,这可能是因为GL的结构发生改变,使其更容易被酶水解。然而有研究发现,与部分多酚类物质(原花青素、缩合单宁)复合会降低蛋白质的消化率[38],本研究结果与之不同,可能的原因是蛋白质的消化性能与其结构密切相关。另外,反应过程中部分酚类化合物与蛋白质之间以非共价键相连接,由于消化过程中蛋白质构象的改变,这些酚类物质被释放,消化酶与这些被释放的多酚发生相互作用从而使酶活性被抑制。在同一阶段,GE-US的消化率大多略高于GE。由紫外光谱分析可知,超声处理促进了共价复合物中芳香族氨基酸的暴露,而芳香族氨基酸含量与蛋白酶的酶切位点密切相关[39],由此推测,超声处理增加了蛋白分子表面的酶切位点。但胃消化60 min时GE360的消化率明显低于GE,这可能是由于在该超声环境中共价反应消耗/掩盖了大量胃蛋白酶的作用位点,如赖氨酸和精氨酸残基,导致胃蛋白酶无法快速识别目标蛋白。

图9 共价复合物的消化性分析Fig.9 Digestibility analysis of covalent complexes
3 结论
本研究通过超声协同H2O2/抗坏血酸氧化体系促进EGCG与GL的共价反应,并对共价复合物进行了结构分析及功能表征。研究发现,超声环境下更有利于EGCG与GL共价反应的进行,当功率为480 W时,GL的多酚结合率最高,比GE提高了10.97 个百分点。在超声环境中共价反应消耗了更多的侧链基团;蛋白质的空间结构发生剧烈的变化,其中有序的α-螺旋相对含量减少,芳香族氨基酸和疏水性氨基酸残基发生转移,其结构稳定性进一步降低。相比于传统共价反应,超声辅助共价修饰在蛋白质的功能性改良方面有更大优势;240 W超声环境中形成的共价复合物水溶性最强,比GL提高了27.89 个百分点;在本研究的消化环境中,超声辅助共价修饰蛋白质消化率及水解度更高。由于US与自由基氧化的协同效应增加了GL对活性分子的负载量,使其抗氧化性得到改善。本实验通过调整不同超声功率辅助GL与EGCG进行共价反应,为提高多酚的生物利用率、拓宽共价修饰在食品工业生产中的应用提供了更多的可能,但US对于共价反应的强化机制还需要进一步研究。
