酶的耐酸性改造及在赭曲霉毒素A脱除中的应用研究进展
2023-11-07赵自通张真真张昊祥梁志宏王鸿磊
赵自通,张真真,张昊祥,阮 丽,梁志宏,2,3,*,王鸿磊
(1.中国农业大学食品科学与营养工程学院,北京 100083;2.食品质量与安全北京实验室,北京 100083;3.农业农村部转基因生物食用安全监督检验测试中心(北京),北京 100083;4.中国农业大学烟台研究院,山东 烟台 264670)
蛋白酶是在现代化生产过程中广泛应用的一类具有高效生物催化功能的蛋白质。过去的几十年里蛋白酶制剂在生物制药、精细化工、食品工业、生物燃料开发、纺织、造纸、农业等领域中的应用急剧增加,几乎涵盖人们日常生活中常见商品的生产制造过程,与人们的衣食住行息息相关[1]。生物酶的开发与设计是生物制造产业的核心技术,工业化应用中对酶功能特性的升级需求加速推动了对具有良好催化和经济特性的改造酶的研究。酶在天然温和的条件下具有高特异性、区域选择性或立体选择性等特性,有助于发展更可持续的化学过程;在真菌毒素脱除领域,已经发现多种氧化酶、水解酶能够高效特异性降解如黄曲霉毒素B1(aflatoxin B1,AFB1)、赭曲霉毒素A(ochratoxin A,OTA)、呕吐毒素(deoxynivalenol,DON)、玉米赤霉烯酮(zearalenone,ZEN)等真菌毒素,其已成为继物理吸附、化学降解、微生物吸附/降解后解决真菌毒素污染最有前景的方法之一[2]。但应用于商业化的真菌毒素降解酶很少,大部分酶仍然因为稳定性差、环境适应性差而处于实验室研究阶段。由于酶催化作用对体系条件要求苛刻,从天然来源中分离出的酶通常在温和条件下非常有效,但在工业化生产过程中的非自然条件(极端pH值、极端温度、极端盐度、有机溶剂)中活性受到抑制。因此,酶促生物催化的潜力尚未被充分开发,找到有效的策略来克服这些缺点是该领域研究人员的目标,同时天然酶对反应体系的苛刻要求使其不能适应食品及饮料等的工业化生产环境,成为阻碍酶工业化应用的瓶颈。本文总结了目前酶耐酸性改造的常用策略及其在OTA脱除领域的应用前景,以期为工业酶的耐酸性研究提供参考,也为真菌毒素脱毒酶的实际应用提供理论依据。
1 酶的耐酸性改造策略
分子改造能够有效提高酶的稳定性。近年来,研究者普遍认同的分子改造方法分为定向进化、理性设计、半理性设计[3](图1)。影响酶蛋白耐酸性的因素主要有活性中心的pKa值[4],底物结合位点的pKa值[5],蛋白质表面电荷[6],蛋白质内部的分子作用力如氢键[7-8]、盐键[9]、芳香堆积[10-11]等,通过理性设计的定点突变改造酶蛋白的分子组成,进而改变其性质,具有快速、直接、准确率高的特点,最常用的耐酸性理性设计策略有同源序列比对[12]、表面电荷优化[13]、分子间相互作用力优化[14]等(图2)。

图1 生物酶的蛋白质工程改造常见方法示意图Fig.1 Schematic diagram of common strategies for protein engineering modification of biological enzymes
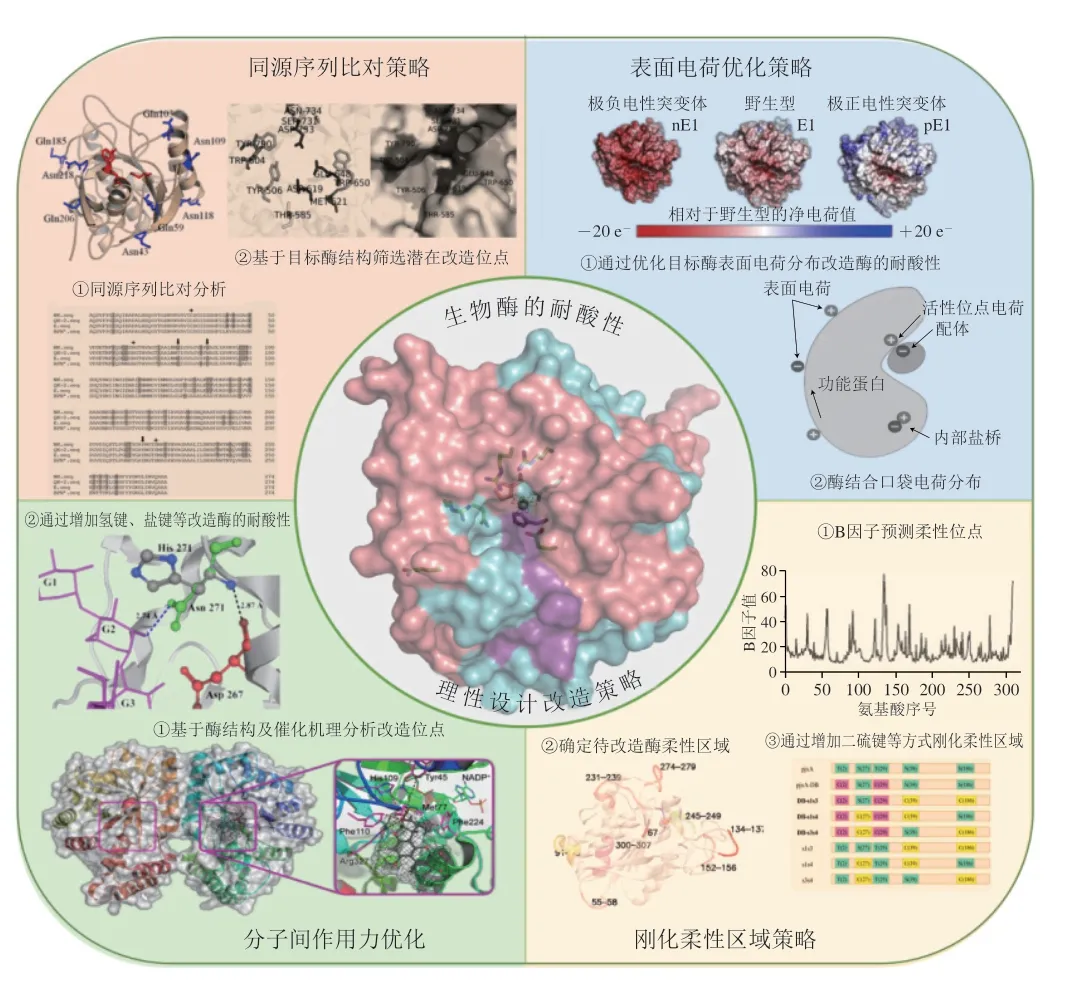
图2 生物酶的耐酸性理性设计策略示意图[4,15-16]Fig.2 Schematic diagram of rational design strategy to improve the acid resistance of biological enzymes[4,15-16]
1.1 同源序列比对策略
在特定的酶家族中,其催化机理及活性中心具有高度相似性,具体体现为具有相同的保守氨基酸,这些氨基酸对酶的催化特性及稳定性具有重要意义[17]。因此,可以通过序列比对工具对比具有耐酸性的酶和不耐酸的酶在保守序列上的差异,进而分析对目标酶耐酸性具有关键影响作用的潜在氨基酸位点,后期通过定点突变、点饱和突变等方式进行验证及筛选得到最佳突变体,目前已有大量研究采用同源序列比对策略改造了酶的耐酸性。Ma Fuqiang等[18]从木聚糖酶GH11家族序列中收集了113 个具有注释pH值的酶构建数据库,通过序列比对分析确定了5 个与pH值相关的潜在氨基酸位点,其中4 个突变体的最适pH值发生显著变化,其组合突变使突变体的最适pH值降低了1.5。Tishkov等[19]通过对糖苷水解酶G12家族的同源序列比对及三维结构分析,发现源于疣孢青霉(Penicillium verruculosum)糖苷水解酶的Asp98Asn更容易与Glu203形成氢键,直接影响酶的pH值稳定性,活性验证实验结果表明Asp98在催化过程中起着一般酸的作用,突变体的羧甲基纤维素比活力没有变化,但其最适pH值由4.0升高至5.1。Shi Xin等[20]采用基于结构的序列比对分析方法确定了源于米曲霉(Aspergillus oryzae)的β-半乳糖苷酶的筛选突变位点,构建突变体并进行验证,发现Tyr138Phe和Tyr364Phe的最适pH值从4.5分别变为5.5和6.0。Li Zhengxue等[21]通过序列比对和表面电荷工程的方法,对源于Bacillus terquilensis的中温β-葡聚糖酶进行耐酸性改造,发现突变体Gln1Glu、Ile133Leu、Val134Ala、Gln1Glu/Ile133Leu酸稳定性提高,其中组合突变体Gln1Glu/Ile133Leu在pH 5.0和pH 6.0条件下处理1 h后,其酸稳定性分别为86.9%和100.5%,均显著高于野生型(38.2%和56.4%);进一步分析认为蛋白质表面负电荷比例的增加可能是其耐酸性提高的原因。
1.2 表面电荷优化策略
疏水氨基酸掩藏在蛋白质的内部,亲水性氨基酸分布在蛋白质的表面,带电荷氨基酸在蛋白质表面可通过静电相互作用形成保护层,稳定蛋白质的结构;基于蛋白质的这一特点,可以通过优化设计蛋白质表面的带电荷氨基酸,使蛋白质表面分布的电荷合理化,增强蛋白质表面的静电相互作用力,从而提高蛋白质稳定性[6,22]。目前,用于分析蛋白质表面电荷分布情况的软件Modeller、Rosetta等已用被广泛应用,Modeller软件可以采用遗传算法来优化设计蛋白质表面带电荷氨基酸的分布[23];Rosetta软件支持多种模式(Rosetta supercharge和AvNAPSA supercharge)用以评估和设计酶的表面电荷[15]。天然天冬氨酸酶(aspartase,AspB)(EC 4.3.1.1)的最适pH值为9,在碱性条件下具有较好的催化活性,Wang Yaling等[24]采用理性设计的策略改造该酶的耐酸性以用于生产β-氨基丁酸(β-aminobutyric acid,BABA)。其首先采用Rosetta supercharge算法设计了多个单点突变,发现突变体S133D在pH 8条件下的催化活性比初始酶提高了1.3 倍。然后在单点突变的基础上择优进行组合突变,结果发现六位点突变体K19E-N87E-N125DS133D-Q262E-N451E的最适pH值为8.0,且其比活力(120.78 mU/mg)是初始酶的3 倍,酶学性质分析也表明突变体酶的pH值稳定性和热稳定性更好。Huang Ziyang等[25]采用定点饱和诱变和表面电荷修饰的半理性设计方法,提高了来源于Pyrococcus horikoshii的几丁质脱乙酰酶(diacetylchitobiose deacetylase derived fromP.horikoshii,PhDac)的催化效率及耐酸性。他们首先通过定点饱和诱变筛选出PhDac突变体M14,其催化效率(催化常数(kcat)/米氏常数(Km))比初始酶提高了2.21倍;比活力达到5 162.17 U/mg,与野生型相比提高了70.02%。由于天然PhDac的最适pH值为7.0~8.0,在利用其制备氨基葡萄糖(glucosamine,GlcN)的过程中因环境酸度较低其催化活性受到抑制,为了进一步提高PhDac的耐酸性,利用Rosetta supercharge算法设计PhDac的表面电荷,针对潜在影响耐酸性的位点构建突变体并进行筛选和验证,找到6 个对最适pH值有较大影响的氨基酸位点,并对其进行组合突变,最终发现突变体M20的最适pH值(pH 6.0)较天然PhDac显著降低,且在pH 5.5时仍能保持较高的催化活性,比活力最高可达6 277.28 U/mg,是野生型PhDac的2 倍。
源于猪的胃蛋白酶A具有极好的耐酸性,Cooper等[26]发现猪胃蛋白酶A中的Glu和Asp均有43 个,其酸性氨基酸的比例较高,因而具有非常低的pI值(pI 2~3),这可减少其在低pH值条件下正电荷的累积,提高其酸稳定性。Bönisch等[27]也发现来源于酸热硫化叶菌(Sulfolobus acidocaldarius)的嗜酸性铁硫蛋白的可溶性结构域表面会积累Asp及Glu等酸性氨基酸,其占比为60%,远高于碱性氨基酸的比例,蛋白表面主要呈现负电势,因此蛋白质表面电荷优化策略也是改善酶蛋白pH值稳定性的有效策略之一。武文慧等[28]利用ROSETTA软件改造谷氨酸脱氢酶,通过调整其正或负电荷残基类型改变蛋白的净电荷,构建的7 个突变体中Asn16Asp和Lys218Asp的最适pH值均由8.0下降到7.0,优化后的酶活力分别提高了2.9 倍和5.4 倍。Liu Yihan等[29]发现改变蛋白质表面的静电作用能够显著提高突变体在低pH值条件下的催化效率和稳定性,表明蛋白质表面的静电相互作用对维持蛋白质构象的稳定性具有重要作用。已经报道的部分酶在耐酸性改造前后的最适pH值变化如表1所示。
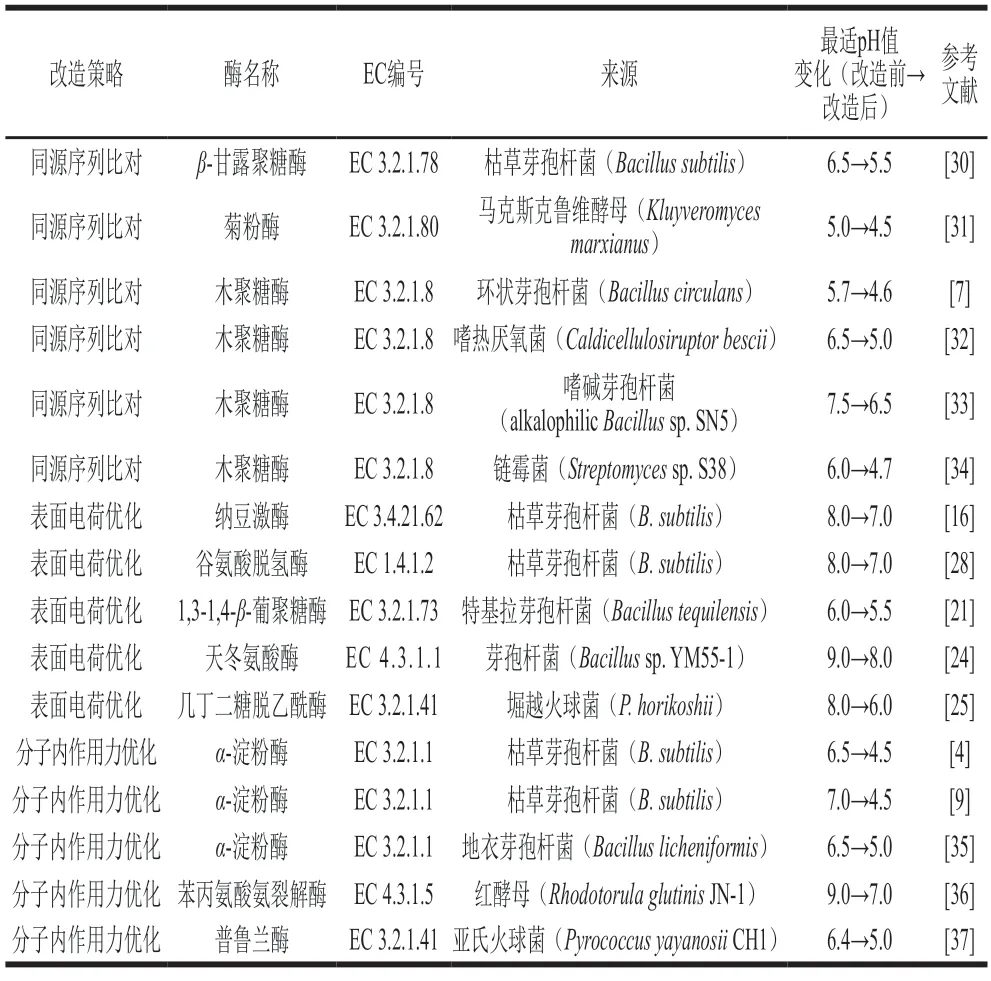
表1 已经报道的部分酶在耐酸性改造前后的最适pH值变化Table 1 Optimal pH of some reported enzymes before and after acid resistance modification
1.3 分子间作用力优化策略
酶的耐酸性除了与其表面电荷相关以外,还受到活性中心及底物结合中心氨基酸pKa值的影响,一些酶的最适pH值与其活性中心/底物结合中心关键残基的pKa值紧密相关。pKa值表征氨基酸电离平衡常数,其变化的同时也改变了局部关键残基的分子间相互作用力,如氢键、芳香堆积作用、盐桥[7,10,38-39]。因此,以pKa值的变化作为指标进行理性设计,其本质也是改变酶的分子间相互作用力。Joshi等[7]研究表明,环状芽孢杆菌(B.circulans)木聚糖酶突变体Asn35Asp最适pH值较初始酶降低了1.1,活力增加了20%,这源于Asp35和Glu172之间形成了一个短的氢键(2.7 Å),稳定了糖基转移的过渡态。Shiraki等[10]研究发现,无色杆菌(Achromobacter lyticus)蛋白酶I在靠近催化三联体位置的Trp169-His210处存在一个独特的芳香环堆积,His210Ala或His210Ser突变体的酸性边界(pH值)较初始酶降低了1.9。Yang Haiquan等[9]对源于枯草芽孢杆菌(B.subtilis)的α-淀粉酶进行耐酸性改造,将His222、His275、His293、His310突变为Asp构建单点突变体及组合突变体,发现突变体的耐酸性显著提高,主要原因是其形成了新的氢键与盐键。Qin Yuqi等[38]筛选得到催化活性提高的内切葡聚糖酶II突变体,该突变体Asn342Val在pH值为5.8时表现出最佳活性,最适pH值比初始酶提高了1,其催化残基和底物间静电相互作用产生了变化。
降低亲核试剂的pKa值不仅可以提高其催化活性,而且可能有助于改变其最优pH值[4,37]。Wang Chenghua等[4]通过降低活性中心pKa值的方法提高来源于B.subtilis的α-淀粉酶(α-amylase,Amy7C)的耐酸性,在距离活性中心4.5 Å的范围内基于计算机同源序列比对和pKa值预测分析构建了多个突变体,结果表明突变体Ala270Lys/Asn271His的最适pH值降低了2,催化效率较初始酶提高了约3.94 倍;突变体的结构分析表明其耐酸能力的改善可能是催化亲核试剂和质子供体残基pKa值的降低所致。Xie Ting等[37]利用相同的方法改变普鲁兰酶(PulPY2,EC 3.2.1.41)的耐酸性及催化活性,他们首先通过在距离活性中心6 Å的范围内引入组氨酸,设计多个突变体,经过筛选发现Gln3His的最适pH值由6.4降低为5.0,最大催化活力为54.2 U/mg,比初始PulPY2(32 U/mg)提高了69.3%;然后对其进行表面电荷优化,发现突变体Ile25Glu的最适pH值降低至5.4,其催化活力比初始酶高1.4 倍;最终结合改变活性中心pKa值和表面电荷优化单点突变设计两者的组合突变,结果表明突变体Gln3His/Ile25Glu的最适pH值为5,最大酶比活力为63.9 U/mg,是初始PulPY2的2 倍,同时突变体Q13H/I25E在pH值为5时的活力较初始酶提高了3.3 倍,其酸耐受性显著提高,在pH 4.8~7.0的范围内最大比活力高于70%。Liu Zhongmei等[16]基于表面电荷、序列比对以及已报道突变综合分析等方法改造纳豆激酶,构建了11 个突变体,发现Tyr217Lys的耐酸性增强,最适pH值较初始酶降低了1,可能的原因是His64的pKa值发生改变,稳定了其质子化状态,进而导致纳豆激酶的耐酸性发生变化。
1.4 刚化柔性区域策略
酶的耐酸性与热稳定性之间存在一定的关联性,在利用刚化柔性区域策略进行酶的热稳定性改造的过程中经常会发现酶的耐酸性、最适pH值也随之发生变化;这说明增加酶的刚性在一定程度上也会增加酶的耐酸性。目前已报道的能够提高酶耐酸性的刚化柔性区域策略有截短突变、引入二硫键等。
截短突变是刚化柔性区域的常用策略。天然酶的loop环由6~16 个表面氨基酸残基组成,对于蛋白质的折叠、功能和稳定性具有重要作用,具有较强的柔性。嗜热酶表面具有较短和较少的loop结构,有利于维持其热稳定性,磷脂酶D的2 个loop环截短突变体Δ37-45和Δ38-46的半衰期较初始酶分别延长了11.7 倍和8.0 倍[40]。Kong Xiangya等[41]为了提高山羊溶酶体α-甘露糖苷酶外源表达产物活性及表达量,通过截短该酶部分结构域的方式构建了多个突变体进行外源表达,结果表明突变体chLAMt具有催化活性,同时发现截短突变体的耐酸耐热性均提高,在79 ℃条件下突变体能保留40%的活性,同时其最适pH值由6.0降低到5.5。Pan Xian等[42]对β-甘露糖苷酶只保留核心区的截短序列以及对其全长碱基序列进行外源表达,发现截短后的突变体(MAN330)与其全长蛋白(MAN493)的最适pH值、最适温度和底物特异性相似,但在pH 9.0~11.0范围内,MAN330的稳定性比MAN493高约7%;在60~80 ℃范围内,MAN330的稳定性比MAN493高约10%,说明截短表达的突变体pH值稳定性及热稳定性比全长蛋白高。Yin Xin等[43]通过将木聚糖酶的N端替换为耐热木聚糖酶片段构建多个突变体,筛选后发现突变体re-NhXyn1157的最适温度由55 ℃升高到85 ℃,pH耐受范围拓宽,可在pH 4.0~8.5内保持85%以上的活性。
引入二硫键也是刚化柔性区域的常用策略。Yang Min等[44]发现在海藻酸裂解酶(EC 4.2.2.3)中引入二硫键后,突变体半衰期延长2.25 h,熔融温度(Tm)升高1.7 ℃。Turunen等[45]在内切-1,4-木聚糖酶II(XynII)的α-螺旋中引入二硫键(S110C-N154C),结果表明突变体在65 ℃下的半衰期由小于l min延长到14 min,同时其pH值稳定性提高,在pH 4.0~9.0的范围内突变体酶活性均高于野生型。Suzuki等[46]在转谷氨酰胺酶的N末端引入一个二硫键(D3C-G283C),发现突变体热稳定性得到显著改善,其中55 ℃条件下的半衰期较初始酶延长了1.79 倍,由29.2 min延长到81.5 min,半失活温度由57 ℃升高到66 ℃。Teng等[47]在嗜酸性木聚糖酶中引入两个二硫键(T2C-T29C、S39C-S186C)后,突变体在pH 3.0~5.0的酸性环境中保持相对稳定的同时,其最适温度从50 ℃升高到70 ℃,比活力较初始酶提高了3.76 倍,kcat/Km提高了2.14 倍。因此,基于目前已有的文献报道及国内外研究进展,采用刚化柔性区域的理性设计策略,能够同时筛选出耐酸性及耐热性提高的突变体,进而得到具有更高环境耐受性的重组酶制剂。
1.5 突变体的筛选策略
通过随机突变或理性设计策略进行脱毒酶改造的过程中,发生有益突变的概率非常低(低于1/105),因此对突变体快速高通量筛选以获得最佳突变体尤为重要[48]。传统的筛选方法是采用琼脂平板或微孔板进行筛选;酶(如纤维素酶、淀粉酶、脂肪酶、蛋白酶、多聚半乳糖醛酸酶等[49-51])对显色底物具有降解作用,其可以在菌落周围产生水解圈,因此常用于筛选高活性菌株[52]。与琼脂平板筛选法相比,微孔板筛选可借助计算分析平台,通过如吸光度、荧光强度等信号高通量筛选有益突变体,其筛选量可达104~105个/周[53],显著提高了筛选速率。最近的研究表明,流式细胞术及微流控技术联合生物传感器、电化学传感器可以轻松筛选106~1010个突变体文库,为生物酶改造中的快速高通量筛选提供了有力支撑[48]。
尽管采用蛋白质工程方法改造生物酶的技术已经相当成熟,但针对真菌毒素脱毒酶进行改造并导向实际应用的研究仍然处在初步阶段。在众多已经发现的真菌毒素脱毒酶中,目前仅有少数研究采用理性设计策略改造OTA脱毒酶、ZEN脱毒酶的耐酸性、热稳定性及催化活性。虽然理性设计具有无需高通量大量筛选突变体的优势,同时也存在改造效果不理想的情况,以及可能遗漏活性更好的突变体等问题。因此,为了获得更加理想的真菌毒素脱毒酶突变体以用于实际的脱毒应用,未来可以借助日趋成熟的高通量筛选技术对脱毒酶进行改造。
2 脱毒酶耐酸性改造在OTA脱除中的潜在应用
2.1 OTA的限量标准及污染现状
赭曲霉毒素(ochratoxins,OTs)是由曲霉属和青霉属等霉菌产生的一类氯酚类真菌毒素,现已发现超过20 种OTs家族的化合物[54],主要包括OTA和赭曲霉毒素B(ochratoxin B,OTB),其中OTA暴露范围最广泛,毒性最强,1994年被国际癌症研究机构和世界卫生组织列为IIB类致癌物质[55]。近期研究发现长期低剂量接触OTA有引起儿童自闭症恶化的潜在风险[56]。GB 2761—2017《食品安全国家标准 食品中真菌毒素限量》对葡萄酒(2.0 μg/kg)、咖啡(5.0 μg/kg)等都有OTA限量要求;欧盟EC/1881—2006Setting Maximum Levels for Certain Contaminants in Foodstuffs规定葡萄酒中OTA限量同样是2.0 μg/kg,但其2020年将食品及辅料中的OTA限量修订为0.5(婴儿食品)~20 μg/kg(干辣椒);食品法典委员会(Codex Alimentarius Commission,CAC)认为受到OTA污染严重的农产品/食品排序依次为谷物>葡萄及其制品>咖啡及其制品>白酒>其他[57],葡萄和咖啡是受污染最严重的经济作物(表2)。根据国内市场监督管局及欧盟食品饲料类快速预警系统(The Rapid Alert System for Food and Feed,RASFF)发布的通知,葡萄、咖啡及其制品等产品中检出OTs的频率较高,2021年RASFF发布的预警中,在葡萄、咖啡及其制品等产品中检出OTA的频率为44.1%[58]。综上,葡萄酒及咖啡中的OTs污染造成了巨大的食品安全隐患。

表2 不同农产品中OTA的检出率和污染水平Table 2 Detection rates and contamination levels of OTA in different agricultural products
2.2 耐酸OTA脱毒酶的应用前景
目前已经发现羧肽酶A(carboxypeptidase A,CPA)、酰胺酶、酯酶、蛋白酶等具有OTA降解活性,其能够催化OTA降解为赭曲霉毒素α(ochratoxin α,OTα)和苯丙氨酸,是OTA无害化处理的理想方式[71]。其中源于牛胰脏的CPA发现最早,而且同时具有降解OTA及OTB的能力[72-73],能够在短时间内将OTA完全降解,最适作用pH值为8.0,CPA降解OTA的pH值范围为6.0~9.0,超出此范围其OTA降解活性急剧下降[74]。此外,源于枯草芽孢杆菌(B.subtilisCW14)及溶杆菌(Lysobactersp.CW239)菌株的羧肽酶DacA及rCP4同样具有OTA降解活性,其最适pH值均为7,在酸性环境中其OTA降解活性均受到一定程度的抑制[72,75]。除了羧肽酶以外,近年来发现来源于寡养单胞菌(Stenotrophomonas acidaminiphila)和黑曲霉(Aspergillus niger)的酰胺酶AHD3和OTase同样具有OTA降解活性,且其降解活性高于牛胰脏CPA,其最适pH值均为7,在酸性环境中的催化活性受到抑制[74,76]。
研究表明,OTA在pH>12的碱性条件下不稳定,能够通过打开内酯环或者降解酰胺键的方式产生毒性低于OTA的产物[77];但是在自然或者酸性条件下OTA非常稳定,很难发生降解[78]。由表3可知,目前已经发现的OTA降解酶的最适pH值均为中性或者偏碱性,且大多数酶的活性范围较窄,在pH值低于5的酸性环境中其OTA降解活性受到强烈抑制,因此获得具有更好耐酸性的酶是解决酸稳定性OTA脱除问题的必然选择。宋佳等[79]研究了重组酰胺水解酶Af-Otd降解OTA的酶学性质,结果表明该酶在弱碱性条件下的活力更高,最适pH值为7.5,但是在酸性条件下活力明显降低;同时,他们发现乙醇浓度对该酶活力有显著影响,在乙醇体积分数超过8%时Af-Otd失去OTA降解活性。易受OTA污染的葡萄酒乙醇体积分数在8%~15%之间,且食品、饲料的pH值均为偏酸性(表2);所以在未来的实际脱毒应用中偏酸性的食品体系会导致OTA降解酶失活,进而失去脱毒能力,这是阻碍OTA脱毒酶工业化应用的瓶颈。因此,利用理性设计的策略对目前已经发现的具有OTA降解活性、背景明确的OTA脱毒酶进行分子改造,使其最适pH值向偏酸性转移,或者增强OTA降解酶的耐酸性,是解决目前OTA降解酶活性作用范围与实际脱毒环境条件不匹配问题的关键。OTA降解酶的催化活性及pH值范围如表3所示。
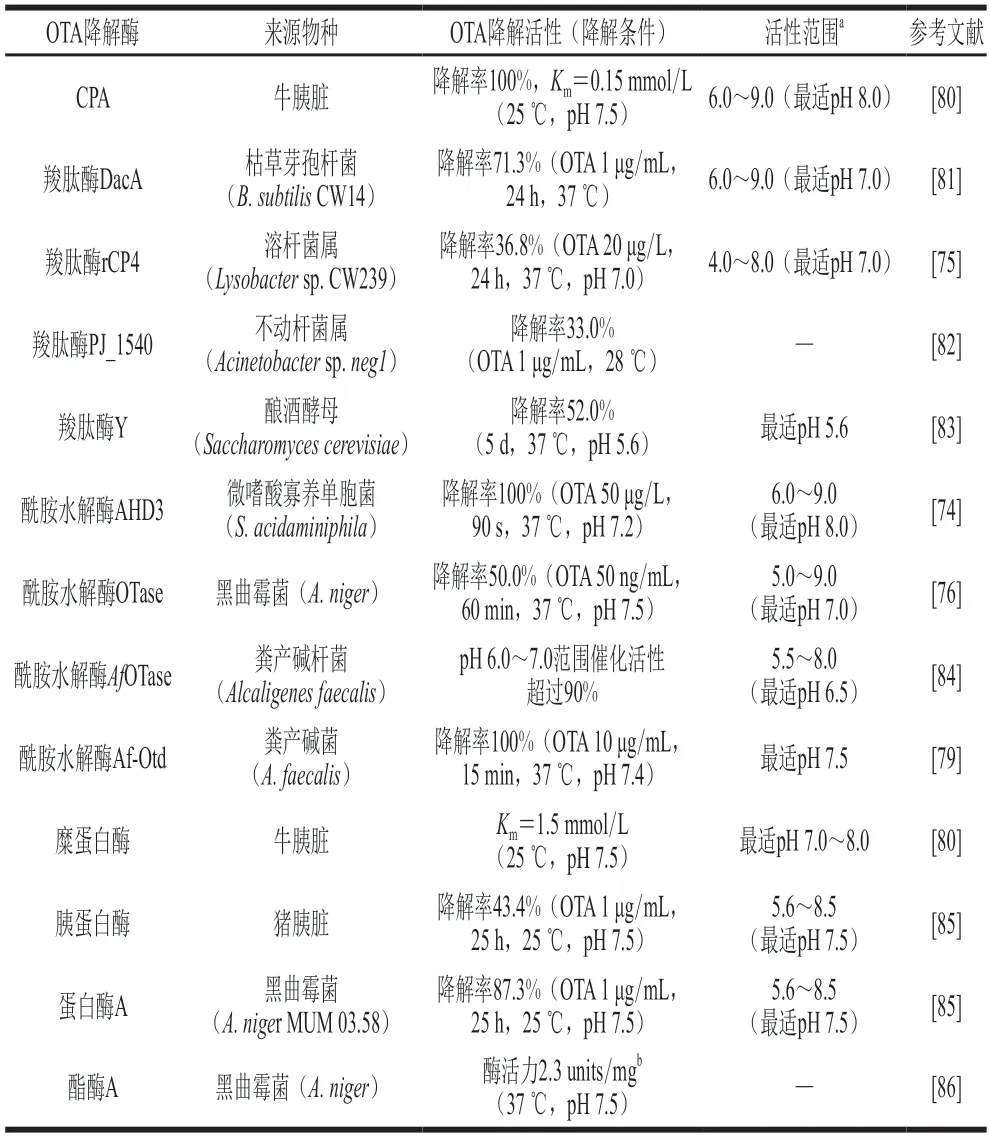
表3 OTA降解酶的催化活性及pH值范围Table 3 Catalytic activity and pH range of OTA-degrading enzymes
2.3 脱毒酶耐酸性改造研究
尽管已经有大量可降解OTA的羧肽酶、酰胺酶、酯酶、蛋白酶等被发现/挖掘、鉴定和研究(表3),但其在耐酸性及耐热性方面仍然无法满足工业应用的要求。为了提高CPA降解OTA的稳定性,马蕾等[87-88]采用沸石咪唑酯骨架化合物(zeolitic imidazolate framework-8,ZIF-8)对CPA进行负载与保护,结果使CPA的底物转化率提高了3 倍,并使其稳定性及OTA降解能力显著提高。虽然采用酶固定技术可以提高酶的表观稳定性,但没有改变酶本身的环境抗逆性,不能从根本上解决脱毒酶稳定性差的问题。因此,基于脱毒酶的晶体结构,采用理性设计改造酶的耐酸耐热能力逐渐引起了研究人员的关注。Xiong Lu等[89]通过对CPA进行截短表达,发现去除CPA酶原中的信号肽及前导肽后在毕赤酵母中表达的成熟CPA(mature CPA,M-CPA)在pH值为3~4及pH 11的环境中比从牛胰脏中直接提取商用CPA(commercial CPA,M-CPA)具有更好的稳定性及催化活性,可能是截短后提高了CPA分子的刚性所致(图3A)。Ming Yue等[90]预测了CPA的柔性区域,以刚化柔性区域的方式构建了多个突变体,结果发现突变体r133-139的热稳定性显著提高,其半衰期延长了40.3 min,半失活温度升高了6.7 ℃,熔融温度Tm升高了3.1 ℃,其热稳定性的提高可能与局部氢键的形成有关(图3B)。
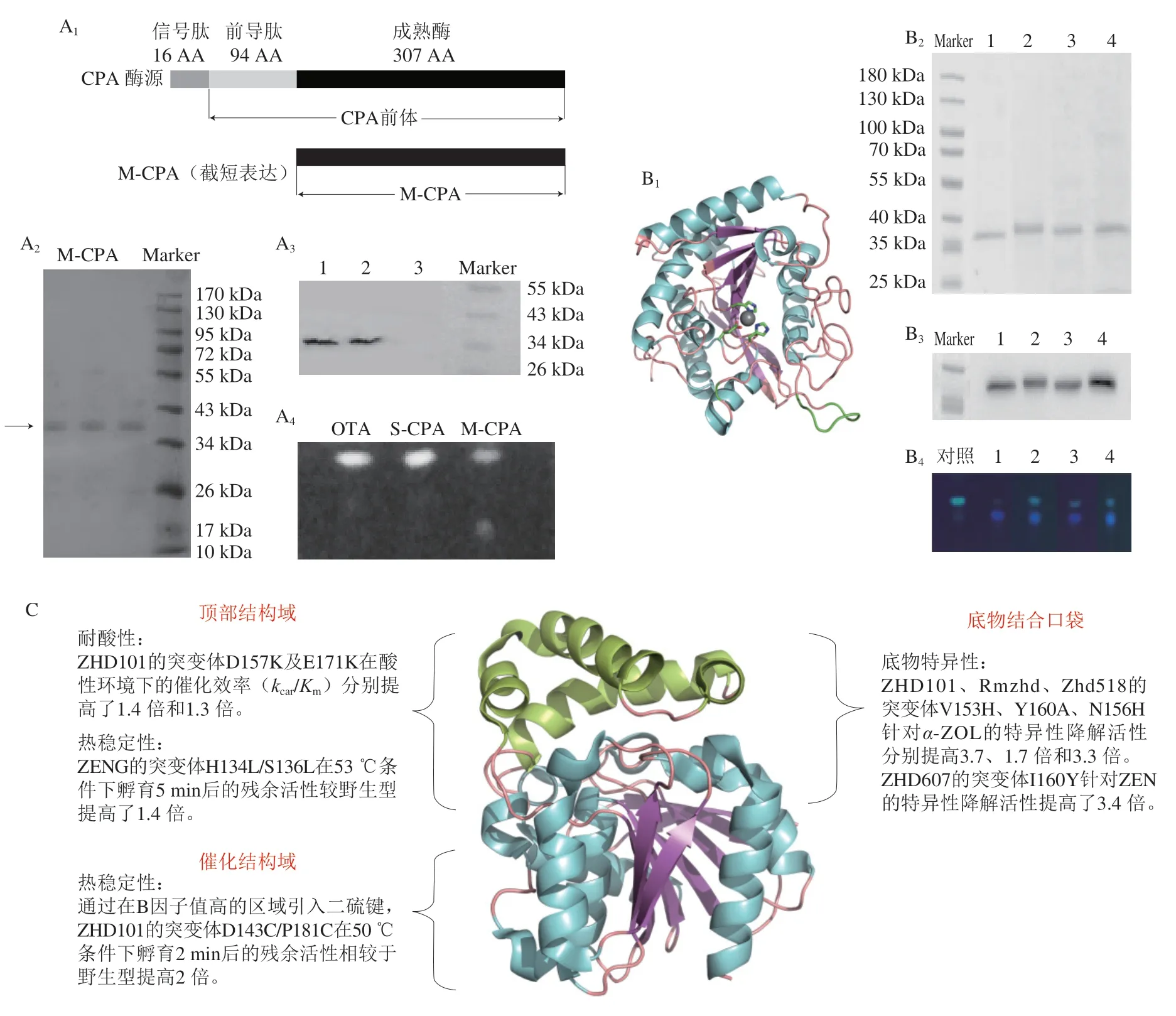
图3 基于理性设计的真菌毒素脱毒酶改造Fig.3 Rational design-based modification of mycotoxin degradation enzymes
除了针对OTA 降解酶的改造外,关于ZEN 降解酶(ZHD101)的改造研究也有报道(图3C)。Yu Xinrui等[92]基于结构和同源序列比对分析,使突变体ZHDM1和Ile160Tyr对ZEN的催化活力较初始酶分别提升了2.9 倍和3.4 倍。Lin Min等[93]采用优化表面电荷的方法提高了ZHD101耐酸性,通过引入带正电荷的赖氨酸改变ZHD101的活性位点pKa值,发现突变体M2(Asp157Lys)和突变体M9(Glu171Lys)在酸性条件下催化效率提高;同时,突变体M8(Asp133Lys)和突变体M9(Glu171Lys)的kcat分别比初始酶提高了2.73 倍和2.06 倍。陈权等[94]通过刚化柔性区域策略改造ZEN水解酶ZHD101的热稳定性,发现突变体Asn156Phe、Ser194Thr和Thr259Phe的熔融温度升高(ΔTm>4 ℃),且酶活力与初始酶类似甚至更高(相对酶活力分别为95.8%、131.6%和169.0%);进一步将3 个突变体进行迭代组合突变,发现Asn156Phe/Ser194Thr的热稳定性最好,Tm较初始酶升高了6.7 ℃。许中霞等[95]通过在ZHD101分子中引入二硫键构建7 个双点突变体,其中突变体Asp143Cys/Pro181Cys在50 ℃孵育后的残余酶活力是初始酶的2 倍。
ZEN降解酶的改造还涉及对底物特异性及降解活性的研究。Xu Zhongxia等[96]将ZHD101中活性中心附近153位的缬氨酸突变为带有极性残基的组氨酸(Val153His),提高了其与底物α-玉米赤霉烯醇(α-zearalenol,α-ZOL)的氢键相互作用,最终使Val153His对毒性更强的α-ZOL的降解活性提高了3.7 倍。随后,Wang Meixing等[97]通过将ZHD518与ZHD101进行序列比对分析获得突变体Asn156His,发现其对α-ZOL的催化活性提高了3.3 倍,且对ZEN、α-玉米赤霉醇(α-zearalanol,α-ZAL)、β-玉米赤霉醇(β-zearalanol,β-ZAL)的降解活性也显著提高。Zheng Yingying等[98]解析了源于Rhinocladiella mackenziei的ZEN降解酶RmZHD的晶体结构,通过与ZHD101的结构进行对比分析,将160位的酪氨酸突变成体积更小的丙氨酸,使底物结合口袋具有更大的空间以结合底物α-ZOL,最终突变体RmZHD对α-ZOL的水解活性是初始酶的1.7 倍。目前对黄曲霉毒素脱毒酶、DON脱毒酶也有研究和初步应用,为了适应工业化需求,真菌毒素降解酶的改造是近期及未来的研究热点。
3 结语
酶制剂具有催化效率高、专一性强等特点,在食品、化工、医药等领域发挥着越来越重要的作用。从天然来源中分离出的酶通常在天然条件下非常有效,但在实际工业化应用的苛刻条件(极端pH值、极端温度、极端盐度、有机溶剂)下极易失去催化活性。因此,对天然酶进行改造使其适应实际生产需求是目前的研究热点,也是推动酶制剂工业化应用的关键。理性设计是目前常用的酶改造方法,其通过分析现有的结构信息提出可能有效的突变策略,然后利用定点突变技术引入突变位点,并筛选出活性或者稳定性增强的突变体酶,具有功能靶向性高、相比于定向进化和半理性设计工作量小等优点。大量研究结果表明理性设计是提高酶耐酸性的有效策略,基于对目标酶背景的调查,可采用同源序列比对、表面电荷优化、分子内作用力优化等策略进行突变体设计,经过异源表达、纯化验证筛选得到稳定性增强的重组酶突变体。但是目前酶的耐酸性改造仍然存在成功率偏低、改造过程中对酶催化活性的影响具有不确定性、最适pH值改变幅度小等问题;未来可以进一步深化计算机辅助突变体设计,尝试综合多种改造策略,进一步提高改造成功率。同时,基于调查结果发现多数易受到OTA污染的食品及食品原料的酸度较低,而目前发现的具有较好实际应用前景的OTA降解酶的最适pH值均为中性或者偏碱性,其活性在偏酸性条件下受到抑制;因此,利用理性设计的策略对目前已经发现的OTA脱毒酶进行分子改造,使其最适pH值向偏酸性转移,或者增强OTA降解酶的耐酸性,是解决目前OTA降解酶活性作用范围与实际脱毒环境条件不匹配问题的关键,也是酶制剂脱毒工业化推广的必由之路。
