食品中植酸及其降解产物的研究进展
2023-11-08陈佳悦刘贵巧李春梅王凤忠
陈佳悦,范 蓓,刘贵巧,李春梅,,王凤忠,
(1.中国农业科学院农产品加工研究所,农业农村部农产品加工综合性重点实验室,北京 100193;2.河北工程大学生命科学与食品工程学院,河北 邯郸 056038)
植酸亦称肌醇1,2,3,4,5,6-六磷酸(myo-inositol 1,2,3,4,5,6-hexakis dihydrogen phosphate,InsP6),是一种包含6 个磷酸基团的环状化合物,其结构式如图1所示。植酸广泛存在于植物中,是磷酸盐的主要存在形式,占总磷的60%~90%,对维持植物正常生理活动发挥重要作用。然而,植酸中因含有带高密度负电荷的磷酸基,具有极强的螯合能力,在生物体内可以与蛋白质和矿质元素螯合形成稳定、难以降解的复合物,使蛋白质和矿质元素的生物利用率降低[1],而大部分磷和矿物质被排出体外也会造成土壤污染和水体富营养化等环境问题[2-3]。因此,植酸通常被认为是抗营养因子。目前,美国、英国、芬兰、意大利、瑞典等发达国家均已制定了植酸每日推荐摄入量,其中美国和英国推荐摄入量较高,为631~746 mg/d,瑞士推荐摄入量最低,为180 mg/d[4],而我国仍缺乏对食品中植酸含量的系统调研,其对人体的健康风险未知。
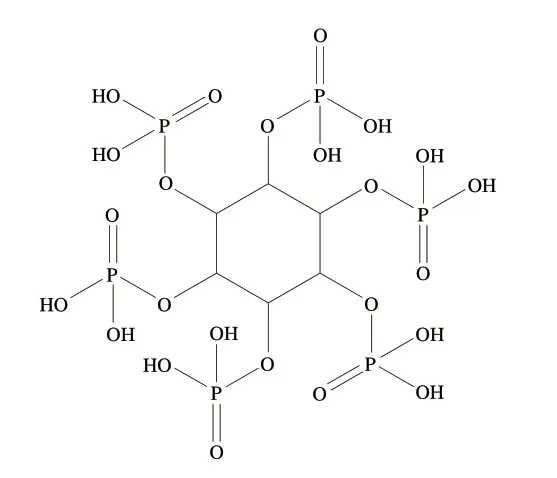
图1 植酸结构式Fig.1 Structure of phytic acid
随着研究的深入,人们发现植酸也有许多有益作用,如抗氧化、抗癌和抗糖尿病等生物活性[4-5]。另有研究表明,在植物种子发育或食品加工过程中,植酸可降解成低级植酸盐(InsP5、InsP4、InsP3等)(图2)[6],不仅降低了植酸盐原有的抗营养作用,且大多数降解产物在细胞信号转导和机体代谢调节中起着非常重要的作用,有些还具有抗癌、降血压等功效[7]。鉴于此,精确测定食品中植酸及其降解产物低级磷酸肌醇的含量,对正确评价其风险尤为重要。因此,本文对植酸及其降解产物的性质、抗营养作用、生物活性以及在食品中的含量水平进行综述,并对其分析测定方法进行探讨,以期为我国开展该领域的相关研究提供参考。
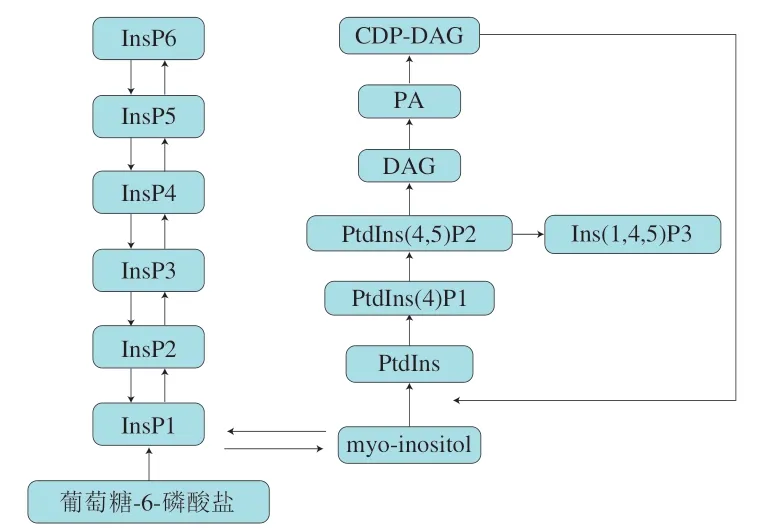
图2 植酸在植物体内的降解过程[6]Fig.2 Degradation pathway of phytic acid in plants[6]
1 植酸及其降解产物的性质
植酸为淡黄色或褐色糖浆状液体,具有极强的水溶性,lgP为-8.47,也可溶于甘油和体积分数95%乙醇溶液,微溶于无水乙醇和甲醇,难溶于无水乙醚、苯和氯仿等有机溶剂。植酸对光稳定,但受热易分解,且随着植酸浓度降低,其热稳定性会随之降低。植酸结构中有12 个可解离的质子或活性位点(图1),其中6 个是强酸性位点,解离常数pKa值为1.5~2.0,两个是弱酸性位点,pKa值为6.0左右,4 个是很弱的酸性位点,pKa值为9.0~11.0[8]。
植酸在内源植酸酶的作用下,磷酸基团按顺序去磷酸化会产生多种水溶性低级磷酸肌醇,包括InsP5、InsP4、InsP3、InsP2、InsP1(图2)[6]。表1列出了植酸及其降解产物的理化性质,随着磷酸基团数量的减少,降解产物的lgP增大,极性降低。
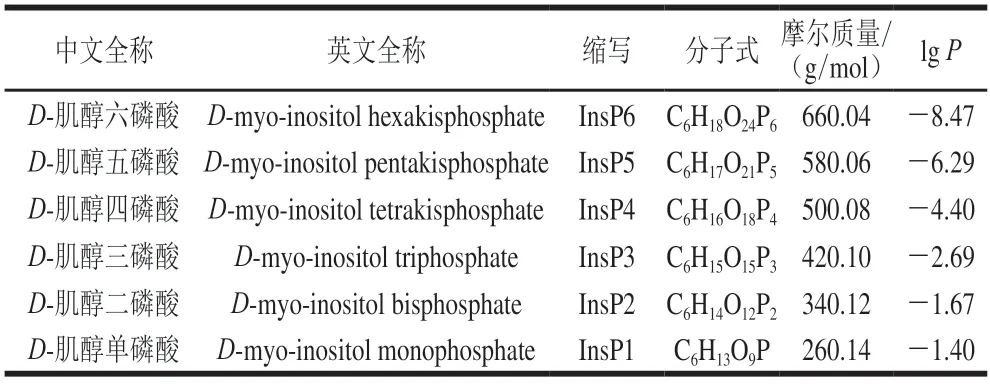
表1 植酸及其降解产物的理化性质Table 1 Physicochemical properties of phytic acid and its degradation products
2 植酸及其降解产物的生理作用
2.1 抗营养作用
植酸分子结构中的6 个磷酸基团具有极强的电负性和螯合能力,能与二价或三价金属离子如Zn2+、Cu2+、Fe2+、Fe3+、Ca2+、Mg2+、Mn2+等发生结合反应形成植酸盐,这些植酸盐在酸性pH值下可溶,但在生理pH值下难溶,而人类消化道缺乏植酸降解酶,因此植酸难以被胃肠道消化吸收,从而使得这些被结合的金属离子生物利用率大幅降低[5,9-11]。据报道,在缺乏植酸的情况下,人体可以从食物中多吸收20%的锌和60%的镁[5]。一项研究表明,在含有2、25 mg和250 mg植酸的小麦卷中,锌的吸收率分别被抑制了18%、64%和82%[12]。植酸主要抑制人体对铁、锌、钙和镁元素的吸收[13-15],这对于长期以谷物和豆类作为主食的发展中国家尤为明显,矿物质吸收的减少,特别是锌和铁吸收的减少,会导致贫血、早产、婴儿大脑发育迟缓、免疫和认知功能下降等[5]。
通常采用植酸与矿质元素的物质的量比评估食品中矿质元素的生物利用率,研究表明,有利于铁、锌和钙元素吸收的植酸与矿质元素物质的量比参考值分别为n(植酸)∶n(铁)<1、n(植酸)∶n(锌)<15、n(植酸)∶n(钙)<0.24[16]。当食品中植酸与矿质元素的物质的量比低于参考值时,认为植酸的含量对矿质元素生物利用率没有影响,反之则表明对其吸收有不利影响。Nissar等[4]建议每100 g食物植酸摄入量应低于25 mg,以减少微量营养素的损失。表2列出了不同国家植酸的每日推荐最高限制摄入量。

表2 不同国家植酸的每日推荐最高限制摄入量[4]Table 2 Recommended maximum daily intake of phytic acid in different countries[4]
由于植酸在自然界中以离子形式存在,因此还可与一些带电的蛋白质结合形成复合物,环境的pH值会显著影响植酸与蛋白质的结合能力,当pH值低于蛋白质等电点时,蛋白质具有正电荷,可以直接通过静电结合与植酸形成二元复合物,使蛋白质的结构改变,从而影响一些酶的活性、蛋白质溶解性和消化率[17-18]。体外研究表明,蛋白质来源、溶解性、膳食中Ca2+和Mg2+水平等多种因素会影响植酸与蛋白质的结合程度[19-20]。此外,植酸可螯合蛋白酶活性中心的金属离子,抑制胰蛋白酶、胰凝乳蛋白酶和胃蛋白酶等多种蛋白酶的活性,使其降解蛋白质的效率降低[17,21]。植酸还可通过氢键直接或通过蛋白质间接与淀粉链结合生成植酸-蛋白-淀粉复合体,从而降低淀粉的溶解性和可消化性[22]。
与植酸相比,目前关于植酸降解产物的研究相对较少。有研究表明InsP5与植酸有相近的螯合能力,一般被视为抗营养因子,而随着磷酸基团数量的减少,其螯合能力大为降低[2]。在相同条件下,InsP6的蛋白聚合力是InsP5的(4.6±0.1)倍[23];虽然低级磷酸肌醇InsP1~4对蛋白聚合力影响较小,但磷酸化程度低至InsP3的植酸降解产物仍可抑制胃蛋白酶活性[23],且可螯合Fe3+使其利用率降低[23-24]。Lönnerdal等[25]的研究表明,InsP6和InsP5对乳鼠锌吸收有较强抑制作用。目前,植酸酶已广泛应用于食品和动物饲料中,以提高矿质元素和蛋白质的利用率[26-28]。
2.2 生物活性
植酸除对人体有抗营养作用外,还具有多种生物活性作用。抗氧化是植酸最显著的特征,植酸肌醇环各位上的磷酸基团与Fe3+形成的植酸-Fe3+螯合物稳定性高,可以有效抑制Fe3+诱导的羟自由基产生,从而抑制脂质过氧化[29]。但植酸仅在体外表现出高抗氧化活性,而对生物体内抗氧化能力没有提升作用。Rimbach等[30]的研究表明小鼠体内大量的植酸会降低铁的生物利用率,却对体内抗氧化能力的提高作用较小。植酸还具有广谱的抗癌作用,可有效防治结肠癌、乳腺癌、前列腺癌、肝癌、皮肤癌等[4-5,17]。相关研究表明,植酸还能降低细胞生长速度,促进癌细胞向正常表型分化[31]。此外,植酸可通过络合铁离子以减轻铁诱导的低密度脂蛋白胆固醇氧化,降低血浆中总胆固醇含量,从而预防冠心病的发生[4-5]。近期研究还表明植酸可通过调节炎症反应和肠道菌群结构维持血乳屏障的完整性[32]。
植酸降解产物InsP2~5在细胞信号转导和机体代谢调节中也具有重要作用,其中InsP5可特异性地抑制磷酸肌醇3-激酶信号传输通路,使体外培养的癌细胞对抗癌药物的作用更加敏感,引起癌细胞凋亡[33]。InsP4对T淋巴细胞的正常分化具有重要作用,且在中性粒细胞中,InsP4通过阻断InsP3介导的pH结构域蛋白质质膜转位从而实现对InsP3信号转导途径的反向调控[34]。InsP3是作为Ca2+信号转导途径中的第二信使,InsP3/Ca2+信号转导途径可调控多种细胞代谢过程[7,35]。此外,InsP3还具有降血压、消炎、抗氧化等功效[7,36]。
3 植酸及其降解产物的含量分布
植酸广泛存在于谷物、豆类、油籽和坚果等食品中。已有研究发现小麦和水稻等单子叶植物中约90%的植酸分布于糊粉层或麸皮层中,约10%存在于胚芽中;而玉米与其他谷物不同,88%植酸存在于胚芽中,而胚乳中含量仅占3.2%;在大豆等双子叶植物中,约99%的植酸分布于整个子叶中[37]。食品中植酸的含量如表3所示,谷类及其制品中含麸皮的谷类植酸含量较高,其中米糠的植酸质量分数最高达8.7%,麦麸中最高达3.9%;豆类中大豆的植酸含量最高,为(1 709.40±4.67)mg/100 g,其制品大豆浓缩蛋白的植酸质量分数较高,为1.12%~2.34%;油料类中芝麻的植酸质量分数最高,为1.44%~5.36%,烤熟后其质量分数亦较高,为3.93%~5.72%;与上述3 类食品相比,坚果类的植酸质量分数相对最高,最高值范围为4.47%~9.42%,其中杏仁的植酸质量分数最高,为0.35%~9.42%。
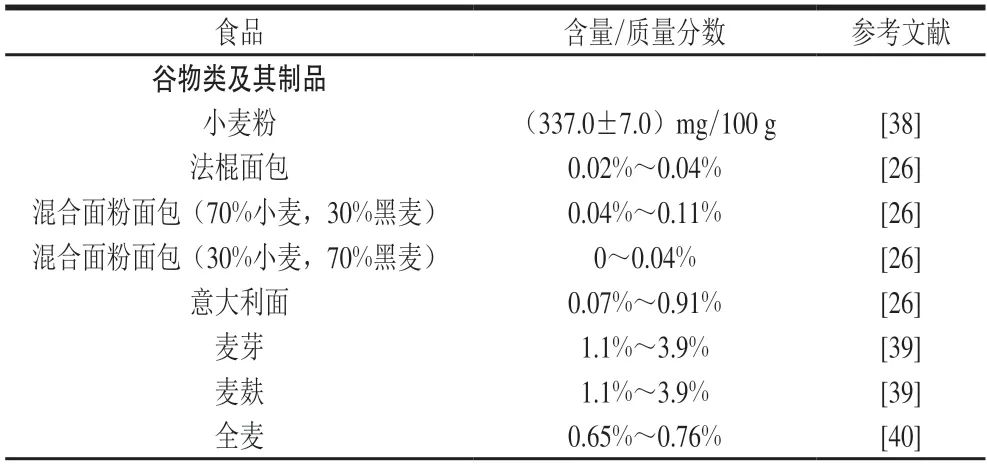
表3 食品中植酸含量水平Table 3 Contents of phytic acid in foods
近年来,随着研究的深入,为了更加准确评估植酸对营养吸收的抑制程度,研究人员开始关注食品中植酸及其降解产物的精确含量。Sun Mingjing等[49]对美国农场大豆和玉米中的植酸及其降解产物含量进行测定,结果显示大豆和玉米样品中均检出InsP4~6,且以InsP6为主要存在形式;大豆样品中InsP6含量为8.64~12.26 μmol/g,InsP5含量为3.01~3.70 μmol/g,InsP4含量为0.69~0.99 μmol/g;与大豆相比,玉米中植酸及其降解产物的含量相对较低,InsP6含量为5.95~7.82 μmol/g,InsP5含量为2.35~2.91 μmol/g,InsP4含量为0.37~0.58 μmol/g。Burgos等[16]通过测定阿根廷尾穗苋谷物中植酸及其降解产物含量发现,总植酸含量为3 051.3 mg/100 g,其中InsP6和InsP5占总植酸含量的90%以上,InsP4和InsP3分别占总植酸含量的8.4%和1.0%;热加工过程导致InsP6含量显著降低,降幅达19%~27%,但伴随着InsP5含量显著升高,这可能是由于谷物在加工过程中内源植酸酶未完全水解InsP6。Frontela等[50]也发现谷物粉中InsP5含量在烘烤后升高43%~368%。表4汇总了目前已报道食品中植酸降解产物的含量。

表4 食品中植酸的降解产物含量Table 4 Contents of phytic acid degradation products in foods
4 食品中植酸及其降解产物检测的分析方法
4.1 前处理方法
食品中植酸及其降解产物的常用前处理方法主要包括酸浸提法、超声提取法、微波提取法、固相萃取法等。
4.1.1 酸浸提法
酸浸提法是提取植酸及其降解产物较为常用的方法,盐酸是主要的提取剂,通常采用0.5 mol/L或0.66 mol/L盐酸常温提取2~4 h,最长提取时间为24 h。Liu Xiaodan等[59]比较了盐酸、甲酸、三氟乙酸和乙酸对生物组织及坚果等中植酸及其降解产物的提取效果,发现3.2 mol/L乙酸对InsP1~6具有最好的提取效果,回收率为64.1%~119.6%。Yu Saisai等[61]建立了一种更环保的小麦制品中植酸的提取方法,即采用超纯水和强酸性阳离子交换树脂提取2 h,与传统盐酸提取法相比,该方法提取率更高,回收率为85.8%~105.0%,这主要是由于盐酸提取剂中金属离子的存在阻碍了植酸的甲酯衍生化,而强酸性阳离子交换树脂的添加可有效去除金属离子。此外,对于脂肪含量较高的食品,脂肪会影响植酸的提取效率,通常需在提取前进行脱脂处理,使其质量分数降低至5%以下[62]。
4.1.2 超声提取法
与传统酸浸提法相比,超声提取法利用超声波所产生的热效应、空化效应和机械振动等作用,极大地缩短了提取时间,提取效率更高。Simonet等[56]以2 mol/L盐酸为提取剂,利用超声波提取豆类和坚果中植酸及其降解产物,发现5 min内即可成功提取InsP1、InsP2和InsP3,20 min内可完全提取InsP6;当提取时间超过45 min时,可能由于InsP6发生水解,其回收率降低,而低级磷酸肌醇InsP5、InsP4、InsP3和InsP2的回收率则有所升高,因此,最终选用20 min作为超声时间,InsP1~6的回收率可达94.4%~107.7%。
4.1.3 微波提取法
微波提取法也是目前测定食品中植酸常用的提取方法之一。Liu Tong等[63]考察了微波提取剂浓度、提取时间和温度对核桃中植酸的提取效率,发现0.66 mol/L盐酸和0.52 mol/L硫酸对植酸的提取效率无显著影响;采用0.66 mol/L盐酸作为提取剂时,当微波提取温度从100 ℃升高至125 ℃,或提取时间从10 min延长至20 min,植酸的提取率无显著差异,但当温度升高至150 ℃时,InsP6发生水解,其提取率降低;与传统盐酸提取相比,当采用0.66 mol/L盐酸和0.52 mol/L硫酸混合溶剂(1∶1,V/V)作为提取剂时,植酸的提取率较高,最优微波条件为提取温度100 ℃、提取时间10 min、液料比20∶1;该方法与传统的酸浸提法(提取时间3 h)相比显著缩短了提取时间,提高了提取效率。
4.1.4 固相萃取法
固相萃取法已经广泛应用于食品样品中植酸及其降解产物的净化,硅胶阴离子交换剂SAX、阴离子交换树脂AG1-X8和AG1-X4是目前常用的固相萃取填料。Burbano等[54]比较了AG1-X8和SAX柱对豆类中InsP3~6的提取效果,结果发现两种固相萃取柱的回收率接近,但SAX柱的变异系数更小,且SAX柱的优势在于预处理时间更短,可重复性和再现性更强。由于酸提取液的酸度通常较高,大多数InsPn不能保留在离子交换柱上,因此,一般在进行固相萃取净化前采用蒸发[54,64-65]或稀释[40,66-67]降低酸度。然而,Chen Qingchuan[47]研究发现蒸发处理后,食品中InsP5和InsP6的回收率较低,这可能是干燥后的提取物未完全从玻璃容器壁中溶解所致[68],因此,最终选择将提取液稀释10 倍以降低酸度,然后采用SAX固相萃取柱净化,以2 mol/L盐酸进行洗脱,结果显示InsP5和InsP6的回收率为89.6%~104.8%。
部分食品中植酸及其降解产物的前处理方法汇总如表5所示。

表5 食品中植酸及其降解产物检测的前处理方法Table 5 Sample pretreatment for analysis of phytic acid and its degradation products in foods
4.2 仪器分析方法
4.2.1 分光光度法
植酸具有较强的螯合性,可以与其他一些化合物竞争螯合离子。研究人员利用植酸与磺基水杨酸竞争螯合Fe3+的特点测定植酸含量,其原理是磺基水杨酸与Fe3+反应生成紫红色络合物,在500 nm波长处吸光度最高,当植酸存在时能竞争螯合其中的Fe3+,发生褪色反应,吸光度下降量与植酸的浓度成反比。我国现行有效的GB 5009.153—2016《食品安全国家标准 食品中植酸的测定》[71]就是根据这个原理而制定的,方法检出限为0.006 g/kg,定量限为0.02 g/kg。该方法最大的优点是不需要昂贵的仪器,操作简单,但该方法中Fe3+同样可与植酸降解产物低级磷酸肌醇发生反应,容易使所测植酸含量结果偏高。
4.2.2 离子色谱法
离子色谱法是利用待测物在离子交换树脂柱与流动相间的反复交换,使样品中各离子分离,该方法能够通过阴离子交换色谱柱结合梯度洗脱将植酸及其降解产物有效分离,具有灵敏度高、重现性好、简便快速等特点。Chen Qingchuan等[47]采用CarboPac PA-100色谱柱(250 mm×4 mm,10 μm)经盐酸梯度洗脱测定了豆类、坚果中的InsP5和InsP6的含量,方法检出限为1.5~3.4 μmol/L,该方法将植酸及其降解产物低级磷酸肌醇有效分离,消除了低级磷酸肌醇的干扰,定量结果更准确。陆智辉等[73]利用离子色谱法测定了棉仁样品中的植酸含量,选用AG11-HC阴离子交换色谱柱(4 mm×250 mm)并对分析条件进行优化,结果表明,在洗脱液30.0 mmol/L KOH溶液、流速1.0 mL/min、柱温30 ℃、进样量20 μL的色谱条件下,样品中植酸峰与杂质峰得到完全分离,方法检出限为0.059 μg/mL,定量限为0.196 μg/mL。
4.2.3 高效液相色谱法
高效液相色谱法(high performance liquid chromatography,HPLC)是目前使用较为广泛的植酸及其降解产物定量检测方法,该方法选择性和灵敏度更高。C18柱是最常用的色谱分离柱,但由于植酸为离子型化合物,极性较大,在反相键合相色谱柱上的保留时间相对较短,难以与液相色谱柱死时间进行区分,因此,通常采用在流动相中添加离子对试剂以增加溶质与非极性固定相的作用,改善分离效果。目前,已报道用于植酸及其降解产物分析的离子对试剂包括四丁基氢氧化铵溶液、正戊胺、乙酸二己基铵。Zhang Shaojun等[53]比较了3 种离子对试剂(乙酸二丁基铵、乙酸二戊基铵和乙酸二己基铵)对InsP1~6在C18柱上分离效果,结果显示乙酸二己基铵可快速有效分离InsP1~6。此外,衍生化处理也有助于植酸在C18柱的保留,但步骤比较繁琐。通常采用三甲基硅烷基重氮甲烷对植酸磷酸根甲酯化,以提高磷酸根的疏水性和稳定性,降低其酸性和金属螯合能力[61,74]。
由于植酸及其降解产物没有发色和荧光基团,因此无法直接利用紫外或荧光检测器测定植酸及其降解产物,需经过一定的预处理过程或与一些特定的检测器联用。Dost等[75]利用植酸对硫氰酸铁有色络合物的置换反应,采用十八烷基硅烷键合硅胶填料(octadecylsilyl,ODS)色谱柱分离并检测硫氰酸铁浓度的降低量,建立了利用高效液相色谱-紫外检测法(high performance liquid chromatography-ultraviolet,HPLC-UV)测定小麦及其制品中植酸含量的方法,方法检出限为0.5 μg/mL。蒸发光散射检测器(evaporative light-scattering detector,ELSD)和示差折光检测器(refractive index detector,RID)不依赖于物质的官能团或光学特性,是一种通用型质量检测器,可用于食品中植酸含量的测定,但HPLCRID方法对流动相要求比较高,无法进行梯度洗脱,从而使待测组分与干扰成分分离困难,故灵敏度相对较低。
4.2.4 液相色谱-串联质谱法
近年来,液相色谱-串联质谱方法(liquid chromatograph tandem mass spectrometer,LC-MS/MS)在食品中植酸及其降解产物的检测中得到广泛应用(表6)。与上述HPLC方法相比,其具有灵敏度更高、选择性更好等特点。Yu Saisai等[61]建立了小麦中植酸的LC-MS/MS结合柱前衍生分析方法,样品经超纯水和强酸性阳离子交换树脂搅拌提取2 h,三甲基硅烷基重氮甲烷衍生,C18色谱柱分离,以大气压化学电离(atmospheric pressure chemical ionization,APCI)正离子、多反应监测(multiple reaction monitoring,MRM)模式进行植酸的定性分析,方法检出限为0.07 ng/mL,定量限为0.25 ng/mL。Liu Xiaodan等[59]采用非衍生化LC-MS/MS对坚果、燕麦中InsP1~6进行测定,选用阴离子色谱柱分离,流动相为200 mmol/L碳酸铵(pH 9.0)-5%甲醇水溶液,质谱采用电喷雾离子源(electron spray ionization,ESI)负离子-选择性反应监测模式(selective reaction monitoring,SRM),方法检出限为0.25 pmol。Zhang Shaojun等[53]采用非衍生化LC-MS/MS对大豆、玉米、水稻、拟南芥籽粒等中InsP1~6进行测定,选用C18反向色谱柱分离,以5%乙腈水溶液(含5 mmol/L乙酸二己基铵,pH 7.0)-乙腈为流动相,质谱条件为ESI负离子-MRM模式,方法检出限为0.3~3.0 pmol,定量限为0.3~30.0 pmol。
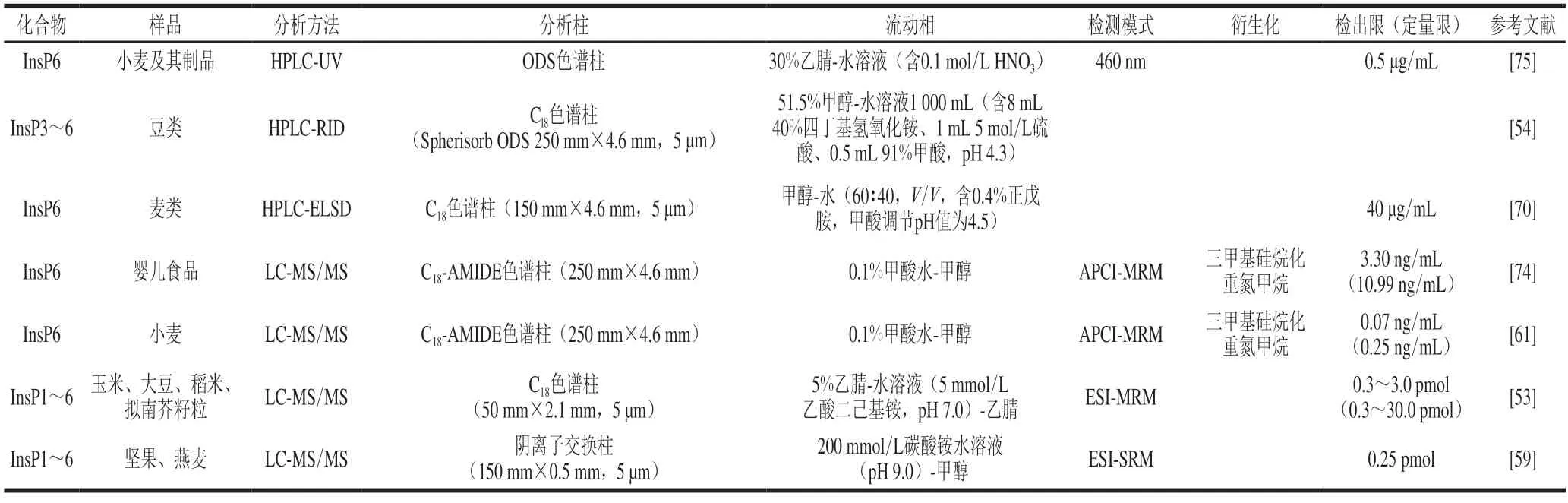
表6 食品中植酸及其降解产物的HPLC法和LC-MS/MS法Table 6 High performance liquid chromatography and liquid chromatography-tandem mass spectrometry methods for the determination of phytic acid and its degradation products in foods
5 结语
基于植酸的抗营养作用以及在食品中的浓度水平,美国、英国、芬兰等发达国家均已制定了植酸每日推荐摄入量,而我国却缺乏相应的推荐膳食摄入量规定。与国外相比,我国在植酸方面的研究工作还不全面,应该加快开展食品中植酸推荐摄入量的制定。此外,目前仍缺乏专门针对植酸及其降解产物低级磷酸肌醇的分析方法。虽然我国目前也制定了食品中植酸检测方法的国家标准,但仅限于植酸的测定,且缺乏区分植酸及其降解产物的特异性方法,所测植酸含量为包含降解产物在内的总植酸含量,容易使结果偏高。因此,应尽快开展相关的基础研究,准确评估我国食品中植酸及其降解产物的存在状态、含量水平及对营养吸收的抑制程度,制定符合我国国情的膳食推荐摄入量和检测方法。
