中链脂肪酸基于肠道微生态改善代谢综合征的研究进展
2023-11-07付稀钰赵敏洁冯凤琴
付稀钰,赵敏洁,冯凤琴
(浙江大学生物系统工程与食品科学学院,浙江 杭州 310058)
随着生活水平的提高和饮食习惯的改变,肥胖、2型糖尿病、高脂血症等代谢相关的疾病发病率越来越高,并且有着年轻化的趋势。健康稳定的肠道微生态对维持正常的肠道功能和机体健康具有非常重要的作用。大量研究表明,中链脂肪酸能改变肠道微生物组成和丰度、调节肠道微生物代谢、改善肠道炎症,还能够调节糖脂代谢、改善代谢综合征,并且由于其独特的代谢特性,中链脂肪酸在改善癌症和神经系统疾病方面也具有良好的生理功效。本文对中链脂肪酸改善代谢综合征和肠道微生态的作用进行了综述,以期对未来的相关研究提供新的思路和参考。
1 中链脂肪酸及其甘油酯
中链脂肪酸(medium-chain fatty acid,MCFA)是指含有8~12 个碳原子的饱和脂肪酸,包括辛酸(C8)、癸酸(C10)和月桂酸(C12)。中链甘油三酯(mediumchain triglyceride,MCT)由MCFAs组成。椰子油、棕榈仁油和乳脂是MCTs的三大天然来源。其中,椰子油含有45%~52%的月桂酸、5%~10%的辛酸、4%~8%的癸酸[1];棕榈仁油含有2.4%~6.2%的辛酸、2.6%~7.0%的癸酸和41%~55%的月桂酸[2];与椰子油和棕榈仁油相比,乳脂中的MCTs含量偏低,占总脂肪酸的4%~12%[3]。此外,黄油、奶酪等乳脂含量较高的乳制品中也含有一定量的MCTs。
除了天然油脂来源的MCTs,人工合成是获得高纯度、高含量MCTs的另一大手段。植物体内脂质的天然合成发生在质体中,2C单元依次连接到酰基载体蛋白(acyl carrier protein,ACP)的酰基链上,达到特定长度后被硫酯酶水解,产生游离脂肪酸(free fatty acid,FFA)进入内质网组装成为甘油三酯[4],根据这一原理可以通过基因工程的手段合成MCTs。Rutter等在解脂耶氏酵母中表达了5 种特异性的中链酰基-酰基载体蛋白硫酯酶,可以产生高达细胞总脂质40%的辛酸和癸酸[5]。然而利用基因工程合成MCTs需要明确其生物合成机制和相关的基因,在一定程度上限制了基因工程的应用。另一种应用更加广泛的合成方法是通过对甘油三酯进行结构化修饰,在化学催化剂或脂肪酶的催化下将不同的脂肪酸结合在同一个甘油骨架上,从而得到MCFAs含量更高的结构化甘油三酯。人工合成结构脂通过改变油脂中的脂肪酸组成,可以使甘油三酯具有更优的物理化学性质和更好的生理功效。
与长链脂肪酸(long-chain fatty acid,LCFA)相比,MCFAs的链长更短、分子质量更小,因此MCFAs的水解、吸收、代谢会更快。膳食摄入的甘油三酯在舌脂肪酶、胃脂肪酶和胰脂肪酶的作用下,sn-1,3位酯键被水解,产生2-单甘酯和FFAs,2-单甘酯再进一步水解为甘油和FFAs或异构化生成1-单甘酯[6]。LCFAs的吸收代谢需要有胆汁酸盐的辅助,通过小肠黏膜吸收后,形成乳糜微粒,最后通过淋巴循环运输到肝脏,在肉碱转运系统的辅助下进入线粒体,而MCFAs可直接通过门静脉吸收运输到肝脏,并且进入线粒体时不需要肉碱转运系统,可以更快地被氧化生酮[7-8]。在肝脏线粒体中,MCFAs主要通过β-氧化进行快速代谢产能,产生的乙酰辅酶A进入三羧酸循环或在辅酶因子的作用下进一步转化为β-羟基丁酸(β-hydroxybutyrate,BHB)、乙酰乙酸(acetoxyacetic acid,ACA)和丙酮等酮体[9]。其中,丙酮通过呼吸或尿液的方式被排出体外,BHB和ACA通过单羧酸转运蛋白由肝脏转运到血液中,再被机体所利用[10]。在饥饿条件下,肝脏脂肪酸也可以通过ω-氧化产生能量。月桂酸既可以通过门静脉运输,也可以形成甘油三酯进入淋巴循环,再通过肉碱穿梭进入肝脏线粒体,在不存在LCFAs的情况下,月桂酸可以按照LCFAs的方式吸收代谢[6]。除了在肝脏中进行β-氧化外,MCFAs还可以直接穿过血脑屏障进入大脑,作为神经元和星形胶质细胞的替代能源。在脑细胞中,辛酸和癸酸的代谢不依赖肉碱棕榈酰转移酶1(carnitine palmotoyltransferase 1,CPT-1),在星形胶质细胞中选择性合成谷氨酰胺,用于神经元中γ-氨基丁酸(gamma-aminobutyric acid,GABA)的合成[11]。在星形胶质细胞中,辛酸更容易发生β-氧化产生酮体,而癸酸主要通过刺激糖酵解产生乳酸并促进星形胶质细胞和神经元之间的乳酸穿梭,为脑细胞提供能量,癸酸还可以特异性促进线粒体质子泄漏,从而表现出潜在的抗氧化特性[12-14]。
大量研究表明,MCFAs及其甘油酯在改善肥胖和糖脂代谢、神经系统疾病、心血管疾病(cardiovascular disease,CVD)和癌症方面都具有良好的生理功效。MCFAs可通过组蛋白乙酰化诱导胰岛素抵抗细胞中和脂代谢相关的诱导细胞凋亡DFF45样效应因子c(cell death-inducing DFF45-like effector C,CIDEC)、甘油三磷酸脱氢酶(glycerol-3-phosphate dehydrogenase 1,Gpd1)的表达,从而改善胰岛素抵抗,并且癸酸表现出比辛酸更强的作用[15]。MCTs替代LCTs可剂量依赖性降低高脂饮食(high-fat diet,HFD)的致肥胖作用,抑制肝脏脂肪变性,促进肝脏产热,并且随着基础脂肪酸氧化的增强,糖原合酶活性增加,胰岛素抵抗得到改善[16]。MCFAs可以促进胆固醇的逆向转运,促进胆固醇的排出,降低促动脉粥样硬化蛋白聚糖酶的表达,从而改善动脉粥样硬化[17-18]。但是MCFAs并不一定利于改善CVD,研究表明,高剂量的月桂酸甘三酯对肥胖大鼠胆固醇代谢有不利影响,会升高血浆中甘油三酯和低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)的水平,可能会增加CVD的风险[19]。MCTs产生的酮体作为大脑的替代能源,对于创伤性脑损伤具有保护作用[20]。辛酸和癸酸都能改善线粒体功能,但是由于辛酸和癸酸在脑细胞中的代谢差异,癸酸可通过直接抑制α-氨基3-3羟基-5-甲基-4-异恶唑丙酸受体(α-amino-3-hydroxy-5-methyl-4-isoxazole-propionic acid receptor,AMPAR)表现出更强的抗癫痫作用[14,21]。辛酸和癸酸通过下调癌细胞中细胞周期调节基因(CDK2、CDK4)和细胞分裂基因(CKSIb、CCNA2、CCND1)、上调细胞凋亡基因(NR4A1、P21),从而表现出抗癌活性[22]。月桂酸处理的癌细胞中表皮生长因子受体(epidermal growth factor receptor,EGFR)表达量降低,细胞周期蛋白依赖性激酶抑制剂p21Cip1/WAF1表达量升高,在许多癌细胞中表现出剂量依赖性抗癌细胞增殖和促癌细胞凋亡的作用[23-24]。月桂酸对癌症所衍生的心肌损伤和骨骼肌萎缩也具有改善作用[25-26]。
2 代谢综合征与肠道微生态
2.1 代谢综合征
代谢综合征是肥胖、胰岛素抵抗、高血糖、血脂异常、高血压、高尿酸血症、持续低度炎症等许多CVD风险因素在机体内同时存在的状态,同时可能伴随着非酒精性脂肪肝、痛风、多囊卵巢综合征和遗传性或获得性脂肪萎缩[27]。当出现肥胖或超重、高血糖、高血压以及血脂异常4 项中的3 项或更多时,即被认为患有代谢综合征。随着生活水平的不断提高,代谢综合征的发病率不断升高,逐渐成为了全球性的公共卫生问题。
近40 年来,全球肥胖发病率不断升高,许多国家儿童的肥胖发病率已经高于成人[28]。在能量过剩的情况下,脂肪组织通过增生和肥大两种方式进行扩张。脂肪组织的增生是指机体分化产生新的脂肪细胞,能够维持脂肪组织释放的脂肪因子水平和胰岛素敏感性,但是脂肪组织肥大会使脂肪细胞缺氧,导致组织纤维化,降低脂肪组织的功能,使得血液中葡萄糖和脂质水平升高,并增加非脂肪组织中有毒脂质的积累[29]。脂肪组织是脂肪储存的一大场所,但是当超过其可以储存的最大容量时,脂肪会异位储存到肝脏、骨骼肌、心脏等其他组织中,从而对机体代谢产生不利影响[30]。在动脉粥样硬化患者中,肥胖患者患2型糖尿病的风险是正常体质量患者的4.5 倍,并且肥胖和2型糖尿病之间的部分关联是由肝脏脂肪堆积导致的非酒精性脂肪肝病(nonalcoholic fatty liver disease,NAFLD)所介导的[31]。
脂肪组织中巨噬细胞的积累和肥胖程度呈正相关,并参与体内脂肪组织激活的炎症反应[32]。巨噬细胞有M1和M2两种表型,M1巨噬细胞表达高水平的白细胞介素-6(interleukin-6,IL-6)、肿瘤坏死因子(tumor necrosis factor-α,TNF-α)等促炎细胞因子,M2巨噬细胞由IL-4和IL-13诱导产生,具有一定的抗炎功能[33]。HFD所诱导的肥胖初期,脂肪细胞逐渐变大,巨噬细胞中IL-10的表达量降低,而诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)和TNF-α的表达量增加,并且随着肥胖的逐渐加剧,巨噬细胞从M2极化状态转变为M1促炎状态[34]。肥胖所引发的炎症反应又会进一步促进其他疾病的发展。
甘油三酯以脂肪滴的形式在肝脏中过度沉积会导致肝脏脂肪变性,促进脂肪肝的发生。当NAFLD发展到一定程度时,会导致非酒精性脂肪肝炎(nonalcoholic steatohepatitis,NASH)、肝纤维化、肝硬化和肝癌等一系列疾病[35]。肥胖所导致的全身性炎症反应促进了NAFLD的发展,血液中的炎症因子、肠道炎症、骨骼肌炎症和脑组织炎症会促进甘油三酯在肝细胞中的积累,加速肝脂肪变性[36]。
胰岛素抵抗是导致2型糖尿病的重要因素,而肥胖是胰岛素抵抗最主要的诱因之一。研究表明,肥胖能够降低固醇调节元件结合蛋白1C(sterol regulatory elementbinding protein 1c,SREBP1C)的表达,削弱其对脂肪细胞DNA的修复作用,加速脂肪细胞衰老和炎症反应的发生[37]。脂肪组织分泌的瘦素和脂联素可以增加机体的胰岛素敏感性,而TNF-α和IL-6会抑制胰岛素的作用[30]。在代谢综合征的发展过程中,脂肪组织炎症促进了促炎细胞因子的释放,导致脂肪组织中的胰岛素抵抗,释放的炎症因子作用于其他组织导致全身性的胰岛素抵抗。此外,肥胖会破坏肠道屏障功能,导致肠道微生物以细胞外囊泡的形式泄漏,微生物DNA入侵胰岛,促进胰岛炎症和β细胞功能障碍的发生,降低胰岛素水平[38]。胰岛素对脑神经元、胶质细胞和大脑认知、情绪有重要的影响,全身性胰岛素抵抗会导致脑胰岛素抵抗和脑功能障碍,增加阿尔茨海默症等神经退行性疾病的患病风险[39]。
代谢综合征已经被证实是许多癌症的诱发因素,如结肠癌、肾癌、肝癌、乳腺癌、胰腺癌和子宫内膜癌、食管腺癌[40-44]。在肿瘤微环境中,肥胖导致的炎症反应会促进肿瘤的生长;胰岛素抵抗所诱发的高胰岛素血症会导致胰岛素样生长因子(insulin-like growth factor 1,IGF-1)水平增加,从而促进癌症的发展;内源性类固醇激素水平改变可能会增加子宫内膜癌、乳腺癌和前列腺癌的患病风险[42]。肥胖还会诱导自然杀伤(natural killer,NK)细胞的细胞代谢重新编程为脂质代谢,抑制NK细胞效应分子的表达,从而抑制NK细胞的细胞毒性,减弱NK细胞的抗肿瘤作用[45]。
2.2 肠道微生态与人体健康
肠道菌群是人体微生物群的一大组成部分,对维持肠道健康和正常的肠道功能有着重要的作用。肠道微生物的定植从出生时就开始,兼性菌和厌氧菌先后在肠道内定植,在一岁时肠道微生物即具有稳定的成人特征[46],厚壁菌(Firmicutes)和拟杆菌(Bacteroidetes)是其中两大主要的类型[47]。肠道菌群及其代谢物通过肠-脑轴、肠-肝轴和肠-心轴实现大脑、肝脏、心脏和肠道之间的双向信号传导,越来越多的研究表明健康稳定的肠道微生态有助于有益菌的定植,对维持机体健康有着重要的作用。
2.2.1 肠-脑轴
肠-脑轴是大脑和肠道之间的双向信号传导网络,受到神经、内分泌和免疫水平上的调节[46]。下丘脑-垂体-肾上腺轴调节皮质醇的分泌,皮质醇改变肠道细胞通透性和肠道屏障功能,导致肠道微生物的改变。肠道微生物的改变进一步影响循环细胞因子的水平、迷走神经通路和色氨酸代谢,从而对大脑产生影响。肠道微生物的代谢产物,如一些短链脂肪酸(short chain fatty acids,SCFAs)、乙酰胆碱、细菌胞外多糖等,都具有神经活性[48]。研究表明,随着抑郁症的发生,产丁酸盐的粪球菌(Coprococcus)和粪杆菌(Faecalibacterium)丰度下降,并且肠道拟杆菌丰度低的个体中抑郁症的患病率更高[49]。自闭症谱系障碍患者的肠道中拟杆菌丰度下降,阿克曼菌(Akkermansia)、萨特氏菌(Sutterella)和毛螺菌(Lachnospiraceae)丰度升高,结肠中牛磺酸和5-氨基戊酸含量减少,可影响神经元的发育以及神经兴奋和抑制间的平衡[50]。与肥胖类似,阿尔茨海默症患者体内厚壁菌和拟杆菌的比例也发生了改变,通过肠道微生物可能将阿尔茨海默症和2型糖尿病联系起来[51]。
2.2.2 肠-肝轴
肠-肝轴通过门静脉联系肠道和肝脏,门静脉将肠道衍生物运输到肝脏,将胆汁酸等从肝脏运输到肠道,许多肝脏疾病的发生都和肠道稳态被破坏有关。在酒精性肝病的发展过程中,肠道屏障功能被破坏,肠道通透性增加,导致肠道微生物易位增加,破坏胆汁酸稳态,最终导致肝脏炎症恶化[52]。肥胖是导致非酒精性肝病的重要因素之一,HFD诱导的肠道微生态失调导致肠道屏障完整性受损,肠道微生物中的潜在有害物质异位进入肝脏,进一步诱导促炎级联反应,加速脂肪肝到肝炎的发展[53-54]。拟杆菌属、普雷沃氏菌属(Prevotella)和瘤胃球菌(Ruminococcus)的丰度和NAFLD的严重程度有关[55]。NAFLD 患者体内肠杆菌和链球菌(Streptococcus)丰度较高,而阿克曼菌丰度降低,在肝癌患者体内拟杆菌和瘤胃球菌丰度增加,但是双歧杆菌(Bifidobacterium)丰度降低[56]。酒精性肝病中胆汁酸肝脏合成量增加,而在肝硬化和肝癌情况下,胆汁酸肝脏合成量减少。酒精性肝病、NAFLD、肝硬化和肝癌都会使粪便中次级胆汁酸水平增加。次级胆汁酸在肠道上皮细胞中通过法尼醇X受体(farnesoid X receptor,FXR)发出信号,抑制肠道FXR信号通路可改善肠道线粒体功能,抑制神经酰胺的合成,下调肝脏SREBP1C和CIDEA的表达,从而缓解肝脏脂肪变性[57]。
2.2.3 肠-心轴
肠-心轴是肠道和心脏之间的双向信号网络。与肠道微生物相关的SCFAs、胆汁酸代谢和三甲胺-三甲胺氧化物(trimethylamine-trimethylamine-N-oxide,TMATMAO)代谢会影响CVD的发展[58]。高脂膳食中的磷脂酰胆碱、胆碱等物质通过肠道微生物酶复合物代谢产生TMA进入门静脉循环并运输至肝脏,在肝脏中含黄素单加氧酶的作用下代谢为TMAO[59]。TMAO能够促进动脉粥样硬化和血栓的形成,与心脏肥大、心脏纤维化、2型糖尿病和肥胖有关[60-61]。肠道微生物产生的SCFAs可以改善肠道黏膜屏障,通过激活肾小球旁器官和外周脉管系统的嗅觉受体51E2(olfactory receptor,OR51E2)调节血压,激活组蛋白乙酰转移酶并抑制组蛋白去乙酰化酶,从而抑制炎症和调节免疫[58]。肠道微生物通过去结合、氧化/差向异构化、酯化、脱硫等方式影响机体内胆汁酸池的变化,次级胆汁酸进入门静脉循环发挥信号分子的作用。心肌细胞表达的FXR是一种细胞凋亡介质,心脏FXR的激活刺激线粒体死亡信号的传导,导致心肌细胞凋亡,通过化学抑制FXR信号通路或基因敲除FXR可减少心肌细胞凋亡和纤维化[62]。
与CVD心血管疾病相关的肠道微生物代谢途径汇总如表1所示。

表1 与CVD相关的肠道微生物代谢途径[59]Table 1 Metabolic pathways of gut microbes associated with CVD[59]
3 MCFAs改善代谢综合征
MCFAs主要来自于膳食中的MCTs,和LCFAs相比,MCFAs代谢产能更快,可以通过增强β-氧化作用来改善肥胖,但是由于饱和脂肪酸的作用,过量MCFAs会加剧脂肪组织炎症和增加肝脏中饱和脂肪酸的积累[63-64]。MCFAs能够增强机体产热和脂肪氧化,从而抑制脂肪的沉积,并且具有增强胰岛素敏感性、改善2型糖尿病的作用[65]。除了改善肥胖以外,MCFAs也已经被证实在治疗癌症、代谢疾病和神经系统疾病等方面都具有良好的作用,基于MCFAs的MCT生酮饮食也已经被应用于相关疾病的治疗[11,22,66-67]。
3.1 抑制食欲、增强饱腹感
食欲受到激素和大脑神经系统的共同调节,肠道内分泌细胞储存和释放促进食欲(生长素释放肽等)和抑制食欲(胰高血糖素样肽1(glucagon-like peptide 1,GLP-1)、肽YY(peptide YY,PYY)和胆囊收缩素(cholecystokinin,CKK)等)的激素。在进食过程中肠道释放的食欲激素可以直接刺激下丘脑来影响食欲,也可以通过迷走神经将饱腹感信号传到孤束核并投射到弓状核,再由弓状核对肠道激素信息进行整合,产生食欲信号。神经肽Y(neuropeptide Y,NPY)和刺鼠相关肽(agouti-related peptide,AgRP)神经元能够产生促进食欲的信号,阿黑皮质素原(proopiomelancortin,POMC)神经元能够产生抑制食欲的信号,下丘脑室旁核接收到这些食欲信号后,向更高级的神经中枢发出信号,从而平衡饱腹感和饥饿感[68-69]。
和LCFAs相比,MCFAs的吸收代谢更快,能够更有效地促进饱腹感信号的释放。G蛋白偶联受体(G protein-coupled receptor,GPR)信号的激活会刺激肠道内分泌细胞释放相关的食欲激素。在餐前给予MCFAs的结肠释放剂可减少肥胖患者的摄食量并升高PYY水平,MCFAs能够刺激GPR120和GPR84,促进肠道内分泌细胞最大程度地释放厌食激素,再将厌食信号传递到中枢神经系统,从而抑制食欲[70]。
除此之外,胃排空的速率和饥饿感密切相关。和等热量的LCTs相比,MCTs能通过延长胃排空时间和升高β-羟基丁酸水平来减少48 h内的能量摄入,并且可导致PYY水平的持续升高,进一步抑制食欲[71]。
3.2 促进脂肪组织分解、刺激机体产热
脂肪组织分为白色脂肪组织(white adipose tissue,WAT)和棕色脂肪组织(brown adipose tissue,BAT),WAT主要负责合成代谢,存储甘油三酯,防止非脂肪组织中的脂质积累,并作为内分泌器官分泌脂肪因子,影响机体代谢。BAT主要负责分解代谢,响应β-肾上腺素能和胰岛素信号,直接摄取葡萄糖,并通过氧化脂质产生能量[72-73]。甘油三酯的细胞内降解需要先激活激素敏感性甘油三酯脂肪酶(hormone sensitive lipase,HSL)和脂肪甘油三酯水解酶(adipose triglyceride lipase,ATGL),解偶联蛋白1(uncoupling protein 1,UCP1)在BAT中高度表达,是BAT产热的激动剂。研究表明,在长期摄入中链甘油二酯的雄性C57BL/6小鼠体内,WAT中HSL和ATGL以及BAT中UCP1的表达量均升高,中链甘油二酯通过刺激WAT分解和BAT产热促进体内脂肪的消耗[74]。肝脏胰岛素信号和β3肾上腺素信号可以激活肝脏蛋白激酶(protein kinase,Akt)来抑制肝脏FOXO1,从而增强WAT中儿茶酚胺诱导的脂肪组织分解,并通过提升循环成纤维细胞生长因子21水平促进BAT产热[75]。β3-肾上腺素受体(β3-adrenergic receptor,β3-AR)对脂肪分解很重要,MCFAs刺激小鼠体内去甲肾上腺素对β3-AR信号的传导,上调环磷酸腺苷和Akt的活化水平,激活HSL的磷酸化,从而激活BAT产热,促进脂肪酸的氧化[76]。人体内BAT产热的激活和小鼠有所不同,小鼠体内BAT产热是由β3-AR所介导,而人体BAT缺少β3-AR,产热由β2-AR介导[77]。富含MCTs的HFD能够剂量依赖性地上调CPT1A和PPARγ辅激活蛋白1a(peroxisome proliferactive activated receptor gamma coactivator 1a,PPARGC1A)的表达,并且可通过GPR40刺激肝脏组织中UCP1的表达,从而促进健康小鼠和肥胖小鼠的肝脏脂质分解,改善代谢紊乱[37]。
3.3 调节mTOR信号通路
哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)是磷脂酰肌醇激酶相关蛋白激酶家族中的一种,可以整合营养、能量和代谢,从而调控细胞活动[78]。mTOR受到hamartin/tuberin复合体的调节,胰岛素和一些生长因子通过激活磷脂酰肌醇-3-激酶/蛋白激酶(phosphatidylinositol 3-kinase/protein kinase,PI3K/Akt)信号来抑制hamartin/tuberin信号,从而激活mTOR,而在能量和营养缺乏的情况下,AMPK通路被激活,增强了hamartin/tuberin对mTOR的抑制[79]。PI3K/Akt-mTOR通路是调节机体代谢的一大经典通路,在调节糖脂代谢、癌症、神经系统疾病方面都有重要的作用[80-82]。MCT生酮饮食可抑制mTOR通路,并且癸酸可以不依赖胰岛素和葡萄糖,直接结构特异性地抑制mTOR信号,从而改善神经系统疾病[83]。MCFAs处理可增加肝脏HepG2细胞中Akt和mTOR的基础磷酸化水平,有利于增加肝细胞的胰岛素敏感性以及维持肝脏正常的脂质代谢[80]。
MCFAs对代谢综合征的影响汇总如表2所示。

表2 MCFAs对代谢综合征的影响Table 2 Effects of MCFAs on metabolic syndrome
4 肠道微生态在MCFAs改善代谢综合征中的作用
4.1 改善肠道微生物组成
MCFAs会影响肠道微生物的组成和丰度。在正常成年人的肠道微生物中,厚壁菌和拟杆菌的比例(F/B)为10.9∶1[88],但是在肥胖人群中,这个比例更高。随着年龄的改变,肠道微生物的组成会发生变化,婴儿时期的肠道微生物水平较低,其中柔嫩梭菌(Clostridium leptum)和球状梭菌(Clostridium coccoides)的比例很高,而老年人体内的大肠杆菌(E.coli)和拟杆菌的丰度更高,并且随着年龄的增长,厚壁菌和拟杆菌的比例先增大后减小[88]。肠道微生物在饮食诱导的代谢异常和肥胖的发展中发挥重要的作用。肥胖导致的全身性炎症会影响肠道正常功能,HFD能够促进肠道中代谢产生脂多糖(lipopolysaccharide,LPS)的微生物数量增加,从而使机体处于促炎状态,导致代谢性内毒素血症,LPS再通过TLR4和CD14发出信号,促进肥胖和胰岛素抵抗的发生、升高脂肪组织中的炎症因子水平[89]。MCFAs能够调节革兰氏阳性菌和革兰氏阴性菌的比例,降低厚壁菌和变形菌比例,提高拟杆菌和可产生SCFAs的细菌比例,从而改善炎症和肥胖[90]。MCFAs能够抑制由于HFD喂养导致的小鼠肝脏脂肪酸水平增加,降低F/B和变形菌丰度[50]。
MCFAs及其甘油酯对肠道微生态的影响汇总如表3所示。
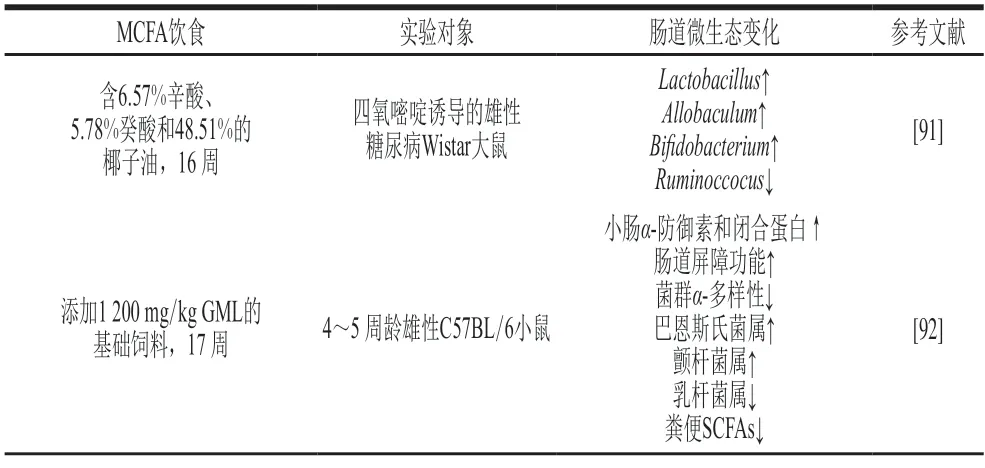
表3 MCFAs及其甘油酯对肠道微生态的影响Table 3 Effects of MCFAs and their glycerides on intestinal microecology
4.2 影响肠道微生物代谢物
肠道微生物组成和丰度的改变会导致肠道微生物代谢物的变化。SCFAs由肠道微生物发酵产生,厚壁菌门主要产生丁酸,拟杆菌门主要产生乙酸和丙酸[97]。SCFAs通过GPR信号调节Treg细胞的分化和免疫因子的产生,从而影响肠道免疫功能,并且GPR信号的激活介导了脑-肠轴之间的信号传导[98]。SCFAs在维持肠道健康、改善肝脏糖代谢、促进肿瘤细胞凋亡、抑制病原微生物生长、促进胎儿神经系统发育等多方面具有积极的作用[75,98]。MLCT能够增加拟杆菌丰度,剂量依赖性地增加粪便SCFAs的浓度[50]。单辛酸甘油酯能够增加梭菌、毛螺菌等可产SCFAs的肠道微生物丰度[95]。
由肝脏产生的胆汁酸被肠道微生物代谢为次级胆汁酸,通过FXR和TGR5信号调节脂质代谢和胆固醇稳态。肠道中次级胆汁酸主要由梭菌属产生,包括C.scindens、C.hiranonis、C.hylemonae和C.sordellii[99]。MCFAs可以促进粪便胆固醇排泄,但是并不能够改善血清胆固醇谱[100]。三月桂酸甘油酯可以降低胆固醇的生物合成,促进胆汁酸的粪便排泄,从而改善胆固醇代谢,但是长期高剂量作用会加速LDL-C受体降解,减少LDL向肝脏转运,导致血浆中LDL-C和总胆固醇水平升高,增加CVD风险[19]。
肠道微生物不直接产生5-羟色胺(5-hydroxytryptamine,5-HT),但是其代谢产生的SCFAs和胆汁酸可以刺激5-HT的释放。机体90%的5-HT由肠道嗜铬细胞产生,对维持正常的肠道神经系统(enteric nervous system,ENS)功能具有重要的作用[101]。5-HT和迷走神经受体结合后,可延缓胃排空、增加饱腹感[102]。
GABA是一种广泛存在于哺乳动物体内的中枢神经系统抑制性神经递质,与ENS功能和中枢神经系统疾病有着密切的关系,肠道微生物中的双歧杆菌和乳酸杆菌可产生GABA,通过迷走神经通路影响神经系统[103]。将瘦人群肠道微生物通过粪菌移植到代谢综合征男性患者体内,结果表明后者血浆GABA水平升高,胰岛素敏感性得到改善[104]。
4.3 激活GPR信号
GPR是哺乳动物体内的一类膜蛋白家族,所有的游离脂肪酸受体(free fatty acid receptor,FFAR)都属于GPR,当脂肪酸和GPR结合时,GPR会发生构象变化,从而激活G蛋白,进一步调节免疫、能量代谢、激素分泌等[105-106]。GPR40(FFAR1)和GPR120(FFAR4)主要被LCFAs和不饱和脂肪酸激活;GPR41(FFAR3)和GPR43(FFAR2)被SCFAs激活;GPR84与百日咳毒素敏感的Gi/o蛋白偶联,被M CFAs 特异性激活,胰岛β 细胞中GPR 40 和Gq蛋白偶联,MCFA 可作为配体激活GPR40[107]。GPR在肠道内高度表达,GPR的激活对调节机体葡萄糖稳态具有重要的作用。
MCFAs作为配体激活GPR40,肠道GPR40的激活会刺激肠道内分泌细胞分泌肠促胰岛素,促进GLP-1和抑胃肽(gastric inhibitory peptide,GIP)的分泌[108]。胰岛β细胞中GPR40的激活通过三磷酸肌醇(inositol triphosphate,IP3)介导的内质网释放来增加胞质Ca2+水平,从而使胰岛β细胞去极化,促进胰岛素的分泌[108]。癸酸诱导胰岛β细胞中的GPR40激活,辛酸刺激胰岛β细胞线粒体生酮,二者可协调改善胰岛β细胞功能并促进脂毒性应激功能的恢复[67]。
LCTs的摄入会刺激肠道内分泌K细胞产生GIP,而GIP的过多产生会导致肥胖和胰岛素抵抗,MCFAs通过抑制GPR120信号来抑制LCFAs诱导的胆囊收缩素(cholecystokinin,CCK)作用,增加细胞内Ca2+浓度,从而抑制LCFAs诱导的GIP过度分泌[109]。癸酸和月桂酸以剂量依赖性的方式促进肠道内分泌细胞STC-1中GLP-1的分泌,并且癸酸的作用是通过激活肠道GPR84而不是激活GPR40所介导的[110]。
肠道微生物代谢产生的SCFAs进入机体循环后与机体其他部位的GPR结合,进一步调节糖脂代谢[106]。在免疫细胞和脂肪组织中的GPR84激活可能对健康产生不利的影响。GPR84是一种促炎受体,激活后会加剧LPS诱导的多形核白细胞中IL-8和巨噬细胞中TNF-α的产生,通过增强NOD样受体热蛋白结构域蛋白3(NOD-like receptor thermal protein domain associated protein 3,NLRP3)炎性体的激活,促进巨噬细胞的促炎M1极化,从而促进肠道炎症的发生[111-112]。HFD诱导促炎巨噬细胞浸润脂肪组织,导致脂肪组织中GPR84表达量升高,癸酸-GPR84信号增强了TNF-α对脂肪细胞3T3-L1中脂联素表达的抑制作用,可能会促进肥胖和糖尿病的恶化[113]。
4.4 中链脂肪酸单甘酯改善肠道微生态
中链脂肪酸单甘酯作为食品添加剂能调节小鼠肠道微生物,有助于维持正常的肠道功能,改善HFD诱导的肥胖[94,114-116]。正常饮食中添加单辛酸甘油酯(glycerol monocaprylate,GMC)能够增加肠道微生物的α-多样性,使乳酸杆菌和产SCFAs的细菌丰度升高,有助于维持肠道稳态[94]。补充GML能够降低体循环TNF-α、IL-6和LPS水平,改善全身性炎症[114]。中、高剂量GML能够改善HFD诱导的肠道绒毛高度降低和隐窝深度增加,有助于提高肠道运动性和消化吸收能力[116]。GML预处理能够促进双歧杆菌和乳酸杆菌在肠道中的定植,增加粪便SCFAs水平,可预防由葡聚糖硫酸钠诱导的肠道微生物失调和结肠炎的发生,并且研究表明,GML饮食小鼠的肠道微生物通过粪菌移植可以重塑抗生素处理小鼠的肠道微生物群[117]。然而,正常饮食添加GML会促进肠道菌群失调,升高血清LPS水平,加剧全身性炎症[115]。正常饮食中添加单癸酸甘油酯(glycerol monodecanoate,GMD)能够增加肠道微生物的α-多样性,在提高胰岛素敏感性、改善葡萄糖稳态和抗炎方面表现出了良好的作用效果。
5 结语
膳食添加MCFAs及其甘油酯可以通过激活GPR信号、抑制食欲、促进脂肪组织分解、调节mTOR信号通路、调节肠道微生态,改善代谢综合征。肠道微生态作为影响机体健康的一大靶点,得到了广泛的关注,但是目前关于MCFAs及其甘油酯对肠道微生态调控机制的研究并不充分。
现阶段,有关MCFAs及其甘油酯作为饲料添加剂在动物养殖方面改善肠道微生态的研究较多,但是作为食品添加剂对人体肠道微生态的影响研究较为缺乏。MCFAs及其甘油酯会影响肠道微生物的组成和丰度,但是目前的研究大部分采用16S rRNA测序[91,96,118],只能精确到属水平,未能明确具体菌株在MCFAs及其甘油酯改善代谢综合征中的作用。MCFAs在小肠段被吸收,那么MCFAs及其甘油酯是通过改善机体代谢间接地影响肠道微生态,还是直接在肠道发挥作用再影响机体健康,这是一个值得探讨的问题。通过同位素示踪的方法可以研究不同肠道微生物对营养素的偏好和利用情况,有助于明确MCFAs及其甘油酯在塑造肠道微生物群中的作用[119]。疾病的发展过程通常伴随着肠道微生态的变化,肠道微生态的变化和机体健康之间的因果关系尚不明确。通过无菌小鼠、粪菌移植的手段可以对肠道微生物在改变机体代谢和疾病发展过程中的具体作用进行验证[117,120]。有关MCFAs及其甘油酯对肠道微生态影响的研究大部分停留在肠道菌群及其代谢物的变化层面,具体的分子机制尚不明晰。今后可采用多组学联用技术[121],以更加明确肠道微生态在改善代谢综合征中的具体作用,从而对MCFAs及其甘油酯的实际应用提供更有力的科学依据。
