QuEChERS-HPLC-MS/MS测定谷物中除虫菊素残留
2023-11-06闵芳芳袁璐丁若雯
闵芳芳,袁璐,丁若雯
(1. 江西省检验检测认证总院检测认证技术发展研究院,江西南昌,330052;2. 江西省药品检查员中心,江西南昌,330000)
0 引言
除虫菊素是由除虫菊花中分离萃取的具有杀虫效果的活性成分,它包括除虫菊素I(pyrethrins Ⅰ)、除虫菊素II(pyrethrins II)、瓜叶菊素I(cinerinⅠ)、瓜叶菊素II(cinerin II)、茉酮菊素I(jasmolin I)、茉酮菊素II(jasmolin I),其中除虫菊素I和除虫菊素II为其主要成分。由于除虫菊素具有高效、广谱、低残留、对人畜低毒等特点,因此被广泛应用于卫生杀虫领域[1,2]。随着人们对食品安全的重视,食品中除虫菊素的残留问题正逐渐引起关注,如我国新版的《食品中农药最大残留限量》(GB 2763—2021)中除虫菊素的品类新增了水果枸杞(鲜)、调味料(叶类调味料)及药用植物枸杞(干)。
关于除虫菊素的检测分析,郝佳伟等人通过利用固体分散剂净化的方式对黄芪样品进行前处理用HPLCMS/MS实现对除虫菊素I和除虫菊素II进行检测[3]。还有文献报道,采用高效液相色谱-串联质谱法无需样品净化步骤亦可对蔬菜中除虫菊素I和除虫菊素II进行检测[4]。同时,秦信先利用气相色谱串联质谱建立起了除虫菊素6个组分在传统中药材枸杞上的分析方法[5]。目前,可以检索到的关于谷物中的除虫菊素的检测方法多参照(GB/T 20769—2008),该方法需经过固相净化柱子净化,操作烦琐,同时洗脱液中含有甲苯,具有致突变性及致畸性等毒性。因此,建立一种简单、高效、准确的检测谷物中除虫菊素检测方法成为迫切需求。液相色谱-串联质谱技术 (HPLC-MS/MS) 具有分离效果好、灵敏度高、抗干扰能力强、选择性好等优点,目前已成为农残检测的首选方法[6-8]。本研究利用液相色谱-串联质谱技术, 建立了谷物样品中除虫菊素I和除虫菊素II的快速检测方法。
1 材料与方法
1.1 仪器与试剂
Agilent 6470B高效液相色谱-串联质谱仪,美国Agilent公司;电子天平,瑞士METTLER TOLEDO公司;多管涡旋混合仪,上海安谱实验科技股份有限公司;TDL离心机,上海安亭科学仪器厂;涡旋仪, 德国IKA公司。
乙腈和甲醇(色谱纯,德国Merck公司);甲酸(色谱纯,上海安谱实验科技股份有限公司);PSA(分析纯,上海安谱实验科技股份有限公司);Si(分析纯,上海安谱实验科技股份有限公司);除虫菊素I标准品(1000 μg/mL,天津阿尔塔科技有限公司);除虫菊素II标准品(100 μg/mL,天津阿尔塔科技有限公司)。
1.2 标准溶液的配置
移取1.0 mL除虫菊素I和除虫菊素II标准品溶液,分别置于100 mL和10 mL棕色容量瓶中, 用乙腈定容,配制成10.0 μg/mL标准储备液。
取适量除虫菊素I和除虫菊素II的标准储备液,用乙腈配置成质量浓度为1μg/L、5μg/L、20μg/L、50μg/L、100μg/L、200μg/L、500μg/L、1000μg/L的系列标准工作液。
1.3 实验方法
1.3.1 样品前处理
称取约5 g(精确至0.0001 g)样品于50 mL离心管,加入10mL乙腈,于2500 Hz下涡旋混5min充分提取,4500 rmp下离心5 min。取2 mL上清液于10 mL离心管(含50 mg PSA+50 mg Si)中,涡旋混合2 min,于4500 rmp下离心5 min,取上清液过0.22 μm有机滤膜供分析备用。
1.3.2 色谱和质谱条件
色谱条件:Agilent Poroshell 120 EC-C18( 50 mm×2.1 mm,2.7 μm);柱温: 30℃;进样量: 2 μL;流动相:乙腈( A) 和0.1%甲酸水( B) , 液相条件见表1。
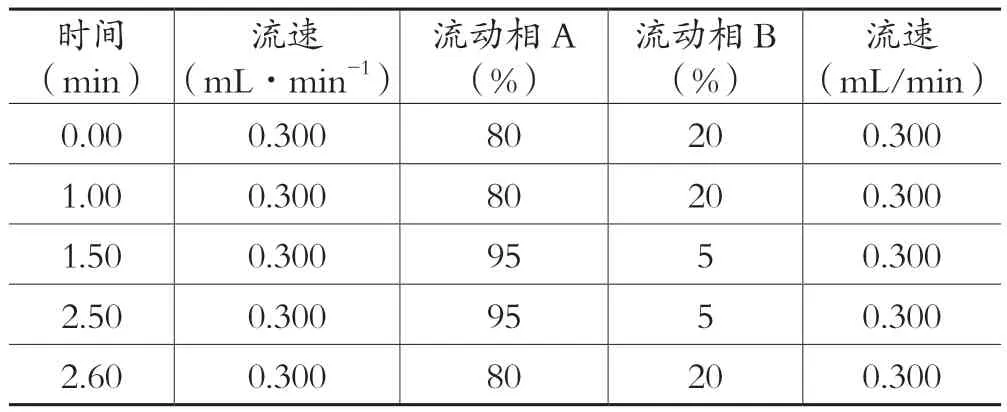
表1 除虫菊I和除虫菊素II素液相条件
质谱条件:扫描方式为正离子扫描,检测方式为多重反应监测模式(MRM);干燥气温度:350℃;干燥气流速:11 L/min;雾化器压力:45 psi;鞘气温度:350℃;毛细管电压: 3500 V;电子倍增管电压: 500 V;除虫菊素I和除虫菊素II的质谱参数见表2。
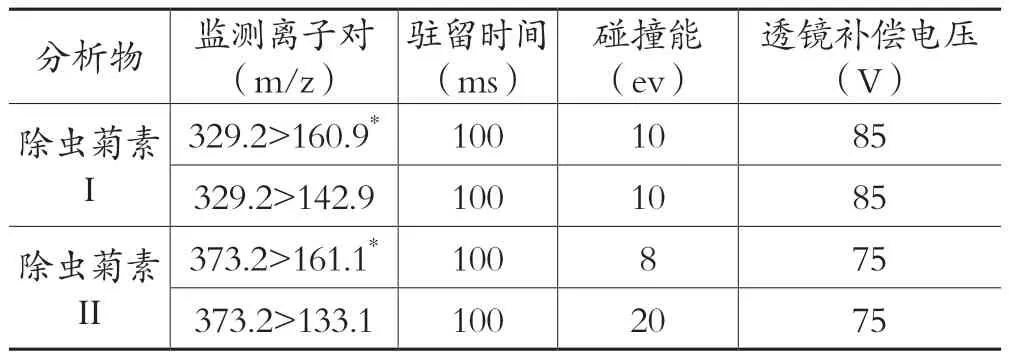
表2 除虫菊素I和除虫菊素II的质谱参数
2 结果与讨论
2.1 LC-MS/MS的优化
2.1.1 流动相的选择
本实验考察了甲醇/乙腈-0.1%甲酸水溶液为流动相梯度洗脱,对除虫菊素I和除虫菊素II的峰形及离子化效率的影响。结果表明,用乙腈-0.1%甲酸水溶液为流动相,除虫菊素I和除虫菊素II的离子化率更高、峰型更窄、对称性更好,且灵敏度更高。因此,本实验选择乙腈-0.1%甲酸水溶液为流动相。
2.1.2 质谱参数的优化
在正离子模式下,分别用质量浓度为1000 μg/L 的除虫菊素I和除虫菊素II的标准溶液进行全扫描确定母离子;在SIM模式下,对透镜补偿电压进行优化;在Product Ion模式下,选取质量数大、丰度强、干扰少的为定性离子和定量离子;最后,在MRM模式下,对碰撞能进行优化。除虫菊素I和除虫菊素II的一级和二级质谱图如图1。

图1 除虫菊素I和除虫菊素II的一级和二级质谱图
2.2 样品前处理优化
2.2.1 提取溶剂的选择
除虫菊素I和除虫菊素II均不溶于水,易溶于甲醇、乙腈等有机溶剂,因此,本实验分别向阴性大米和小麦中添加质量浓度为0.1 mg/kg除虫菊素I和除虫菊素II来考察甲醇和乙腈作为提取剂对目标化合物的提取率的影响。结果如表3所示,乙腈作为提取剂,大米和小麦中除虫菊素I和除虫菊素II的提取率均在92%以上,同时,相对于甲醇来说,大米和小麦中的除虫菊素I和除虫菊素II的提取率都更高。因此,本研究选择乙腈作为大米和小麦中的除虫菊素提取溶剂。
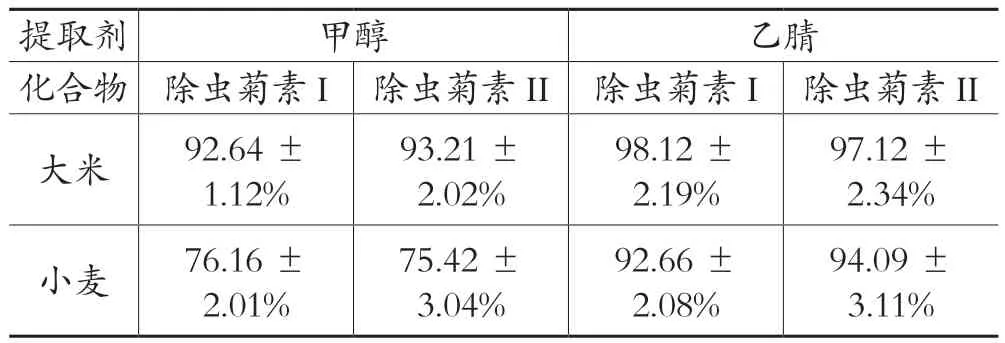
表3 不同提取剂对大米和小麦中除虫菊素I和除虫菊素II的提取效率的影响(n=3)
2.2.2 净化条件的优化
PSA主要去除极性干扰物,如有机酸、色素和糖类杂质;Si主要去除如糖类等极性较大的杂质。由于大米和小麦中主要成分为淀粉,因此,本研究通过分别添加0.1 mg/kg到阴性大米和小麦中来考察PSA、Si以及PSA和Si对大米和小麦中除虫菊素I和除虫菊素II的提取率的影响,不同净化剂对待测物的提取率如图2所示。结果表明:在大米和小麦中,用PSA和Si组合比单一的PSA或单一的Si对除虫菊素I和除虫菊素II有更高的提取率,因此,本实验选取50 mg PSA和50 mg Si组合的分散吸附剂作为最终的净化剂。
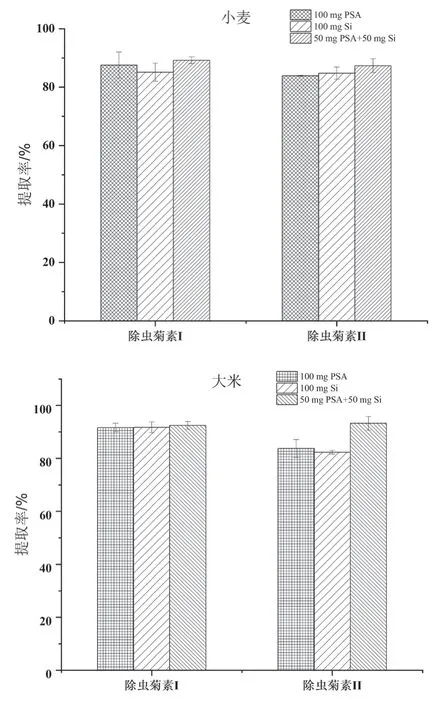
图2 不同固相分散剂对大米和小麦中除虫菊素I和除虫菊素II的提取率的影响(n=3)
2.3 方法验证
2.3.1 基质效应
本实验分别配置大米和小麦作为基质的标准曲线及纯溶剂配置标准曲线,按照公式(1)计算基质效应。纯溶剂配置除虫菊素I和除虫菊素II标准曲线的斜率分别为221.97和107.39;用大米作为基质配置除虫菊素I和除虫菊素II标准曲线的斜率分别为207.97和100.80;用小麦作为基质配置除虫菊素I和除虫菊素II标准曲线的斜率分别为192.00和91.53。结果表明,大米作为基质对除虫菊素I和除虫菊素II的基质效应分别为0.94和0.94;小麦作为基质对除虫菊素I和除虫菊素II的基质效应分别为0.86和0.85。一般来说,基质效应<0.85表现为基质抑制;基质效应>1.15,表现为基质增强;0.85≤基质效应≤1.15,基质效应可以忽略[9]。基于上述结果,本实验可以选用纯溶剂配置除虫菊素I和除虫菊素II的标准曲线。
2.3.2 线性范围和检出限
将除虫菊素I和除虫菊素Ⅱ的标准使用液配制成标准工作液,得到该两种物质在大米和小麦的标准曲线和相关系数(见表4)。结果表明,除虫菊素I和除虫菊素II在质量浓度为1~1000 μg/L时,呈现良好的线性关系。
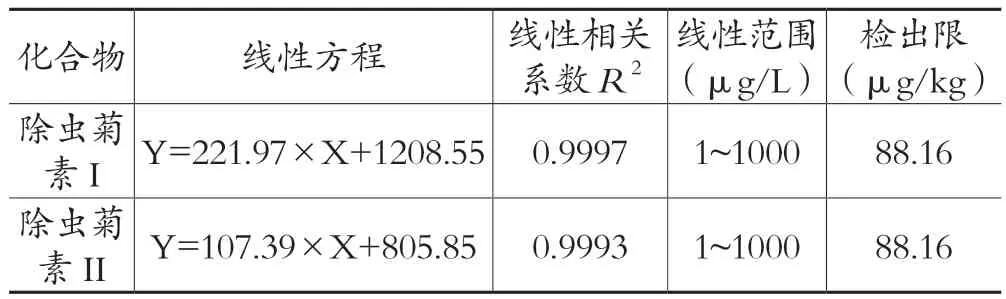
表4 除虫菊素I和除虫菊素II的线性方程
2.3.3 精密度和精密度
由表5可知,在添加质量分数为0.04~0.40 mg/kg范围内,除虫菊素I在大米和小麦的回收率分别为91.22%~93.25%和89.21%~90.56%,相对标准偏差分别为0.59%~3.29%和1.19%~2.90%;除虫菊素II在大米和小麦的回收率分别为90.33%~91.41%和88.32%~89.76%,相对标准偏差分别为1.16%~5.06%和2.98%~4.22%。符合农药残留分析要求[10]。依据GB/T 20769—2018,除虫菊素的检测检出限为88.16 μg/kg,而本方法中除虫菊在此浓度的信噪比(S/N)均大于3,本方法满足要求,因此设定检出限为88.16 μg/kg。
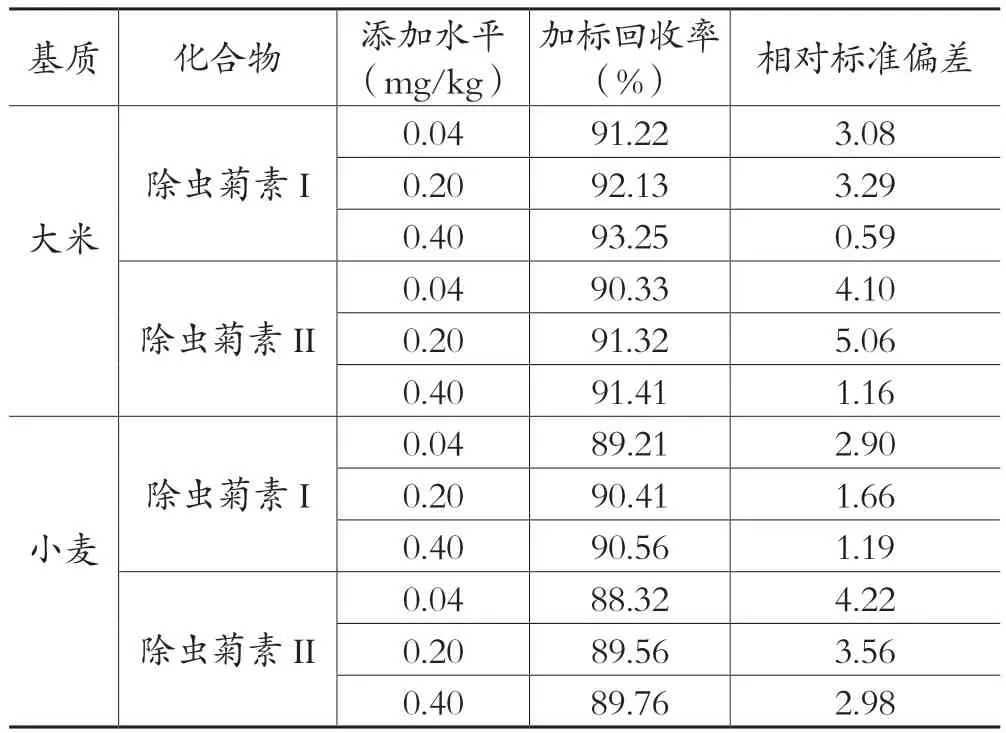
表5 不同质量浓度水平除虫菊素I和除虫菊素II的回收率和精密度(n=6)
3 结论
本研究基于高压液相色谱串联质谱法建立了一个简便、快速、高效地测定谷物中除虫菊素的分析方法。该方法灵敏度高,线性关系、准确度和精密度均满足方法学指标,可为谷物中除虫菊素残留的快速检测提供技术手段。
