血清乙型肝炎病毒RNA监测聚乙二醇干扰素治疗核苷(酸)类似物经治低病毒载量慢性乙型肝炎患者疗效
2023-11-06贺潇瑾龙云铸陈芝慧谭英征
贺潇瑾, 龙云铸, 周 娟, 李 丹, 周 青, 袁 婷, 卿 玲, 黄 莎, 陈芝慧, 谭英征
中南大学湘雅医学院附属株洲医院 感染内科,湖南 株洲 412006
抗乙型肝炎病毒(hepatitis B virus,HBV)治疗是慢性HBV感染者治疗的关键,实现乙型肝炎病毒表面抗原(hepatitis B surface antigens,HBsAg)清除或HBsAg血清学转换是抗病毒治疗的理想终点[1]。目前,临床使用的抗病毒治疗药物主要是核苷(酸)类似物[nucleos(t)ide analogues,NAs]和聚乙二醇化干扰素α(pegylated-interferon-alpha,PEG-IFNα),二者均可有效控制病毒复制,但NAs对肝内HBV共价闭合环状DNA(covalently closed circular deoxyribonucleic acid,cccDNA)无直接清除作用,因此,很难达到治疗的理想终点。PEG-IFNα可通过抗病毒、抗增殖和免疫调节多重作用来实现抗病毒效应,抗原清除率和持续应答率较高,应答者疗效稳定,但治疗过程中不良反应较NAs多,因此,限制了部分患者的选用。多项国内外研究发现,NAs单药治疗基础上联合或序贯PEG-IFNα治疗,较单用NAs或干扰素对部分优势人群显示出更好的疗效[2-3]。血清HBV RNA是近年发展起来的HBV病毒学指标,HBV前基因组RNA(pregenomic RNA,pgRNA)是其在血清中的主要存在形式。HBV pgRNA是由cccDNA为模板生成的HBV外壳蛋白基因,能直接反映肝内cccDNA水平[4]。目前研究结果普遍认为,血清HBV RNA有可能成为CHB患者抗病毒治疗疗效预测及停药管理的新的临床监测标志物[5-6]。本研究通过对NAs经治低病毒载量CHB患者联合PEG-IFNα治疗与继续NAs单药治疗进行比较,分析HBsAg清除情况与相关因素,同时,探讨应用HBV RNA预测NAs经治低病毒载量CHB患者抗病毒疗效的价值,为临床进一步优化抗病毒方案及评估疗效提供一定的经验依据。现报道如下。
1 对象与方法
1.1 研究对象 本研究为单中心、前瞻性、观察性研究。选取自2020年4月至2022年4月年株洲市中心医院收治及住院的76例CHB患者为研究对象,符合《慢性乙型肝炎防治指南(2019年)》诊断标准,其中,男性64例,女性12例;年龄26~58岁,平均年龄(41.0±8.1)岁。纳入标准:(1)年龄18~65岁;(2)经NAs 抗病毒治疗时间>1年(NAs种类、方案不限),获得乙型肝炎e抗原(hepatitis Be antigen,HBeAg)阴性(抗-HBe阳性或阴性),HBVDNA<1 000 IU/ml,HBsAg<1 500 IU/ml;(3)无干扰素使用禁忌证。排除标准:(1)伴其他嗜肝病毒感染和(或)人类免疫缺陷病毒感染;(2)合并酒精性肝病、自身免疫性肝病、肝功能失代偿(Child-Pugh评分>7分)、肝硬化、肝癌及其他任何肝疾病;(3)合并严重心、脑、肺、肾、血液系统等原发疾病或肿瘤病史;(4)存在干扰素治疗禁忌证或过敏。在被充分告知聚乙二醇干扰素α-2b(pegylated interferon alpha-2B,Peg-IFNα-2b)治疗的益处和风险后,患者按自愿选择是否接受治疗分为联合治疗组(n=42)与原方案治疗组(n=34)。本研究经医院医学伦理委员会批准。所有研究对象均签署知情同意书。
1.2 血清HBV RNA检测 抽取患者空腹外周静脉血5 ml,1 h内离心分离血清,储存于-80℃冰箱,避免反复冻融。采用热景生物HBV pgRNA测定试剂盒[聚合酶链反应(polymerase chain reaction,PCR)-荧光探针法]在荧光定量PCR仪上检测血清HBV pgRNA,操作严格遵照试剂说明书进行,检测下限为100 copies/ml,标准曲线满足R2>0.98认定检验结果有效。
1.3 治疗方案 原方案治疗组是延续原NAs方案继续单药治疗,联合治疗组是在原NAs方案基础上联合Peg-IFNα-2b注射液180 μg、每周1次进行治疗。治疗时间为48周,若治疗期间,患者的中性粒细胞计数≤0.75×109个/L或血小板计数<50×109个/L,则将Peg-IFNα-2b的剂量调整为180 μg、每2周1次,2周后复查;如恢复则增加至原剂量。中性粒细胞计数≤0.50×10个9/L、血小板计数<25×109个/L或发生严重不良事件,则停Peg-IFNα-2b。
1.4 观察指标与疗效判断 所有纳入患者在基线、每隔4周检测血常规、生化学指标。在基线、每隔12周加测HBV pgRNA、HBVDNA、HBsAg、抗-HBs、甲状腺功能,其中,HBVDNA检测下限为20.00 IU/ml,HBsAg检测下限为0.05 IU/ml,抗-HBs检测下限为10.00 mIU/ml。将在基线、每隔24周加测甲胎蛋白、腹部超声及Fibroscan。同时观察治疗期间发生的不良反应及出现异常的实验室指标。主要终点为治疗结束时的HBsAg清除率,治疗48周达到HBsAg清除(HBsAg<0.05 IU/ml)为应答,HBsAg未清除(HBsAg≥0.05 IU/ml)则为未应答。
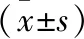
2 结果
2.1 两组一般资料比较 两组患者的性别、年龄、HBsAg、HBVDNA、HBV pgRNA、血常规及肝功能等一般资料比较,差异均无统计学意义(P>0.05)。见表1。
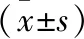
表1 两组一般资料比较
2.2 两组抗病毒治疗疗效比较 治疗24周时,联合治疗组的HBsAg清除率、HBVDNA阴转率,以及HBV pgRNA下降>1.0 lg copies/ml百分比均明显高于原方案治疗组,差异均有统计学意义(P<0.05)。治疗48周时,联合治疗组的HBsAg清除率、HBsAg血清学转换率均高于原方案治疗组,差异均有统计学意义(P<0.001)。见表2。

表2 两组抗病毒治疗疗效比较/例(百分率/%)
2.3 联合干扰素治疗前后HBV pgRNA、HBVDNA、HBsAg表达水平比较 治疗24周和治疗48周时,HBV pgRNA、HBVDNA、HBsAg均低于基线水平,差异有统计学意义(P<0.05);且治疗48周时,HBV pgRNA、HBVDNA、HBsAg均低于治疗24周时,差异均有统计学意义(P<0.05)。见表3。
2.4 联合治疗组血清HBV pgRNA与HBsAg、HBVDNA的相关性分析 在联合治疗组中,采用Spearman秩相关分析进行两变量之间的相关性分析,结果显示,治疗前,患者的HBV pgRNA水平与HBsAg、HBVDNA水平呈中强度正相关(r=0.472,P=0.017;r=0.519,P=0.043)。但随治疗时间的延长,两者相关系数逐渐减弱,治疗24周、治疗48周时,HBV pgRNA水平与HBsAg水平呈弱正相关(r=0.264,P=0.045;r=0.148,P=0.039); HBV pgRNA水平与HBVDNA水平无相关性(r=0.376,P=0.059;r=0.325,P=0.078)。
2.5 联合治疗组HBsAg清除预测因素的单因素及多因素Logistic回归分析 48周疗程结束,仅联合治疗组出现应答患者,其中,16例HBsAg清除者纳入应答组,26例未出现应答者纳入未应答组。以性别、年龄、基线HBsAg、基线HBVDNA水平及治疗24周HBV pgRNA下降>1.0 lg IU/ml为自变量,以治疗48周时是否达到HBsAg清除作为因变量(应答=1,未应答=0),进行Logistic回归分析,结果显示,基线HBsAg≤2.0 lg IU/ml(比值比=2.69,95%可信区间1.46~5.24,P=0.028)、治疗24周HBV pgRNA下降 >1.0 lg copies/ml(比值比=4.51,95%可信区间2.41~7.23,P=0.047)与治疗第48周时HBsAg清除显著相关,是HBsAg清除的独立预测因素。见表4、5。

表4 治疗48周时HBsAg清除影响的单因素分析/例(百分率/%)

表5 治疗48周时HBsAg清除影响的多因素Logistic回归分析
2.6 独立预测HBsAg清除因素的ROC曲线分析 ROC曲线分析结果显示,基线HBsAg水平治疗、24周HBV pgRNA下降程度与联合治疗组结束治疗时HBsAg清除具有相关性。较低的基线HBsAg水平、治疗中期较快的HBV pgRNA下降对于HBsAg的清除均有较好的预测价值。见表6。
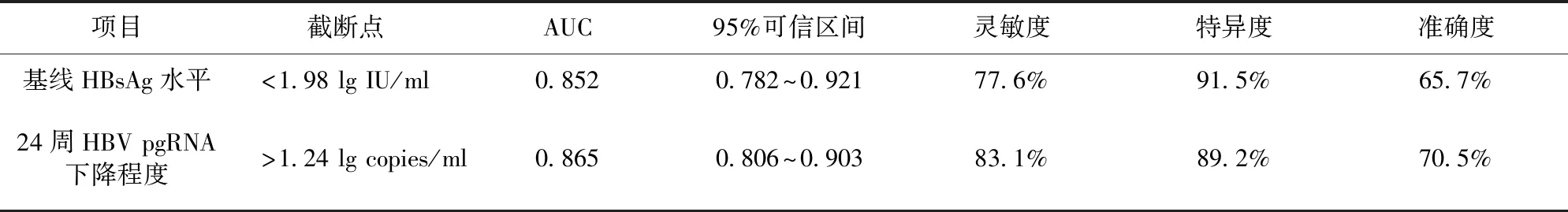
表6 HBsAg清除影响因素ROC分析
2.7 不良反应监测 联合治疗组治疗48周内,22例(52.4%)在治疗初期出现发热,乏力,适当休息后症状自行缓解;19例(45.2%)出现不同程度外周血白细胞、血红蛋白和血小板下降,给与调整干扰素剂量和(或)加用升白细胞及血小板药物后回升;15例(35.7%)出现丙氨酸氨基转移酶升高,均未超过2倍正常值上限;4例(9.5%)诉体质量下降,未下降超过基础体质量的10%;3例(7.1%)出现脱发。上述治疗期间所有不良反应均随对症治疗和(或)调整药物剂量而改善,未影响治疗进行。所有患者均未出现甲状腺功能异常、自身免疫性疾病、精神异常等不良反应。
3 讨论
早诊断、早治疗是延缓CHB患者进展至终末期肝病的关键,尽可能追求临床治愈是目前国内外指南推荐的理想治疗方法[7]。有研究报道,对于适合的优势人群可以通过优化治疗方案实现早期功能性治愈[8]。OSST研究及NEW SWITCH研究结果显示,长期NAs治疗后,基线HBeAg清除且HBsAg<1 500 IU/ml的患者序贯PEG-IFNα-2a,治疗48周时HBsAg清除率较高(22.2%~26.5%),并且治疗第12周或24周时HBsAg<200 IU/ml的患者最有可能获得HBsAg阴转(48.9%~77.8%)[9-10]。另一项研究采用序贯Peg-IFNα-2a作为NAs停药的策略,结果表明,20%基线 HBsAg<1 500 IU/ml的患者可实现HBsAg清除,且基线HBsAg<500 IU/ml是预测HBsAg阴转的最佳指标[11]。本研究纳入NAs经治后获得HBeAg阴转,HBVDNA<1 000 IU/ml且HBsAg<1 500 IU/ml的CHB患者76例,在治疗结束时,联合Peg-IFNα-2b治疗组的HBsAg清除率约38.1%,HBsAg血清学转换率约33.3%,显著高于继续NAs单药治疗组(0)。与以上研究比较,本研究HBsAg清除率更高,分析原因考虑与真实世界研究存在一定的选择偏倚相关。本研究纳入的患者为NAs经治后HBeAg阴性,且为HBVDNA及HBsAg均更低的患者,此类人群机体免疫耐受降低,清除HBV的T淋巴细胞免疫功能易被激活,在此基础上联用干扰素治疗,可以在抗病毒的同时增强免疫,进一步促进HBsAg清除及血清学转化。
cccDNA是HBV持续复制的原始模板,检测肝组织内cccDNA是判断HBV感染彻底治愈的理想指标。HBV pgRNA携带有全部cccDNA 转录信息,NAs药物不影响pgRNA的生成,对于NAs治疗的患者,其血清HBV pgRNA在外周血中存在的时间相较于HBVDNA更长,可能适用于长期特异性监测cccDNA转录水平[12]。本研究结果显示,在基线水平HBVpgRNA与HBVDNA、HBsAg呈中等强度相关,联合治疗24周后,HBVpgRNA与HBVDNA相关性消失,与HBsAg的相关性随治疗时间的延长而下降,考虑与联合治疗后HBV pgRNA、HBsAg与HBVDNA下降快慢不同相关。因为无论NAs还是干扰素均可直接导致HBVDNA的生成障碍,但不能直接抑制HBV pgRNA、HBsAg生成,HBVpgRNA及HBsAg的下降是由于HBVDNA的减少,cccDNA池的补充减少,从而cccDNA转录为HBVpgRNA、HBsAg减少。这提示,在干扰素治疗后期,HBVDNA阴转后,可依据HBVpgRNA及HBsAg的变化判断治疗效果及指导停药。国外有研究发现,NAs联合Peg-IFN治疗的CHB患者,其血清HBVRNA水平的下降幅度显著高于NAs单药治疗的患者,并且血清HBVRNA水平的动态变化可预测病毒学应答的发生情况[13]。本研究结果显示,基线HBsAg水平<2.0 lg IU/ml、治疗24周HBV pgRNA下降>1.0 lg copies/ml与治疗48周HBsAg清除显著相关,ROC曲线评估二者对HBsAg清除的预测价值也有类似发现,这提示,在临床工作中,基线HBsAg水平较低(HBsAg<1.98 lg IU/ml)、治疗24周HBV pgRNA下降>1.24 lg copies/ml可以较好地预测HBsAg清除,与李淑等[14]研究报道一致。
本研究联用Peg-IFNα-2b的不良反应与其他文献报道一致[3,15-16],大多数患者出现发热、乏力,部分患者出现外周血细胞减少,极少数患者出现脱发、体质量下降,但症状均较轻,经对症处理后可恢复正常,未出现严重不良事件发生,提示了与普通干扰素比较,聚乙二醇化干扰素安全性尚可,但仍然需要密切监测。
本研究也存在一定局限性,对于影响HBsAg清除的因素,未将HBV基因型纳入本研究深入分析。对于干扰素的作用,较多研究发现不仅限于治疗期间,还存在持久的后续效应[8]。此外,HBV pgRNA除了评估抗病毒治疗疗效,对停药后复发风险也有预测价值[17]。因此,本研究也将继续随访,同时扩大样本量进行观察,以获取联合治疗有关长期预后的更多数据。
综上所述,联合Peg-IFNα-2b治疗可以提高NAs经治低病毒载量CHB患者的HBsAg清除率,基线HBsAg≤2.0 lg IU/ml、治疗第24周HBV pgRNA下降>1.0 lg copies/ml可以预测治疗第48周的HBsAg清除。
