原发性肾病综合征患儿血清白细胞介素6、白细胞介素1β、白细胞介素2水平与急性肾损伤相关性分析
2023-11-06宋琳岚董艳迎牛云鹤
宋琳岚, 黄 博, 董艳迎, 牛云鹤, 李 燕, 周 源
1.西安交通大学附属第二医院 检验科,陕西 西安 710004;西安交通大学附属西安市儿童医院2.检验科;3.肾脏科,陕西 西安 710003
原发性肾病综合征(primary nephrotic syndrome,PNS)是以肾小球病变为主的临床综合征,属于儿科常见病之一[1]。急性肾损伤(acute kidney injury,AKI)是PNS患儿常见严重合并症,不仅使病情加重,疾病治疗难度增加,还影响患儿康复,给患儿及家属增添心理压力及经济负担[2]。有研究报道,儿童AKI经早期发现和规范化治疗,能够降低发展成慢性肾衰竭甚至死亡的风险[3]。明确PNS患儿合并AKI的机制及参与疾病进展的关键因子,采取有效靶向治疗减轻患儿AKI,对改善患儿预后有重要意义。PNS属于免疫介导的炎性疾病,免疫功能紊乱及炎症细胞因子分泌异常参与PNS病变进展,炎症介质异常分泌提示机体组织可能存在感染或损伤情况[4-5]。白细胞介素(interleukin,IL)-6、IL-1β和IL-2均为炎症介质,在调节机体炎性反应方面发挥重要作用,但目前关于IL-6、IL-1β、IL-2参与PNS发病及合并AKI的具体机制尚未明确[6]。本研究旨在探讨PNS患儿血清IL-6、IL-1β、IL-2水平与AKI的相关性。现报道如下。
1 资料与方法
1.1 一般资料 选取西安交通大学附属第二医院自2021年10月至2022年11月收治的80例PNS患儿为研究对象。纳入标准:符合PNS诊断标准[7];年龄2~14岁;临床资料完整。排除标准:先天性或遗传性肾病综合征;继发于乙型肝炎病毒感染、系统性红斑狼疮、过敏性紫癜、骨髓瘤等的肾病综合征;使用肾毒性药物;合并心脑血管、肝或免疫系统等严重疾病;伴精神认知障碍。根据是否合并AKI将PNS患儿分为A组(合并AKI,n=36)与B组(未合并AKI,n=44)[8]。A组:男性25例,女性11例;年龄3~13岁,平均(8.46±2.17)岁。B组:男性23例,女性21例;年龄2~14岁,平均(8.62±2.41)岁。两组患儿一般资料比较,差异无统计学意义(P>0.05),具有可比性。本研究经医院伦理委员会批准。所有患儿家属均签署知情同意书。
1.2 研究方法 根据患儿发生AKI后的峰值血肌酐(serum creatinine,Scr)水平、尿量评定AKI分期[9]:Scr升高至基础值1.5~1.9倍或尿量<0.5 ml/(kg·h)(时间>6 h)为1期;Scr升高至基础值2.0~2.9倍或尿量<0.5 ml/(kg·h)(时间>12 h)为2期;Scr升高至基础值3.0倍及以上或24 h持续少尿或无尿>12 h为3期。采集所有患儿入院时外周静脉血5 ml,以3 000 r/min离心10 min。采用化学发光酶联免疫分析法检测并比较两组患儿血清IL-6、IL-1β、IL-2水平,试剂盒由西门子有限公司提供。采用贝克曼肌酐酶法检测血清Scr水平。采集所有患儿排空膀胱后24 h尿液,存于配有防腐剂的有盖清洁容器内,采用双缩脲法进行24 h尿蛋白定量测定。
1.3 观察指标 检测并比较两组患儿IL-6、IL-1β、IL-2水平及24 h尿蛋白定量及血清Scr水平。
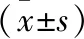
2 结果
2.1 两组患儿血清IL-6、IL-1β、IL-2水平比较 B组患儿血清IL-6、IL-1β水平均高于A组,IL-2水平低于A组,差异均有统计学意义(P<0.05)。见表1。
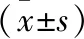
表1 两组患儿血清IL-6、IL-1β、IL-2水平比较
2.2 两组患儿24 h尿蛋白定量及血清Scr水平比较 B组患儿24 h尿蛋白定量及血清Scr水平均高于A组,差异均有统计学意义(P<0.05)。见表2。
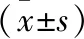
表2 两组患儿24 h尿蛋白定量及血清Scr水平比较
2.3 血清IL-6、IL-1β、IL-2水平与AKI严重程度相关性分析 PNS患儿血清IL-6与24 h尿蛋白定量、血清Scr水平、AKI分期呈正相关性(r=0.350、0.308、0.537,P<0.05)。PNS患儿血清IL-1β与24 h尿蛋白定量、血清Scr水平、AKI分期呈正相关性(r=0.418、0.504、0.595,P<0.05)。IL-2与24 h尿蛋白定量、血清Scr水平、AKI分期呈负相关性(r=-0.412、-0.420、-0.404,P<0.05)。
2.4 血清IL-6、IL-1β、IL-2对PNS患儿合并AKI的预测价值分析 血清IL-6、IL-1β、IL-2联合预测PNS患儿合并AKI的ROC曲线下面积(area under curve,AUC)、特异度均高于血清IL-6、IL-1β、IL-2单独预测,三者联合预测价值最高。见表3、图1。
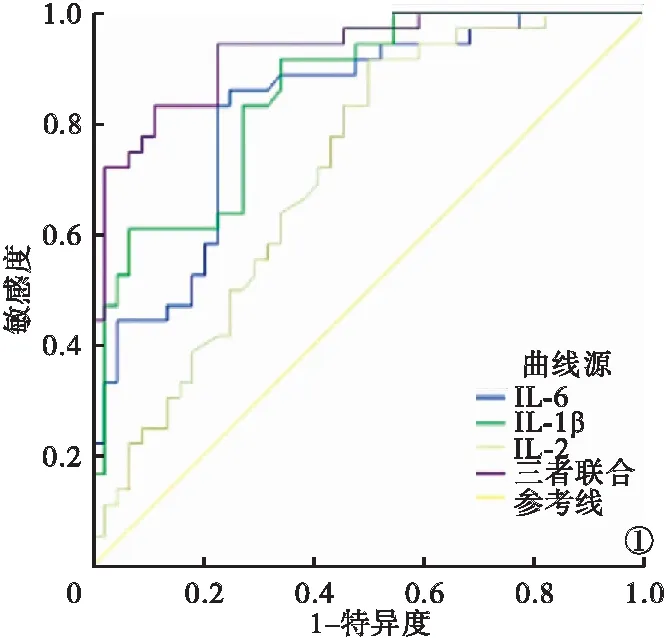
图1 血清IL-6、IL-1β、IL-2单独及联合预测PNS患儿合并AKI的ROC曲线图
3 讨论
肾是特异性自身免疫感染因子及异常免疫应答的常见靶点,器官再生能力差、毒素累积、缺氧、动脉血容量不足等各种致病条件均可影响肾结构及功能丧失,最终导致肾小球硬化及肾损伤[10]。AKI为PNS患儿的严重合并症,感染、重度水肿、急性肾小管坏死等因素均可导致AKI发生,AKI病理发展分为起始、延伸、维持和恢复4个阶段[11]。起始阶段肾组织轻微损伤,因肾内自发保护机制,该阶段及时修复损伤可完全恢复;延伸阶段由于肾缺血及再灌注延长,组织炎症反应不断扩大,致使肾小球滤过率下降,该阶段是AKI早期诊断及治疗干预的最佳时机;维持及恢复阶段肾组织损伤严重,肾小球滤过率持续降低,这两个阶段需采取内源性再生手段帮助修复AKI,但完全恢复可能性较低[12]。因此,早期发现并及时给予有效治疗措施对改善PNS患儿AKI至关重要。
IL-6为来源广泛的正向调节因子,主要发挥促炎作用,正常机体血清IL-6水平处于低应答状态,其表达既受机体稳态控制,又可在炎症刺激后发生上调[13]。IL-1β由IL-1分泌,属于常见炎症因子,具有调节树突状细胞、巨噬细胞等作用,能驱化、促进辅助性T细胞17分化,刺激相关细胞因子产生,诱导炎症反应及免疫失衡[14]。IL-2属于辅助性T细胞1类细胞因子,能通过复杂免疫调节作用促使机体发挥抗感染、抗肿瘤、改善免疫失衡状态等功能。本研究结果显示:B组患儿血清IL-6、IL-1β水平均高于A组,IL-2水平低于A组,差异均有统计学意义(P<0.05)。这提示,血清IL-6、IL-1β、IL-2可能参与PNS患儿AKI发生过程。分析原因可能为:IL-6能够通过反式呈递通路促进T细胞分化,诱导肾小球间质成纤维细胞增殖及合成,加重肾小管间质病变,而内皮素可进一步趋化单核细胞分泌更多促炎因子,造成局部炎症浸润,同时IL-6能提高内皮细胞和巨噬细胞促凝血活性,使系膜细胞蛋白激酶活性增加,从而导致AKI[15-16]。有研究报道,靶向抗IL-6细胞因子的生物制剂可通过阻断IL-6活性,抑制肾炎症,来减轻炎症介质诱导的AKI[17]。IL-1β可与IL-1受体结合,诱导其他白细胞介素、肿瘤坏死因子、干扰素等炎症因子及促进纤维化介质合成,促使炎性细胞向肾组织浸润,最终导致肾间质纤维化及肾小球硬化[18]。有研究认为,IL-1β是儿童PNS炎症反应的核心介质,通过监测IL-1β有助于评估PNS病情进展,抑制机体IL-1B水平上升可能帮助缓解PNS患儿AKI情况[19]。炎症因子介导的肾组织损伤在PNS发病过程中发挥重要启动性作用,IL-2由活化T细胞产生,是参与体内免疫调控的多肽,其异常表达能激活多种免疫细胞,影响靶细胞的免疫应答反应,其水平降低提示机体细胞免疫功能下降,免疫系统出现紊乱,从而促进IL-1、IL-6等促炎因子产生[20]。Rose等[21]研究发现,IL-2缺乏可促使狼疮性肾炎患者肾内CD4+活化,通过低剂量IL-2治疗可降低肾内调节性T细胞活性及其增殖,从而改善肾组织损伤。
24 h尿蛋白定量与肾病关系密切,健康机体尿液蛋白含量极低,尿蛋白含量的持续增多是肾组织受损的重要标志[22]。Scr是人体肌肉代谢产物,可通过肾小球滤过,并近乎全部随尿液排除体外,因此临床常用血清Scr辅助评估人体肾功能损害程度,血Scr升高说明肾功能受损[23]。本研究结果显示,B组患儿24 h尿蛋白定量及血清Scr水平均高于A组,差异均有统计学意义(P<0.05)。这说明,PNS合并AKI患儿肾功能损伤更为严重。本研究结果还发现:血清IL-6、IL-1β均与24 h尿蛋白定量、血清Scr水平、AKI分期呈正相关性;IL-2与24 h尿蛋白定量、血Scr水平、AKI分期呈负相关性。这表明,炎症介质IL-6、IL-1β、IL-2均与AKI有关。本研究中ROC曲线分析得出,血清IL-6、IL-1β、IL-2三者联合预测价值最高。这表明,血清IL-6、IL-1β、IL-2的联合检测可作为PNS患儿合并AKI的生物学预测指标,临床可通过早期检测PNS患儿血清IL-6、IL-1β、IL-2水平评估AKI发生风险,及时采取针对性预防措施修复AKI。
综上所述,血清IL-6、IL-1β、IL-2水平均与PNS患儿合并AKI显著相关,可用作未来生物学标志物和分子治疗的药物靶标。
