学龄前儿童重症支原体肺炎实验室检查和免疫功能分析
2023-11-05周玉林俞怡雪范玉洁骆亚丽周卫芳姜艳群
周玉林 俞怡雪 范玉洁 骆亚丽 周卫芳 姜艳群


[摘 要] 目的:分析影响学龄前儿童发生重症支原体肺炎(severe mycoplasma pneumoniae pneumonia,SMPP)的因素及其预测SMPP效能。方法:行支气管肺泡灌洗的学龄前支原体肺炎(mycoplasma pneumoniae pneumonia,MPP)患儿101例,分为重症组53例和普通组48例。采用实时荧光定量PCR(RT-qPCR)法检测支气管肺泡灌洗液(BALF)中肺炎支原体(MP)载量及社区获得性呼吸窘迫综合征毒素(CARDS TX)表达量,酶联免疫吸附法(ELISA)检测血清炎症因子(IL-4、IL-6、IL-8、IL-1β及TNF-α)水平。血常规、淋巴细胞亚群、体液免疫检测由医院检验科完成。结果:两组支气管肺泡灌洗液中MP载量和CARDS TX表达量比较,差异均无统计学意义(P>0.05)。重症组外周血淋巴细胞计数为(3.09±2.00)×109/L,低于普通组的(4.38±2.93)×109/L,差异有统计学意义(P<0.05);中性粒细胞计数与淋巴细胞计数比值(NLR)、血小板计数与淋巴细胞计数比值(PLR)、C反应蛋白(CRP)水平分别为3.03±2.61、163.17±103.75和32.30(19.00,38.25)mg/L,高于普通组的1.46±1.00、112.29±60.72和2.55(0.44,10.24)mg/L,差异均有统计学意义(P<0.05)。重症组BALF中IL-4、IL-6、IL-8、IL-1β、TNF-α水平分别为3.20±1.69 ng/L、27.12±17.82 ng/L、69.99±29.46 ng/L、13.83±1.72 ng/L和25.24±1.30 ng/L,高于普通组的1.76±0.83 ng/L、6.12±4.41 ng/L、20.35±10.59 ng/L、10.12±1.02 ng/L和23.26±0.71 ng/L,差异均有统计学意义(P<0.05)。重症组CD3+CD4+、CD4+/CD8+、CD3-CD19+T细胞计数分别为0.87(0.60,1.42)×109/L、1.10(0.95,1.60)和0.51(0.26,0.98)×109/L,低于普通组的1.26(0.87,1.89)×109/L、1.50(1.30,1.90)和0.81(0.50,1.45)×109/L,差异均有统计学意义(P<0.05)。重症组IgM、IgA水平高于普通组,差异均有统计学意义(P<0.05)。Logistic回归分析显示,NLR、PLR、CRP、IgM、IL-6和IL-8是影响SMPP发生的危险因素。ROC曲线分析显示,CRP预测SMPP的曲线下面积为0.859,取最佳临界值8.570 mg/L时,预测SMPP发生的敏感度为75.00%,特异度为90.60%。结论:过度炎症反应和免疫功能紊乱可能是学龄前SMPP发生的主要病理机制,CRP对SMPP发生的预测价值较高。
[关键词] 支原体肺炎;重症;实验室检查;免疫功能
[中图分类号] R725.6 [文献标志码] B [DOI] 10.19767/j.cnki.32-1412.2023.04.024
社区获得性肺炎是儿童时期的常见病、多发病,国内10%~30%儿童社区获得性肺炎由肺炎支原体(mycoplasma pneumoniae,MP)感染引起[1],重症支原体肺炎(severe mycoplasma pneumoniae pneumonia,SMPP)患儿发病率逐年上升[2]。本文选择2017年1月—2019年12月在我院住院行纤维支气管镜支气管肺泡灌洗的学龄前支原体肺炎(mycoplasma pneumoniae pneumonia,MPP)患儿为研究对象,检测肺泡灌洗液(bronchoalveolar lavage fliuld,BALF)中肺炎支原体载量、社区获得性呼吸窘迫综合征毒素(community- acquired respiratory distress syndrome toxin,CARDS TX)表达量以及血常规、细胞因子水平和免疫功能等指标,探究各指标对发生SMPP的预测价值。
1 资料与方法
1.1 一般資料 学龄前支原体肺炎患儿101例,根据病情分为重症组53例和普通组48例。重症组中男性25例,女性28例,平均年龄4.81±1.63岁。普通组中男性25例,女性23例,平均年龄4.48±1.25岁。两组性别、年龄比较,差异均无统计学意义(P>0.05)。纳入标准:(1)年龄3~6岁,符合《诸福棠实用儿科学》肺炎诊断标准[3];(2)符合支气管镜术指征[4];(3)符合肺炎支原体感染标准:鼻咽吸取物(nasopharyngeal aspirates,NPA)或支气管肺泡灌洗液(bronchoalveolar lanage fluid,BALF)中MP-DNA-PCR>1.0×103 copies/mL;单份血清MP-IgM≥1.1 S/CO,双份血清的第2份IgG和(或)IgM较第1份增高4倍及以上(相隔7~14天)。(4)重症组符合SMPP诊断标准[5]:在MPP确诊基础上符合以下任意1条:①明显气促或心动过速,伴或不伴呼吸困难、动脉血压下降及发绀;②大环内酯类抗生素治疗>7天无效,腋温持续≥38.5℃;③胸部影像学显示大面积致密影并累及面积≥2/3肺;④伴随胸腔积液、肺不张等肺部并发症;⑤合并低氧血症、心力衰竭等其他系统严重损伤。排除标准:(1)其他病毒、细菌等病原体感染;(2)支气管肺发育不良、肺结核、支气管哮喘、先天性心脏病、免疫缺陷病、遗传代谢疾病;(3)病历资料不全者。本研究经我院伦理委员会批准,所有患儿家长签署知情同意书。
1.2 方法
1.2.1 临床资料收集:利用医院病历系统回顾性收集入选患儿一般临床资料、入院后24小时内血常规、C反应蛋白(CRP)、淋巴细胞亚群、血清免疫球蛋白检测结果。血常规、淋巴细胞亚群、体液免疫检测由医院检验科完成。
1.2.2 肺泡灌洗液收集:患儿均于入院3天内完成纤维支气管镜支气管肺泡灌洗术,具体操作严格遵循《中国儿科可弯曲支气管镜术指南》(2018年版)[4]进行。电子支气管镜前端到达病变支气管,经工作孔道注入37 ℃ 0.9%生理盐水(每次注入5~10 mL,总量≤10 mL / kg)进行支气管肺泡灌洗,以13.3~20.0 kPa负压获取BALF,保存于灭菌收集器。将1管BALF移入离心管中,4 ℃下1 200 r/min离心5 min,取上清液分装于不含RNA酶的EP管。剩余沉淀加0.5 mL Trizol,吹打混匀后立即转入不含RNA酶的EP管,放入-80 ℃冰箱备用。
1.2.3 BALF中MP载量测定:将BALF从-80 ℃冰箱取出,复温后经震荡、离心、去上清液,加入裂解液提取DNA,再进行PCR 扩增,仪器为美国BIO-RAD公司的iCycler iQ荧光定量PCR仪,引物及探针来自于广州达安基因股份有限公司,具体操作按照试剂盒(达安基因股份有限公司)说明书进行。
1.2.4 BALF中CARDS TX表达量: BALF 标本 4 ℃ 下 12 000 r/min 在低温高速离心机中离心 5 min,管底沉淀加入 0.5 mL Trizol,提取总 RNA,并逆转录合成 cDNA。以pdh A为内参,采用RT-qPCR法检测CARDS TX,计算各段各基因表达的平均Ct值,采用相对表达量2-△△Ct法比较各基因的表达差异。试剂盒购自北京艾德莱生物,具体操作步骤按说明书。
1.2.5 血清炎症因子测定:取静脉血2 mL, 3 000 r/min离心10 min,分离收集血清,应用ELISA双抗体夹心法检测上清中IL-6、 IL-8和TNF-α水平,试剂盒购自欣博盛生物科技有限公司。
1.3 统计学处理 应用SPSS 25.0统计学软件对数据进行分析处理。符合正态分布的计量资料以±s表示,组间比较采用独立样本t检验;不符合正态分布的计量资料以M(P25,P75)表示,组间比较采用Mann-Whitney U检验。采用Logistic回归分析影响SMPP发生的危险因素,ROC曲线评价相关指标对SMPP的预测效能。P<0.05为差异有统计学意义。
2 结 果
2.1 两组肺泡灌洗液中MP载量及CARDS TX表达量比较 重症组和普通组MP载量分别为5.71±1.40、5.29±2.32,CARDS TX表达量分别为1.6(0.5,
2.50)、2.50(1.38,2.50),两组MP载量和CARDS TX表达量比较,差异均无统计学意义(P>0.05)。
2.2 两组血常规及CRP水平比较 重症组淋巴细胞计数为(3.09±2.00)×109/L,低于普通组的(4.38±2.93)×109/L,差异有统计学意义(P<0.05);NLR(中性粒细胞计数/淋巴细胞计数比值)、PLR(血小板计数/淋巴细胞计数比值)、CRP水平分别为3.03±2.61、163.17±103.75和32.30(19.00,38.25)mg/L,高于普通组的1.46±1.00、112.29±60.72和2.55(0.44,
10.24)mg/L,差异均有统计学意义(P<0.05)。两组白细胞及中性粒细胞计数比较,差异均无统计学意义(P>0.05)。见表1。
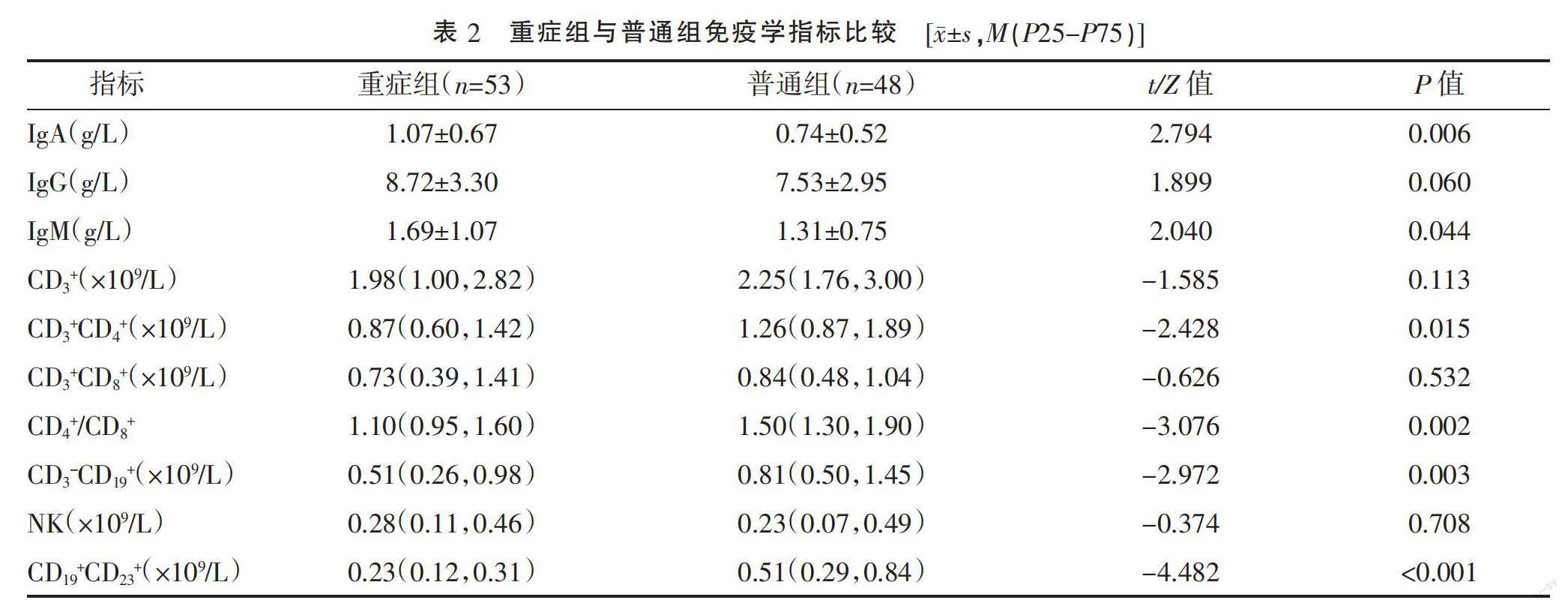
2.3 两组免疫指标比较 重症组CD3+CD4+、CD4+/CD8+、CD3-CD19+、CD19+CD23+T细胞计数分别为0.87(0.60~1.42)×109/L、1.10(0.95~1.60)、0.51(0.26~0.98)×109/L、0.23(0.12~0.31)×109/L,低于普通组的1.26(0.87~1.89)×109/L、1.50(1.30~1.90)、0.81(0.50~1.45)×109/L、0.51(0.29~0.84)×109/L,差异均有统计学意义(P<0.05)。重症组IgM、IgA水平高于普通组,差异均有统计学意义(P<0.05)。两组CD3+细胞、CD3+CD8+细胞及NK细胞计数比较,差异均无统计学意义(P>0.05)。见表2。
2.4 两组肺泡灌洗液中炎症因子水平比较 重症组肺泡灌洗液中IL-4、IL-6、IL-8、IL-1β、TNF-α水平均高于普通组,差异均有统计学意义(P<0.001)。见表3。
2.5 Logistic回归分析影响SMPP发生的危险因素 以发生SMPP为因变量,LYM、NLR、PLR、CRP、IgM、IgA、IL-4、IL-6、IL-8为自变量,行多因素Logistic回归分析,结果显示NLR、PLR、CRP、IgM、IL-6、IL-8是影响SMPP发生的危险因素,具有统计学意义(P<0.05)。
2.6 相關实验室指标对SMPP的预测效能 ROC曲线分析显示,CRP曲线下面积(area under the curve,AUC)最大,为0.859(95%CI:0.781~0.937,P<0.001),NLR、PLR、IgM、IL-6、IL-8的AUC均小于0.75。CRP取最佳临界值8.570 mg/L时,预测SMPP发生的敏感度为75.00%,特异度为90.60%。见图1。3 讨 论
支原体是介于病毒和细菌之间的一类缺乏细胞壁的小型原核病原微生物,支原体肺炎多发生于学龄前和学龄儿童。MP一方面通过病原体及其毒素直接损伤宿主呼吸道上皮细胞[6],另一方面通过体液免疫、细胞免疫、细胞因子等间接损伤机体,引起全身炎症反应[7]。CARDS TX是MP产生的重要毒素,分布于MP细胞质内及细胞膜上。本研究结果显示,重症组患儿肺泡灌洗液MP载量及CARDS TX表达量与普通组比较,差异均无统计学意义(P>0.05),可能是患儿经过一段时间的治疗,部分病原体被灭活排出,也可能是病原体载量不是重症肺炎发病的主要原因,病情严重程度不完全取决于CARDS TX。
本研究中重症组淋巴细胞计数低于普通组,淋巴细胞计数降低导致NLR、PLR增高,考虑为MP感染后主要是中性粒细胞反应性增生,在局部发挥杀菌作用,与既往研究一致[8]。免疫功能紊乱是MP感染致病机制之一。重症组血清IgA、IgM水平高于普通组,持续的高免疫球蛋白血症对机体免疫损伤更严重[9]。既往研究证实MP感染可导致淋巴细胞活化,淋巴细胞亚群的平衡遭到破坏,淋巴细胞亚群变化与MPP进展密切相关,尤其是CD4+Th细胞与MPP的严重程度相关[10]。本研究中重症组CD3+CD4+、CD4+/CD8+、CD3-CD19+、CD19+CD23+T细胞计数低于普通组,差异均有统计学意义(P<0.05)。
MP进入人体呼吸道后,机体为清除MP而产生IL-6、IL-8等促炎因子,同时MP释放的毒素刺激巨噬细胞释放促炎因子,导致大量炎症细胞聚集造成免疫损伤。另一方面,机体通过促进抑炎因子分泌来减轻炎性反应的损害[11],两者失衡造成机体内环境稳态失衡,就会引起疾病的发生。IL-4主要由辅助型T细胞2(Th2)分泌,刺激B细胞增殖,促进免疫球蛋白生成。IL-6由淋巴细胞、成纤维细胞及巨噬细胞产生,在机体炎症反应、自身免疫及抗感染方面具有重要作用[12]。IL-8是由单核细胞产生的一种趋化因子,它募集中性粒细胞、T淋巴细胞在感染组织内浸润和释放活性物质引发炎症反应,造成组织损伤[13]。TNF-α是在各种致炎因素刺激下最早分泌的炎性因子,主要由单核细胞和巨噬细胞产生,可刺激IL-1β等次级炎症因子的产生,进而促进T细胞传递信号启动炎性反应。有研究发现,MP、CARDS TX可刺激机体产生TNF-α、IL-1β等促炎细胞因子[14]。本研究中重症组肺泡灌洗液中IL-4、IL-6、IL-8、IL-1β、TNF-α水平高于普通组,差异均有统计学意义,提示炎症因子在SMPP的免疫发病机制中发挥重要作用。
本研究Logistic回归分析发现,NLR、PLR、CRP、IgM、IL-6、IL-8是影响SMPP发生的危险因素。ROC曲线分析显示,CRP的AUC最大,为0.859,NLR、PLR、IgM、IL-6、IL-8的AUC均小于0.75。CRP取最佳临界值8.570 mg/L时,预测SMPP的敏感度为75.00%,特异度为90.60%。CRP是肝脏合成的一种急性时相反应蛋白,是常用的敏感炎症指标,常于炎症性疾病发病6~8小时升高,24~48小时达到高峰,升高幅度与感染或炎症反应严重程度正相关。本研究中CRP诊断SMPP的最佳临界值为8.570 mg/L,低于其他研究中的临界值[15],考虑与本研究对象为学龄前儿童,免疫反应不如大龄儿童强,而且患儿入院时大多病程大于48小时有关。NLR、 PLR、IgM、IL-6、IL-8的AUC均小于0.75,提示单一炎症指标或者免疫指标不能有效评估SMPP,预测SMPP可能需要多个免疫指标综合评估。
综上所述,过度炎症反应和免疫功能紊乱可能是SMPP发生的主要病理机制,然而本次研究病例数较少,未统计患儿入院前病程天数,存在一定的局限性,今后需要扩大病例数进一步研究。
[参考文献]
[1] 焦明远,聂庆东,伊洁. 儿童社区获得性肺炎的病原体研究[J]. 中华医院感染学杂志,2013,23(14):3550-3551,3554.
[2] GAO L W,YIN J,HU Y H,et al. The epidemiology of paediatric Mycoplasma pneumoniae pneumonia in North China: 2006 to 2016[J]. Epidemiol Infect,2019,147:e192.
[3] 胡亚美,江载芳,申昆玲,等. 诸福棠实用儿科学[M]. 第8版. 北京:人民卫生出版社,2015:1255-1262.
[4] 国家卫生健康委员会人才交流服务中心儿科呼吸内镜诊疗技术专家组,中国医师协会儿科医师分会内镜专业委员会,中国医师协会内镜医师分会儿科呼吸内镜专业委员会,等. 中国儿科可弯曲支气管镜术指南(2018年版)[J]. 中华实用儿科临床杂志,2018,33(13):983-989.
[5] 张晗,尚云晓. 重症肺炎支原体肺炎早期识别[J]. 中国实用儿科杂志,2015,30(3):176-179.
[6] NOLEVAUX G,BESSACI KABOUYA K,VILLENET N,et al. Epidemiological and clinical study of Mycoplasma pneumoniae respiratory infections in children hospitalized in a pediatric ward between 1999 and 2005 at the Reims University Hospital[J]. Arch Pediatr,2008,15(11):1630-1636.
[7] 張海邻,陈志敏,刘瀚旻,等. 肺炎支原体感染的致病机制[J]. 中华儿科杂志,2016,54(2):94-97.
[8] LIU Y,ZHANG X,WANG Y,et al. The role of granulocyte macrophage colony stimulating factor in hospitalized children with Mycoplasma pneumoniae pneumonia[J]. J Infect Che-mother,2018,24(10):789-794.
[9] 牛波,池跃朋,帅金凤,等. 儿童难治性肺炎支原体肺炎免疫机制探讨[J]. 中国医药导报,2016,13(6):107-110.
[10] WANG M,WANG Y,YAN Y,et al. Clinical and laboratory profiles of refractory Mycoplasma pneumoniae pneumonia in children[J]. Int J Infect Dis,2014,29:18-23.
[11] BAO Y X,LI J,TIAN Y,et al. Atopy: a risk factor of refractory Mycoplasma pneumoniae pneumonia[J]? Clin Respir J,2017,11(6):931-934.
[12] 刘芳,赵宇华,陈霜慧. IL-6、IL-8及IL-10在肺炎支原体肺炎患儿血清中的表达及临床意义[J]. 实用临床医药杂志,2015,19(17):61-63,66.
[13] MATSUO J,SAKAI K,OKUBO T,et al. Chlamydia pneumoniae enhances Interleukin 8 (IL-8) production with reduced azithromycin sensitivity under hypoxia[J]. APMIS,2019,127(3):131-138.
[14] LI G,FAN L P,WANG Y Q,et al. High co-expression of TNF-α and CARDS toxin is a good predictor for refractory Mycoplasma pneumoniae pneumonia[J]. Mol Med Camb Mass,2019,25(1):38.
[15] 陳跃,乐原,王丹. 检测25-羟维生素D乳酸脱氢酶及C-反应蛋白水平在儿童难治性肺炎支原体肺炎早期诊断中的价值[J]. 中国妇幼保健,2022,37(17):3112-3116.
[收稿日期] 2022-11-30
(本文编辑 赵喜)
