血浆cfDNA评估原发性肝癌患者放疗效果的临床研究
2023-11-05袁小鹏王向前易琼陆红梅杨百霞杨燕光
袁小鹏 王向前 易琼 陆红梅 杨百霞 杨燕光
[摘 要] 目的:分析原发性肝癌患者放疗前后血浆游离核酸(cell-free DNA,cfDNA)浓度变化,探讨cfDNA对原发性肝癌放疗效果的评估作用。方法:行放射治疗的中晚期原发性肝癌患者40例,在放疗前24 h、放疗后48 h、40 Gy时及放疗结束时测定患者血浆中cfDNA、血清中甲胎蛋白(alpha fetal protein,AFP)、谷丙转氨酶(alanine amintransferase,ALT)及谷草转氨酶(aspartate aminotransferase,AST)浓度,并在放疗前、放疗40 Gy时同时行MRI/CT检查,评估肿瘤大小的变化。结果:患者放疗后48 h血浆cfDNA浓度与基线值比值>1,为2.38±0.33,提示cfDNA浓度一过性升高,但在放疗40 Gy时及放疗结束时血浆cfDNA浓度与基线值比值均<1,分别为0.30±0.07和0.25±0.05,与放疗前比较,差异均有统计学意义(P<0.05)。患者放疗后48 h、40 Gy时及放疗结束时血清AFP与基线值比值均<1,分别为0.65±0.13、0.19±0.08和0.14±0.06,呈逐渐下降趋势,放疗40 Gy时及放疗结束时与放疗前比较,差异均有统计学意义(P<0.05)。放疗40 Gy时肿瘤直径与基线值比值为0.65±0.15,提示肿瘤较放疗前缩小。患者放疗后48 h、40 Gy时及放疗结束时血清ALT及AST浓度与基线值比值均接近1,差异均无统计学意义(P>0.05)。结论:联合检测血浆cfDNA和血清AFP浓度有助于评估原发性肝癌的放疗效果。
[关键词] 游离核酸;原发性肝癌;放射治疗;甲胎蛋白
[中图分类号] R735.7 [文献标志码] B [DOI] 10.19767/j.cnki.32-1412.2023.04.013
全球原发性肝癌发病率位居恶性肿瘤第6位,死亡率位居第2位,约55%新发病例发生在我国[1]。原发性肝癌主要为肝细胞癌(hepatocellular carcinoma,HCC),治疗方式包括手术、介入、分子靶向、放射治疗、免疫治疗等[2-3]。随着放疗技术的不断发展,放射治疗在小肝癌、中晚期肝癌治疗中的地位日趋重要[4],治疗方式也由姑息性放疗逐渐向根治性放疗转变。由于受放疗敏感性和耐受性的影响,仍有部分患者疗效不佳。血清甲胎蛋白(alpha fetal protein,AFP)在肝癌诊断、疗效监测中具有重要作用,但灵敏度和特异度有限[5]。因此,寻找更加有效、准确和检测方便的生物标记物尤为重要。目前,液体活检对提高肝癌早期发现、改善患者预后、提高生存率及生存质量的重要作用得到广泛关注,其中血浆游离核酸(cell-free DNA,cfDNA)是目前研究的热点之一[6-7]。本研究选择我院2019年1月—2021年6月确诊并进行放射治疗的40例中晚期原发性肝癌患者,通过联合检测患者放疗不同阶段血浆cfDNA和血清AFP浓度,评估放疗对原发性肝癌的治疗效果。
1 资料与方法
1.1 一般资料 中晚期原发性肝癌患者40例,其中男性22例,女性18例,年龄18~75岁,平均55.0±6.3岁。纳入标准:(1)根据巴塞罗那分期和国际抗癌联盟UICC 2017年TNM分期(第8版)为中晚期手术不可切除的原发性肝癌,Child-Pugh 肝功能分级A/B级,体力状况PS评分0~2分;(2)病理检查证实为肝细胞癌;(3)至少有一个肿瘤病灶可以准确测量大小,且该病灶既往未接受过局部治疗;(4)预期生存期≥12周;(5)无心、脑、肾等主要脏器功能障碍。排除标准:(1)弥漫性肝内病变,无法行放射治疗者;(2)既往患有或同时存在其他恶性肿瘤;(3)合并严重感染;(4)入组前1个月内有消化道出血者;(5)临床资料不完整或未完成全部治疗者。本研究经医院伦理委员会审核批准,所有患者签署知情同意书。
1.2 放疗计划 患者仰卧位,真空垫固定体位,訓练患者平静呼吸。采用螺旋CT 5 mm层距连续增强扫描定位,扫描范围自膈顶上3 cm至右肾下极,将CT图像资料和相关数据输入TPS治疗计划系统进行设计。采用定位CT和MRI图像融合技术,在定位CT窗宽400、窗位40进行勾画,画出大体肿瘤体积(GTV)和周边危及器官(organs at risk,OAR),并根据解剖结构及屏障作相应修改,确定临床靶体积(CTV)及计划靶区(PTV)。放射治疗处方剂量:肿瘤直径≤5 cm,48~60 Gy /8~10 f,3次/周;肿瘤直径>5 cm,40~54 Gy /10~15 f,5次/周。优化指标:≥50%的等剂量曲线包绕PTV;靶区周围危及器官如胃肠道、脊髓的剂量不超过耐受剂量;接受>30 Gy剂量照射的正常肝脏体积(V30)达到最小化(均<30%);病灶≤5.0 cm采用立体定向体部放疗(stereotactic body radiation therapy,SBRT),>5.0 cm采用调强放疗(intensity-modulated radiation therapy,IMRT)。
1.3 实验室检测 在放疗前24 h、放疗后48 h、放疗40 Gy及放疗结束时取患者血液置入EDTA抗凝采血管,室温,3 000 r/min离心10 min,吸取上层血浆600 μL,转移至1.5 mL离心管中,PBS稀释后4 ℃下3 000 r/min离心1 min,取上清液。使用Quanti DNA Direct cfDNA检测试剂盒(南京帝基生物科技有限公司),参照说明书测定上清液中cfDNA浓度。同时由我院中心实验室测定患者血清AFP、谷丙转氨酶(ALT)和谷草转氨酶(AST)水平。
1.4 影像学检查 在放疗前及放疗40 Gy时作增强MRI(1.5T)检查,螺距为5 mm。
1.5 统计学处理 应用SPSS 23.0统计学软件对数据进行分析处理。计量资料以均数±标准差表示,组间比较采用t检验。P<0.05为差异有统计学意义。
2 结 果
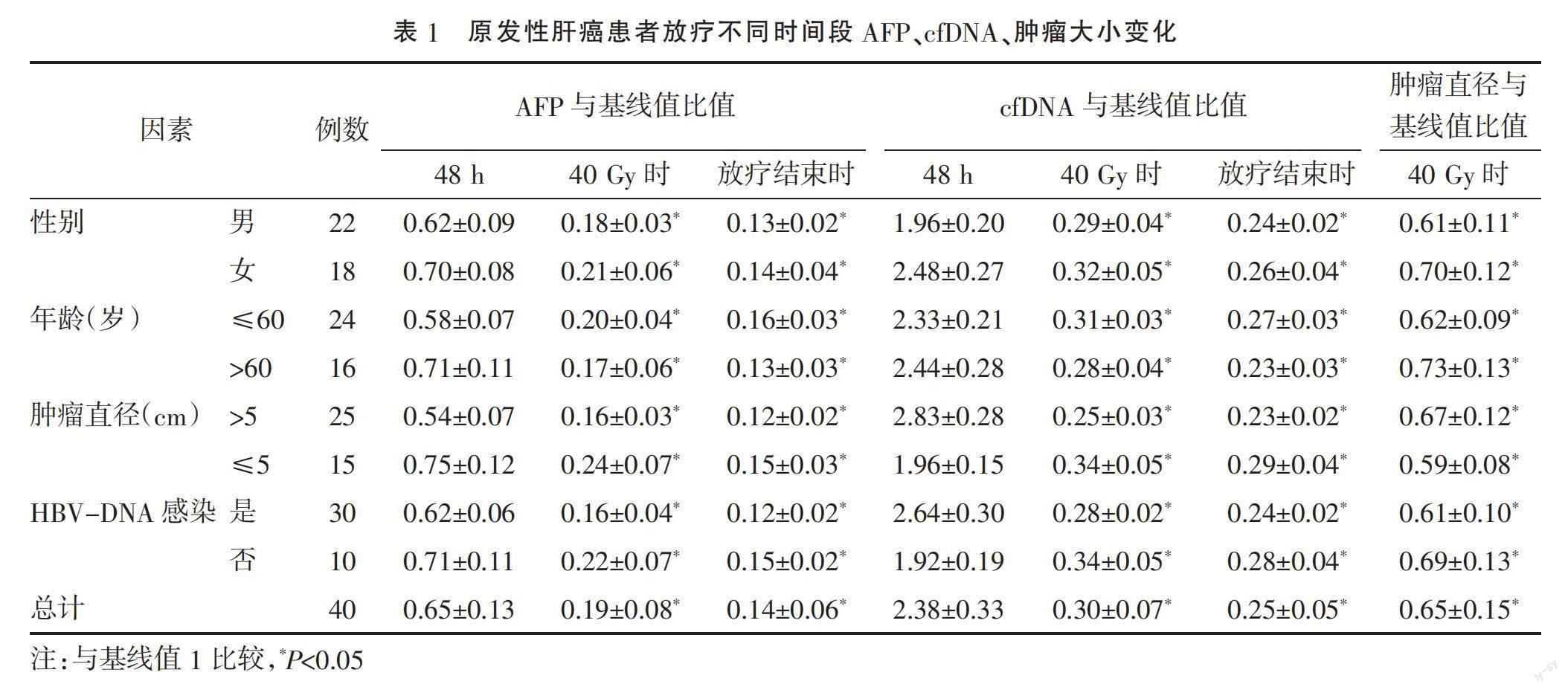
2.1 原发性肝癌患者放疗不同时间段cfDNA、AFP、肿瘤直径变化 计算放疗后各时间点cfDNA、AFP、肿瘤直径与基线值(放疗前24 h)的比值,比值<1表示放疗后测定的数值较放疗前下降,>1表示放疗后测定的数值较放疗前升高。结果显示,不同性别、年龄、肿瘤直径、HBV-DNA感染状态患者以及统计所有患者放疗后48 h、放疗40 Gy时及放疗结束时血清AFP与基线值比值均<1,且呈现逐渐下降趋势,放疗40 Gy时及放疗结束时与放疗前比较,差异均有统计学意义(P<0.05)。而cfDNA浓度在放疗后48 h时与基线值比值>1,提示cfDNA浓度短期内一过性升高,在放疗40 Gy时明显下降,放疗结束时进一步下降,与基线值比值均<1,与放疗前比较差异均有统计学意义(P<0.05)。放疗40 Gy时肿瘤直径与基线值比值均小于1,与放疗前比较差异有统计学意义(P<0.05),提示肿瘤较放疗前缩小。见表1。
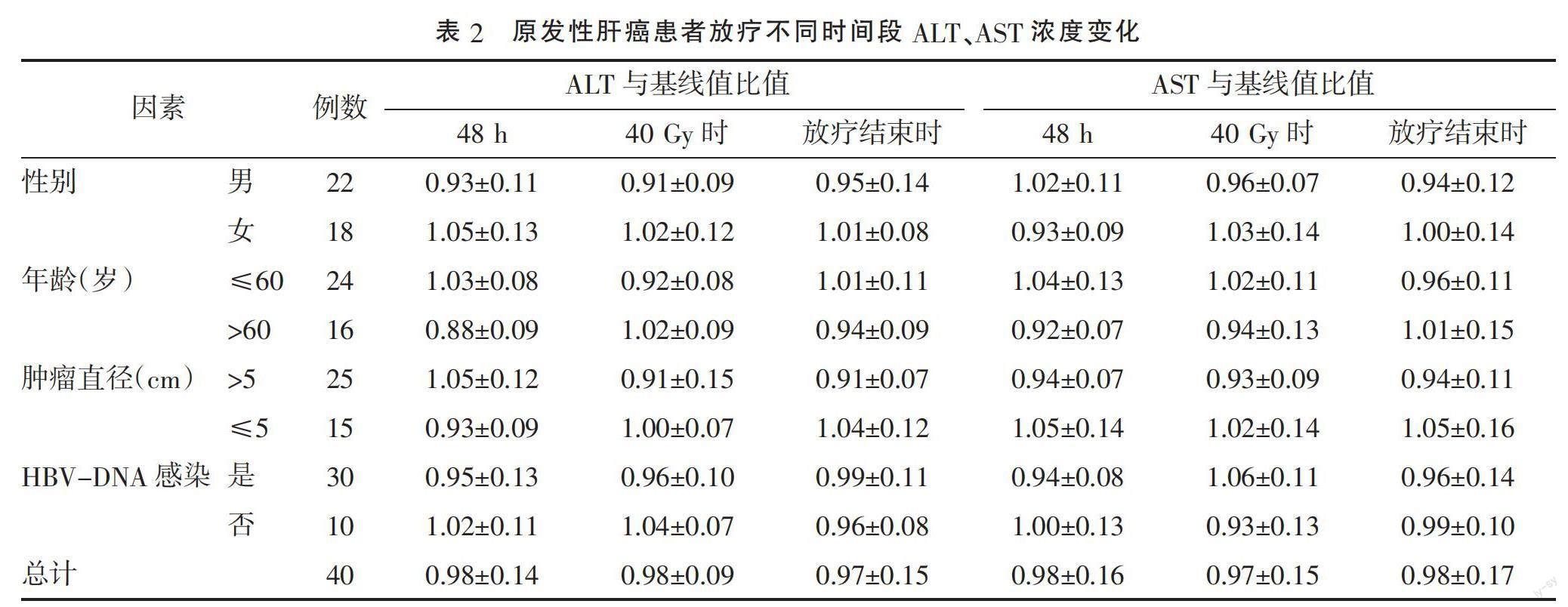
2.2 原发性肝癌患者放疗不同时间段ALT、AST浓度变化 不同性别、年龄、肿瘤直径、HBV-DNA感染状态患者以及所有患者放疗后48 h、40 Gy时及放疗结束时血清ALT及AST水平与基线值比值均接近1,差异均无统计学意义(P>0.05),提示放疗后患者血清ALT及AST浓度无明显变化。见表2。
3 讨 论
cfDNA主要是程序性细胞死亡或急性细胞损伤时释放的DNA片段,可间接反映细胞损伤的程度[8]。循环肿瘤DNA(circulating tumor DNA,ctDNA)是目前cfDNA研究最深入的分支,主要来自坏死或凋亡的肿瘤细胞、肿瘤细胞外泌体及循环肿瘤细胞,可用于检测点突变及获得性耐药的突变基因,指导耐药后用药[9-10]。由于患者外周血中ctDNA含量较低,不易提取和鉴定,且检测操作复杂,成本较高,临床应用受到限制。研究表明,血浆cfDNA含量与ctDNA呈正相关[11]。健康人血液中可检测到低浓度cfDNA,而在肺癌、结直肠癌、乳腺癌和卵巢癌等患者血液中cfDNA显著增加,可为肿瘤遗传学、进展机制和耐药性研究提供信息[12]。通过检测cfDNA水平可间接反映肿瘤细胞死亡数量及机体损伤程度,方法准确快速、便捷高效、灵敏度和特异度高,且价格低廉。
HBV相关肝细胞癌患者同时处于乙肝导致的机体炎症反应和肝细胞癌两种状态。研究表明,在不同HBV-DNA病毒复制水平、CTP分级、TNM分期、肿瘤数目、血管是否侵犯HCC患者之间cfDNA浓度的差异均有统计学意义(P<0.05),并且cfDNA浓度与血清白蛋白浓度、血小板计数、肿瘤大小呈线性相关[13]。研究发现,HCV相关HCC患者血清cfDNA水平明显高于HCV携带者,接受治疗性肝切除术的cfDNA高水平患者总生存期(OS)较低水平患者明显缩短(P=0.017),同时血清cfDNA是OS和远处转移的预测因子[14]。研究表明,检测cfDNA水平对监测HCC患者疗效具有一定价值,cfDNA高表达组患者5年生存率较cfDNA低表达组低(P<0.05),无进展生存期(progression-free survival,PFS)较cfDNA低表达组缩短(P<0.05)[15]。已有研究利用实时定量PCR测定130例胃癌患者血清或血浆中cfDNA浓度,显示血浆中cfDNA浓度较血清更低,浓度变化范围更稳定,说明血浆cfDNA更合适作为cfDNA的检测样品[16]。
本研究结果显示,放疗后短期内血浆cfDNA濃度一过性升高,提示肿瘤细胞对放疗敏感,坏死后从细胞内释出,随着放射线对肿瘤细胞大量杀伤,体内肿瘤负荷降低,导致血浆cfDNA浓度不断降低,同时MRI复查显示肿瘤直径同步缩小。放疗后各时间点血清AFP与基线值比值逐渐下降,与cfDNA联合检测对肝癌放疗效果有一定的预测作用。血清ALT、AST水平在放疗前后无显著变化,说明所采取的放疗方案对肝脏的损伤较轻。
[参考文献]
[1] FERLAY J,COLOMBET M,SOERJOMATARAM I,et al. Estimating the global cancer incidence and mortality in 2018:GLOBOCAN sources and methods[J]. Int J Cancer,2019,
144(8):1941-1953.
[2] ZHENG R,ZUO T,ZENG H,et al. Mortality and survival analysis of liver cancer in China[J]. Zhonghua Zhong Liu Za Zhi,2015,37(9):697-702.
[3] CHIANG C L,CHAN A C Y,CHIU K W H,et al. Combined stereotactic body radiotherapy and checkpoint inhibition in unresectable hepatocellular carcinoma: a potential synergistic treatment strategy[J]. Front Oncol,2019,9:1157.
[4] WANG H,ZHENG L,WANG J,et al. Efficacy and safety study on the hepatocellular carcinoma patients with Child-Pugh B score using stereotactic body radiation therapy[J]. Zhonghua Gan Zang Bing Za Zhi,2019,27(5):384-387.
[5] WANG W,WEI C. Advances in the early diagnosis of hepatocellular carcinoma[J]. Genes Dis,2020,7(3):308-319.
[6] XU R H,WEI W,KRAWCZYK M,et al. Circulating tumour DNA methylation markers for diagnosis and prognosis of hepatocellular carcinoma[J]. Nat Mater,2017,16(11):1155-1161.
[7] YANG J D,LIU M C,KISIEL J B. Circulating tumor DNA and hepatocellular carcinoma[J]. Semin Liver Dis,2019,39(4):452-462.
[8] SIMONE C B. Thoracic radiation normal tissue injury[J]. Semin Radiat Oncol,2017,27(4):370-377.
[9] SIRAVEGNA G,MUSSOLIN B,BUSCARINO M,et al. Clonal evolution and resistance to EGFR blockade in the blood of colorectal cancer patients[J]. Nat Med,2015,21(7):795-801.
[10] CHABON J J,SIMMONS A D,LOVEJOY A F,et al. Circulating tumour DNA profiling reveals heterogeneity of EGFR inhibitor resistance mechanisms in lung cancer patients[J]. Nat Commun,2016,7:11815.
[11] VOLIK S,ALCAIDE M,MORIN R D,et al. Cell-free DNA (cfDNA):clinical significance and utility in cancer shaped by emerging technologies[J]. Mol Cancer Res,2016,14(10):898-908.
[12] CHENG F,SU L,QIAN C. Circulating tumor DNA: a promising biomarker in the liquid biopsy of cancer[J]. Oncotarget,2016,7(30):48832-48841.
[13] WANG D,HU X,LONG G,et al. The clinical value of total plasma cell-free DNA in hepatitis B virus-related hepatocellular carcinoma[J]. Ann Transl Med,2019,7(22):650.
[14] TOKUHISA Y,IIZUKA N,SAKAIDA I,et al. Circulating cell-free DNA as a predictive marker for distant metastasis of hepatitis C virus-related hepatocellular carcinoma[J]. Br J Cancer,2007,97(10):1399-1403.
[15] 薛晨祺,徐春陽,姚煜,等. 替吉奥联合阿帕替尼辅助治疗TACE术后原发性肝癌的临床观察及cfDNA与疗效的相关性[J]. 临床与病理杂志,2022,42(11):2689-2698.
[16] PARK J L,KIM H J,CHOI B Y,et al. Quantitative analysis of cell-free DNA in the plasma of gastric cancer patients[J]. Oncol Lett,2012,3(4):921-926.
[收稿日期] 2022-07-26
(本文编辑 赵喜)
