产肠毒素大肠杆菌四价基因工程灭活疫苗研制
2023-11-04许崇利佘玉罕付凤洋史沁红许崇波
许崇利 佘玉罕 付凤洋 史沁红 许崇波

摘要:目的 利用PCR和基因定點突变技术,分别扩增出K88ac、K99、LTB和突变的ST1基因,构建了重组菌株BL21(DE3)(pXKKSL4),酶切鉴定和序列分析表明构建的pXKKSL4表达载体包含有K88ac-K99-3ST1-LTB融合基因且阅读框架正确。方法 SDS-PAGE分析表明融合蛋白占菌体总蛋白含量的35.72%。ELISA检测证实融合蛋白能与ST1单抗、LTB、K88ac和K99抗体相结合。结果 乳鼠灌胃实验表明K88ac-K99-3ST1-LTB融合蛋白已失去ST1天然毒性,免疫保护试验表明菌株氢氧化铝佐剂苗和包涵体粗提物氢氧化铝佐剂苗均具有良好的免疫效果,其免疫保护率分为98%和96%。结论 上述研究表明构建的四价灭活疫苗不但解决了ST1肠毒素毒性问题,而且又赋予其免疫原性,同时增加K99菌毛可使免疫效果进一步增强,这样从肠毒素和菌毛两种途径,达到预防由ETEC引起的腹泻目的,从而有效控制腹泻的发生,为将来制备产肠毒素大肠杆菌基因工程灭活疫苗打下坚实基础。
关键词:产肠毒素大肠杆菌;灭活疫苗;融合基因;表达
中图分类号:S859.797文献标志码:A文献标识码
Development of a tetravalent genetically engineered inactivated vaccine against
enterotoxigenic Escherichia coli
XU Chongli1 ,SHE Yuhan1 ,FU Fengyang1 ,SHI Qinhong1 ,XU Chongbo2*
英文作者单位(1 College of Medical Technology, Chongqing Medical and Pharmaceutical College, Chongqing 401331,China;
2 Henry Fok School of Biology and Agriculture, Shaoguan University, Shaoguan,Guangdong 512005,China)
Abstract: Objective The K88ac, K99, LTB and ST1 genes were respectively amplified by PCR and site-directed mutagenesis and the recombinant strain BL21(DE3)(pXKKSL4) was constructed. Enzyme digestion identification and sequence analysis showed that the constructed pXKKSL4 expression vector contained K88ac-K99-3ST1-LTB fusion gene and the reading frame was correct.Method The SDS-PAGE analysis showed that the expression level of the fusion proteins were about 35.72% of total cellular protein. ELISA confirmed that the fusion protein could bind to ST1 monoclonal antibody, LTB, K88ac and K99 antibodies. Result The results of intragastric test of suckling rat showed that the fusion protein had lost the toxicity of natural ST1 enterotoxin. The immune protection test showed that the aluminum hydroxide adjuvant vaccine of strain and crude extract of inclusion body had good immune effect and the immune protection rate was 98% and 96%.Conclusion The above studies indicated that the constructed tetravalent inactivated vaccine not only solved the toxicity problem of ST1 enterotoxin but also gave it immunogenicity. At the same time, K99 pili can further enhance the immune effect.This could prevent diarrhea caused by ETEC through both enterotoxin and fimbrium pathways so as to effectively control the occurrence of diarrhea. It lays a solid foundation for the preparation of enterotoxigenic Escherichia coli genetically engineered inactivated vaccine in the future.
Key words: Enterotoxigenic Escherichia coli;Inactivated vaccine;Fusion gene;Expression
产肠毒素性大肠杆菌(Enterotoxigenic Escherichia coli,ETEC)是一类引起人和幼畜(初生仔猪、犊牛、羔羊及断奶仔猪)腹泻的重要病原菌,初生幼畜被ETEC感染后,常因剧烈水样腹泻和迅速脱水而死亡,发病率和死亡率均很高。ETEC具有两类致病因子:一类为肠毒素,另一类为粘着素(或称定居因子),已知的粘着素主要有K88、K99和K99等。ETEC借助这些粘着素定居于宿主肠道粘膜的上皮细胞上,从而大量繁殖、产生大量肠毒素,由肠毒素造成肠粘膜上皮细胞的病理性变化,导致仔猪黄痢。已知来源于猪的ETEC主要粘着素为K88ac,它是导致仔猪黄痢的间接致泻因子。肠毒素是导致仔猪黄痢的直接致泻因子,包括耐热性肠毒素ST和不耐热肠毒素LT两种。根据抗原性及宿主差异,ST又分为ST1和ST2两类。ST不具有免疫原性。LT由一个分子量为28 kDa的A亚单位结合五个分子量为11.5 kDa的B亚单位组成,全LT或其B亚单位都具有良好的免疫原性。ETEC致病率达到20~40%,死亡率甚至高达30%~50%[1-4]。对于ETEC 引起疾病的治疗以药物和疫苗为主,包括以抗肠毒素免疫为主的的类毒素苗或 LT B 亚单位苗;以抗粘附素免疫为基础的的含单价或多价粘附素抗原的灭活全菌苗或亚单位苗。如何避免该病带来的经济损失成为亟待解决的关键问题。目前最有效的措施是采取免疫预防,然而目前使用的传统灭活疫苗大多数存在固有的缺点,且已有的K88-K99和K88ac-LTB基因工程疫苗并没有解决ST1毒性和免疫原性问题,故而免疫效果并不是十分理想。ST1是引起腹泻最关键的毒素因子,如果不解决这一重要因素达不到有效的预防效果必将带来巨大经济损失[5-7]。为此课题组针对产肠毒素大肠杆菌主要毒力因子粘着素K88ac、K99和肠毒素ST1、LTB构建了重组菌株BL21(DE3)(pXKKSL4),且含有K88ac-K99-3ST1-LTB融合基因的pXKKSL4表达载体能高效表达,这样不但解决了ST1肠毒素毒性问题,而且又赋予其免疫原性,同时增加K99菌毛可使免疫效果进一步增强,这样从肠毒素和菌毛两种途径达到预防由ETEC引起的腹泻目的,从而有效控制腹泻的发生,必将带来巨大的经济效益和社会效益。
1 材料与方法
1.1 载体和菌株
大肠杆菌C83539、C83902、HB101(pSLM004) ST+强毒株和DH5α(pEWD299)LT+、LTB+菌株由中国兽医药品监察所提供;受体菌DH5α和BL21(DE3)、质粒pET-28a和pGEM-T购自TaKaRa公司。
1.2 试剂
T4 DNA连接酶、限制性核酸内切酶、质粒小量提取试剂盒购自TaKaRa公司;卡那霉素,氨苄青霉素、DNA Purification System、PCR克隆试剂盒购自Promega公司;K88ac、K99、ST1和LTB ELISA检测试剂盒购自上海晶抗生物工程有限公司;健康兔血清和羊抗兔酶标二抗购自TaKaRa公司。
1.3 表达质粒pXKKSL4的构建
根据Dykes和许崇波等报道的ST、K88ac、K99和LTB基因序列[8-10]設计了相应引物。为了使ST13端两个半胱氨酸突变为丝氨酸(TGT→AGT)设计了3对定点突变引物,P1,P2(包含HindIII、NdeI酶切位点)、P3,P4(包含NdeI、EcoRI酶切位点)、P5,P6(包含EcoRI、BamHI酶切位点)。K88ac 扩增所需引物分别为P7、P8(包含BglⅡ、NcoI酶切位点)。K99 扩增所需引物分别为P9、P10(包含NcoI、HindIII酶切位点)。LTB扩增所需引物P11、P12(包含BamHI、NotI酶切位点)。上述引物序列见表1。
利用PCR引物P7、P8和P9、P10分别从大肠杆菌C83902和C83539质粒中分别扩增出了330 bp K88ac和393 bp K99基因片段,回收PCR扩增产物,DNA连接酶串联后连接至pGEM-T载体,构建重组质粒pXKK2。利用3对PCR引物P1、P2,P3、P4和P5、P6扩增出3个突变的ST1基因,T4DNA连接酶将其串联构成189bp ST1-ST1-ST1突变基因片段。利用PCR引物P11、P12从大肠杆菌C83902质粒中分别扩增出387 bp LTB基因片段并回收PCR扩增产物。将ST1-ST1-ST1串联突变基因片段与LTB基因片段用DNA连接酶连接并克隆至pGEM-T载体,构建重组质粒pXSL2。BglⅡ、HindIII和HindIII、NotI分别酶切重组质粒pXKK2和pXSL2,回收K88ac-K99和ST1-ST1-ST1-LTB片段,T4DNA连接酶连接串联成K88ac-K99-3ST1-LTB片段。PCR反应体系:1 μL模板,2 μL 5 mmol·L-1 dNTP,2 μL 0.1 mol·L-1引物,5 μL 10×Buffer,1 μL 3 U·μL-1 Taq DNA聚合酶,39 μL ddH2O。PCR扩增程序为预变性 95℃ 5min ,94℃变性30 s,50℃退火30 s,72℃延伸1min,30个循环;72℃延伸5min。pET-28a和PCR扩增产物分别用BglⅡ和NotI酶切后加入T4 DNA连接酶16℃过夜,转化至BL21(DE3) 中,涂布于Kan/LB平板上,筛选出的阳性克隆扩大培养,提取质粒进行酶切鉴定并送至公司进行序列测定。
1.4 重组菌株BL21(DE3)(pXKKSL4)表达产物SDS-PAGE分析
取Kan/LB平板,吸取200 μLBL21(DE3)(pXKKSL4)菌液均匀涂布并放置37℃培养16~18h,挑阳性菌落于含Kan抗性的5 mL液体LB培养基中170 r·min-1,37℃培养过夜。将培养菌液以1%比例接种到250 mL含30μg·mL-1卡那霉素的LB液体培养基中37℃恒温培养,170 r·min-1振摇培养达到对数生长期(OD600=0.4~0.6)后加入IPTG,其终浓度为1mmol·L-1,继续培养4h后收集菌体加入20 mL 50 mmol·L-1 Tris·Cl-2 mmol·L-1 EDTA缓冲液进行洗涤,12 000 r·min-1离心10 min,加入10 mL 10 mmol·L-1 Tris·CL、2 mL Triton X-100和终浓度1 mg·mL-1的溶菌酶,30 ℃孵育15 min,超声波破碎2个10 s,12 000 r·min-1离心15 min收集沉淀进行SDS-PAGE检测[11]。
1.5 K88ac-K99-3ST1-LTB融合蛋白的ELISA检测
吸取BL21(DE3)(pXKKSL4)菌体、阳性对照菌株HB101(pSLM004) ST+、 DH5α(pEWD299)LT+强毒株和阴性对照BL21(DE3)(pET-28a)菌体分别进行超声波破碎,ELISA检测菌体裂解物。。
1.6 重组菌株BL21(DE3)(pXKKSL4)的毒性测定
重组菌BL21(DE3)(pXKKSL4)培养物离心收集上清并对沉淀进行裂解制备包涵体粗提物,按照文献提供方法分别实施乳鼠灌胃试验确定融合蛋白是否具有ST1毒性,当G/C值≥0.09则融合蛋白具有ST1毒性,如G/C值≤0.083则融合蛋白已失去ST1毒性[12]。
1.7 免疫保护试验
BL21(DE3)(pXKKSL4)菌液IPTG诱导4 h后,取50 mL菌液12 000 r·min-1离心10 min,弃上清收集菌体,用5 mL TE (50 mmol·L-1 Tris·Cl,2 mmol·L-1 EDTA)重悬菌体,加入5 mL 1%TritonX-100和终浓度100 μg·mL-1的溶菌酶,30 ℃水浴静置15 min,超声波裂解菌体2个10 s后离心收集沉淀制备包涵体粗提物,将其进行10倍稀释并加入10%氢氧化铝胶制备抗原。另外,用终浓度0.4%甲醛对BL21(DE3)(pXKKSL4)菌液(1.24×1010 CFU·mL-1)进行灭活,加入10%氢氧化铝胶混匀,既可作为免疫用抗原。选取300只18~22g小鼠随机分为6组,每组50只,菌株氢氧化铝佐剂苗和包涵体粗提物氢氧化铝佐剂苗分别进行腹腔免疫接种,第二次免疫间隔14d后进行,二免14 d后进行攻毒试验,两组攻毒剂量分别为1 MLD和2 MLD C83902强毒株。腹腔免疫接种K88-LTB双价苗作为对照,每组50只。
1.8 中和试验
选取6只2~3kg家兔每组2只,每组分别用包涵体粗提物氢氧化铝佐剂苗进行腹腔免疫。第一组免疫20 d后采集血液并分离血清;第二组免疫2次,两次免疫间隔时间为14 d,第2次免疫后第15 d采集血液制备血清;第三组免疫3次,每次免疫间隔时间为14 d,第3次免疫后第10 d采集血液制备血清,上述血清分别进行乳鼠灌胃中和试验。
取Amp/LB平板划线接种HB101(pSLM004)ST+工程菌株,37℃培养过夜并挑取阳性菌落接种于LB肉汤培养基中,37 ℃过夜培养后按照1%比例接种于200mL LB肉汤培养基,培养过夜离心收集上清,用生理盐水稀释10倍备用。取10、12、15、17、20 μL制备的ST1肠毒素,分别用生理盐水稀释至总体积0.1 mL后测定1个鼠活性单位ST1肠毒素。等比例兔血清和1个鼠活性单位的ST1肠毒素加入生理盐水至总体积0.1 mL,37℃培养1 h计算G/C值從而对兔血清抗体的中和效果进行评价。试验组分为3组,每组9只,分别注射 ST1+免疫兔血清并计算G/C值,对照组分为两组,分别注射ST1+生理盐水和ST1+健康兔血清并计算G/C值。当G/C值≥0.09,中和试验为阴性而ST1为阳性;当G/C值≤0.083,中和试验为阳性而ST1则为阴性。
2 结果
2.1 重组质粒pXKK2的构建
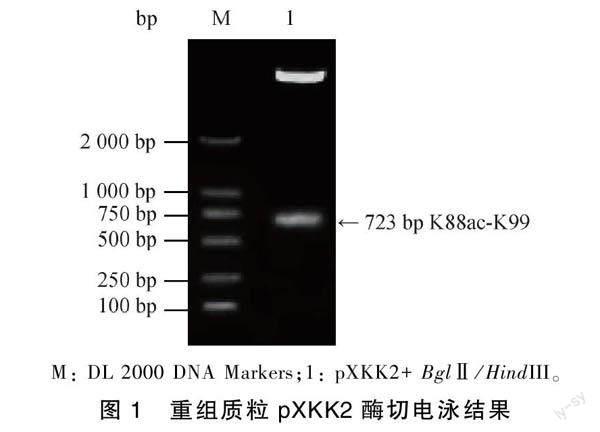
提取大肠杆菌C83539和C83902质粒,利用PCR技术分别扩增出393 bp K99和330 bp K88ac基因片段,T4 DNA连接酶连接PCR扩增产物至pGEM-T载体上构建了重组质粒pXKK2并转化至DH5α受体菌,取Amp/LB平板进行涂布培养过夜后挑取阳性菌落,接种于LB液体培养基扩大培养后利用质粒小量提取试剂盒快速提取质粒并进行1%琼脂糖凝胶电泳。BglⅡ/HindIII双酶切该质粒进行1.2%琼脂糖凝胶电泳,结果表明723 bp K88ac-K99目的基因片段位于位于750 bp与500 bp之间(图1),经DNA序列分析证实,所构建的重组质粒pXKK2中含有K88ac-K99基因,且基因序列和阅读框架均正确。
2.2 重组质粒pXSL2的构建
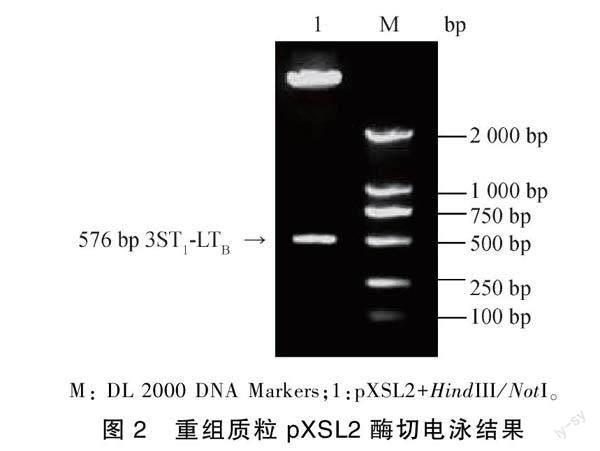
利用定点突变技术以C83902质粒为模板克隆出3 个突变的ST1基因,酶切连接成ST1-ST1-ST1基因片段并与从大肠杆菌C83902质粒中扩增出的LTB基因片段用T4 DNA连接酶克隆至pGEM-T载体,构建重组质粒pXSL2。HindIII/NotI双酶切该质粒经1.2%琼脂糖凝胶电泳,结果表明576 bp ST1-ST1-ST1-LTB目的基因片段位于位于750 bp与500 bp之间(图2),重组质粒pXSL2经测序证实ST1 3′端两个半胱氨酸已突变为丝氨酸(TGT→AGT)
2.3 重组表达质粒pXKKSL4的构建
用BglⅡ、HindIII和HindIII、NotI分别酶切重组质粒并回收K88ac-K99和ST1-ST1-ST1-LTB片段,并用T4DNA连接酶连接串联成K88ac-K99-3ST1-LTB片段,将其插入到BglⅡ/NotI酶切处理的pET-28a中相应酶切位点上,构建了重组质粒pXKKSL4(图3)。BglⅡ/NotI酶切鉴定表明1 299 bp的K88ac-K99-3ST1-LTB融合基因位于1 000~2 000 bp之间,DNA测序证实其基因序列和阅读框架均正确,从而表明构建的重组表达质粒pXKKSL4含有K88ac-K99-3ST1-LTB融合基因(图4)。
2.4 融合蛋白的SDS-PAGE分析和ELISA检测
重组菌株BL21(DE3)(pXKKSL4)用1 mmol/L IPTG 37 ℃诱导4 h后获高效表达,SDS-PAGE分析表明目的蛋白表达量占菌体总蛋白含量的35.72%(图5)。ELISA试剂盒检测表明样品OD值≥ 临界值,表明样品ST1、LTB、K88ac和K99阳性,K88ac-K99-3ST1-LTB融合蛋白能与ST1单抗、LTB、K88ac和K99抗体相结合。
2.5 BL21(DE3)(pXKKSL4)重组菌株毒性试验
为验证BL21(DE3)(pXKKSL4)重组菌株表达的K88ac-K99-ST1-LTB融合蛋白是否丧失ST1肠毒素活性,重组菌BL21(DE3)(pXKKSL4)扩大培养后离心收集上清,菌体沉淀破碎制备包涵体粗提物,二者分别进行乳鼠灌胃试验并计算G/C值,结果均为阴性表明所构建的重组菌株表达K88ac-K99-3ST1-LTB融合蛋白已丧失了ST1肠毒素活性。
2.6 免疫攻毒保护试验
小鼠用菌株氢氧化铝佐剂苗和包涵体粗提物氢氧化铝佐剂苗分别进行免疫,C83539和C83902攻毒后均能得到很好保护。其中包涵體粗提物氢氧化铝佐剂苗免疫组,1 MLD和2 MLD攻毒剂量其免疫保护率分别为96%(48/50)和94%(47/50);菌株氢氧化铝佐剂苗免疫组,1 MLD和2 MLD攻毒剂量其免疫保护率分别为98%(39/50)和96%(48/50),对照组免疫保护率分别为88%(44/50)和82%(41/50)。
2.7 中和试验
不同剂量ST1进行乳鼠灌胃试验从而确定1个鼠活性单位,测得G/C值分别为0.077、0.086、0.095、0.112、0.131,从而确定1个鼠活性单位为15 μL。等比例兔血清和1个鼠活性单位的ST1肠毒素各15 μL混匀后加入生理盐水至总体积0.1 mL,37℃感作1 h进行乳鼠灌胃实验。结果表明试验组三组中和实验均为阳性,G/C值分别为0.072、0.074、0.063,表明K88ac-K99-3ST1-LTB融合蛋白诱发的血清抗体能中和肠毒素ST1毒性,对照组中和实验均为阴性,G/C值分别为0.097、0.108,上述结果证明K88ac-K99-3ST1-LTB融合蛋白具有很好的免疫原性且产生的抗体能中和ST1毒性。
3 讨论
产肠毒素性大肠杆菌(Enterotoxigenic Escherichia coli,ETEC)是导致家畜腹泻最常见的因素,ETEC能分泌肠毒素和粘着素两种致病因子,粘着素主要包括K88、K99、987p、F41和F42等[13-16],ETEC通过粘着素寄居于宿主肠道粘膜的上皮细胞并大量繁殖,产生大量肠毒素导致其发生病理性变化引起腹泻。其中最主要粘着素K88ac是引起腹泻的间接因子。肠毒素引起致腹泻的直接因子,包括耐热性肠毒素ST和不耐热肠毒素LT,其中ST又分为ST1和ST2两种,ST1肠毒素含有6个半胱氨酸残基可形成3对链内二硫键,3对二硫键对ST1生物毒性至关重要,通过定点突变破坏其二硫键从而使ST1失去生物毒性。另外ST不具有免疫原性,但与其他大分子偶联可使其具有免疫原性。LT由A亚单位和B亚单位组成,全LT或单独B亚单位都具有良好的免疫原性[17-18],所以取得高效的免疫预防效果关键是解决ST毒性和免疫原性。
对于由ETEC引起的腹泻,目前主要采取药物进行治疗或者运用全细胞苗及特定菌毛苗进行免疫接种从而预防腹泻,但其治疗和预防效果并不理想,主要是由于当前的疫苗广谱性差及病原菌血清型复杂多样等原因造成的。当前采用的主要预防措施是接种K88-K99、K88ac-LTB双价基因工程苗[19-20],但这些疫苗都没解决最主要的致病因子肠毒素ST1免疫原性和毒性问题,导致其并不能使机体产生很好的预防效果,为此课题组利用基因定点突变技术,分别扩增出突变的ST1基因、K88ac、K99、和LTB基因,并构建了BL21(DE3)(pXKKSL4)重组菌株,且其pXKKSL4表达载体含有K88ac-K99-3ST1-LTB融合基因,同时融合蛋白在受体菌高效表达,表达量占菌体总蛋白含量的35.72%。ELISA检测证实融合蛋白能与ST1单抗、LTB、K88ac和K99抗体相结合。乳鼠灌胃试验证实K88ac-K99-3ST1-LTB融合蛋白已丧失了ST1肠毒素活性。免疫保护试验表明菌株氢氧化铝佐剂苗和包涵体粗提物氢氧化铝佐剂苗均具有良好的免疫效果,1 MLD攻毒剂量菌株氢氧化铝佐剂苗免疫组其免疫保护率分别为98%,1 MLD攻毒剂量包涵体粗提物氢氧化铝佐剂苗免疫组其免疫保护率为96%,而K88-LTB双价苗对照组其免疫保护率为88%,可见构建的K88ac-K99-3ST1-LTB疫苗具有很好的免疫效果。上述研究表明课题组成功构建了针对产肠毒素大肠杆菌的4种主要毒力因子即肠毒素ST1、LTB、K88ac和K99的四价基因工程灭活疫苗候选菌株,不但解决了ST1肠毒素毒性问题,而且又赋予其免疫原性,同时增加K99菌毛可使免疫效果进一步增强,这样从肠毒素和菌毛两种途径,达到预防由ETEC引起的腹泻目的,从而有效控制腹泻的发生,为将来制备产肠毒素大肠杆菌基因工程灭活疫苗打下坚实基础。
参考文献(References)
[1]TALAAT K R, PORTER C K, JAEP K M, et al. Refinement of the CS6-expressing enterotoxigenic Escherichia coli strain B7A human challenge model: A randomized trial[J]. PLoS One, 2020,15(12):e0239888.
[2]ZHAO H, XU Y, LI X, et al. Expression and purification of a recombinant enterotoxin protein using different E.coli host strains and expression vectors[J]. Protein J, 2021,40(2):245-254.
[3]MADHAVAN T P, SAKELLARIS H. Colonization factors of enterotoxigenic Escherichia coli[J]. Adv Appl Microbiol, 2015,90:155-197.
[4]MIRHOSEINI A, AMANI J, NAZARIAN S. Review on pathogenicity mechanism of enterotoxigenic Escherichia coli and vaccines against it[J]. Microb Pathog, 2018,117:162-169.
[5]袁万哲,何孔旺,陆承平.仔猪大肠杆菌病K88K99-987P-F41四价亚单位疫苗制苗株的生物学特性[J].中国兽医科技,2005,35(1):12-15.
YUAN W Z,HE K W,LU C P. Study on biological properties K88-K99-987P-F41 tetravalent subunit vaccine against piglet colibacillosis[J].Chinese Journal of Veterinary Science and Technology, 2005,35(1):12-15.
[6]高跃,于涟,孙立波.大肠杆菌K88-K99抗原工程苗对仔猪黄痢的预防效果[J].中国畜禽传染病,1990,4:18-19.
GAO Y,YU L,SUN L B. Preventive effect of Escherichia coli K88-K99 antigenic engineering vaccine on yellow dysentery of piglets[J].Chinese Journal of Preventive Veterinary,1990,4:18-19.
[7]謝金文,李书光,肖跃强等.基因工程菌K88-K99融合蛋白高密度发酵工艺的初步研究[J].动物医学进展,2015,36(10):43-47.
XIE J W,LI S G,XIAO Y Q,et al. Immune effect of immune complex vaccine of infectious bursal disease in SPF chicks[J]. Progress in Veterinary Medicine,2015,36(10):43-47.
[8]许崇波,卫广森,王文成,等.表达大肠杆菌K88ac-ST1-LTB融合蛋白工程菌株的免疫原性研究[J].中国预防兽医学报,2003,25(1):12-15.
XU CB,WEI G S,WANG W C,et al. Immunogenicity of genetic engineering strain expressing Escherichia coli fimbriac K88ac,heat-stable enterotoxin I and heat-labile enterotoxin B subunit fusion protein[J]. Chinese Journal of Preventive Veterinary,2003,25(1):12-15.
[9]许崇波,卫广森.表达大肠杆菌K88ac-ST1-LTB融合蛋白基因工程菌株的构建[J].生物工程学报,2002, 18(2):216-220.
XU C B,WEI G S. Construction of recombinant strain expressing enterotoxigenic Escherichia coli K88ac-ST1- LTB fusion protein[J].Chinese Journal of Biotechnology,2002,18(2):216-220.
[10]DYKES C W, HALLIDAY I J, READ M J, et al. Nucleotide sequences of four variants of the K88 gene of porcine enterotoxigenic Escherichia coli[J]. Infect Immun, 1985,50(1):279-283.
[11]SAMBROOK J, FRITSCH E F, MANIATIS T. Molecular cloning[M]. 2nd Ed. New York: Cold SpringHarborLaboratory Press, 1989:1-50.
[12]GIANNELLA AR A. Suckling mouse model for detection of heat-stable E.coli enterotoxin: characteristics of the model[J]. Infect Immun, 1976,14(1):95-99.
[13]DUAN Q, PANG S, WU W, et al. A multivalent vaccine candidate targeting enterotoxigenic Escherichia coli fimbriae for broadly protecting against porcine post-weaning diarrhea[J]. Vet Res, 2020,51(1):93.
[14]ZHANG X, YU S, CHENG D, et al. An attenuated Escherichia coli K88ac LT(S63K)ΔSTb efficiently provides protection against enterotoxigenic Escherichia coli in the mouse model[J]. Front Vet Sci, 2021,7:620255.
[15]HUR J, KIM C S, EO S K, et al. Salmonella ghosts expressing enterotoxigenic Escherichia coli k88ab, k88ac, k99, and fasa fimbrial antigens induce robust immune responses in a mouse model[J]. Vet Q, 2015,35(3):125-132.
[16]XIANG Y, WU F, CHAI Y, et al. A new plasmid carrying mphA causes prevalence of azithromycin resistance in enterotoxigenic Escherichia coli serogroup O6[J]. BMC Microbiol, 2020,20(1):247.
[17]LEONARD S R, MAMMEL M K, RASKO D A, et al. Hybrid shiga toxin-producing and enterotoxigenic escherichia sp. Cryptic lineage 1 Strain 7v harbors a hybrid plasmid[J]. Appl Environ Microbiol, 2016,82(14):4309-4319.
[18]SHEPARD S M, DANZEISEN J L, ISAACSON R E, et al. Genome sequences and phylogenetic analysis of K88-and F18-positive porcine enterotoxigenic Escherichia coli[J]. J Bacteriol, 2012,194(2):395-405.
[19]余麗芸,田斌,温丽娟,等. ETEC K99、K88菌毛蛋白抗原表位多肽的设计合成及免疫反应[J].江西农业学报,2013,25(3):88-92.
YU L Y,TIAN B,WEN L J,et al. Design synthesis and immunological reaction of epitope peptides ofETEC K88 and K99 fimbrial protein[J].Acta Agriculturae Jiangxi,2013,25(3):88-92.
[20]葛艳,尤永进,徐泉兴,等. 产肠毒素大肠杆菌肠毒素LTB、STⅠ和STⅡ融合基因的构建与表达研究[J].中国预防兽医学报,2002,24(5):27-29.
GE Y, YOU Y J, XU Q X, et al. Cloning and expressing the fused gene of enerotoxigeric escherichia coli heat labile enterotoxin B subunit heat stabe enterotoxin andⅡ[J]. Chinese Journal of Preventive Veterinary,2002(5):27-29.
(责任编辑:编辑唐慧)
收稿日期:2022-10-22
基金项目:重庆市教育委员会科学技术研究项目(KJZD-K202202803)
作者简介:许崇利(1974—),男,博士,从事微生物分子生物学研究。
*通信作者:许崇波(1968—),男,教授,从事微生物分子生物学研究,e-mail:xcb921@163.com。
