葡萄籽原花青素通过Xc-/GPX4通路拮抗高糖高脂诱导的MIN6细胞铁死亡
2023-11-04王同玲刘丹丹李海燕张丽媛杨瑞瑞陆恒王浩丁玉松
王同玲 刘丹丹 李海燕 张丽媛 杨瑞瑞 陆恒 王浩 丁玉松


摘要:目的 探討葡萄籽原花青素(GSPE)对高脂高糖诱导小鼠胰岛素瘤MIN6细胞损伤的保护作用及可能机制。方法 采用CCK-8法检测细胞活力;Lillie染色检测细胞内亚铁离子(Fe2+);检测谷胱甘肽(GSH),丙二醛(MDA)和超氧化物歧化酶(SOD)含量;荧光探针DCFH-DA标记检测活性氧簇(ROS)水平;Western blot检测铁死亡关键蛋白(GPX4和ACSL4)和Xc-/GPX4信号通路蛋白(SLC7A11、SLC3A2、GSS和GCLM)的表达。结果 高脂高糖处理抑制了MIN6细胞活力,使得Fe2+,MDA含量,ROS水平增加,GSH,SOD含量降低,ACSL4表达水平升高,GPX4以及通路蛋白SLC7A11、SLC3A2、GSS和GCLM表达水平降低。施加不同浓度的GSPE或铁死亡抑制剂ferrostatin-1(Fer-1)干预后,MIN6细胞活力增加,Fe2+,MDA含量,ROS水平,ACSL4表达水平均显著降低,GSH,SOD含量明显升高(P<0.05)。GPX4以及通路蛋白SLC7A11、SLC3A2、GSS和GCLM表达水平显著升高(P<0.05)。结论 GSPE能够通过上调Xc-/GPX4信号通路拮抗MIN6细胞发生铁死亡。
关键词:高糖高脂;MIN6;铁死亡;Xc-/GPX4
中图分类号:中图分类号R285文献标志码:A文献标识码
Grape seed proanthocyanidins exacts antagonize high-glucose and high-fat-induced
ferroptosis in MIN6 cells via the Xc-/GPX4 pathway
WANG Tongling1,LIU Dandan2,LI Haiyan1,ZHANG Liyuan1,YANG Ruirui1,LU Heng1,WANG Hao1,DING Yusong1*
(1 Department of Preventive Medicine, School of Medicine, Shihezi University,Shihezi,Xinjiang 832000, China; 2 Department
of Preventive Medicine, Xinjiang Second Medical College,Karamay,Xinjiang 834000, China)
Abstract: Objective To investigate the protective effect and possible mechanism of grape seed proanthocyanidins (GSPE) on high-fat and high-sugar induced cell injury in mouse insulinoma MIN6 cells. Methods The cell viability was detected by CCK-8 method; intracellular ferrous ions (Fe2+) were detected by Lillie staining; glutathione (GSH), malondialdehyde (MDA) and superoxide dismutase (SOD) contents were detected; reactive oxygen species (ROS) levels were detected by fluorescent probe DCFH-DA labeling; western blot was used to detect iron death key proteins (GPX4 and ACSL4) and Xc-/GPX4 signalling pathway proteins (SLC7A11, SLC3A2, GSS and GCLM) by western blot. Results High-fat and high-sugar treatment inhibited MIN6 cell viability, resulting in increased Fe2+, MDA content, ROS levels, decreased GSH, SOD content, increased ACSL4 expression levels and decreased GPX4 and pathway proteins SLC7A11, SLC3A2, GSS and GCLM expression levels. After the administration of different concentrations of GSPE or the ferroptosis inhibitor ferrostatin-1 (Fer-1), MIN6 cell viability increased, Fe2+, MDA levels, ROS levels, ACSL4 expression levels were significantly reduced, and GSH and SOD levels were significantly increased (P<0.05). GPX4 and pathway proteins SLC7A11, SLC3A2, GSS and GCLM expression levels were significantly increased. SLC3A2, GSS and GCLM expression levels were significantly increased (P<0.05). Conclusion GSPE can antagonize ferroptosis in MIN6 cells through upregulation of the Xc-/GPX4 signaling pathway.
Key words: high glucose and high fat;MIN6;ferroptosis;Xc-/GPX4
糖尿病(Diabetes Mellitus,DM)已经成为一个世界性的公共卫生问题[1],DM患者长期处在糖脂代谢紊乱状态,而长期暴露于高水平的葡萄糖和游离脂肪酸会导致β细胞功能障碍,从而加速DM的发生发展[2]。然而胰岛β细胞死亡的机制尚不明确。流行病学研究报告指出过量的铁储存与DM发展显著关联。铁对胰岛β细胞的毒性,可能是由于Fe2+使线粒体膜电位去极化,导致电子传递链破坏,产生ROS,导致胰岛素合成和分泌减少[3],最终导致胰岛β细胞功能障碍。而过量的铁离子会导致细胞发生一种独特的铁依赖性的细胞死亡方式——铁死亡[4]。
铁死亡最重要的特征是亚铁离子(Fe2+)浓度增加以及通过芬顿反应产生过量ROS导致细胞发生脂质过氧化,Xcˉ/GPX4是一种重要的抗氧化系统,也是铁死亡主要的发生途径之一,Xcˉ系统是由机体细胞膜上轻链亚基(Solute Carrier Family 7,Member 11,SLC7A11)和重链亚基(Solute Carrier Family 3,Member 2,SLC3A2)两个亚基组成[5],谷胱甘肽过氧化物酶4(glutathione peroxidase 4,GPX4)利用GSH将脂质过氧化物还原,GSH主要由谷氨酸-半胱氨酸连接酶(glutamate cysteine ligase,modifier subunit,GCLM)和谷胱甘肽合成酶(Glutathionesynthetase,GSS)催化,当Xcˉ系统被抑制时,GSH合成降低,导致GPX4不能利用GSH,进而引发铁死亡。
目前几乎没有文献关注DM发病机制和胰岛β细胞铁死亡之间的联系。而多酚作为植物来源的生物活性化合物,已被用于治疗由铁过载引起的细胞功能障碍[6]。原花青素作为一种多酚类化合物,可抵抗自由基和氧化应激,是一种强有力的铁螯合剂和抗氧化剂,可以通过抑制受损部位微环境下的铁死亡促进细胞修复[7]。然而到目前为止,原花青素对胰岛β细胞的潜在抗糖尿病作用机制尚未被探索。因此本研究以MIN6为实验对象,利用高浓度葡萄糖联合高浓度棕榈酸钠(high Glucose and high Sodium Palmitate,GP)模拟2型糖尿病的病理特征,建立胰岛β细胞体外损伤模型,以铁死亡为切入点,探讨葡萄籽原花青素(Grape seed proanthocyanidin extracts,GSPE)對高糖、高脂诱导胰岛β细胞死亡的抑制作用,旨在为DM的防治提供新的思路。
1 材料与方法
1.1 主要药物和试剂
小鼠胰岛瘤细胞(MIN6细胞)购自上海富衡生物科技有限公司,胎牛血清和1640培养基购自美国 Gibco 公司,CCK8试剂盒购自北京博奥拓达科技有限公司,GSH、MDA、SOD试剂盒、DCFH-DA 探针和Lillie染色检测试剂盒购自南京建成生物工程研究所,铁死亡抑制剂ferrostatin-1(Fer-1)购自美国MedChemexpress公司,GPX4,酰基辅酶A合成酶长链家族成员4(acyl-CoA synthetase long chain family member 4,ACSL4),SLC7A11和GCLM单克隆抗体购自Abcam,SLC3A2)克隆抗体和GSS单克隆抗体购自武汉三鹰生物技术有限公司。鼠抗β-actin购自武汉博士得生物工程有限公司。羊抗兔IgG,羊抗鼠IgG购自北京中杉金桥生物技术有限公司。高葡萄糖(high Glucose,HG)和棕榈酸钠(Sodium Palmitate,SP)购自西安鲲创科技有限公司,葡萄籽原花青素标准品(GSPE)购自北京索莱宝科技有限公司。
1.2 细胞培养
将胰岛MIN6细胞培养于1640完全培养基(每50mL的完全培养基含有10mL胎牛血清;500μL青霉素-链霉素和50μL巯基乙醇)。将培养瓶置于培养箱(37 ℃,5% CO2)中24h后观察细胞数量与形态。选取对数生长期的细胞进行后续实验。
1.3 实验分组
将对数生长期的MIN6胰岛细胞接种于6孔板中,每孔培养7×105个24h后,设为6组:1)Control:完全培养基培养继续培养;2)GP:HG 25mmol·L-1+SP 200 μmol·L-1;3)L-GSPE:HG 25 mmol·L-1+SP 200 μmol·L-1+GSPE 10mg·L-1;4)M-GSPE:HG 25mmol·L-1+SP 200 μmol·L-1+GSPE 20mg·L-1;5)H-GSPE组:HG 25mmol·L-1+SP 200 μmol·L-1+GSPE 30 mg·L-1;6)Fer-1:HG 25mmol·L-1+SP 200 μmol·L-1+Fer-1 1 μmol·L-1。
1.4 CCK8法检测细胞活力
将对数生长期的MIN6胰岛细胞按7×103个·孔-1细胞接种于96孔板中,每组设置5个复孔,培养24h后,各组施加不同的实验处理后,弃上清,每孔加90μL的完全培养基和10μL的CCK8溶液,再次在培养箱中孵育1.5h后,于酶标仪495nm波长处测定吸光度,计算细胞活力。
1.5 GSH,MDA,SOD的检测
GSH含量测定采用微量酶标法,MDA含量测定采用硫代巴比妥酸法,SOD活力测定采用WST-1法。具体操作见试剂盒说明书。
1.6 ROS水平测定
采用DCFH-DA (10 μmol·L-1)法测定细胞 ROS 水平。将MIN6细胞以每孔1×105个细胞的密度接种于6孔板中。处理后的细胞与分子探针(1μmol·L-1)在37℃下孵育30min,然后用PBS冲洗3次。使用荧光显微镜收集细胞的所有荧光图像(×400),用ImageJ用于分析所有的图像。
1.7 细胞中Fe2+ 含量测定
使用Lillie染色检测试剂盒检测细胞二价铁,根据制造商的说明,将处理后的细胞在染色溶液A中37℃孵育30min,然后用核染色溶液B染色2min,最后使用PBS冲洗3遍。使用荧光显微镜收集各组细胞的荧光图像(×400),用ImageJ分析所有的图像。
1.8 倒置相差显微镜观察细胞形态学
将细胞以每孔1×105个细胞的密度接种于6孔板中,置于培养箱(37℃、5 % CO2)中培养24h;待细胞贴壁后施加不同处理继续培养24 h。采用倒置相差显微镜观察细胞形态学的变化并收集图像(×200)。
1.9 碘化丙啶(PI)染色
将细胞以每孔1×105个的密度接种于6孔板中,在37℃的PI染色液培养箱中孵育20~30 min,然后用PBS冲洗3次。最后使用荧光显微镜收集所有细胞的荧光图像(×200)。
1.10 Western blotting 实验检测铁死亡相关蛋白
将六孔板中加入预冷的PBS洗涤1次,然后每孔加入130μL的RIPA裂解液,在冰上裂解30 min后,收集细胞,离心25 min(4℃、12000g)收集上清,使用BCA试剂盒测定总蛋白含量,进行蛋白浓度的配平,然后加入总体积1/4的5×上样缓冲液,置于100℃金属浴煮10 min。每孔加入等量总蛋白样品使用SDS-PAGE分离样品,并转移到PVDF膜上。5%脱脂奶粉常温下封闭2h,TBST漂洗3次。分别使用稀释过的Ⅰ抗4℃孵育过夜。TBST洗涤3次。加入相应的Ⅱ抗室温孵育2h。TBST洗涤3次,最后使用ECL化学发光法检测所有蛋白的相对表达量。
1.11 统计分析
数据用X-±S表示。数据分析采用统计软件SPSS20.0。采用单因素方差分析或t检验对数据进行统计学检验。所有统计检验均采用P<0.05,认为有统计学意义。
2 结果
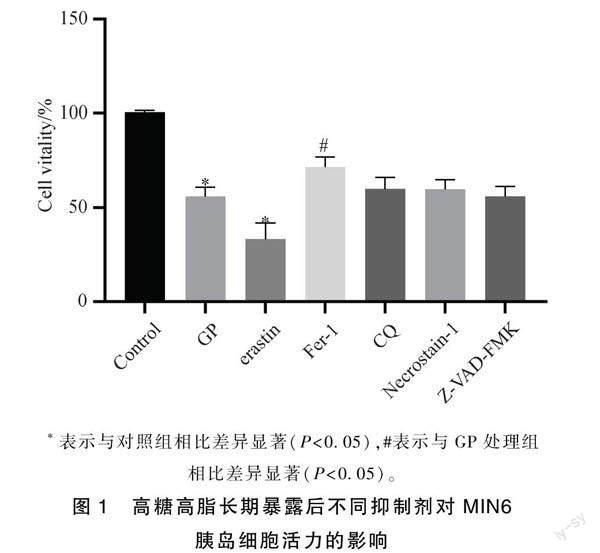
2.1 高糖高脂造成的MIN6细胞损伤中存在铁死亡
由图1可知,GP即高糖高脂组(HG 25 mmol·L-1+SP 200 μmol·L-1)作用于MIN6胰岛β细胞24h,细胞活力为55.74%,与对照组相比差异显著(P<0.05)而铁死亡诱导剂erastin在GP的基礎上作用于MIN6胰岛β细胞24h,细胞活力下降为33.08%,相比对照组细胞活力明显下降(P<0.05)。表明erastin诱导MIN6胰岛β细胞发生了铁死亡,进一步加剧了高糖高脂对细胞的损伤。在GP处理的基础上,再给予MIN6胰岛β细胞铁死亡抑制剂Fer-1,自噬抑制剂CQ,坏死抑制剂Necrostatin-1,和凋亡抑制剂Z-VAD-FMK处理24h后,细胞活力分别上升71.39%,59.71%,59.45%和55.73%。而铁死亡抑制剂Fer-1对细胞活力的改善效果优于其他抑制剂组,与对照组相比差异具有统计学意义(P<0.05),说明铁死亡在高糖高脂造成的MIN6胰岛β细胞的功能损伤中扮演着至关重要的作用。
2.2 Fer-1对高糖、高脂诱导的MIN6胰岛β细胞中氧化指标MDA,SOD,GSH的影响
经 GP处理24h后,与对照组相比,MIN6细胞内 GSH 含量和 SOD 活力显著降低(P<0. 05);MDA含量显著上升(P<0. 05),加入 Fer-1 处理后,与GP相比,细胞内 GSH 含量和 SOD 活力显著升高,同时MDA含量明显降低(P<0. 05),见图2。
2.3 Fer-1对高糖、高脂诱导的MIN6胰岛β细胞中Fe2+的影响
Fer-1对高糖、高脂诱导的MIN6胰岛β细胞中Fe2+的影响结果见图3。
用Lillie试剂盒检测细胞内Fe2+含量,由图3可知,经 GP处理24h后,与对照组相比,GP组MIN6 细胞内 Fe2+水平明显升高(P<0. 05);加入 Fer-1处理后得到改善,与GP相比,细胞内Fe2+水平明显降低(P<0. 05)。
2.4 Fer-1对高糖、高脂诱导的MIN6胰岛β细胞中ROS水平的影响
DCFH-DA荧光探针检测MIN6细胞内ROS含量的变化,图4 可知荧光显微镜结果显示,细胞经GP处理24h后,GP组荧光强度与对照组相比明显增强,表明GP组 ROS的含量明显高于正常组(P<0. 05);经过 Fer-1处理,与GP相比,荧光强度明显降低(P<0. 05),表明ROS的积累水平明显降低。
2.5 GSPE通过抑制铁死亡保护高糖高脂诱导的MIN6细胞功能损伤
为了观察GSPE对高糖高脂诱导的细胞损伤的保护作用,本次实验检测了不同浓度的GSPE对高糖高脂造成的细胞活力的影响。
图5结果表明,不同浓度GSPE处理后,MIN6细胞死亡数量显著降低,细胞活力得到明显改善(P<0. 05)。改善效果呈明显的剂量效应关系,高剂量GSPE改善效果优于Fer-1处理组(P<0. 05)。接下来,评估了MIN6细胞所表现出的形态学变化,在正常条件下培养的MIN6细胞呈多边形,与其他细胞紧密相连。经高糖、高脂处理后,细胞形状更不规则,尖端突出,贴壁细胞数量减少,细胞附着松散,呈圆形,与铁死亡的形态学特征相似。GSPE和Fer-1处理效果相同;死亡细胞粘附减少,贴壁细胞数量增加,细胞恢复正常形态(图6)。由图6 PI染色结果可知,对照组发生死亡的细胞数量明显低于GP处理组。
2.6 GSPE和Fer-1对高糖、高脂诱导的MIN6胰岛β细胞中铁死亡关键蛋白ACSL4和GPX4蛋白表达的影响
由图7可知,在长期暴露于高糖、高脂的MIN6胰岛细胞中铁死亡关键蛋白ACSL4表达水平显著上调(P<0.05),GPX4表达水平显著下调(P<0.05),而GSPE干预后显著改善了这两个关键性蛋白的表达水平(P<0.05),改善程度近似与Fer-1组。结果表明GSPE可能通过抑制细胞发生铁死亡来改善MIN6胰岛细胞功能。
2.7 GSPE通过激活Xc-/GPX4信号通路来保护高糖高脂诱导的MIN6细胞铁死亡
Xc-/GPX4信号通路在铁死亡调控中发挥重要作用。为了确定GSPE对高糖高脂诱导的铁死亡是否通过激活Xc-/GPX4通路来实现,本次实验评估了SLC7A11、SLC3A2、GSS和GCLM在MIN6细胞的表达。如图8所示,与对照组相比,GP组MIN6细胞中的SLC7A11、SLC3A2、GSS和GCLM水平均低于对照组。这些结果表明,Xc-/GPX4通路可能参与了高糖高脂诱导的铁死亡。施加不同剂量的GSPE处理提高了SLC7A11、SLC3A2、GSS和GCLM的表达水平,改善效果近似与Fer-1处理组。表明GSPE对MIN6细胞的保护作用至少部分是通过激活Xc-/GPX4信号通路实现的。
3 讨论
DM是目前面临的最严重的全球健康问题之一,是一种以血糖水平升高为特征的进行性代谢综合征,目前认为DM的发病机制主要是胰岛β细胞功能受损,而由DM诱发的糖脂代谢紊乱又是胰岛β细胞功能受损的主要诱因[8]。目前研究认为铁死亡主要涉及到两个方面。一是谷胱甘肽(GSH) 的消耗,二是谷胱甘肽过氧化物酶4(GPX4) 的活性降低[9]。GPX4 能够降解脂质过氧化物,在铁死亡发生过程中对保护细胞免受氧化损伤起到关键作用。由于GSH是GPX4酶分解过氧化物过程中至关重要的辅助因子,降低GSH的含量,会导致GPX4的酶活性显著降低,使得细胞清除脂质过氧化物的能力下降。最终引起细胞膜氧化损伤,使得膜结构和功能的紊乱,诱导细胞发生铁死亡[10]。迄今为止,只有少数研究探索了DM和铁死亡之间的联系,而没有关于铁死亡在高糖高脂诱导的胰岛β细胞功能损伤中的作用的报道。目前的研究表明铁死亡与糖脂毒性诱导的胰腺损伤中β细胞死亡有关。植物性食物在降血糖和DM防治中发挥着重要作用。植物性食物中的多酚类物质作为植物性化合物可能通过充当铁螯合剂减少GSH消耗,GPX4失活和脂质过氧化进而抑制了MIN6细胞中的铁蓄积和铁死亡[11]。GSPE作为一种多酚类化合物,其抗氧化能力与其铁螯合功能密切相关[6],通过减轻细胞铁死亡从而促进细胞功能的改善。此外,GSPE逆转了铁死亡的关键指标:GPX4和ACSL4的表达变化,并增加了Xc-/GPX4通路相关蛋白的表达。结果表明,GSPE激活Xc-/GPX4信号通路,拮抗糖脂毒性诱导的氧化损伤,抑制β细胞的铁死亡。
GPX4是预防铁死亡的主要酶。有证据表明,产生胰岛素的细胞易受铁死亡的影响,除非它们受到GPX4的保护[12]。近年来,越来越多的证据表明,过量的铁也是引发铁死亡的关键因素[4]。而铁超载是DM的一个重要危险因素[13];ACSL4是参与代谢相关疾病的关键因素[14]。研究表明[15]ACSL4和GPX4被认为是调节铁死亡的主要成分。ACSL4被认为是铁死亡的重要调控因子,而ACSL4的过表达促进了铁死亡的发生发展[16]。因此,本研究选用高糖高脂刺激小鼠胰岛β细胞株MIN6细胞,建立细胞受损的体外模型。探究铁死亡在其中扮演的作用以及GSPE对MIN6细胞活性的影響。研究结果发现高糖高脂会造成细胞活性下降。铁死亡是由于细胞内脂质过氧化水平明显升高,而引发细胞发生的一种不同于其他类型的细胞死亡形式[17]。MDA作为反映机体脂质氧化损伤程度的敏感性重要指标,而SOD是抗氧化防御系统的重要组成部分之一,能直观反应细胞抗氧化能力和过氧化水平[18]。GSH在维持细胞内氧化还原平衡,减少氧化应激,减轻铁死亡中发挥着不可或缺的作用[19]。本实验结果显示高糖高脂造成MDA含量明显升高,SOD活力和GSH含量明显降低,在加入Fer-1后,MDA、GSH和SOD活力发生显著改善,基本恢复正常水平。结果说明铁死亡抑制剂Fer-1对高糖高脂造成的细胞损伤有一定的保护作用。由过量的Fe2+介导芬顿反应会引起ROS积累,进而加速铁死亡的进程。本次实验对细胞内Fe2+和ROS水平也进行了检测。结果显示高糖高脂不仅会引起铁死亡关键蛋白的变化,也会导致Fe2+和ROS水平升高。
Xc-/GPX4通路上的Xc-系统是细胞膜上控制胱氨酸和谷氨酸进出的主要通道,包括轻链亚基(xCT,SLC7A11)和重链亚基(CD98hc,SLC3A2)两个亚基组,其中SLC7A11在GSH的合成尤为重要,当SLC7A11的表达受到抑制时,会显著减少细胞对胱氨酸的摄取,导致细胞抗氧化系统紊乱,进一步增加细胞对铁死亡的敏感性。在铁死亡中也可以通过调控Xc-/GPX4通路中关键物质 GSS、GCLM等来调控下游GSH的含量进而抑制ROS水平从而减缓铁死亡的发生。本实验用Western blot结果验证Xc-/GPX4通路的关键蛋白表达水平,结果显示高糖高脂组的蛋白表达水平有下降趋势,在施加GSPE干预后,蛋白表达水平明显上升,且高浓度GSPE作用效果与Fer-1组相似。
综上所述,GSPE作为一种铁螯合剂和抗氧化剂,改善细胞活性可能是通过抑制细胞发生铁死亡来实现。其机制可能是GSPE通过激活Xc-/GPX4信号通路来抑制铁死亡,从而减少DM中β细胞损伤和功能障碍。本研究为DM的防治以及植物化学物在DM中发挥的作用提供了一定的参考依据。
参考文献(References)
[1]SUN H, SAEEDI P, KARURANGA S, et al. IDF Diabetes Atlas: Global, regional and country-level diabetes prevalence estimates for 2021 and projections for 2045[J]. Diabetes Res Clin Pract, 2022, 183: 109119.
[2]ESCALADA J, OROZCO-BELTRAN D, MORILLAS C, et al. Attitudes towards insulin initiation in type 2 diabetes patients among healthcare providers: A survey research[J]. Diabetes Res Clin Pract, 2016, 122: 46-53.
[3]GERENCSER A A. Metabolic activation-driven mitochondrial hyperpolarization predicts insulin secretion in human pancreatic beta-cells[J]. Biochimica et Biophysica Acta (BBA)-Bioenergetics, 2018, 1859: S999147256X.
[4]DIXON S J, LEMBERG K M, LAMPRECHT M R, et al. Ferroptosis: an iron-dependent form of nonapoptotic cell death[J]. Cell, 2012, 149(5): 1060-1072.
[5]ZHANG L, LIU W, LIU F, et al. IMCA induces ferroptosis mediated by SLC7A11 through the AMPK/mTOR pathway in colorectal cancer[J]. Oxid Med Cell Longev, 2020, 2020: 1675613.
[6]TUGBA, KOSE, MAYRA, et al. Curcumin and (-)- epigallocatechin-3-gallate protect murine MIN6 pancreatic beta-cells against iron toxicity and erastin-induced ferroptosis.[J]. Pharmaceuticals, 2019, 12(1): 26.
[7]ZHOU H, YIN C, ZHANG Z, et al. Proanthocyanidin promotes functional recovery of spinal cord injury via inhibiting ferroptosis[J]. Journal of Chemical Neuroanatomy, 2020, 107: 101807.
[8]JIA X, QIU T, YAO X, et al. Arsenic induces hepatic insulin resistance via mtROS-NLRP3 inflammasome pathway[J]. Journal of Hazardous Materials, 2020, 399: 123034.
[9]GALLUZZI L, VITALE I, AARONSON S A, et al. Molecular mechanisms of cell death: recommendations of the nomenclature committee on cell death 2018[J]. Cell Death Differ, 2018, 25(3): 486-541.
[10]LI T, LIU X, LE J, et al. Loss of p53-mediated cell-cycle arrest, senescence and apoptosis promotes genomic instability and premature aging[J]. Oncotarget, 2016, 7(11): 11838-11849.
[11]LI D, JIANG C, MEI G, et al. Quercetin alleviates ferroptosis of pancreatic beta cells in type 2 diabetes[J]. Nutrients, 2020, 12(10): 2954.
[12]KRUMMEL B, PLOTZ T, JORNS A, et al. The central role of glutathione peroxidase 4 in the regulation of ferroptosis and its implications for pro-inflammatory cytokine-mediated beta-cell death[J]. Biochim Biophys Acta Mol Basis Dis, 2021, 1867(6): 166114.
[13]CHEN L, LI Y, ZHANG F, et al. Elevated serum ferritin concentration is associated with incident type 2 diabetes mellitus in a Chinese population: A prospective cohort study[J]. Diabets Research and Clinical Practice, 2018, 139: 155-162.
[14]KILLION E A, REEVES A R, EL AZZOUNY M A, et al. A role for long-chain acyl-CoA synthetase-4 (ACSL4) in diet-induced phospholipid remodeling and obesity-associated adipocyte dysfunction[J]. Molecular Metabolism, 2018, 9: 43-56.
[15]DOLL S, CONRAD M. Iron and ferroptosis: a still ill-defined liaison[J]. Iubmb Life, 2017, 69(6): 423-434.
[16]KAGAN V E, MAO G W, QU F, et al. Oxidized arachidonic and adrenic PEs navigate cells to ferroptosis[J]. Nature Chemical Biology, 2017, 13(1): 81-90.
[17]LUO E F, LI H X, QIN Y H, et al. Role of ferroptosis in the process of diabetes-induced endothelial dysfunction[J]. World J Diabetes, 2021, 12(2): 124-137.
[18]QI J, KIM J W, ZHOU Z, et al. Ferroptosis affects the progression of nonalcoholic steatohepatitis via the modulation of lipid peroxidation-mediated cell death in mice[J]. Am J Pathol, 2020, 190(1): 68-81.
[19]KOPPULA P, ZHANG Y, ZHUANG L, et al. Amino acid transporter SLC7A11/xCT at the crossroads of regulating redox homeostasis and nutrient dependency of cancer[J]. Cancer Commun (Lond), 2018, 38(1): 12.
(責任编辑:编辑唐慧)
收稿日期:中文收稿日期2022-01-11
基金项目:中国博士后科学基金项目(2017M613310XB);石河子大学科研项目(ZZZC201704A)
作者简介:王同玲(1994—),女,硕士研究生,专业方向为天然产物对糖尿病的影响及其机制。
*通信作者:丁玉松(1979—),男,副教授,从事天然产物对糖尿病的影响及其机制,e-mail: 51603030@qq.com。
