对酯化反应机理的再认识
2023-11-03郭志强王红轩黄素兰
郭志强 王红轩 黄素兰


摘要: 酯化反应是羰基衍生物的重要反应之一,是中学阶段重要的基础反应,反应过程复杂且具有可逆性。鉴于中学教学中用“酸脱羟基、醇脱氢”这一口诀简单概括酯化反应机理的片面性,通过详细阐述酯化反应中的“加成-消除机理”、“碳正离子机理”、“酰基正离子机理”三种典型的酯化反应机理,帮助中学教师通过认识物质结构来认识酯化反应各种机理的本质,并建议在有机反应的教学中适当渗透一些简单的有机反应机理,引领学生更多地关注物质的结构以理解有机反应的本质。
关键词: 酯化反应; 反应机理; 化学教学; 有机化学
文章编号: 1005-6629(2023)09-0093-04 中图分类号: G633.8 文献标识码: B
有机反应机理是有机化学结构理论的重要组成部分,但《普通高中化学课程标准(2017年版2020年修订)》(以下简称“新课标”)在“有机化学基础”模块对反应机理未做要求,因此教师在教学中,往往回避了有机反应中的机理问题,使得学生缺乏对有机反应本质的认识,造成面对一些复杂的有机反应时,没有系统的分析方法,只能利用死记硬背的知识进行分析,因此不利于学生核心素养的发展。白建娥认为,在高中有机化学教学中酌情渗透一些反应机理非但没有违背新课标理念,还体现了化学学习领域的特点和与大学化学课程的关联性,保持了课程的持续性和一贯性[1]。
1 关于酯化反应的教学现状
酯化反应是羰基衍生物的重要反应之一,反应过程复杂且具有可逆性,是中学阶段研究有机化学重要的基础反应。人教版2019化学必修第二册给出乙酸和乙醇在浓硫酸的催化作用下可以发生酯化反应,生成乙酸乙酯和水,不要求知道断键位置[2];人教版2020化学选择性必修3有机化学基础使用同位素示踪法,证实乙酸与乙醇的酯化反应是乙酸分子中羧基的羟基与乙醇分子中羟基的氢原子结合成水,其余部分相互结合成酯[3],据此中学教师总结出酯化反应的断键口诀为“酸脱羟基、醇脱氢”,方便学生记忆和理解。
刘帅对同位素示踪法研究酯化反应机理提出疑问[4],通过机理分析明确“酸脱羟基、醇脱氢”机理的不准确性。但该文只提到了酯化反应中常见的一种机理,笔者认为,酯化反应的情况比较复杂,断键方式与酸和醇的结构等因素有很大的关系,仅以乙酸和乙醇的酯化反应进行类比欠妥,甚至会出现科学性的错误。如果将不同类型的酯化反应机理进行梳理,并与教材中同位素示踪法进行比对,有助于中学教师及学生更全面、系统地理解酯化反应,并能更深层次地体会结构对于有机物性质的决定性影响。
2 酯化反应机理的分析
酯化反应由于反应底物结构的不同,中间体稳定性差异较大,如果仅以“酸脱羟基、醇脱氢”来简单地进行学习和记忆,并不利于学生对酯化反应复杂性的认识和理解,甚至很可能出现错误。酯化反应常见的机理有加成-消除机理、碳正离子机理、酰基正离子机理[5]等几种,下面进行具体说明。
2.1 加成-消除机理
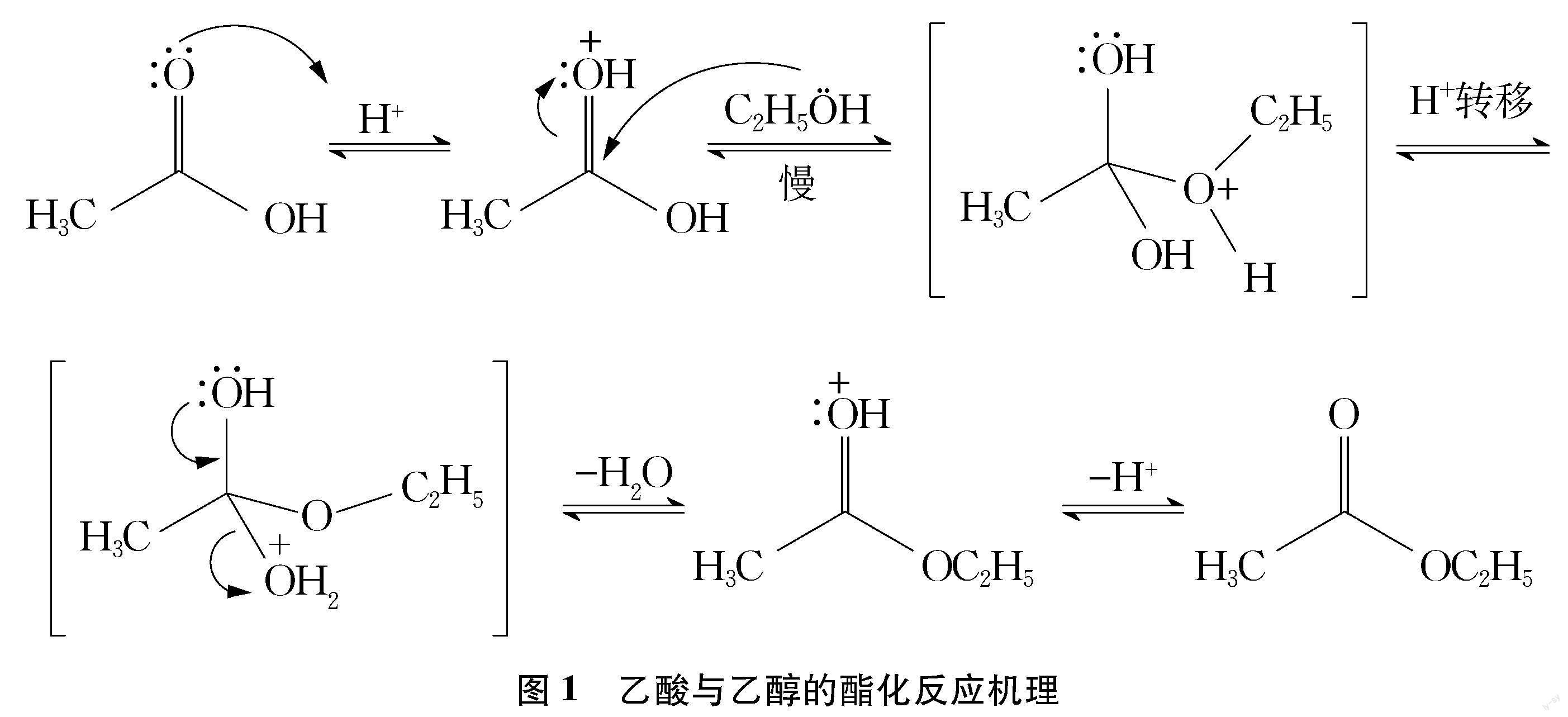
这是酯化反应最常见的机理,乙酸和乙醇的反应就符合该机理,具体见图1。
从图1的反应机理可知,乙酸和乙醇的酯化反应不是一步完成的,它要经过质子化、亲核加成、质子转移、消除水和去质子五个步骤。第一步,由于羰基氧原子的电负性较大,氧上的孤电子对有一定碱性(Lewis碱),在酸性环境中易与溶液中的氢离子结合而发生质子化。第二步,由于质子化的羰基氧吸引电子能力更强,使羰基具有更强的极性,从而使得羰基碳原子的电子云密度降低,正电性更突出,容易受到醇羟基氧原子孤电子对的亲核进攻,发生亲核加成反应,形成一个四面体中间体,该步是反应的决速步(慢反应)。第三步,发生质子转移,将氢离子转移到其中一个羟基上,使其变为一个好的离去基团。第四步,在另一个羟基氧的孤电子对的助推下,消除水分子。第五步,离去质子,得到主要产物乙酸乙酯。
大多数的酯化反应都是按照上述的机理实现,总的结果形式上是亲核试剂(醇)取代了羧酸羰基碳上的羟基,所以称此类反应为酰基碳上的亲核取代,这也是中学教师“酸脱羟基、醇脱氢”口诀的由来。但从机理中能清楚地认识到,脱去水分子的氧原子确实来自于羧酸,但由于羧酸中的羰基氧原子在加成那一步也变成羟基,在四面体中间体中,这两个羟基无法区分,所以在第四步消除水分子那一步中,可以确认水中的氧原子来自羧酸,但具体是羧酸中的羟基氧原子还是羰基氧原子,无法得知,如果同位素示踪原子标记到羧酸的羰基氧上,则在产物水中也会检测到示踪原子,所以“酸脱羟基、醇脱氢”的描述就有不妥,因为从概率角度来说产物水中有一半的氧原子来自羧酸的羰基氧。
2.2 碳正离子机理
当参与酯化反应的醇为三级醇{醇羟基的α位碳上连接3个烃基,如叔丁醇[(CH3)3COH]}时,分子空间位阻较大,与羧酸发生酯化反应时,若与质子化的羧酸发生加成反应形成四面体中间体,反应的活化能会很高,故难以按照加成-消除机理实现酯化反应。
由于三级碳正离子的中心碳原子为sp2杂化,与成键的三个烃基碳原子处于同一平面,烃基的碳氢键能与中心碳原子的空p轨道发生微弱的超共轭作用,从而使碳正离子稳定,因而三级醇在酸性环境中能够质子化并脱水得到活性中间体碳正离子,这类醇发生酯化反应的机理是醇转化为碳正离子而实现的,具体机理见图2。
这类酯化反应经过质子化、脱水、亲核进攻和去质子四个步骤。第一步,三级醇首先質子化,将羟基变为一个好的离去基团。第二步脱去水分子,得到较稳定的三级碳正离子,该步是反应的决速步(慢反应)。第三步,羧酸中电子云密度相对较大的羰基氧原子对碳正离子进行亲核进攻。第四步脱去质子得到对应的酯。
从图2的机理不难得出,这一类酯化反应脱去的水分子中,氧原子来自醇羟基,而羧酸在反应中仅仅是失去了氢原子,故若用“酸脱羟基、醇脱氢”生搬硬套此类反应,则出现了科学性的错误。
2.3 酰基正离子机理
对于另外一些结构特殊的羧酸如2,4,6-三甲基苯甲酸,因为其空间位阻较大,醇分子很难接近羧酸的羰
基,所以也难以按照加成-消除机理发生酯化反应。在该条件下,2,4,6-三甲基苯甲酸的羟基脱水后所形成的酰基碳正离子的中心碳原子是sp杂化的,碳氧键与苯环共平面,酰基正离子通过与苯环的共轭作用而被稳定,从而按照酰基正离子机理实现酯化反应,具体机理见图3。
该反应过程有质子化、脱水、亲核进攻和去质子等几步。第一步,羧酸的羰基氧在硫酸中发生羰基质子化,得到两个完全等价的羟基。第二步,通过氢离子转移并脱水形成较稳定的酰基碳正离子中间体,该步是反应的决速步(慢反应)。第三步,醇羟基氧原子的孤电子对亲核进攻酰基碳正离子。第四步,脱去质子得到相应的酯。
从图3机理可知,反应脱去水分子时,水中的氧原子虽可确认来自于羧酸,但具体是羧酸中羟基氧原子还是羰基氧原子,依然无法得知,所以和加成-消除机理类似,“酸脱羟基、醇脱氢”的描述依然不妥。
此外,酯化反应还有其他的几种已经被证明的反应机理[6],这里不再赘述。
3 酯化反应机理多样性的原因及教学建议
从以上内容可看出,酯化反应的方程式写起来虽然容易,但其反应机理复杂且多样,断键位置不尽相同。究其原因,当然是因为反应物的结构不同导致的。虽然同为羧酸和醇的反应,由于反应物结构不同,将导致整个反应在决速步中的关键中间体的结构差异很大,比如上文在不同机理中提到的四面体中间体、碳正离子中间体、酰基正离子中间体等,不同结构的中间体稳定性各有差异,生成这些中间体对应的活化能也必然不同,因此导致在反应过程中选择结构最合理的反应机理,这是酯化反应表现出多样的反应机理的根本原因。相对于反应物的结构,哪种中间体的结构更稳定,反应就会按哪种机理作为主反应。当然,如果几种中间体的稳定性相差不大,则该反应必然是多种机理混合的反应。
通过以上的分析,笔者认为,教材对这部分内容的描述不是很严谨,容易产生误导,使教师和学生仅通过乙酸和乙醇的酯化反应的同位素示踪法,就将该反应的断键方式推广至一般的酯化反应。上文提到的酯化反应的几种机理中,“酸脱羟基、醇脱氢”的描述均不妥当,甚至对于部分酯化反应来说还存在科学性的问题,故在进行酯化反应相关教学时,笔者认为不必提出“酸脱羟基、醇脱氢”这样的口诀来帮助学生记忆。羧基(-COOH)和醇羟基(-OH)两种官能团并不是很复杂,键的极性很好判断,学生很容易得出反应发生在两个羟基之间,生成水和酯,并能正确书写化学方程式。而对于具体反应的断键位置,中学阶段不可能详细地阐述反应机理,故可按如下步骤进行处理:首先,羧基和醇羟基两种官能团均有断羟基或氢的可能性。其次,通过对醇羟基的氧原子进行同位素标记,判断出醇的断键位置。再次,若醇在反应中断氧氢键,则产物水中的氧必定来自于羧酸,但无法具体判断是羧基官能团中的羰基氧原子还是羟基氧原子(具体的机理教师可适当进行板书演示或者课下与感兴趣的学生沟通交流)。
尽管新课标在“有机化学基础”模块对反应机理未做要求,但要求“从化学键的角度认识官能团与有机化合物之间是如何相互转化的”[7],无论是有机新教材的编写还是新高考有机题目的命制,都在有意识地引导学生去認识有机反应的本质。反应机理直指有机反应的本原,它不仅能回答从反应物到生成物断键、成键的结果,还能描述断键、成键的细节与原因。
只有搞清楚反应机理,才能真正调控有机反应,进而设计最优的合成路线。但要把反应机理融入高中化学教学,一定要辩证地处理好难与易、深与浅、作要求与不作要求的关系。反应机理在教学中润物细无声地渗透,仅是帮助学生理解有机反应本质的教学手段而不是目的。笔者建议教师在有机化学教学中,首先要熟悉中学阶段常见的有机反应的机理,在此基础上能从键的极性角度进行突破,引导学生认识部分官能团的转化机理。比如在教授乙烯与HBr的加成时,若在教学中渗透了该反应机理是H+首先进攻π电子,则学生面对丙烯与HBr反应时,因已知甲基是推电子基,则对应的不对称加成产物就能迅速得出;再比如进行苯酚的教学时,若能渗透氧上的孤电子对能与苯环上的π电子发生部分“肩并肩”的重叠,则对于苯→甲苯→苯酚与溴发生溴化反应时苯环的活性依次增强便有了更深的理解。在教学中以不增加学生负担的前提下逐渐渗透一些简单的有机反应机理,不仅有助于学生理解有机反应,提升学科思维水平,更能为有机合成铺设一条系统和全面的思维路径,提升学生的化学知识结构化水平,发展化学学科核心素养。
参考文献:
[1]白建娥. 《有机化学基础》教学中可酌情渗透反应机理[J]. 中学化学教学参考, 2022,(10): 11~14.
[2]人民教育出版社课程教材研究所化学课程教材研究开发中心. 普通高中化学教科书·化学必修第二册[M]. 北京: 人民教育出版社, 2022: 80.
[3]人民教育出版社课程教材研究所化学课程教材研究开发中心. 普通高中化学教科书·化学选择性必修3·有机化学基础[M]. 北京: 人民教育出版社, 2022: 74.
[4]刘帅, 蔡小蔓, 陈建新. 同位素示踪法在研究酯化反应机理中的两个疑问[J]. 化学教与学, 2018,(9): 30~31.
[5]邢其毅, 裴伟伟, 徐瑞秋,裴坚. 基础有机化学(第4版)[M]. 北京: 北京大学出版社, 2018: 530~532.
[6]迈克尔 B. 史密斯. 李艳梅, 黄志平译. March高等有机化学——反应、机理与结构[M]. 北京: 化学工业出版社, 2019: 705~708.
[7]中华人民共和国教育部制定. 普通高中化学课程标准(2017年版2020年修订)[S]. 北京: 人民教育出版社, 2020: 46.
