传染性法氏囊病病毒新型变异株VP2蛋白原核表达及免疫效果评价
2023-11-02马景霞王常伟吴洪才何吉鑫牛晓赛段志强朱杰
马景霞 王常伟 吴洪才 何吉鑫 牛晓赛 段志强 朱杰



DOI:10.3969/j.issn.2095-1191.2023.06.029
摘要:【目的】構建传染性法氏囊病病毒新型变异株(vaIBDV)VP2蛋白原核表达质粒,并明确VP2蛋白的免疫原性,为vaIBDV亚单位疫苗的开发提供技术支持。【方法】从IBDV新型变异株(BZ)中扩增VP2基因片段,亚克隆至pET-28a(+)载体上构建重组原核表达质粒,并转化大肠杆菌BL21(DE3)感受态细胞,以IPTG诱导表达后通过SDS-PAGE和Western blotting进行鉴定,并以vaIBDV阳性血清进行琼扩效价测定;经Ni-NTA亲和层析纯化及适当浓缩后,制备乳化疫苗并免疫21日龄SPF鸡,通过安全性检验、抗体效价测定及攻毒保护评价进一步验证融合蛋白VP2的免疫原性。【结果】在25 ℃下以IPTG进行诱导表达,获得的融合蛋白VP2主要呈可溶性表达,大小约40 kD,且表达上清液中的融合蛋白VP2能与vaIBDV阳性血清发生特异性反应,其琼扩效价可达1∶32;经Ni-NTA亲和层析纯化及适当浓缩后,融合蛋白VP2的琼扩效价高达1∶256。以融合蛋白VP2为抗原制备的亚单位疫苗稳定性好,安全性高,无免疫引起的不良反应,剖检也未发现接种部位有明显损伤、局部炎症或疫苗吸收不良等现象。免疫21 d后鸡血清琼扩效价平均值达1∶76.8,而血清抗体效价均在1∶20000以上,表明以融合蛋白VP2制备的疫苗可刺激机体产生强烈的体液免疫反应,抗体阳性率达100%;使用IBDV BZ株攻毒后7 d剖检观察鸡法氏囊病变情况,结果显示免疫组鸡只均未发病,其法氏囊也无明显萎缩现象,即免疫保护率达100%。【结论】通过原核表达系统能成功实现vaIBDV VP2蛋白的可溶性表达,且获得的融合蛋白VP2免疫原性良好,能对vaIBDV提供100%的免疫保护效果,为开发vaIBDV亚单位疫苗提供了技术支持。
关键词:传染性法氏囊病病毒(IBDV);新型变异株;VP2蛋白;亚单位疫苗;免疫效果
中图分类号:S852.659.4 文献标志码:A 文章编号:2095-1191(2023)06-1876-08
Prokaryotic expression and immune effect evaluation of VP2 protein of a novel variant infectious bursal disease virus strain
MA Jing-xia1, WANG Chang-wei2, WU Hong-cai2, HE Ji-xin2, NIU Xiao-sai2,
DUAN Zhi-qiang3, ZHU Jie2
(1Binzhou Argo-tech Extension Center,Binzhou,Shandong 256600,China; 2Shandong Binzhou Wohua Biological
Engineering Co.,Ltd.,Binzhou,Shandong 256600,China; 3College of Animal Sciences, Guizhou University,
Guiyang,Guizhou 550025,China)
Abstract:【Objective】This paper constructed the prokaryotic expression plasmid of VP2 protein of a novel variant of infectious bursal disease virus (vaIBDV), and clarified the immunogenicity of VP2 protein, so as to provide technical support for the development of vaIBDV subunit vaccine. 【Method】The VP2 gene fragment was amplified from vaIBDV isolate (BZ strain) and cloned into vector pET-28a(+) to recombine prokaryotic expression plasmid, then transformed into the Escherichia coli BL21(DE3) competent cell, and induced by IPTG. The expressed products were identified by SDS-PAGE and Western blotting, and the titer was determined by vaIBDV-positive serum through agar-gel precipitation (AGP). After purification by Ni-NTA affinity chromatography and proper concentration, the emulsified vaccine was prepared and used to immunize 21-day-old SPF chickens. The immunogenicity of the fusion protein VP2 was further verified by safety test, antibody titer determination and immune challenge experiment. 【Result】The fusion protein VP2 was mainly expressed in soluble form at 25 ℃ induced by IPTG, and the size was about 40 kD. The fusion protein VP2 in the expression supernatant could specifically react with vaIBDV positive serum, and its agar diffusion titer could reach 1∶32. After purification by Ni-NTA affinity chromatography and appropriate concentration, the agar diffusion titer of the fusion protein VP2 was as high as 1∶256. The subunit vaccine prepared with the fusion protein VP2 as the antigen had good stability, high safety, and no adverse reactions caused by immunization. No obvious damage, local inflammation, and poor vaccine absorption were found at the inoculation site. After 21 d of immunization, the average agar diffusion titer of chi-cken serum was 1∶76.8, and the serum antibody titer was above 1∶20000, indicating that the vaccine prepared with the fusion protein VP2 could stimulate the body to produce a strong humoral immune response, and the antibody positive rate was 100%. The pathological changes of bursa of Fabricius in chickens were observed 7 d after challenging with IBDV BZ strain. The results showed that none of the chickens in the immunized group had disease, and there was no obvious atrophy of bursa of Fabricius, which meant that the immune protection rate was 100%. 【Conclusion】The soluble expression of vaIBDV VP2 protein is successfully achieved by prokaryotic expression system, and the obtained fusion protein VP2 has good immunogenicity and can provide 100% immune protection against vaIBDV, which provides technical support for the development of vaIBDV subunit vaccine.
Key words: infectious bursal disease virus(IBDV); novel variant strain; VP2 protein; subunit vaccine; immune effect
Foundation items: National Natural Science Foundation of China (31960698); Binzhou Wohua Biological Fund ([WH]201901QB01-02)
0 引言
【研究意義】传染性法氏囊病(Infectious bursal disease,IBD)是一种全球范围内广泛流行且主要危害青年鸡群的免疫抑制性疾病,其病原是传染性法氏囊病病毒(Infectious bursal disease virus,IBDV)(王占伟等,2012;梅永杰等,2016)。IBDV可分为I型和II型2个血清型,但只有血清I型对鸡有致病性。在过去长时间的流行过程中,血清I型IBDV发生过2次较大的变异,先后出现了经典毒株(cIBDV)、变异株(vIBDV)和超强毒株(vvIBDV)(范林进等,2019;王雨龙,2021)。自2017年以来,不同于早期vIBDV的新型变异株(vaIBDV)在我国呈现流行趋势,感染鸡群虽然眼观无明显的临床症状,但其生产性能下降,剖检可见法氏囊严重萎缩,给我国养禽业带来新的挑战(严专强等,2020;程小果等,2022)。值得注意的是,感染vaIBDV的鸡群均免疫过vvIBDV疫苗,说明在实际生产中针对vvIBDV开发的商品疫苗并不能对vaIBDV产生免疫作用(崔平等,2020)。vaIBDV具备一定的免疫逃逸能力,且会引起严重免疫抑制,影响鸡群的整体免疫效果(Fan et al.,2020;Xu et al.,2020)。因此,研发针对vaIBDV的疫苗对科学防控IBD暴发流行具有重要意义。【前人研究进展】目前,疫苗接种仍是防控IBD暴发流行最主要的措施,使用的疫苗主要有传统减毒活疫苗、灭活疫苗及新型疫苗(Witter and Hunt,1994;杨宵玥等,2018)。免疫活疫苗可诱导鸡群在短时间内产生主动免疫,但免疫效果易受母源抗体的干扰,甚至导致免疫失败(Jackwood,2017)。此外,一些商品化IBDV活疫苗毒力偏强,不仅有可能引起免疫抑制,还存在毒力返强和散毒等生物安全风险(Müller et al.,2012)。灭活疫苗相对来说安全性更高,但其免疫效果略低,需要多次加强免疫,因而增加了免疫成本(朱思思和李永红,2019)。目前,绝大多数传统疫苗都是基于cIBDV或vvIBDV研制,未能对vIBDV或vaIBDV提供可靠的免疫保护作用(Yang and Ye,2020),已商品化的新型疫苗主要有亚单位疫苗及病毒载体疫苗。IBDV基因组由A和B片段组成,共编码5种蛋白,分别是VP1、VP2、VP3、VP4和VP5(李赛赛等,2017;Sahithi et al.,2019),其中,VP2蛋白是病毒核衣壳的主要组成部分,占病毒总蛋白的51%,也是主要的宿主保护性抗原(范林进,2020;秦颖,2021)。VP2至少包含2~3个与宿主保护相关的中和表位,通过刺激机体产生中和抗体而免受病毒侵害(Li et al.,2020)。至今,针对IBDV的亚单位疫苗均以VP2为主要疫苗抗原,而禽痘病毒、禽腺病毒、新城疫病毒和火鸡疱疹病毒常被用作基因工程病毒载体以表达VP2蛋白,该策略获得的VP2蛋白重组病毒活载体疫苗在免疫后不会导致法氏囊损伤,从而避免活疫苗免疫可能导致的免疫抑制(Huang et al.,2004;Zhou et al.,2010;Kurukulasuriya et al.,2017)。国外已有多种商业化表达IBDV VP2蛋白的活载体疫苗上市,在国内市面上相关载体活疫苗主要是鸡传染性法氏病病毒火鸡疱疹病毒载体活疫苗(vHVT-013-69株)。【本研究切入点】在vvIBDV的防控过程中,以VP2蛋白为抗原的亚单位疫苗取得了理想防控效果,但以vvIBDV为基础开发的亚单位疫苗已无法控制vaIBDV的感染,因此亟待以新出现的vaIBDV为防控目标研发新的亚单位疫苗。【拟解决的关键问题】以山东滨州沃华生物工程有限公司2019年分离获得的IBDV新型变异株(BZ)为研究对象,构建其VP2蛋白原核表达质粒并利用大肠杆菌进行诱导表达,以期获得针对vaIBDV的保护性抗原,为vaIBDV亚单位疫苗的开发提供技术支持。
1 材料与方法
1. 1 试验材料
IBDV BZ株由山东滨州沃华生物工程有限公司分离并保存(崔平等,2020);21日龄SPF鸡由山东滨州沃华生物工程有限公司实验动物中心提供;pET-28a(+)载体购自Novagen公司;大肠杆菌DH5α和BL21(DE3)感受态细胞及HRP标记兔抗鸡IgG购自生工生物工程(上海)股份有限公司;核酸提取试剂盒(EasyPure Viral DNA/RNA Kit)、反转录试剂盒及Phanta® Max Super-Fidelity DNA聚合酶购自南京诺唯赞生物科技股份有限公司;AxyPrepTM DNA Gel Extraction Kit购自爱思进生物技术(杭州)有限公司;限制性内切酶和T4 DNA连接酶购自赛默飞世尔科技(中国)有限公司;2×Easy Taq PCR Super Mix购自北京全式金生物技术股份有限公司;质粒提取试剂盒购自天根生化科技(北京)有限公司;Ni-NTA亲和层析介质购自南京金斯瑞生物科技有限公司;BeyoColor™彩色预染蛋白分子量标准购自上海碧云天生物技术有限公司;DAB显色试剂盒购自上海雅酶生物医药科技有限公司;IBDV VP2蛋白ELISA抗体检测试剂盒购自百沃特(天津)生物技术有限公司;vaIBDV琼扩抗原购自中国兽医药品监察所(农业农村部兽药评审中心);鸡vaIBDV阳性血清由山东滨州沃华生物工程有限公司自制。
1. 2 引物设计与合成
根据GenBank已公布的IBDV A节段基因序列(NC_004178.1),设计VP2基因特异性扩增引物(VP2-F:5'-CGAGGATCCTAAATGACAAACCTGCA AGATC-3';VP2-R:5'-AGCACTCGAGCCTTATGGC CCGGATTATG-3')(下划线部分分别为BamH I和Xho I酶切位点),并委托生工生物工程(上海)股份有限公司合成。
1. 3 核酸提取及VP2基因PCR扩增
按照EasyPure Viral DNA/RNA Kit说明提取IBDV BZ株组织RNA,并反转录合成cDNA,然后使用Phanta® Max Super-Fidelity DNA聚合酶进行PCR扩增。PCR反应体系30.0 μL:2×Phanta Max Buffer 15.0 μL,Phanta® Max Super-Fidelity DNA聚合酶0.6 μL,cDNA模板2.0 μL,dNTP Mix(10 mmol/L) 0.6 μL,上、下游引物各1.2 μL,ddH2O 9.4 μL。擴增程序:95 ℃预变性3 min;95 ℃ 15 s,56 ℃ 15 s,72 ℃ 90 s,进行35个循环;72 ℃终延伸5 min。PCR扩增产物经1.0%琼脂糖凝胶电泳检测后,使用胶回收试剂盒进行纯化回收。
1. 4 重组原核表达质粒构建与鉴定
使用BamH I和Xho I限制性内切酶对VP2基因片段和pET-28a(+)载体进行双酶切,回收酶切产物后以T4 DNA连接酶进行连接。连接产物转化DH5α感受态细胞,挑取5个单菌落进行菌液PCR鉴定,阳性菌液送至生工生物工程(上海)股份有限公司测序。测序正确的菌液适量扩大培养,提取质粒并进行双酶切鉴定,阳性重组原核表达质粒命名为pET-28a-VP2。以重组原核表达质粒pET-28a-VP2转化BL21(DE3)感受态细胞,挑取单个菌落接种于含50 μg/mL卡那霉素的LB液体培养基中培养过夜,即获得表达质粒菌液。
1. 5 融合蛋白VP2诱导表达与鉴定
取对数生长期的新鲜菌液按1∶100比例接种至LB液体培养基(含50 μg/mL卡那霉素)中,37 ℃下220 r/min振荡培养2~3 h,至菌液OD600 nm达0.4~0.6时加入终浓度为0.5 mmol/L的IPTG,在25 ℃下进行诱导表达,诱导过夜后离心收集菌体。用1∶10体积的PBS重悬菌体,高压破碎后4 ℃下10000 r/min离心10 min,收集上清液,沉淀用等体积的PBS重悬。取上清液、沉淀悬浮液与5×蛋白上样缓冲液按4∶1比例混匀,金属浴100 ℃煮沸5 min,冷却至室温后进行SDS-PAGE检测和Western blotting鉴定,并以vaIBDV阳性血清测定上清液中的蛋白琼扩效价。
1. 6 融合蛋白VP2纯化及疫苗制备
使用Ni-NTA亲和层析对诱导表达上清液进行纯化,并用PEG-6000进行适当浓缩。纯化浓缩产物经SDS-PAGE检测后,以vaIBDV阳性血清测定其琼扩效价。用PBS将融合蛋白VP2原液进行1∶8稀释作为水相,加入适量Tween-80;将Marcol 52白油、Span-80和硬脂酸铝按照合适比例混匀,高压灭菌后作为油相。按水相∶油相=1∶3(v/v)进行乳化,根据《中华人民共和国兽药典》(2005年版)对配制的疫苗进行剂型、稳定性及无菌检验。
1. 7 融合蛋白VP2安全性检验
取10羽21日龄SPF鸡,于颈部皮下注射制备的疫苗(1.0 mL/羽),同时设空白对照组(5羽21日龄SPF鸡),注射后连续观察14 d,检验是否存在因疫苗注射引起任何局部或全身不良反应。
1. 8 融合蛋白VP2免疫效果评价
选择20羽21日龄SPF鸡随机分成3组,其中,免疫组10羽(颈部皮下注射制备的疫苗,注射剂量为0.3 mL/羽),攻毒对照组5羽,空白对照组5羽。于免疫后21 d翅下静脉采血并分离血清,以纯化的融合蛋白VP2为抗原测定血清琼扩效价,同时以ELISA抗体检测试剂盒测定血清抗体效价。使用IBDV BZ株对SPF鸡进行点眼和口服攻毒,攻毒剂量为101.5 EID50,连续观察7 d后进行剖检,观察法氏囊有无病变。
2 结果与分析
2. 1 VP2基因扩增结果
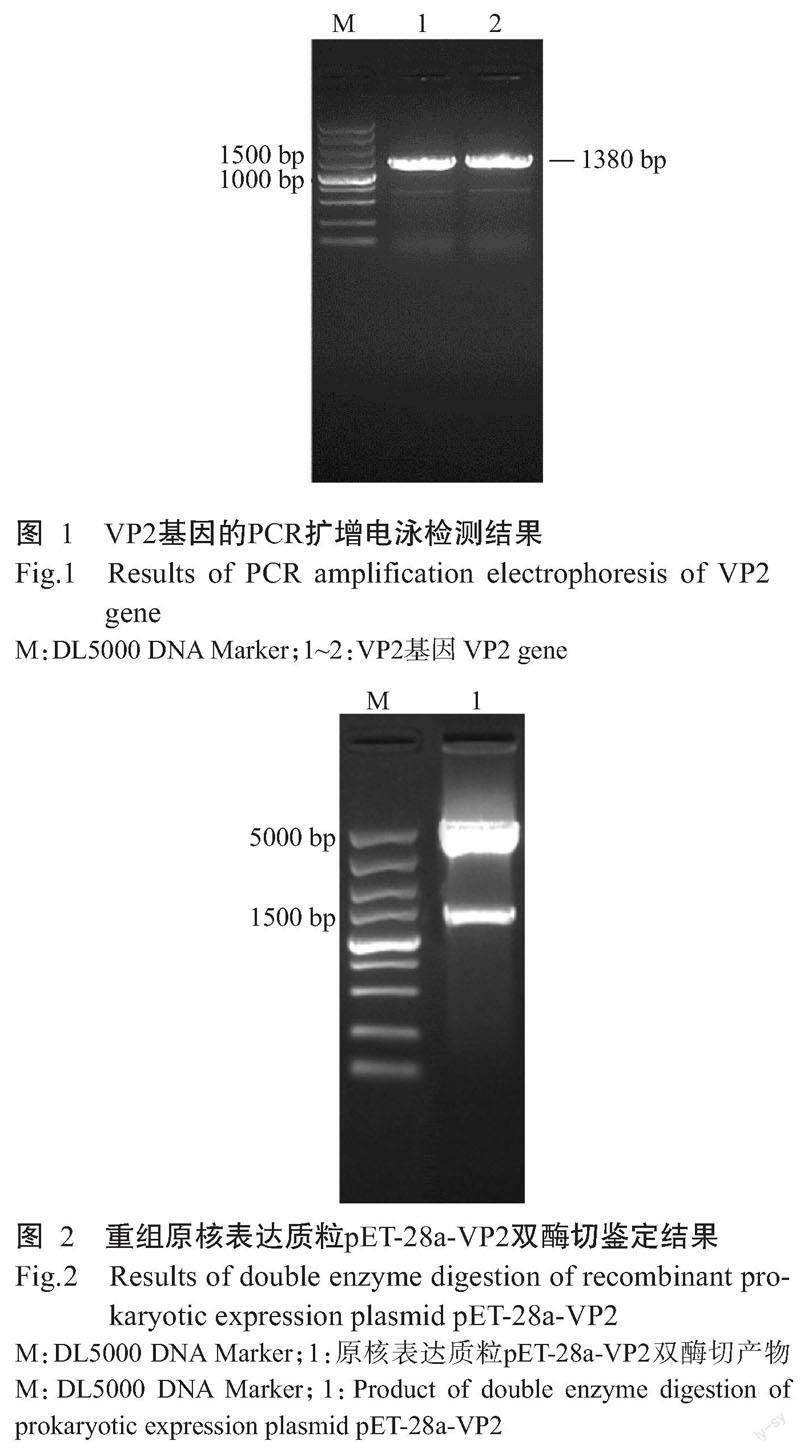
以IBDV BZ株的cDNA为模板对VP2基因进行扩增,经1.0%琼脂糖凝胶电泳检测可观察到1380 bp大小的目的条带(图1),与预期结果相符。
2. 2 重组原核表达质粒pET-28a-VP2构建及鉴定结果
使用BamH I和Xho I限制性内切酶对重组原核表达质粒pET-28a-VP2进行酶切鉴定,结果如图2所示,重组原核表达质粒的双酶切产物分别获得1365 bp的VP2基因条带和5300 bp左右的载体条带,且测序结果显示无碱基突变,表明重组原核表达质粒pET-28a-VP2构建成功。
2. 3 融合蛋白VP2表达与鉴定结果
通过SDS-PAGE对融合蛋白VP2的表达情况进行检测,结果(图3-A)发现诱导表达获得的融合蛋白VP2主要存在于上清液中,即呈可溶性表达,蛋白大小约40 kD,与预期结果相符。Western blotting鉴定结果(图3-B)显示,上清液中的融合蛋白VP2能与vaIBDV阳性血清发生特异性反应,其琼扩效价可达1∶32。可见,构建的重组原核表达质粒pET-28a-VP2通过BL21(DE3)感受态细胞能成功表达出VP2蛋白,且表达获得的融合蛋白VP2具有良好反应原性。
2. 4 融合蛋白VP2纯化与疫苗制备情况
2. 4. 1 融合蛋白VP2纯化效果 通过Ni-NTA亲和层析纯化上清液中的融合蛋白VP2并进行适当浓缩,经SDS-PAGE检测及琼脂扩散试验鉴定其纯化效果。结果如图4所示,融合蛋白VP2纯化洗脱液在预期的位置获得单一条带,纯化效果较好,纯化浓缩后的融合蛋白VP2琼扩效价高达1∶256。
2. 4. 2 疫苗制备情况 根据《中华人民共和国兽药典》(2005年版)对配制的疫苗进行剂型、稳定性及无菌检验,结果显示,制备获得的疫苗呈典型油包水型,少量疫苗滴入(除第1滴外)冷水中后无扩散现象;10 mL的疫苗经3000 r/min离心15 min,管底未见水相析出;无菌检验结果显示疫苗无细菌生长,均符合相关规定。
2. 5 VP2蛋白亚单位疫苗安全性检验结果
疫苗安全性检验结果显示,接种疫苗后所有鸡只的精神状态、采食及饮水均未见异常,接种部位无红肿反应,且剖检也未发现接种部位有明显损伤、局部炎症或疫苗吸收不良等现象(图5)。
2. 6 VP2蛋白亚单位疫苗的免疫保护效果评价
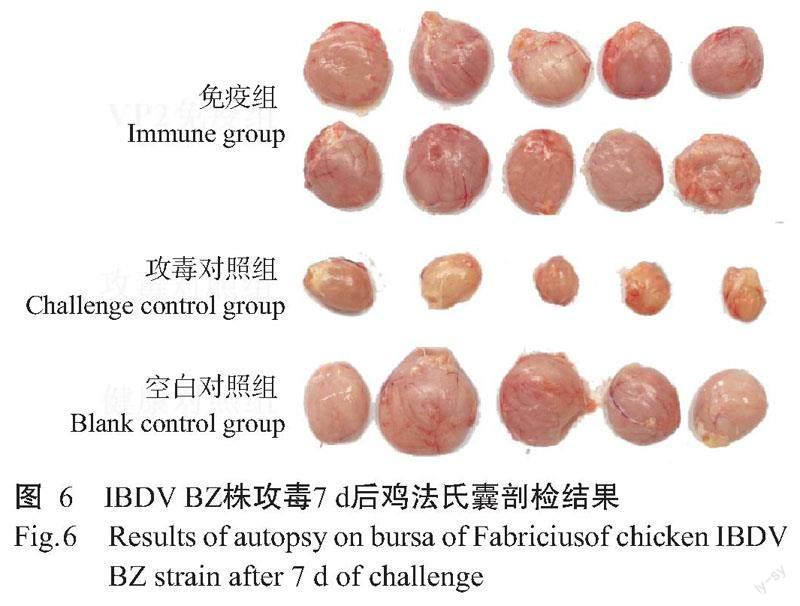
免疫后21 d采集鸡血清,分别使用vaIBDV琼扩抗原和ELISA抗体检测试剂盒测定血清琼扩效价及抗体效价,结果显示,鸡血清琼扩效价平均值达1∶76.8,而血清抗体效价均在1∶20000以上,表明诱导表达获得的融合蛋白VP2具有良好免疫原性,免疫后可刺激机体产生强烈的体液免疫反应,抗体阳性率达100%。使用IBDV BZ株攻毒后7 d,剖检鸡只并观察其法氏囊病变情况,结果显示,攻毒对照组鸡只发病率为100%,其法氏囊出现萎缩的典型病变(图6);免疫组鸡只均未发病,其法氏囊也无明显萎缩现象,即免疫保护率达100%。
[图 6 IBDV BZ株攻毒7 d后鸡法氏囊剖检结果
Fig.6 Results of autopsy on bursa of Fabriciusof chicken IBDV BZ strain after 7 d of challenge]<G:\2023.6\马景霞6.jpg>[免疫组
Immune group][攻毒对照组
Challenge control group][空白对照组
Blank control group]
3 讨论
自20世纪90年代以来,vvIBDV的流行给养禽业带来巨大经济损失,虽然随着疫苗的普遍使用及生物安全意识和饲养管理水平的提高,vvIBDV逐渐得到控制,但vaIBDV仍在鸡群中广泛流行(Li et al.,2015;Fan et al.,2020;Xu et al.,2020)。vaIBDV不会造成明显的临床症状或死亡率升高,但能导致法氏囊在短时间内萎缩,引起严重的免疫抑制而影响疫苗免疫效果(崔平等,2020;王雨龙,2021)。此外,多项研究数据表明,现有的商品化疫苗已不能对vaIBDV提供100%的保护效果(崔平等,2020;Fan et al.,2020)。可见,vaIBDV的出现给当前家禽养殖业带来极大挑战,因此亟待研发针对vaIBDV的疫苗。
VP2蛋白是IBDV主要的结构蛋白,也是主要的保护性抗原。VP2蛋白的第206~350位氨基酸区域变异较频繁,被称为IBDV高变区,与病毒毒力及中和抗体表位等密切相关(秦颖,2021)。本研究中,IBDV BZ株包含有vIBDV的特征性氨基酸位点(222T、249K、286I和318D),也具有vaIBDV的独特氨基酸位点(221K、252I和299S),当前的IBD疫苗已不能对IBDV BZ株提供有效的免疫保护(崔平等,2020)。范林进(2020)也研究证实,VP2蛋白是IBDV毒力和抗原变异的重要决定因素,各关键氨基酸位点的变异均会对病毒毒力、中和抗体活性及免疫逃逸能力造成一定影响。由于VP2高变区与抗体中和活性及病毒毒力密切相关,导致vaIBDV与vvIBDV的抗原差异明显,也进一步佐证VP2蛋白是最优的IBDV基因工程亚单位疫苗抗原靶点(洪家兵等,2020;王彦伟等,2020;肖倩等,2022;张文英等,2022)。因此,根据VP2蛋白开发针对vaIBDV的亚单位疫苗具有可行性。
亚单位疫苗是将病原体中具有免疫原性的蛋白在体外通过合适的表达系统进行表达,再利用纯化蛋白作为免疫原进行免疫,以诱导产生抗体而达到保护的目的(谭伟等,2014;汪梦竹等,2022)。本研究通过大肠杆菌表达系统成功表达出vaIBDV的VP2蛋白,经Ni-NTA亲和层析纯化获得高纯度的融合蛋白VP2。融合蛋白VP2主要呈可溶性表达,为后续的处理及规模化生产提供了便利条件。但Ni-NTA亲和层析纯化技术操作复杂且成本较高,不适合大规模生产,如后续应用到生产中宜采用饱和硫酸铵盐析进行蛋白纯化。本研究结果表明,通过原核表达获得的融合蛋白VP2在未经纯化处理前(诱导表达上清液)的琼扩效价为1∶32,经纯化及浓缩后琼扩效价高达1∶256。高效率的可溶性表达能显著提高蛋白产量,同时有效降低生产成本,因此在实际生产应用过程中还需进一步优化诱导表达条件及蛋白后期处理工艺。
在免疫效果评价中,以融合蛋白VP2配制的疫苗可刺激机体产生强烈的体液免疫反应,抗体水平较高,也反映了该蛋白具备良好的免疫原性;在攻毒保护试验中,VP2蛋白亚单位疫苗能为免疫鸡只提供100%的免疫保護。本课题组前期研究发现,传统的鸡新城疫—禽流感(H9亚型)—鸡传染性法氏囊病三联灭活疫苗在免疫后21 d对包括BZ株在内的5株vaIBDV的免疫保护率仅为50%~80%,对BC6/85株(vvIBDV)则可以提供100%的免疫保护。随着vaIBDV的暴发流行,国内各地分离获得的IBDV毒株也逐渐增多,针对vaIBDV疫苗开发的研究也日益增多。荣俊等(2020)利用IBDV FJ-1812株构建了能表达VP2蛋白的表达载体及工程菌,诱导表达获得的VP2蛋白能对IBDVFJ-1812株提供完全保护,而vvIBDV基因工程亚单位疫苗对IBDV FJ-1812株的攻毒只提供部分保护。此外,由于原核表达体外表达技术对于蛋白结构的修饰程度较弱,很难保证蛋白的天然构象,而可能对蛋白的免疫原性造成不利影响(汪梦竹等,2022)。已有研究证实,在VP2蛋白表达盒N端添加构象原件模拟IBDV VP3蛋白C末端与VP2蛋白互作,有利于VP2蛋白正确构象的形成,从而提高其免疫原性(Saugar et al.,2005;张文英等,2022)。因此,今后应在本研究基础之上进一步优化VP2蛋白的诱导表达条件,以期将免疫原性更强、保护效果最佳的VP2蛋白应用到vaIBDV疫苗研发中,为有效防控IBD暴发流行及保障家禽养殖业健康发展提供技术保障。
4 結论
通过原核表达系统能成功实现vaIBDV VP2蛋白的可溶性表达,且获得的融合蛋白VP2免疫原性良好,能对vaIBDV提供100%的免疫保护效果,为开发vaIBDV亚单位疫苗提供了技术支持。
参考文献:
程小果,程宁,王慧. 2022. 鸡传染性法氏囊病毒新型变异株的流行现状及综合防控[J]. 上海畜牧兽医通讯,(3):56-58. [Cheng X G,Cheng N,Wang H. 2022. Current status of the epidemic of a new variant of infectious bursal disease virus in chickens and comprehensive prevention and control[J]. Shanghai Journal of Animal Husbandry and Veterinary Medicine,(3):56-58.] doi:10.14170/j.cnki.cn31-1278/s.2022.03.003.
崔平,牛晓赛,董新荣,李军朝,杨灵芝,朱杰. 2020. 蛋鸡源传染性法氏囊病病毒变异株的分离、鉴定及攻毒保护试验[J]. 中国家禽,42(9):35-39. [Cui P,Niu X S,Dong X R,Li J Z,Yang L Z,Zhu J. 2020. Isolation,identification and immune challenge experiment of infectious bursal disease virus variant strains isolated from laying hens[J]. China Poultry,42(9):35-39.] doi:10.16372/j.issn.1004-6364.2020.09.006.
范林进,王雨龙,吴甜甜,李凯,姜楠,高玉龙,高立,刘长军,崔红玉,潘青,张艳萍,刘玉凤,孙先本,刘俊启,王笑梅,祁小乐. 2019. 我国传染性法氏囊病病毒新型变异株分析研究[J]. 中国预防兽医学报,41(11):1164-1169. [Fan L J,Wang Y L,Wu T T,Li K,Jiang N,Gao Y L,Gao L,Liu C J,Cui H Y,Pan Q,Zhang Y P,Liu Y F,Sun X B,Liu J Q,Wang X M,Qi X L. 2019. The prevalence of novel variant strains of infectious bursal disease virus in China[J]. Chinese Journal of Preventive Veterinary Medicine,41(11):1164-1169.]doi:10.3969/j.issn. 1008-0589.201907028.
范林进. 2020. 鸡传染性法氏囊病病毒新型变异株的鉴定及疫苗株构建[D]. 北京:中国农业科学院. [Fan L J. 2020. Identification and vaccine strain construction of the novel variant infectious bursal disease virus[D]. Beijing:Chinese Academy of Agricultural Sciences.] doi:10.27630/d.cnki.gznky.2020.000327.
洪家兵,王萍,王晓玥,于非可,刘文晓,李永清. 2020. 鸡传染性法氏囊病病毒VP2蛋白在昆虫细胞—杆状病毒表达系统中的分泌表达及免疫原性分析[J]. 中国兽医杂志,56(12):14-17. [Hong J B,Wang P,Wang X Y,Yu F K,Liu X W,Li Y Q. 2020. Secreted expression and immunogenicity analysis of VP2 protein of infectious bursal disease virus in baculovirus expression system[J].Chinese Journal of Veterinary Medicine,56(12):14-17.]
李赛赛,郭玉堃,舒静超,曾磊,郭婉莹,郭豫杰. 2017. 鸡传染性法氏囊病病毒VP2蛋白可溶性原核表达及免疫原性分析[J].中国兽医学报,37(12):2281-2287. [Li S S,Guo Y K,Shu J C,Zeng L,Guo W Y,Guo Y J. 2017. Proka-ryotic expression and immunogenicity analysis of the VP2 protein of infectious bursal disease virus[J]. Chinese Journal of Veterinary Science,37(12):2281-2287.] doi:10. 16303/j.cnki.1005-4545.2017.12.07.
梅永杰,王永山,欧阳伟,潘群兴,孟凯,王晓丽,夏兴霞,诸玉梅,董晨红,毕振威,王晶宇,吴红玲,姚火春. 2016. 华东地区传染性法氏囊病病毒流行株的分离及其生物学特性分析[J]. 中国兽医科学,46(5):550-557. [Mei Y J,Wang Y S,Ouyang W,Pan Q X,Meng K,Wang X L,Xia X X,Zhu Y M,Dong C H,Bi Z W,Wang J Y,Wu H L,Yao H C. 2016. Isolation and characterization of biological properties of infectious bursal disease viruses from eastern China in recent years[J]. Chinese Veterinary Science,46(5):550-557.] doi:10.16656/j.issn.1673-4696. 2016.05.003.
秦颖. 2021. 传染性法氏囊病病毒变异株分离鉴定及不同系统表达VP2蛋白免疫原性分析[D]. 扬州:扬州大学. [Qin Y. 2021. Identification of infectious bursal disease virus variant strain and immunogenicity analysis of VP2 protein expressed in different expression systems[D]. Yangzhou:Yangzhou University.] doi:10.27441/d.cnki.gyzdu.2021.002242.
荣俊,匡红艳,李国攀,楚电峰,蔡联燊,徐保娟. 2020. 用于预防鸡传染性法氏囊病毒新变异株的基因工程亚单位疫苗及其制备方法:CN110664999A[P]. 2020-01-10. [Rong J,Kuang H Y,Li G P,Chu D F,Cai L S,Xu B J. 2020. Genetically engineered subunit vaccine for the prevention of a new mutant strain of infectious bursal virus in chickens and its preparation method:CN110664999A[P]. 2020-01-10.]
谭伟,谢丽基,谢芝勋. 2014. 禽流感病毒疫苗研究进展[J]. 南方农业学报,45(8):1492-1497. [Tan W,Xie L J,Xie Z X. 2014. Research updates of vaccines against avian influenza virus[J]. Journal of Southern Agriculture,45(8):1492-1497.] doi:10.3969/j:issn.2095-1191.2014.8.1492.
汪梦竹,蒲飞洋,赵泽阳,冯茜莉,李易聪,王慧慧,马忠仁,李倬. 2022. 新型疫苗的研究进展[J]. 畜牧与兽医,54(9):141-147. [Wang M Z,Pu F Y,Zhao Z Y,Feng X L,Li Y C,Wang H H,Ma Z R,Li Z. 2022. Advances in deve-lopment of novel types of vaccines[J]. Animal Husban-dry & Veterinary Medicine,54(9):141-147.]
王彦伟,张素玲,吴芃,耿笑林,黄玉欣,李鹏昊,王孟月,李向东,逄文强,田克恭. 2020. 鸡传染性法氏囊病病毒rVP2蛋白高效组装亚病毒颗粒的鉴定[J]. 中国畜牧兽医,47(6):1677-1684. [Wang Y W,Zhang S L,Wu P,Geng X L,Huang Y X,Li P H,Wang M Y,Li X D,Pang W Q,Tian K G. 2020.Identification of subviral particles efficiently self-assemdled by infectious bursal disease virus rVP2 protein[J]. China Animal Husbandry & Veterinary Medicine,47(6):1677-1684.] doi:10.16431/j.cnki.1671-7236.2020.06.005.
王雨龍. 2021. 鸡传染性法氏囊病病毒的基因分型及新型变异株亚单位疫苗的研究[M]. 北京:中国农业科学院. [Wang Y L. 2021. An improved scheme for infectious bursal disease virus genotype classification and development of a subunit candidate vaccine against novel variant infectious bursal disease virus[M]. Beijing:Chinese Aca-demy of Agricultural Sciences.] doi:10.27630/d.cnki.gznky. 2021.000217.
王占伟,邵国青,刘茂军,冯志新,王丽,高云飞,周开华,尹秀凤. 2012. 鸡传染性法氏囊病病毒抗血清的研制[J]. 南方农业学报,43(12):2079-2082. [Wang Z W,Shao G Q,Liu M J,Feng Z X,Wang L,Gao Y F,Zhou K H,Yin X F. 2012. Antiserum development for chicken infectiousbursal disease virus[J]. Journal of Southern Agriculture,43(12):2079-2082.] doi:10.3969/j:issn.2095-1191.2012. 12.2079.
肖倩,黄秀英,丁莉,左榕琳,李成山,邢刚. 2022. 鸡传染性法氏囊病病毒VP2蛋白的可溶性表达及其免疫原性研究[J]. 中国动物传染病学报,30(4):156-162. [Xiao Q,Huang X Y,Ding L,Zuo R L,Li C S,Xing G. 2022. So-luble expression and immunogenicity analysis of VP2 protein of infectious bursal disease virus[J]. Chinese Journal of Animal Infectious Diseases,30(4):156-162.] doi:10.19958/j.cnki.cn31-2031/s.2022.04.019.
嚴专强,尹丽娟,刘琳琳,杨德鸿,梁晓颖,魏晓娜,黄建飞,周庆丰. 2020. 鸡传染性法氏囊病毒新型变异株的分离鉴定[J]. 家禽科学,(7):50-52. [Yan Z Q,Yin L J,Liu L L,Yang H D,Liang X Y,Wei X N,Huang J F,Zhou Q F. 2020. Isolation and identification of a novel mutant strain of infectious bursal virus in chickens[J]. Poultry Science,(7):50-52.] doi:10.3969/j.issn.1673-1085.2020. 07.019.
杨宵玥,陈玲,宋亚芬,蒋桃珍. 2018. 鸡传染性法氏囊病新型疫苗的研究进展[J]. 中国兽药杂志,52(5):79-85. [Yang X Y,Chen L,Song Y F,Jiang T Z. 2018. Advances in new vaccine researches of the infectious bursal disease[J]. Chinese Journal of Veterinary Drug,52(5):79-85.] doi:10.11751/ISSN.1002-1280.2018.05.12.
张文英,姜楠,王雨龙,马广斌,牛鑫鑫,黄萌萌,王国栋,宋桂才,李凯琳,刘爱晶,王素艳,高立,崔红玉,刘长军,李凯,潘青,张艳萍,王笑梅,高玉龙,祁小乐. 2022. 鸡传染性法氏囊病病毒新型变异株衣壳蛋白重组真核表达质粒的免疫原性分析[J]. 中国家禽,44(6):31-35. [Zhang W Y,Jiang N,Wang Y L,Ma G B,Niu X X,Huang M M,Wang G D,Song G C,Li K L,Liu A J,Wang S Y,Gao L,Cui H Y,Liu C J,Li K,Pan Q,Zhang Y P,Wang X M,Gao Y L,Qi X L. 2022. Immunogenicity analysis on recombinant eukaryotic expression plasmid expressing capsid protein of novel variant strain of infectious bursal disease virus[J]. China Poultry,44(6):31-35.] doi:10. 16372/j.issn.1004-6364.2022.06.006.
朱思思,李永红. 2019. 鸡传染性法氏囊病病毒及疫苗的研究进展[J]. 广东畜牧兽医科技,44(3):9-13. [Zhu S S,Li Y H. 2019. Research progress of infectious bursal disease virus and vaccine in chicken[J]. Guangdong Journal of Animal and Veterinary Science,44(3):9-13.] doi:10.3969/j.issn.1005-8567.2019.03.003.
Fan L J,Wu T T,Wang Y L,Hussain A,Jiang N,Gao L,Li K,Gao Y L,Liu C J,Cui H Y,Pan Q,Zhang Y P,Wang X M,Qi X L. 2020. Novel variants of infectious bursal disease virus can severely damage the bursa of fabricius of immunized chickens[J]. Veterinary Microbiology,240:108507. doi:10.1016/j.vetmic.2019.108507.
Huang Z,Elankumaran S,Yunus A S,Samal S K. 2004. A recombinant Newcastle disease virus (NDV) expressing VP2 protein of infectious bursal disease virus (IBDV) protects against NDV and IBDV[J]. Journal of Virology,78(18):10054-10063. doi:10.1128/JVI.78.18.10054-10063. 2004.
Jackwood D J. 2017. Advances in vaccine research against eco-nomically important viral diseases of food animals:Infectious bursal disease virus[J]. Veterinary Microbiology,206:121-125. doi:10.1016/j.vetmic.2016.11.022.
Kurukulasuriya S,Ahmed K A,Ojkic D,Gunawardana T,Goonewardene K,Gupta A,Chow-Lockerbie B,Popo-wich S,Willson P,Tikoo S K,Gomis S. 2017. Modified live infectious bursal disease virus (IBDV) vaccine delays infection of neonatal broiler chickens with variant IBDV compared to turkey herpesvirus (HVT)-IBDV vectored vaccine[J]. Vaccine,35(6):882-888. doi:10.1016/j.vaccine. 2017.01.005.
Li G P,Kuang H Y,Guo H X,Cai L S,Chu D F,Wang X,Hu J X,Rong J. 2020. Development of a recombinant VP2 vaccine for the prevention of novel variant strains of infectious bursal disease virus[J]. Avian Pathology,49(6):557-571. doi:10.1080/03079457.2020.1791314.
Li K,Courtillon C,Guionie O,Allée C,Amelot M,Qi X L,Gao Y L,Wang X M,Eterradossi N. 2015. Genetic,antigenic and pathogenic characterization of four infectious bursal disease virus isolates from China suggests continued evolution of very virulent viruses[J]. Infection,Genetics and Evolution,30:120-127. doi:10.1016/j.meegid.2014. 12.016.
Müller H,Mundt E,Eterradossi N,Islam M R. 2012. Current status of vaccinesagainst infectious bursal disease[J]. Avian Pathology,41(2):133-139. doi:10.1080/03079457. 2012. 661403.
Sahithi K D,Nancy P A,Vardhan G P V,Kumanan K,Vijayarani K,Hema M. 2019. Detection of infectious bursal di-sease virus (IBDV) antibodies using chimeric plant virus like particles[J]. Veterinary Microbiology,229:20-27. doi:10.1016/j.vetmic.2018.12.008.
Saugar I,Luque D,Oña A,Rodríguez J F,Carrascosa J L,Trus B L,Castón J R. 2005. Structural polymorphism of the major capsid protein of a double-stranded RNA virus:An amphipathic alpha helix as a molecular switch[J]. Structure,13(7):1007-1017. doi:10.1016/j.str.2005.04. 012.
Witter R L,Hunt H D. 1994. Poultry vaccines of the future[J]. Poultry Science,73(7):1087-1093. doi:10.3382/ps. 0731087.
Xu A H,Pei Y,Zhang K R,Xue J,Ruan S F,Zhang G Z. 2020. Phylogenetic analyses and pathogenicity of a variant infectious bursal disease virus strain isolated in China[J]. Virus Research,276:197833. doi:10.1016/j.virusres. 2019.197833.
Yang H,Ye C J. 2020. Reverse genetics approaches for live-attenuated vaccine development of infectious bursal di-sease virus[J]. Current Opinion in Virology,44:139-144. doi:10.1016/j.coviro.2020.08.001.
Zhou X M,Wang D C,Xiong J M,Zhang P J,Li Y Q,She R P. 2010. Protection of chickens,with or without maternal antibodies,against IBDV infection by a recombinant IBDV-VP2 protein[J]. Vaccine,28(23):3990-3996. doi:10. 1016/j.vaccine.2010.03.021.
(責任编辑 兰宗宝)
收稿日期:2023-03-31
基金项目:国家自然科学基金项目(31960698);滨州沃华生物基金项目([WH]201901QB01-02)
第一作者:马景霞(1966-),https://orcid.org/0009-0007-0834-7382,推广研究员,主要从事动物疫病防控研究工作,E-mail:hjx20211105 @163.com
