基于16S rRNA和gyrB基因串联DNA特征序列的气单胞菌鉴定方法
2023-11-02陈天楠胡鲲
陈天楠 胡鲲





DOI:10.3969/j.issn.2095-1191.2023.06.027
摘要:【目的】建立基于16S rRNA序列和gyrB基因串聯DNA特征序列的属内菌种鉴定方法,为气单胞菌的种间区分提供技术支持。【方法】以2020—2021年在我国福建、江苏等地分离获得的水产源气单胞菌和NCBI已公布且完成全基因组测序的10种气单胞菌为研究对象,分别以16S rRNA序列、gyrB基因及2个基因序列串联后得到的新DNA特征序列作为构建系统发育进化树的依据,比较不同系统发育进化树的鉴定结果,并以运动性试验、溶血性试验、糖发酵试验进行辅助鉴定。【结果】在基于16S rRNA序列构建的系统发育进化树中,中间气单胞菌、嗜水气单胞菌、达卡气单胞菌、肠源气单胞菌等聚类在不同分支上,未能形成独立的种属进化分支;在基于gyrB基因构建的系统发育进化树中,达卡气单胞菌、豚鼠气单胞菌和嗜水气单胞菌聚类在同一分支上,而异嗜糖气单胞菌和维氏气单胞菌聚类在另一分支上。将16S rRNA序列和gyrB基因串联组成新DNA特征序列再构建系统发育进化树建树,能完全有效分离气单胞菌属的不同菌株,将不同种的气单胞菌独立聚为一支,较好地实现种间区分。【结论】将16S rRNA序列和gyrB基因串联组成新DNA特征序列再构建系统发育进化树,较基于16S rRNA序列或gyrB基因单独构建系统发育进化树具有更高的分辨力,是一种理想的保守序列相似性高的属内菌种鉴定方法。因此,在16S rRNA测序鉴定为气单胞菌的情况下可再次以gyrB基因为测序对象,获得序列信息后与16S rRNA序列串联构建系统发育进化树,能更加精确地将气单胞菌鉴定到种水平。
关键词:气单胞菌;16S rRNA序列;gyrB基因;串联DNA序列;系统发育进化树
中图分类号:S917.1 文献标志码:A 文章编号:2095-1191(2023)06-1858-10
Identification of Aeromonas based on 16S rRNA and gyrB gene tandem DNA characteristic sequence
CHEN Tian-nan1,2,3, HU Kun1,2,3*
(1National Demonstration Center for Experimental Fisheries Science Education(Shanghai Ocean University),
Shanghai 201306,China;2National Pathogen Collection Center for Aquatic Animals(Shanghai Ocean University),
Shanghai 201306,China;3Key Laboratory of Freshwater Aquatic Genetic Resources,Ministry of Agriculture and
Rural Affairs(Shanghai Ocean University),Shanghai 201306,China)
Abstract:【Objective】This work was aimed to establish a identification method of Aeromonas based on 16S rRNA sequence and gyrB gene tandem DNA characteristic sequence, and to provide research technical support for the differentia-tion of Aeromonas at the species level. 【Method】The aquatic bacteria, which were detected as Aeromonas later, isolated from Fujian, Jiangsu and other places in China from 2020 to 2021 and ten different species of Aeromonas that have completed genome sequencing on NCBI were taken as the experimental objects. The 16S rRNA sequence, gyrB gene and the new DNA characteristic sequences obtained from the tandem of the two sequences were used as the basis for the establishment of the evolutionary tree. The results were identified by comparing different evolutionary trees, meanwhile, exercise tests, hemolysis tests, and sugar fermentation tests were also be used for auxiliary identification. 【Result】The results showed that the combined tree had better discrimination effect than the single gene tree. In the phylogenetic evolution tree constructed based on single 16S rRNA sequences, A. media, A. hydrophila, A. dhakensis, and A. enteropelogenes were dispersed on different branches, and did not form independent species and evolutionary branches. In the phylogenetic evolution tree constructed based on the single gyrB gene, A. dhakensis, A. caviae, and A. hydrophilawere clustered on the same branch, while A. allosaccharophila and A. veronii were also clustered on the same branch. By combining 16S rRNA sequence and gyrB gene in tandem to form a new DNA characteristic sequence, the phylogenetic evolutionary tree was constructed, which could completely and effectively isolate different strains of Aeromonas, and cluster different species of Aeromonas into an independent branch, so as to achieve better interspecific differentiation. 【Conclusion】The phylogenetic tree constructed by combining 16S rRNA sequence and gyrB gene in tandem to form a new DNA sequence has better identification ability than the phylogenetic tree constructed solely based on 16S rRNA sequence or gyrB gene. It is an ideal method for genus species identification with high conserved sequence similarity. Therefore, in the case of the identification of Aeromonas by 16S rRNA sequencing, gyrB gene can be used as the sequencing object again, and after obtaining sequence information, the phylogenetic evolutionary tree can be constructed in tandem with 16S rRNA sequence to more accurately identify Aeromonas to the species level.
Key words: Aeromonas;16S rRNA sequence;gyrB gene;tandem DNA sequence; phylogenetic tree
Foundation items:“Technological Innovation of Blue Granary”of National Key Research and Development Program of China(2019YFD0900102);National Freshwater Aquatic Germplasm Resources Bank Construction Project (FGRC:18537)
0 引言
【研究意义】据统计,2020年我国渔业总产值达13517.24亿元,其中海水养殖3836.20亿元、淡水养殖6387.15亿元;淡水养殖面积5040.56千ha,而受灾面积达808.79千ha,水产品损失1525996.46万元中除去台风及洪涝导致的1151197.81万元外,剩下的以病害损失最严重(208778.81万元)(农业农村部渔业渔政管理局等,2021)。鱼病是制约我国水产养殖健康发展的瓶颈问题,尤其是细菌性鱼病。气单胞菌(Aeromonas sp.)作为水产常见的条件性致病菌,能引起鱼类行动缓慢、吃食减少、鳍部充血、体表溃疡及腹水等症状(戴瑜来等,2019),目前已鉴定的气单胞菌有36个种、12个亚种(邓玉婷等,2019)。因此,开展水产气单胞菌鉴定分型研究,对预测防控水产养殖疾病及确保我国水产渔业持续健康发展具有重要意义。【前人研究进展】气单胞菌最早于1893年被发现,1943年被划分入弧菌科(Vibrionaceae),在1984年版的《伯杰氏细菌鉴定手册》中气单胞菌仍归属于弧菌科,按其表型与致病性最初仅有3个种:嗜水气单胞菌(A. hydrophila)、斑点气单胞菌(A. punctatus)和杀鲑气单胞菌(A. salmonides)。随着微生物学研究的不断深入,越来越多的气单胞菌被研究发现,在1994年版的《伯杰氏细菌鉴定手册》中新增了维氏气单胞菌(A. veronii)、中间气单胞菌(A. media)、舒伯特气单胞菌(A. schubertii)和嗜泉气单胞菌(A. eucrenophila)4种新的气单胞菌,但此时气单胞菌仍归属于弧菌科。基于5S rRNA和16S rRNA序列的生物分类研究,有学者质疑气单胞菌与弧菌科的不同,并呼吁气单胞菌应独立成科(宋元鍉和何晓青,1990)。目前,气单胞菌在《国际系统与进化微生物杂志》(International Journal of Systematic and Evolutionary Microbiology,IJSEM)的生物分类中隶属于气单胞菌目(Aeromonadales)气单胞菌科(Aeromonadaceae)气单胞菌属(Aeromonas)。近年来,不断报道有新的气单胞菌被发现,包括A. simiae(Mokracka et al.,2001)、A. culicicola(Pidiyar et al.,2002)、A. molluscorum(Miñana-Galbis et al.,2004)、A. sharmana(Saha and Chakrabarti,2006)、A. bivalvium(Miñana-Galbis et al.,2007)、A. tecta(Demarta et al.,2008)、A. aquariorum(Martínez-Murcia et al.,2008)、A. diversa(Miñana-Galbis et al.,2009)、A. rivuli(Figueras et al.,2011)、A. staiwanensis、A. sanarellii(Beaz-Hidalgo et al.,2012)等,对于日益增多的气单胞菌种类,亟待探索出更加精确的鉴定方法。【本研究切入点】在细菌鉴定中,目前最常用最准确的方法是分子生物学鉴定,其中16S rRNA序列因在原核生物中广泛存在且具有高度的保守性,已发展成为微生物鉴定的金标准(史斌等,2013;劉赛,2018;麻强生等,2020)。由于16S rRNA序列的高度保守性,细菌鉴定时能精确到属,但难以继续往下精确到种,因此需要额外的辅助手段来进一步鉴定。【拟解决的关键问题】以2020—2021年在我国福建、江苏等地分离获得的水产源气单胞菌和NCBI已公布且完成全基因组测序的10种气单胞菌为研究对象,分别以16S rRNA序列、gyrB基因及2个基因序列串联后得到的新DNA特征序列作为构建系统发育进化树的依据,比较不同系统发育进化树的鉴定结果,并以运动性试验、溶血性试验、糖发酵试验进行辅助鉴定,旨在进一步优化16S rRNA细菌鉴定方法,为气单胞菌的种间区分提供技术支持。
1 材料与方法
1. 1 试验材料
Taq DNA聚合酶预混液、DNA分子量标准、6×DNA Loading Buffer及细菌基因组快速抽提试剂盒购自生工生物工程(上海)股份有限公司;GoldenViewTM核酸染料购自北京博迈德基因技术有限公司;50×TAE溶液购自北京酷来搏科技有限公司;盐酸四甲基对苯胺和水杨酸购自上海凛恩科技发展有限公司;七叶苷购自阿拉丁试剂(上海)有限公司;琼脂糖、BHI液体培养基、AHM培养基、Kovacs试剂、葡萄糖、蔗糖及阿拉伯糖购自青岛海博生物技术有限公司;其他试剂均为国产分析纯。菌株为2020—2021年辽宁、山东、江苏、上海、福建、新疆各地水产研究所上报的部分气单胞菌属菌株和上海海洋大学国家水生动物病原库自行分离的气单胞菌属菌株,详见表1。
常见培养基:BHI固体培养基、LB液体培养基、AHM培养基、0.002 mol/L氢氧化钠溶液、溴甲酚紫指示剂均按说明进行配制。糖发酵试验管:各类糖粉末(g)∶蛋白胨(g)∶蒸馏水(mL)=1∶0.5∶100,分装于15 mL离心管中,滴加2~3滴溴甲酚紫指示剂,并以稀醋酸或碳酸氢钠溶液调节pH至7.0左右(溶液呈紫色)。121 ℃高压灭菌15 min,超净台内放置备用。脱纤维羊血琼脂培养基:在普通LB固体培养基温度降至50 ℃凝固前,按脱纤维羊血∶固体培养基=1∶10比例加入脱纤维羊血,混匀,凝固后倒置于超净台内备用。
1. 2 试验方法
1. 2. 1 细菌培养 冻存菌株复苏活化:(1)从-80 ℃冰箱取出菌株冻存管,解冻后用移液枪吸取100 µL菌液接种至LB液体培养基中,30 ℃复苏培养24 h。(2)以灭菌接种环蘸取少许已复苏的菌液,划线接种至LB固体培养基上,30 ℃培养24 h。(3)判断菌株无污染后,挑取长势良好的菌落接种至新的LB液体培养基中,30 ℃培养18 h后即可使用。
1. 2. 2 生理生化鉴定 根据GB/T 18652—2002《致病性嗜水气单胞菌检验方法》,检测菌株的氧化酶、运动性、吲哚、葡萄糖、蔗糖、阿拉伯糖、七叶苷、水杨苷等8项指标。同时,对LB固体培养基上生长成型的菌落滴加1~2滴1%盐酸四甲基对苯胺,静置观察其颜色变化;以灭菌接种环挑取LB固体培养基上生长成型的单菌落,水平穿刺接种至AHM半固体培养基上,30 ℃培养24 h,观察细菌运动性;在长有菌落的AHM培养基顶部滴加4~5滴Kovacs试剂,观察管壁内颜色变化;用灭菌接种环挑取LB固体培养基上生长成型的少许菌落,分别接种到5管不同糖发酵试验管内,30 ℃培养24 h,观察其颜色变化。
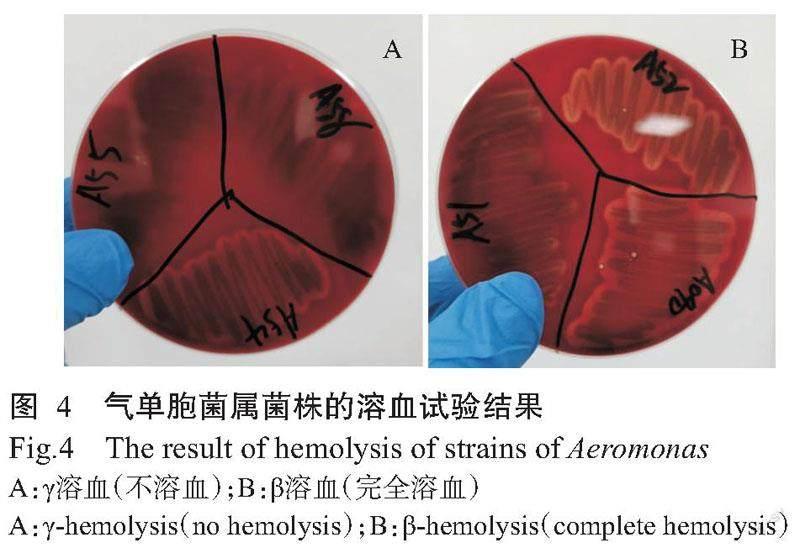
1. 2. 3 溶血试验 以灭菌接种环蘸取少许新鲜菌液,在脱纤维羊血琼脂培养基上划分的3个区内各自划线接种,30 ℃培养24 h,观察溶血现象。
1. 2. 4 细菌总DNA提取 采用热裂解法提取细菌DNA,步骤如下:取纯培养菌液1.0 mL置于灭菌的1.5 mL离心管中,100 ℃水浴锅内加热5 min后0 ℃冰浴7 min,然后13000 r/min离心6 min,收集上清液,-20 ℃保存备用。
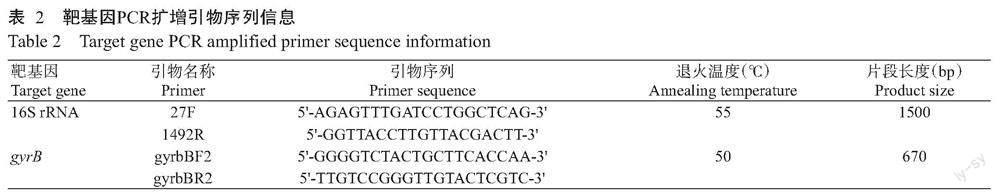
1. 2. 5 气单胞菌基因引物设计 选择16S rRNA序列和gyrB基因为靶基因(表2)。gyrB基因擴增引物为气单胞菌多位点分型管家基因标准引物(https://pubmlst.org/),16S rRNA序列扩增引物参考韦小瑜等(2016)的方法进行设计。
1. 2. 6 16S rRNA序列和gyrB基因扩增及测序分析 根据2×Taq DNA聚合酶预混液试剂使用说明,优化PCR反应体系50.0 µL:2×Taq DNA聚合酶预混液25.0 µL,上、下游引物各1.0 µL,DNA模板2.0 µL,双蒸水补足至50.0 µL。扩增程序:95 ℃预变性150 s;95 ℃ 15 s,50 ℃ 30 s,72 ℃ 1 min,进行34个循环;72 ℃延伸10 min。PCR扩增产物经1.0%琼脂糖凝胶电泳(120 V,30 min)检测合格后,送至生工生物工程(上海)股份有限公司测序。
1. 2. 7 菌株种属系统发育进化树构建 将测序获得的2段序列导入SeqMan进行拼接,并根据波峰消除重叠部分的错误,去除拼接后序列首尾2段杂乱峰部分,即得到新的DNA特征序列。选择维氏气单胞菌、嗜水气单胞菌、简达气单胞菌(A. jandaei)、杀鲑气单胞菌、温和气单胞菌(A. sobria)、肠源气单胞菌(A. enteropelogenes)、达卡气单胞菌(A. dhakensis)、豚鼠气单胞菌(A. caviae)、中间气单胞菌、异嗜糖气单胞菌(A. allosaccharophila)等10种气单胞菌属菌株,下载NCBI已公布且完成全基因组测序的气单胞菌属菌株,并采用基因的标准序列在其中检索这些菌株各自的16S rRNA序列和gyrB基因序列。通过MegAlign和MEGA 7.0删除新DNA特征序列多出的核苷酸及补正缺失的核苷酸,将修正好的序列剪切至统一长度。将标准菌株和待测菌株的序列共同导入MEGA 7.0中,选择邻接法(Neighbor-Joining,NJ)构建系统发育进化树,通过判断进化分支上的已有标准菌株来确定菌株种属,Bootstrap设为1000次。
2 结果与分析
2. 1 气单胞菌属菌株培养及其生理生化鉴定结果
分离获得的气单胞菌属菌株在LB固体培养基上能形成光滑圆润、半透明、淡黄色的较小菌落(图1)。AHM半固体培养基穿刺培养时,菌株沿着穿刺孔向培养基内侧扩散蔓延即具有运动性,若菌株只在穿刺孔道壁上生长则表明菌株没有运动性。气单胞菌属菌株的AHM半固体培养基运动性鉴定结果见图2。糖发酵试验的指示剂为溴甲酚紫,当颜色由紫色变黄色即说明气单胞菌能分解糖类产酸,促使培养基环境pH下降而变色。气单胞菌属菌株的糖发酵试验结果见图3。
依据GB/T 18652—2002《致病性嗜水气单胞菌检验方法》进行判定,结果(表4)显示:有11株菌株的8项指标均呈阳性,判为嗜水气单胞菌;3株运动性阴性的菌株为杀鲑气单胞菌;另外21株菌株中,有1株氧化酶呈阳性而蔗糖呈阴性的判为简达气单胞菌,10株阿拉伯糖呈阴性的判为维氏气单胞菌,10株阿拉伯糖呈阳性但七叶苷和水杨苷呈阴性的判为温和气单胞菌。同时根据《伯杰氏细菌鉴定手册》(第8版)及《常见细菌鉴定手册》(2001年版),蔗糖、阿拉伯糖和七叶苷在嗜水气单胞菌、中间气单胞菌、豚鼠气单胞菌及维氏气单胞菌上均存在假阴性或假阳性现象,即上述菌株判断可能存在一定的假定误差。
2. 2 气单胞菌属菌株溶血试验结果
观察脱纤维羊血琼脂培养基若出现红色消退,则代表培养基内血细胞被破坏,出现溶血现象。气单胞菌属菌株溶血试验结果(图4)显示,除了BYK07和BYK08菌株为γ溶血(不溶血)外,其余菌株均为β溶血(完全溶血),基本符合气单胞菌均存在一定毒力因子的情况。
2. 3 靶基因PCR扩增电泳观察及其测序分析结果
由图5可看出,气单胞菌属菌株的16S rRNA序列和gyrB基因PCR扩增产物分别在1000~2000和500~750 bp处出现单一明亮的目的条带,与预期结果相符,可进行下一步测序分析。将测序得到的16S rRNA序列和gyrB基因核苷酸序列文件导入SeqMan,通过波峰图形式进行观察。双向测序波峰相互拼接,且以2段波峰独立不交错为优,中间的核苷酸序列相互吻合,呈现较好的波峰性状。其部分序列测序波峰如下图5所示。
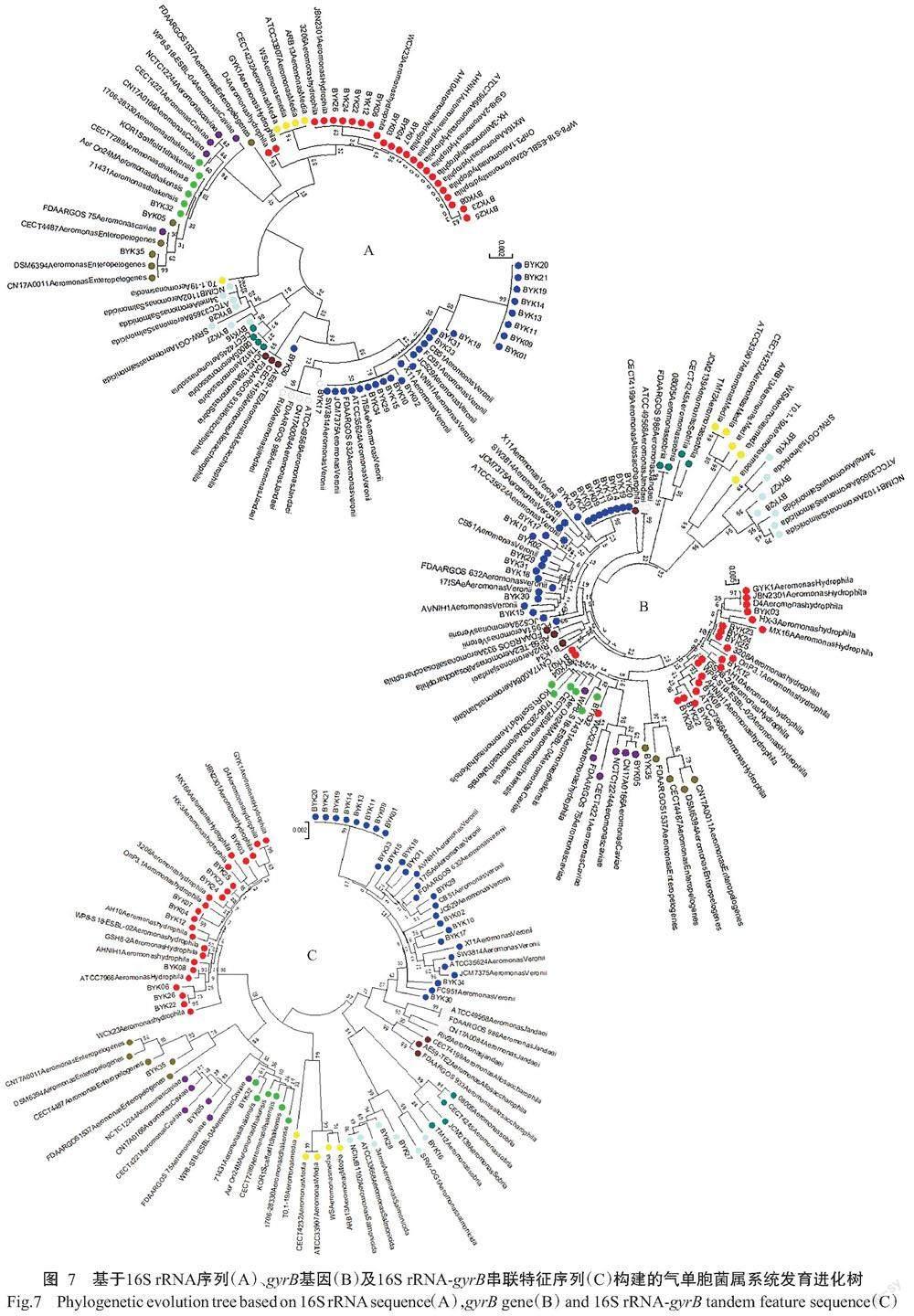
2. 4 16S rRNA序列和gyrB基因联合构建系统发育进化树
系统发育进化树显示:在基于16S rRNA序列构建的系统发育进化树(图7-A)中,中间气单胞菌、嗜水气单胞菌、达卡气单胞菌、肠源气单胞菌等聚类在不同分支上,未能形成独立的种属进化分支。在基于gyrB基因构建的系统发育进化树(图7-B)中,达卡气单胞菌、豚鼠气单胞菌和嗜水气单胞菌聚类在同一分支上,而异嗜糖气单胞菌和维氏气单胞菌聚类在同一分支上。说明基于这2个基因序列单独构建系统发育进化树时均存在一定的干扰分支,而影响菌株的鉴定判断。将这2个基因序列串联组成新DNA特征序列再构建系统发育进化树建树(图7-C),则能完全有效分离气单胞菌属的不同菌株(表5)。
表 5 气单胞菌属菌株鉴定结果
Table 5 Strain identification results of strains of Aeromonas
[菌株 Strain 16S rRNA gyrB 16S rRNA-gyrB BYK01 维氏气单胞菌 维氏气单胞菌 维氏气单胞菌 BYK02 维氏气单胞菌 维氏气单胞菌 维氏气单胞菌 BYK03 嗜水气单胞菌 嗜水气单胞菌 嗜水气单胞菌 BYK04 嗜水气单胞菌 嗜水气单胞菌 嗜水气单胞菌 BYK05 肠源气单胞菌 豚鼠气单胞菌 豚鼠气单胞菌 BYK06 嗜水气单胞菌 嗜水气单胞菌 嗜水气单胞菌 BYK07 嗜水气单胞菌 嗜水气单胞菌 嗜水气单胞菌 BYK08 嗜水气单胞菌 嗜水气单胞菌 嗜水气单胞菌 BYK09 维氏气单胞菌 维氏气单胞菌 维氏气单胞菌 BYK10 维氏气单胞菌 维氏气单胞菌 维氏气单胞菌 BYK11 维氏气单胞菌 维氏气单胞菌 维氏气单胞菌 BYK12 嗜水气单胞菌 嗜水气单胞菌 嗜水气单胞菌 BYK13 维氏气单胞菌 维氏气单胞菌 维氏气单胞菌 BYK14 维氏气单胞菌 维氏气单胞菌 维氏气单胞菌 BYK15 维氏气单胞菌 维氏气单胞菌 维氏气单胞菌 BYK16 杀鲑气单胞菌 杀鲑气单胞菌 杀鲑气单胞菌 BYK17 简达气单胞菌 维氏气单胞菌 维氏气单胞菌 BYK18 维氏气单胞菌 维氏气单胞菌 维氏气单胞菌 BYK19 维氏气单胞菌 维氏气单胞菌 维氏气单胞菌 BYK20 维氏气单胞菌 维氏气单胞菌 维氏气单胞菌 BYK21 维氏气单胞菌 维氏气单胞菌 维氏气单胞菌 BYK22 嗜水气单胞菌 嗜水气单胞菌 嗜水气单胞菌 BYK23 嗜水气单胞菌 嗜水气单胞菌 嗜水气单胞菌 BYK24 嗜水气单胞菌 嗜水气单胞菌 嗜水气单胞菌 BYK25 嗜水气单胞菌 嗜水气单胞菌 嗜水气单胞菌 BYK26 嗜水气单胞菌 嗜水气单胞菌 嗜水气单胞菌 BYK27 杀鲑气单胞菌 杀鲑气单胞菌 杀鲑气单胞菌 BYK28 杀鲑气单胞菌 杀鲑气单胞菌 杀鲑气单胞菌 BYK29 维氏气单胞菌 维氏气单胞菌 维氏气单胞菌 BYK30 维氏氣单胞菌 维氏气单胞菌 维氏气单胞菌 BYK31 维氏气单胞菌 维氏气单胞菌 维氏气单胞菌 BYK32 达卡气单胞菌 达卡气单胞菌 达卡气单胞菌 BYK33 维氏气单胞菌 维氏气单胞菌 维氏气单胞菌 BYK34 维氏气单胞菌 异嗜糖气单胞菌 维氏气单胞菌 BYK35 肠源气单胞菌 肠源气单胞菌 肠源气单胞菌 ]
3 讨论
在我国,目前仅有嗜水气单胞菌和杀鲑气单胞菌的国标及维氏气单胞菌的行标3种检测标准可供参考,其他气单胞菌的鉴定方法暂时参考国外的相关标准;此外,我国养殖水环境复杂,菌株可能存在基因的选择性表达,导致部分研究结果存在明显差异。生理生化试验存在较多不确定性,各气单胞菌属菌株对单项检测项目也存在部分菌株呈阳性、部分菌株呈阴性的可能。在菌株样本量足够的情况下,通常能统计出各项指标间的规律性而划分菌种类别(胡静仪和王金良,2004)。但试验菌株样本量小甚至仅有1株的情况下,若检测中存在多个假阳性项目,其生理生化鉴定结果累加后出现误判的可能性明显增加。因此,针对单株菌株鉴定时通常选择更加精细的16S rRNA序列鉴定法。综合生理生化鉴定结果与测序结果可发现,基于16S rRNA和gyrB基因串联特征序列构建的系统发育进化树与生理生化试验结果的吻合率仅为48.6%,其中多数误差出现在生理生化试验鉴定为温和气单胞菌的菌株上。
采用16S rRNA序列鉴定时,也会因为基因片段包含信息少等情况而出现误差。Tindall等(2010)研究认为,序列同源性在97%以上为同一个种,序列同源性在95%以上则为同一个属。在GenBank中也发现,在默认显示100条相近结果下,16S rRNA序列同源性均在99.92%以上;扩大搜索至1000条相近结果时,16S rRNA序列同源性仍维持在99.50%以上,且检索结果中各种气单胞菌属菌株均有出现。因此,需要通过增加测序基因,增大鉴定信息量,最大限度减少这种情况的出现。Michael Soler等(2004)、Janda和Abbott(2010)研究表明,gyrB基因是气单胞菌管家基因中相对保守但又存在一定变异的基因。在GenBank中,gyrB基因在100条相近结果下只能达90%~95%的同源性,表明gyrB基因能实现同属不同种的精准识别。gyrB基因在鉴定分类上较16S rRNA序列更加精确,在气单胞菌及其他水产养殖致病菌中均已得到验证(黄慧等,2019;蔡红艳等,2021;冯震等,2021;傅奇等,2021)。可见,gyrB基因在气单胞菌鉴定分类上更具优势。但系统发育进化不仅仅依据核苷酸序列相似性,同时受序列排序变化等多个因素的影响。在基于gyrB基因构建的系统发育进化树中也存在菌株交叉情况,为此本研究采用16S rRNA序列和gyrB基因串联特征序列构建系统发育进化树,该方法在芽孢杆菌(朱成科等,2017;傅奇等,2020a,2020b,2021)和弧菌(冯震等,2021)上已有研究报道。本研究结果表明,将16S rRNA序列与gyrB基因串联组成新DNA特征序列再构建系统发育进化树,较基于16S rRNA序列或gyrB基因单独构建系统发育进化树具有更高的分辨力,是一种理想的保守序列相似性高的属内菌种鉴定方法。因此,在16S rRNA测序鉴定为气单胞菌的情况下可再次以gyrB基因为测序对象,获得序列信息后与16S rRNA序列串联构建系统发育进化树,能更加精确地将气单胞菌鉴定到种水平。
4 结论
将16S rRNA序列和gyrB基因串联组成新DNA特征序列再构建系统发育进化树,较基于16S rRNA序列或gyrB基因单独构建系统发育进化树具有更高的分辨力,是一种理想的保守序列相似性高的属内菌种鉴定方法。因此,在16S rRNA测序鉴定为气单胞菌的情况下可再次以gyrB基因为测序对象,获得序列信息后与16S rRNA序列串联构建系统发育进化树,能更加精确地将气单胞菌鉴定到种水平。
参考文献:
蔡红艳,方玉洁,于可艺,黄振洲,代航,王多春. 2021. 基于16S rRNA和gyrB基因的施万菌种水平鉴定分析[J]. 疾病监测,36(1):42-47. [Cai H Y,Fang Y J,Yu K Y,Huang Z Z,Dai H,Wang D C. 2021. Identification of Shewanella at species level based on 16S rRNA and gyrB genes[J]. Disease Surveillance,36(1):42-47.] doi:10. 3784/jbjc.202007130239.
戴瑜来,戴杨鑫,马恒甲,黄辉,林启存,许宝青. 2019. 气单胞菌对水生动物的危害及噬菌体防控研究进展[J]. 水产养殖,40(2):48-50. [Dai Y L,Dai Y X,Ma H J,Huang H,Lin Q C,Xu B Q. 2019. Research progress on the harm of Aeromonas to aquatic animals and phage prevention and control[J]. Journal of Aquaculture,40(2):48-50.] doi:10.3969/j.issn.1004-2091.2019.02.017.
邓玉婷,谭爱萍,张瑞泉,赵飞,姜兰. 2019. 广东主要水产养殖地区气单胞菌耐药状况的调查分析[J]. 南方农业学报,50(11):2375-2383. [Deng Y T,Tan A P,Zhang R Q,Zhao F,Jiang L. 2019. Antimicrobial resistance of Aeromonas isolates from aquaculture areas in Guangdong[J]. Journal of Southern Agriculture,50(11):2375-2383.] doi:10.3969/j.issn.2095-1191.2019.11.01.
冯震,张芝华,肖珊珊,张欢,秦峰,楊美成. 2021. 基于16S rRNA和gyrB基因串联DNA特征序列的副溶血性弧菌鉴定[J]. 上海预防医学,33(5):372-376. [Feng Z,Zhang Z H,Xiao S S,Zhang H,Qin F,Yang M C. 2021. Identification of Vibrio parahaemolyticus based on the concatenated DNA sequencing of 16S rRNA and gyrB gene[J]. Shanghai Journal of Preventive Medicine,33(5):372-376.] doi:10.19428/j.cnki.sjpm.2021.20874.
傅奇,甘美裕,王艳,林俊杰,卢源钦,肖玉娟. 2021. 16S与gyrB基因联合建树快速鉴定一株蜡样芽孢杆菌[J]. 食品与生物技术学报,40(10):98-103. [Fu Q,Gan M Y,Wang Y,Lin J J,Lu Y Q,Xiao Y J. 2021. Rapid identification of a Bacillus cereus strain with phylogenetic tree based on combination of 16S and gyrB gene[J]. Journal of Food Science and Biotechnology,40(10):98-103.] doi:10.3969/j.issn.1673-1689.2021.10.013.
傅奇,林俊杰,冯亚栋,肖玉娟. 2020a. 16S与gyrB基因联合建树快速鉴定一株解淀粉芽胞杆菌[J]. 食品与发酵工业,46(12):116-120. [Fu Q,Lin J J,Feng Y D,Xiao Y J. 2020a. Identification of a Bacillus amyloliquefaciens strain using a phylogenetic tree based on 16S and gyrB gene sequences[J]. Food and Fermentation Industries,46(12):116-120.] doi:10.13995/j.cnki.11-1802/ts.023253.
傅奇,林俊杰,甘美裕,卢源钦,肖玉娟. 2020b. 16S与gyrB基因联合建树快速鉴定海水中的一株地衣芽胞杆菌[J]. 海洋科学,44(4):90-95. [Fu Q,Lin J J,Gan M Y,Lu Y Q,Xiao Y J. 2020b. Identification of a Bacillus licheniformis strain from seawater using a phylogenetic tree based on 16S and gyrB gene sequences[J]. Marine Sciences,44(4):90-95.] doi: 10.11759/hykx20191018002.
胡静仪,王金良. 2004. 气单胞菌属分类与鉴定方法[J]. 国外医学(临床生物化学与检验学分册),25(5):478-479. [Hu J Y,Wang J L. 2004. Classification and identification of Aeromonas[J]. Foreign Medical Sciences (Section of Medgeography),25(5):478-479.] doi:10.3969/j.issn.1673-4130.2004.05.034.
黄慧,李荣誉,樊国燕,裴亚玲,王晓琳,娄飞. 2019. 耐恩諾沙星沙门菌gyrA和gyrB基因的分子特征分析[J]. 河南农业科学,48(2):150-153. [Huang H,Li R Y,Fan G Y,Pei Y L,Wang X L,Lou F. 2019. Molecular characterization of gyrA and gyrB genes of enrofloxacin-resistant Salmonella[J]. Journal of Henan Agricultural Sciences,48(2):150-153.] doi:10.15933/j.cnki.1004-3268.2019.02.022.
刘赛. 2018. 基于16S rRNA序列可变区的微生物物种鉴定及分析[D]. 西安:西安电子科技大学. [Liu S. 2018. Taxonomic classification and analysis based on 16S rRNA variable regions[D]. Xi᾿an:Xidian University.] doi:10. 7666/d.D01663744.
麻强生,焦世璋,张小丽,李世瑛,马小军,刘倩. 2020. 鲟源海豚链球菌分离鉴定及药敏试验[J]. 甘肃农业大学学报,55(4):14-21. [Ma Q S,Jiao S Z,Zhang X L,Li S Y,Ma X J,Liu Q. 2020. Isolation,identification and drug sensitivity test of Streptococcus iniae from hybrid sturgeon[J]. Journal of Gansu Agricultural University,55(4):14-21.] doi:10.13432/j.cnki.jgsau.2020.04.003.
农业农村部渔业渔政管理局,全国水产技术推广总站,中国水产学会. 2021. 2020中国渔业统计年鉴[M]. 北京:中国农业出版社. [Fishery and Fishery Administration Bureau of the Ministry of Agriculture and Rural Affairs,National Fishery Technology Extension Station,China Aquatic Society. 2021. China fishery statistics yearbook 2020[M]. Beijing:China Agricultural Press.] doi:10.43455/y.cnki.yzytn.2021.000001.
史斌,龙塔,赵战勤,薛云. 2013. 16S rRNA序列分析在猪肠道细菌鉴定中的应用[J]. 河南农业科学,42(6):134-136. [Shi B,Long T,Zhao Z Q,Xue Y. 2013. Application of sequence analysis of 16S rRNA gene in identi-fying porcine intestinal bacteria[J]. Journal of Henan Agricultural Sciences,42(6):134-136.] doi:10.3969/j.issn. 1004-3268.2013.06.033.
宋元鍉,何晓青. 1990. 弧菌科、气单胞菌科和邻单胞菌属分类的进展[J]. 国外医学(微生物学分册),(6):262-264. [Song Y T,He X Q. 1990. Progress in the classification of Vibrio,Aeromonas,and Pseudomonas genera[J]. Foreign Medical Sciences (Section of Microbiology),(6):262-264.]
韦小瑜,游旅,田克诚,朱琳,张仁俊,吉光辉,唐光鹏,王定明. 2016. 4株气单胞菌临床分离株基于gyrB和rpoB基因序列的分子鉴定[J]. 应用预防医学,22(5):386-389. [Wei X Y,You L,Tian K C,Zhu L,Zhang R J,Ji G H,Tang G P,Wang D M. 2016. Molecular identification of 4 clinical Aeromonas isolates by gyrB and rpoB gene sequencing[J]. Journal of Applied Preventive Medicine,22(5):386-389.] doi:10.3969/j.issn.1673-758X.2016.05. 002.
朱成科,刘桂嘉,张争世,李明朔,雷骆,王建,邓星星,周朝伟,郑宗林. 2017. 黄颡鱼源维氏气单胞菌Aha和gyrB基因双重PCR检测方法的建立[J]. 中国预防兽医学报,39(10):810-814. [Zhu C K,Liu G J,Zhang Z S,Li M S,Lei L,Wang J,Deng X X,Zhou C W,Zheng Z L. 2017. Establishment of a duplex PCR assay based on Aha and gyrB genes for detection of Aeromonas veronii[J]. Chinese Journal of Preventive Veterinary Medicine,39(10):810-814.] doi:10.3969/j.issn.1008-0425.201704002.
Beaz-Hidalgo R,Shakèd T,Laviad S,Halpern M,Figueras M. 2012. Chironomid egg masses harbour the clinical species Aeromonas taiwanensis and Aeromonas sanarellii[J]. FEMS Microbiology Letters,337(1):48-54. doi:10.1111/1574-6968.12003.
Demarta A,Küpfer M,Riegel P,Harf-Monteil C,Tonolla M,Peduzzi R,Monera A,Saavedra M J,Martínez-Murcia A. 2008. Aeromonas tecta sp. nov.,isolated from clinical and environmental sources[J]. Systematic and Applied Microbiology,31(4):278-286. doi:10.1016/j.syapm.2008. 04.005.
Figueras M J,Alperi A,Beaz-Hidalgo R,Stackebrandt E,Brambilla E,Monera A,Martínez-Murcia A J. 2011. Aeromonas rivuli sp. nov.,isolated from the upstream region of a karst water rivulet[J]. International Journal of Systematic and Evolutionary Microbiology,61(2):242-248. doi:10.1099/ijs.0.016139-0.
Martínez-Murcia A J,Saavedra M J,Mota V R,Maier T,Stackebrandt E,Cousin S. 2008. Aeromonas aquariorum sp. nov.,isolated from aquaria of ornamental fish[J]. International Journal of Systematic and Evolutionary Microbiology,58(5):1169-1175. doi:10.1099/ijs.0.65352-0.
Michael Janda J,Abbott S L. 2010. The genus Aeromonas:Taxonomy,pathogenicity,and infection[J]. Clinical Microbiology Reviews,23(1):35-73. doi:10.1128/CMR. 00039-09.
Miñana-Galbis D,Farfán M,Carme Fusté M,Gaspar Lorén J. 2004. Aeromonas molluscorum sp. nov.,isolated from bivalve molluscs[J]. International Journal of Systematic and Evolutionary Microbiology,54(6):2073-2078. doi:10.1099/ijs.0.63202-0.
Miñana-Galbis D,Farfán M,Carme Fusté M,Gaspar Lorén J. 2007. Aeromonas bivalvium sp. nov.,isolated from bivalve molluscs[J]. International Journal of Systematic and Evolutionary Microbiology,57(3):2073-2078. doi:10. 1099/ijs.0.64497-0.
Miñana-Galbis D,Farfán M,Gaspar Lorén J,Carme Fusté M. 2009. Proposal to assign Aeromonas diversa sp. nov. as a novel species designation for Aeromonas group 501[J]. Systematic and Applied Microbiology,33(1):15-19. doi:10.1016/j.syapm.2009.11.002.
Mokracka J,Krzyminska S,Szczuka E. 2001. Virulence factors of clinical isolates of Aeromonas caviae[J]. Folia Microbiologica,46(4):321-326. doi:10.1007/bf02815621.
Pidiyar V,Kaznowski A,Badri Narayan N,Bpatole M,Shouche Y S. 2002. Aeromonas culicicola sp. nov.,from the midgut of Culex quinquefasciatus[J]. International Journal of Systematic and Evolutionary Microbiology,52(5):1723-1728. doi:10.1099/00207713-52-5-1723.
Saha P,Chakrabarti T. 2006. Aeromonas sharmana sp. nov.,isolated from a warm spring[J]. International Journal of Systematic and Evolutionary Microbiology,56(8):1905-1909. doi:10.1099/ijs.0.63972-0.
Soler L,Yánez M A,Chacon M R,Aguilera-Arreola M G,Catalán V,Figueras M J,Martínez-Murcia A J. 2004. Phylogenetic analysis of the genus Aeromonas based on two housekeeping genes[J]. International Journal of Systematic and Evolutionary Microbiology,54(5):1511-1519. doi:10.1099/ijs.0.03048-0.
Tindall B J,Rosselló-Móra R,Busse H J,Ludwig W,Kämpfer P. 2010. Notes on the characterization of prokaryote strains for taxonomic purposes[J]. International Journal of Systematic and Evolutionary Microbiology,60(1):249-266. doi:10.1099/ijs.0.016949-0.
(責任编辑 兰宗宝)
收稿日期:2022-06-08
基金项目:国家重点研发计划“蓝色粮仓科技创新”重点专项(2019YFD0900102);国家淡水水产种质资源库建设项目(FGRC:18537)
通讯作者:胡鲲(1976-),https://orcid.org/0000-0003-4541-2917,博士,教授,博士生导师,主要从事水生动物医学研究工作,E-mail:khu@shou.edu.cn
第一作者:陈天楠(1997-),https://orcid.org/0000-0001-5626-8725,研究方向为水生动物医学,E-mail:1350735975@qq.com
