乳腺颗粒细胞瘤的影像学表现及临床病理学特征分析
2023-11-01邓亚兰
邓亚兰,刘 莉
复旦大学附属肿瘤医院放射诊断科,复旦大学上海医学院肿瘤学系,上海 200032
颗粒细胞瘤(granular cell tumor,GCT)是一种罕见的具有Schwann细胞分化的神经源性肿瘤。GCT可发生于身体各部位,以口腔、胃肠道及头颈部多见,发生于乳腺的GCT(GCT-B)十分罕见,占所有GCT的5%~15%[1],目前国内多为个案报道[1-3],其影像学表现相关的文献仍然较少。现回顾并分析11例GCT-B的影像学资料及临床病理学资料,旨在提高临床医师对该疾病的认识及诊断水平。
1 资料和方法
1.1 患者资料
收集2017年3月—2022年12月于复旦大学附属肿瘤医院诊治且经手术后病理学检查证实的11例GCT-B患者的数字化乳腺X线摄影(digital mammography,DM)、乳腺磁共振成像(magnetic resonance imaging,MRI)及临床病理学资料。其中1例女性患者于2007年发现右乳单发肿块,2017年自觉肿块缓慢增大来就诊。2例女性由体检筛查发现乳腺单发肿块。另8例患者既往体健,均为无意间发现乳腺单发肿块来诊,病程2周~8个月。均无明显乳房疼痛、压痛、皮肤改变及乳头溢液等情况。
1.2 检查方法
DM检查采用美国Hologic公司的Selenia数字乳腺机,女性患者常规行头尾位和内外斜位摄片,男性患者行头尾位摄片。乳腺MRI平扫及动态增强采用美国GE公司的Signa 1.5 T MRI设备及乳腺专用线圈。患者取俯卧位,双侧乳腺自然下垂。平扫序列及参数:脂肪抑制T2加权成像(T2-weighted imaging,T2WI)[重复时间(repetition time,TR)2 500~3 800 ms、回波时间(echo time,TE)90~110 ms]和T1加权成像(T1-weighted imaging,T1WI)(TR 480~960 ms,TE 10 ms),层厚5 mm,层间距1 mm。动态增强扫描采用三维快速梯度回波序列+脂肪抑制加水抑制T1WI扫描,TR 200 ms,TE 5 ms,视野32 cm×32 cm,矩阵256×160。对比剂采用钆喷替酸葡甲胺(Gd-DTPA),剂量0.1 mmol/kg,10 s内快速团注,继而快速团注10 mL生理盐水冲管。
1.3 图像分析
由2名乳腺放射科主治医师共同阅片,并达成一致意见。DM、MRI表现评估参照美国放射学会提出的乳腺影像报告和数据系统(Breast Imaging Reporting and Data System,BI-RADS)标准。DM观察乳腺腺体密度,病灶形态、边缘、密度及有无钙化。MRI观察病灶的信号、形态特征和动态增强表现。
2 结 果
2.1 一般情况
本组11例患者中,女性10例,男性1例,年龄20~66岁,中位年龄35岁,多为绝经前女性(8例)。本组均为单发病灶,4个位于右乳,7个位于左乳,10个病灶出现在乳腺上象限(表1,图1)。10例患者进行DM检查,6例患者进行乳腺MRI检查。临床触诊病灶质韧或硬,活动度好,均无明显乳房压痛、皮肤改变及乳头溢液情况,腋下未扪及肿大淋巴结。所有患者均行手术切除。2例患者还进行了前哨淋巴结活检,组织病理学转移均呈阴性。病理切除时的平均直径为14.1 mm(10~17 mm)。11例患者随访至今,均未出现肿瘤复发。平均随访时间为34.2个月(4~70个月)。
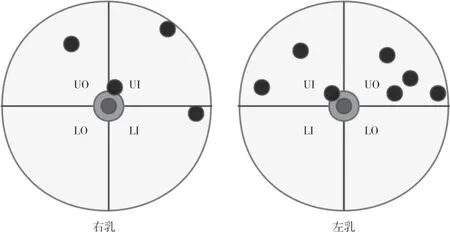
图1 本组GCT-B病灶分布图
2.2 DM表现
10例患者行DM检查,病灶呈等或高密度肿块,均不伴钙化,包括1例男性患者(表2,图2)。9例女性患者中,1例乳腺散在纤维腺体型(b型),5例为不均匀致密型(c型),3例为致密型(d型)。4例形态不规则,5例呈卵圆形,1例圆形。5例病灶边缘可见毛刺。BI-RADS 0、4A、4B、4C类分别为1、4、1、4例。
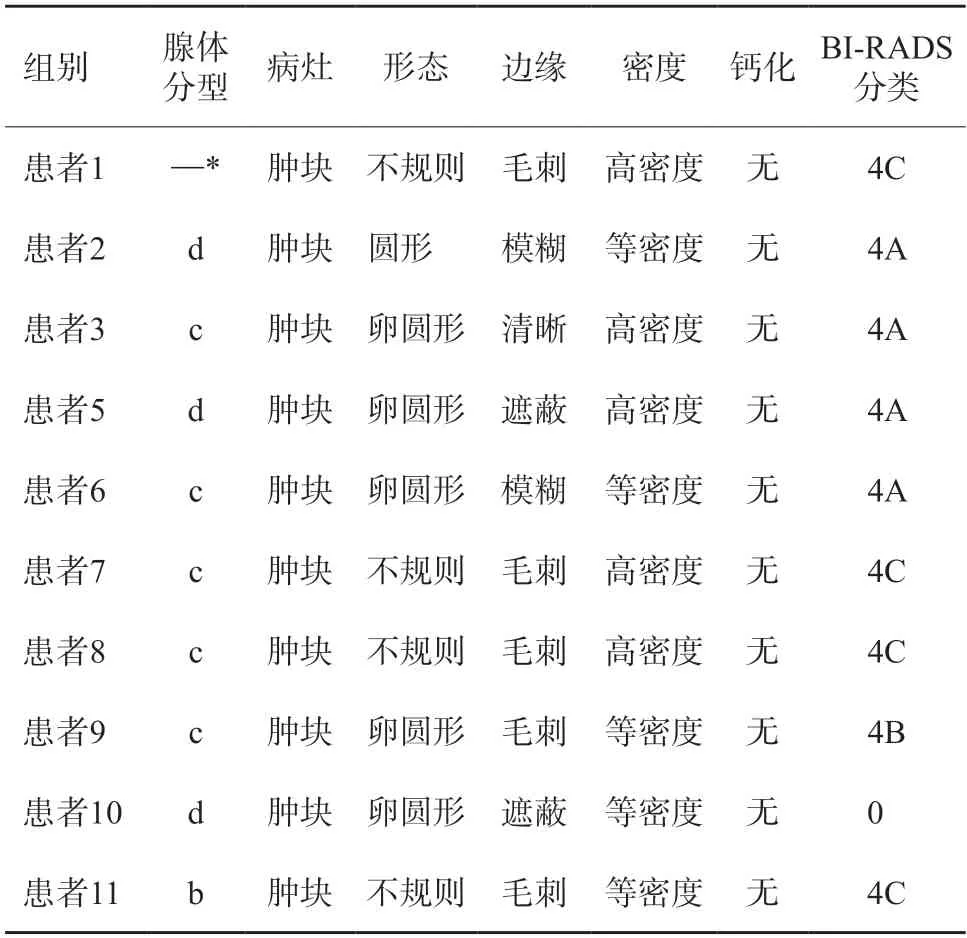
表2 原发性乳腺颗细胞瘤患者的DM表现
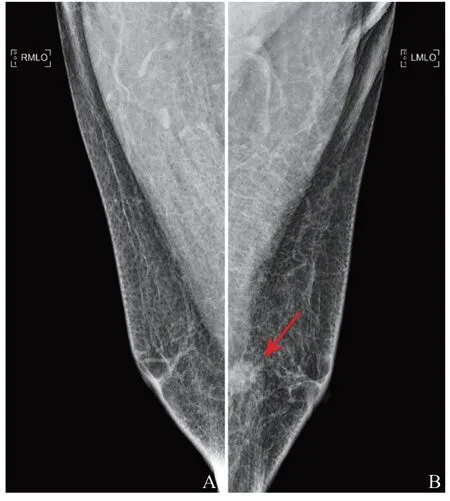
图2 患者1(男性,66岁)DM图像
2.3 MRI表现
6例患者行MRI平扫及动态增强检查(表3),2例形态不规则,2例呈卵圆形,2例圆形。3例边缘光整,3例边缘不光整。肿块T1WI呈等信号或低信号,T2WI上信号多变,以稍高信号为主(3例)。动态增强扫描早期快速强化,晚期持续强化(3例)或强化增强(3例)。1例病灶伴可疑胸肌受累(图3)。BI-RADS 4A类3例,BI-RADS 4B类1例,BI-RADS 4C类2例。
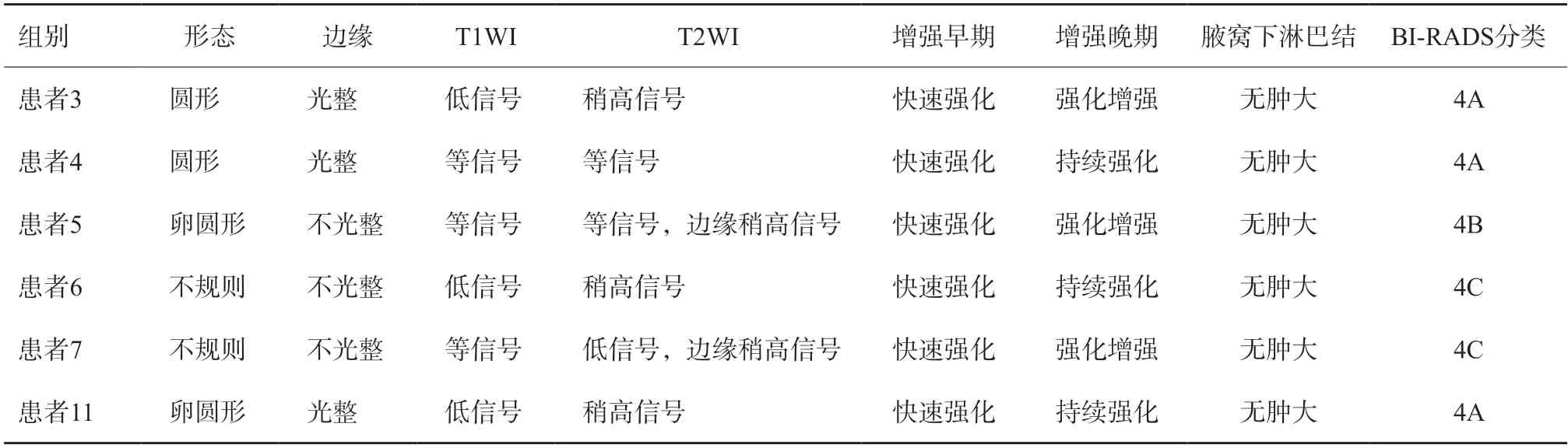
表3 原发性乳腺颗细胞瘤患者的乳腺MRI特征
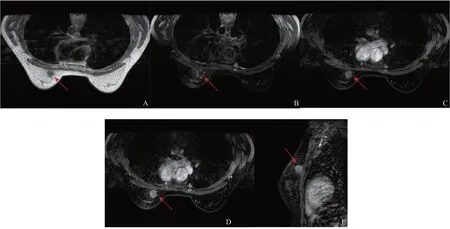
图3 患者7(女性,26岁)乳腺MRI图像
2.4 病理学检查结果
11例患者病灶均经手术切除。光镜下可见不规则排列的多边形细胞巢,瘤细胞体积较大,胞质丰富并呈嗜酸性颗粒状。免疫组织化学检查(表4):11例S-100阳性,10例SOX-10阳性,7例CD68阳性,5例Vimentin阳性,5例TFE3阳性,4例神经元特异性烯醇化酶(NSE)阳性,3例PGP9.5阳性,Ki-67增殖指数1%~10%。1例病理学诊断为非典型或恶性潜能未定的GCT(图4),其余均为良性GCT。
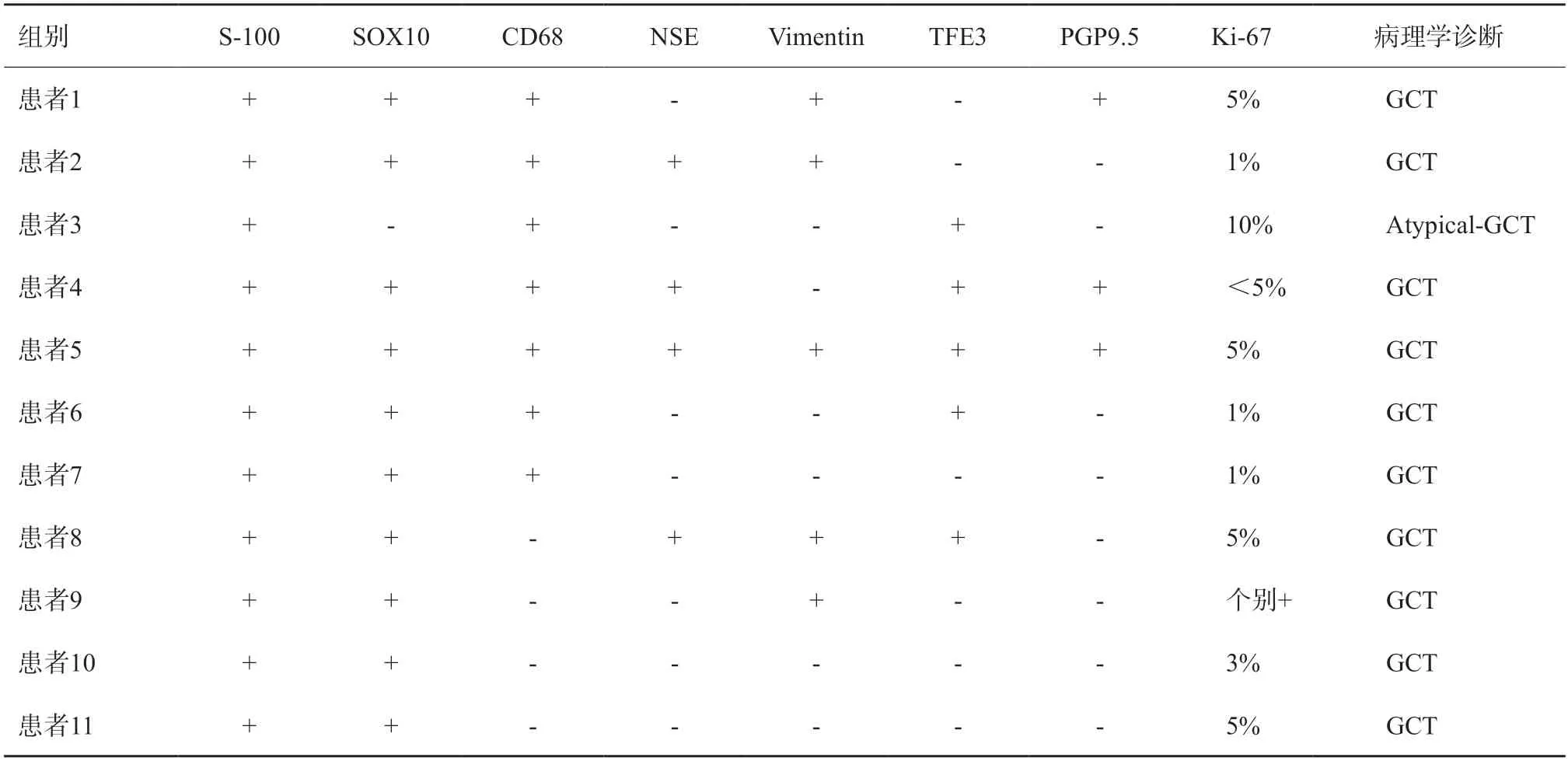
表4 原发性乳腺颗细胞瘤病理学及免疫组织化学检查结果
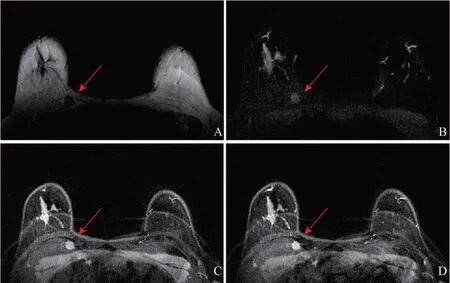
图4 患者3(女性,35岁)乳腺MRI图像
3 讨 论
1926年Abrikossoff首次报道GCT,当时GCT被认为起源于横纹肌细胞,并被命名为肌母细胞瘤[3]。经过多次关于其起源的争论,目前确定其起源于周围神经细胞,最广泛接受的理论是Schwann细胞起源[1,3]。免疫组织化学肿瘤细胞S-100强阳性表达是其神经源性起源的有力证据[4]。本组11例病灶S-100均呈强阳性。
GCT-B男女性皆可发生,男女性别比约为1∶9,多见于30~50岁的绝经前女性[1]。绝大多数GCT为良性,通常表现为乳腺实质内单发、质硬、活动度良好的无痛性肿块,直径多10~20 mm。象限切除术是其主要的治疗手段,保证切缘阴性的情况下预后良好,如果切缘阳性,有复发的可能[5]。仅约2%的GCT为恶性,其进展快,预后差,化疗及放疗效果尚不明确[3,6]。因此恶性GCT-B需行局部扩大切除或单侧乳房切除术,必要时行患侧腋窝淋巴结清扫。当GCT-B肿块直径>4 cm时,应高度怀疑为恶性[7]。GCT-B好发于乳腺内上象限[1,7-8],推测与该象限的周围神经细胞起源和锁骨上皮肤感觉神经的分布有关。本组11例GCT-B虽未观察到内上象限分布偏好,但有10例病灶发生在乳腺上象限。
DM图像上,GCT-B可显示边缘不规则、毛刺、星状等假恶性征象,易误诊为浸润性乳腺癌[9-10]。目前尚未见病灶内有钙化灶的报道,本组中10例行DM检查的病灶也均未出现钙化。GCT-B在DM上也可表现为边缘清晰、类圆形的高密度肿块,易误诊为乳腺纤维腺瘤。
MRI图像上,T1WI呈低或中等信号,虽然有文献[1,8]报道称GCT-B在T2WI图像上几乎看不到,但本组6例行MRI检查的病灶在T2WI上均能显示,以稍高信号为主,这与Corso等[5]的研究结论一致。增强MRI表现为不同程度的强化,可表现为缓慢强化,也可表现为快速强化和边缘强化[8]。本组病灶动态增强多表现为早期快速强化。
目前GCT主要依靠病理学检查及免疫组织化学检测确诊。GCT-B的镜下组织学特征和免疫表型具有特征性,可为诊断提供依据。GCT-B细胞多呈圆形或多角形,细胞质嗜酸性、粗颗粒状。免疫组织化学方面,文献[1,7,11]报道中均为S-100蛋白呈阳性,被认为是GCT的敏感性标志物。此外SOX10、CD68及NSE也有很高的阳性率。本组患者中,部分患者PGP9.5和Vimentin也呈阳性,提示其可能是GCT-B的标志物。Vimentin高表达在癌症中并不常见,有助于区分良恶性肿瘤[7]。而PGP9.5是神经和神经内分泌组织的标志物,存在于神经元和所有类型的人类神经内分泌细胞中[12]。
综上所述,GCT-B是一种罕见的乳腺肿瘤,临床症状和影像学表现无特异性,易误诊为浸润性乳腺癌或乳腺纤维腺瘤。对表现为乳房单发无痛小肿块、DM上肿块不伴钙化及MRI上肿块呈早期快速强化的年轻患者应警惕该病的可能性。诊断有困难时,应及早进行病理组织学检查。
