CEUS时间-强度曲线定量模型在宫颈癌同步放化疗中的应用价值
2023-11-01唐修亮
唐修亮,缪 青,杨 斌
1.南京医科大学金陵临床医学院,江苏 南京 210002;
2.江苏省肿瘤医院超声科,江苏 南京 210009
中晚期宫颈癌常采用放疗为主、化疗为辅的治疗策略,ⅡB~ⅣA期首选同步放化疗(concurrent chemoradiotherapy,CCRT)[1-2],对病灶的评估方法主要包括影像学检查[计算机体层成像(computed tomography,CT)、磁共振成像(magnetic resonance imaging,MRI)]和肿瘤标志物检测[糖类抗原(carbohydrate antigen)125、鳞状细胞癌抗原(squamous cell carcinoma antigen,SCCA)]等。超声在妇科疾病中被广泛应用,近年来经阴道超声检查诊断效能明显提高[3]。超声造影(contrast-enhanced ultrasound,CEUS)技术能够进一步显示病灶内部微血管灌注情况[4],对于病灶诊断、疗效评估均有重要的临床意义,已广泛应用于全身多脏器疾病诊疗工作。本研究旨在通过经阴道CEUS联合时间-强度曲线(time intensity curve,TIC)分析宫颈肿瘤在CCRT前后血流灌注变化情况,探讨其对中晚期宫颈癌CCRT的早期疗效评估价值。
1 资料和方法
1.1 研究对象
本研究是一项前瞻性研究,选择2018年8月—2020年8月于江苏省肿瘤医院放疗科接受CCRT的中晚期宫颈癌患者,依据纳入及排除标准,共纳入宫颈癌患者16例。纳入标准:依据国际妇产科联盟(International Federation of Gynecology and Obstetrics,FIGO)标准,2018年分期在ⅡB以上(不具备根治性手术条件);全程接受CCRT,CEUS及临床资料完整。排除标准:宫颈占位性病变侵犯阴道或放疗后阴道闭锁导致经阴道超声无法进行,有放化疗病史。
1.2 仪器与试剂
采用法国Supersonic公司的Imagine Aixplorer超声诊断仪,使用阴道超声探头SE12-3(频率3~12 MHz)。CEUS造影剂采用声诺维(SonoVue),定量分析软件为QontraXt V.3.06。
1.3 方法
1.3.1 CEUS检查及定量分析
检查前嘱患者排空膀胱,取截石位,无菌探头套包裹探头,于阴道后穹隆附近多方位探查宫颈,以病灶最佳切面进入CEUS模式,肘静脉团注造影剂2~4 mL,全程对宫颈CEUS过程进行录像。
CEUS定量分析采用软件对造影视频进行脱机分析。对于治疗前肿块边界清晰的肿块,感兴趣区(region of interest,ROI)为整个肿块,CCRT治疗后边界不清的肿块,ROI选择原肿块区,大小尽量保持一致。治疗前肿块边界不清时,ROI选择为整个宫颈。ROI选择时避开坏死区域,并去除坏帧。经软件分析得到TIC,并获得ROI的峰值强度(peak enhancement,PE)、达峰时间、伽马曲线的尖度(sharpness of the bolus,β)、曲线下面积(area under curve,AUC)(图1)。
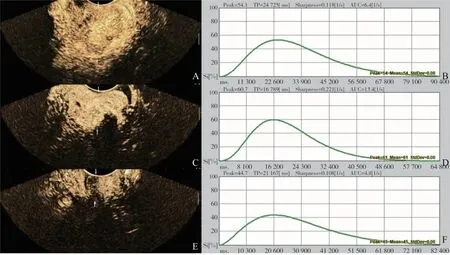
图1 典型病例(患者,女性,48岁,FIGO ⅢB期,TP方案)CCRT治疗前后CEUS和TIC
1.3.2 CCRT
外照射采用三维适形放射治疗。辐射能量为6 MV X射线,采用常规分割方法分剂量1.8~2.0 Gy,每天1次,每周5次,总照射次数25~28次,外照射总剂量45~50 Gy,部分患者根据淋巴结转移情况适当加量。当外照射剂量达到40 Gy时开始同步穿插腔内近距离放疗(intracavitary brachy therapy,ICBT)。腔内近距离放疗A点单次剂量为6~7 Gy/次,每周1次,A点总剂量为28~35 Gy。
放疗期间辅以同步化疗,根据患者病理学分期及耐受程度选择单药方案和TP方案,其中单药方案为奈达铂30 mg/m2静脉滴注化疗,于外照射后第1天或第2天开始第1次化疗,每周1个疗程,共进行3~6个疗程;TP方案为紫杉醇135 mg/m2第1天奈达铂70 mg/m2静脉滴注化疗,于外照射后第1或第2天开始第1次化疗,每3~4周1个疗程,共进行1~2个疗程[5]。
1.4 统计学处理
采用SPSS 26.0 软件对数据结果进行统计学分析。计数资料以n(%)表示,计数资料采用χ2检验。定量资料以±s表示,对定量资料进行正态性检验,符合正态分布采用配对样本t检验,不符合正态分布采用Mann-WhitneyU秩和检验。P<0.05为差异有统计学意义。
2 结 果
2.1 一般资料
本研究中,16例宫颈癌患者平均年龄(54.00±8.97)岁,病理学类型均为鳞状细胞癌,其中已绝经患者10例(62.5%)。根据FIGO分期,16例患者中ⅡB期8例、ⅢB期8例;根据化疗方式分组,单药组8例,TP组8例。
2.2 CEUS定量分析结果
治疗前行CEUS并进行定量分析,分析结果作为基线,并分别于CCRT治疗2周和外照射结束后再次进行CEUS,将其结果与基线进行对比(表1)。结果显示整体患者和TP组患者CCRT治疗2周及外照射结束后达峰时间分别较治疗前缩短(图2)。
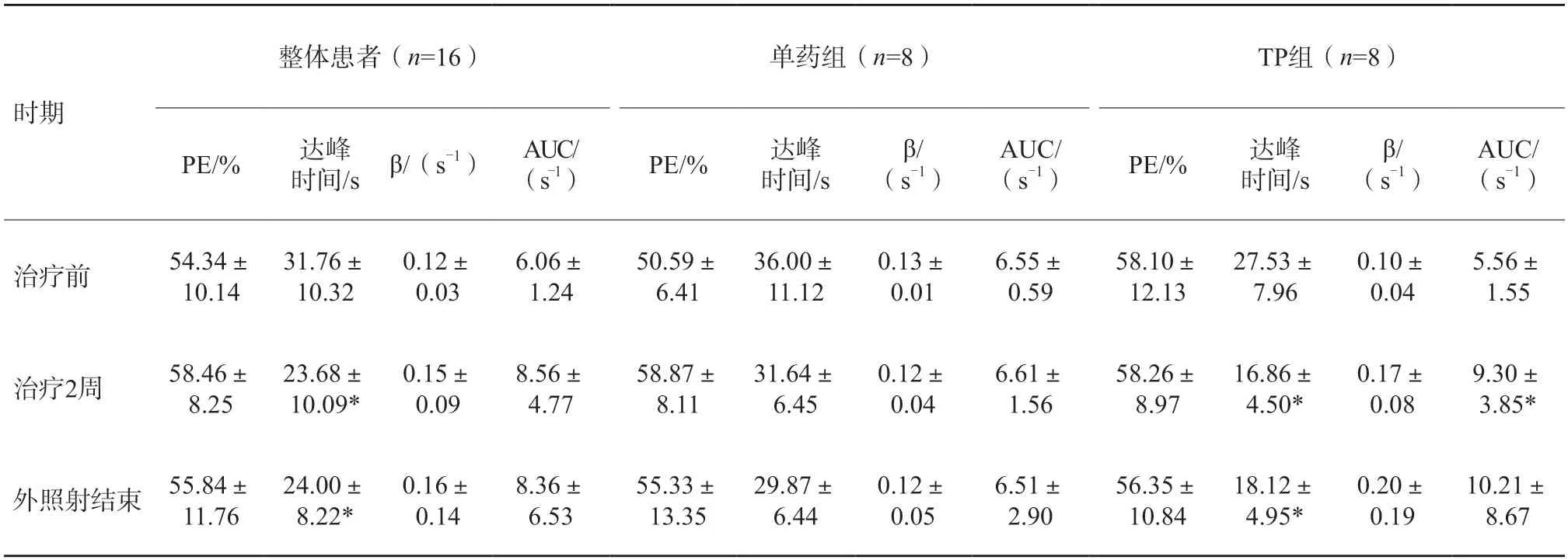
表1 CCRT治疗前后CEUS联合TIC曲线模型分析对比
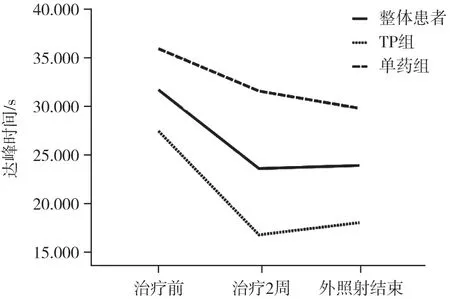
图2 整体患者、TP组、单药组治疗前后达峰时间变化情况
3 讨 论
宫颈癌是女性常见的恶性肿瘤,尽管许多国家和地区已经开展人乳头状瘤病毒疫苗接种和宫颈癌筛查,但世界范围内宫颈癌发病率和死亡率仍呈现升高趋势,中国肿瘤数据显示2005—2015年全国、城乡宫颈癌中国人口标化发病率和标化死亡率整体同样呈上升趋势[6-7]。CCRT是中晚期宫颈癌的首选治疗方法,常用的影像学评估手段包括CT和MRI等,但考虑到辐射、耗时和费用高等缺点,这些检查不宜频繁进行。与之相比,超声检查具有无辐射、价格低、动态观察和可重复性强的特点,可以根据需要在短期内多次检查。近年来随着CEUS技术的发展,通过超声能够观察病灶内部更加细微的血流灌注情况,其应用已从早期的仅限于病灶良恶性鉴别[8-9],扩展到在全身多脏器肿瘤疗效评估中发挥作用[10-12]。
在此背景下本研究旨在探讨经阴道CEUS在中晚期宫颈癌CCRT治疗中的应用价值,通过与TIC定量模型相结合,可近距离观察宫颈肿瘤内部微血管灌注情况并定量分析灌注变化情况[13-14],通过观察治疗过程中的病灶变化,探索其在早期对CCRT疗效评估方面的应用价值。
本实验中,CCRT 2周后,整体患者的肿瘤内部血流灌注发生了明显变化,主要表现为达峰时间较基线明显缩短,尽管整体平均峰值强度没有明显变化,但肿瘤内部的血流平均灌注速度显著增加。
有文献[15-16]报道的结果与本实验不同,其认为治疗后肿瘤内部血流灌注量减少,导致达峰时间延长。实际上,这些研究的观点与本研究的结论并不矛盾,造成不同结论的主要原因:首先,本研究中患者治疗采用了CCRT,与部分报道仅采用化疗不同。其次,本研究在治疗过程中选择了较早的评估时间点,即治疗2周及外照射结束后,并未选择在全部治疗结束后进行评估。CCRT治疗早期和全部治疗结束后肿瘤内部的血流灌注参数可能不同。
关于CEUS评估宫颈癌CCRT疗效的研究较少,但一些研究[17-18]采用CT和MRI等技术得出了与本实验类似的结果。有文献[19]报道,宫颈癌患者接受CCRT治疗平均3.3周后,动态增强CT(dynamic contrast enhanced CT,DCE-CT)显示肿瘤内部血容量(blood volume,BV)显著增加,与肿瘤的完全缓解显著相关,初期灌注较高或初期灌注较低治疗后增高的患者预后较好。尽管不同影像学技术的原理不同,但这一结果显示CCRT前期肿瘤内部血流可能有一定程度的增加,进一步验证了本研究中达峰时间缩短的准确性。因此,经阴道CEUS同样具有早期评估宫颈癌CCRT疗效的临床价值。
宫颈癌CCRT药物的选择多年来一直存在争议,研究认为在耐受性良好的前提下,与铂类单药加放疗相比,铂类联合化疗加放疗可提高局部晚期宫颈癌患者的生存率[20-21]。在本研究中,TP组在治疗2周及外照射结束后达峰时间明显缩短,而单药组没有明显变化,可能与TP方案的效果更加显著有关,这需要进一步的研究来验证。
本研究有一定的局限性,主要是样本数量有限且随访时间仅限于CCRT治疗过程中,这可能对结果产生一定影响。因此,需要更大样本量和多中心的合作研究来进一步验证。
综上所述,CEUS联合TIC能够反映宫颈癌CCRT治疗后肿瘤内部血流灌注的变化,具有一定的早期疗效评估价值,值得进一步研究。
