紫色红曲霉Mrr2基因的过表达对桔霉素积累的影响
2023-11-01唐光甫满海乔赵杰宏
唐光甫,满海乔,赵杰宏,韩 洁
(贵州中医药大学/贵州省中药生药学重点实验室,贵州贵阳 550025)
红曲霉的生产和应用在我国及许多亚洲国家有着悠久的历史,被广泛用于食品添加剂、葡萄酒工业和医疗保健等方面[1]。红曲霉在生长过程中能够产生多种具有生物活性的次级代谢产物,主要有红曲色素、洛伐他汀和γ-氨基丁酸[2-6]。红曲色素具有抗菌、抗肿瘤和抗氧化功能等生物活性[7-9],可以取代部分亚硝酸盐被用于肉制品中抑制细菌生长[10]。洛伐他汀是HMG-CoA还原酶抑制剂,已被FDA批准用于高脂血症的治疗,还作为紫杉醇治疗前列腺癌细胞的化学增敏剂[11]。但是,红曲霉在发酵过程中也会生产一种真菌毒素-桔霉素,其具有肝毒性、肾毒性、致癌和致畸作用[12-14],严重制约了红曲产业的发展。
目前,为了有效抑制红曲霉在发酵过程中桔霉素的积累,增加有益次级代谢产物的产生,国内外学者分别从菌种选育、发酵条件优化、分子调控等方面进行研究,并取得了重要进展。Zhen等[15]在发酵液中添加0.2 mol/L的NaCl能显著降低桔霉素的含量,并增加色素和洛伐他汀(Monacolin K)的产量。Hajjaj 等[16]利用同位素标记法深入探讨了13C在桔霉素中的部分生物合成途径,结果表明桔霉素和红曲色素均由聚酮类生物合成途径产生,前期均由1分子乙酰CoA 和3分子丙二酰CoA在 PKS酶的催化作用下形成四酮体,随后分开,一条途径与乙酰CoA缩合,通过甲基化、缩合、还原、甲氧基化、还原、氧化和脱水等步骤最终形成桔霉素;另一条路径是4个酮基的聚酮链与丙二酰辅酶A 缩合,形成红曲色素中间产物,然后经过一系列步骤最终形成红曲色素。目前桔霉素的合成调控网络还有很多步骤不清楚。
基因Mrr2是红曲霉中一个功能未经试验证实的基因,编码一种变位酶,推测在红曲霉代谢调控中有重要作用。该研究采用农杆菌介导遗传转化获得Mrr2过表达菌株,分析Mrr2基因对红曲霉中桔霉素合成的影响,初步证实Mrr2是红曲霉中桔霉素合成的重要调控基因。
1 材料与方法
1.1 菌株和试剂紫色红曲霉(Monascuspurpureus)菌株由贵州中医药大学生药学实验室提供。桔霉素标准品购自北京TM standard公司;Genegreen核酸染料、FastKing一步法除基因组cDNA 第一链合成预混试剂和Talent荧光定量检测试剂盒购自北京天根生化科技有限公司;柱式真菌总RNA抽提纯化试剂盒购自上海生工生物工程有限公司。Taq酶购自北京索莱宝科技有限公司;Mrr2 (GenBank: KT781075)过表达载体pGUS-Mrr2(含PgpdA-GUS-Mrr2-Tnos表达框)由武汉淼灵生物构建。
1.2Mrr2基因序列分析利用Primer 5 plus设计Mrr2引物序列(表1),PCR扩增产物送北京六合华大基因公司测序验证。使用在线工具(http://linux1.softberry.com/berry.phtmL)预测Mrr2编码的氨基酸序列。用BLAST程序中的CD-search (http:// https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)预测Mrr2的功能。用MEGA 11进行同源性分析。
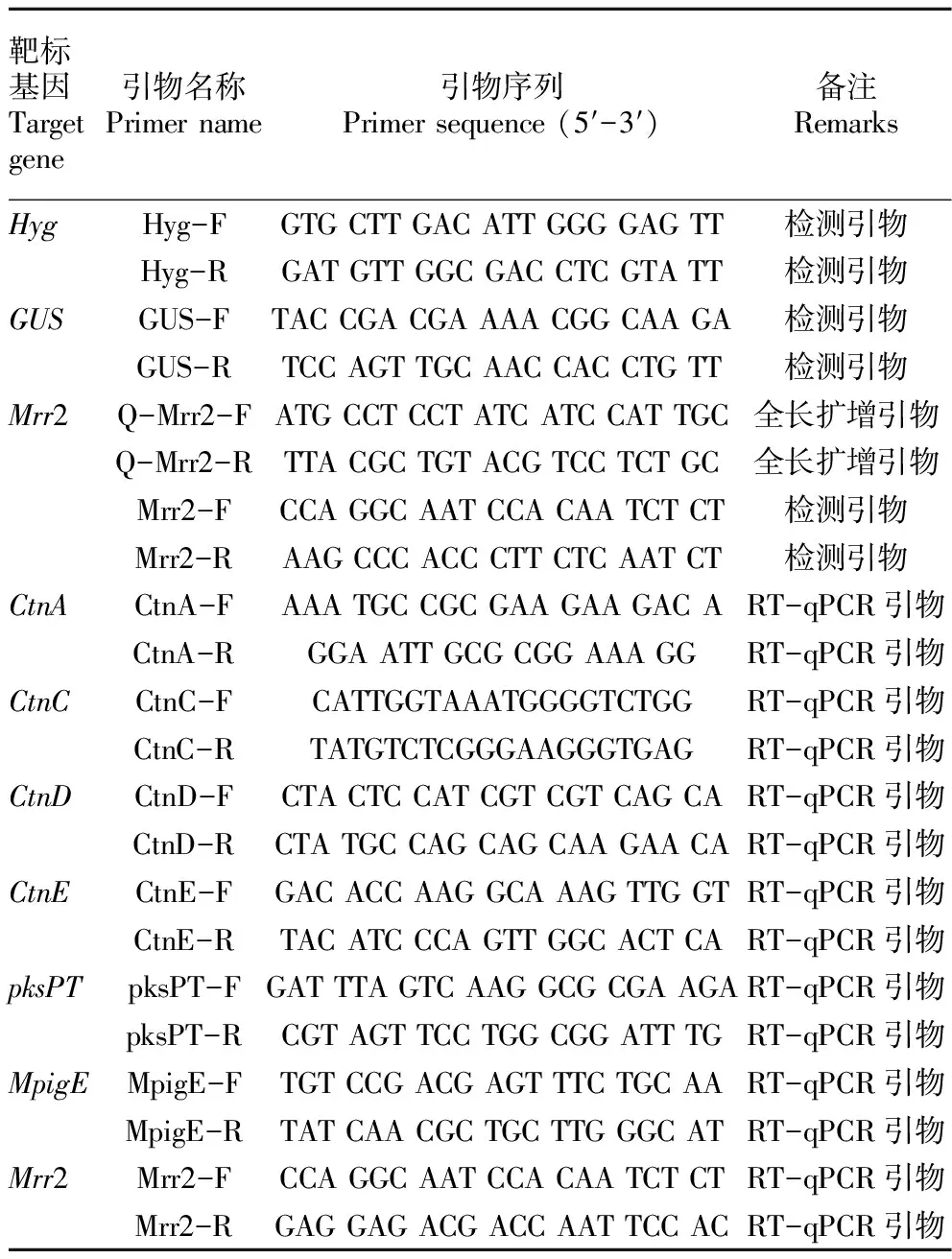
表1 PCR及RT-qPCR检测引物
1.3 农杆菌介导遗传转化将pGUS-Mrr2经冻融法转化农杆菌AGL1感受态,涂布在含50 mg/L 卡那霉素抗生素的固体LB培养基上筛选,对抗性单菌落进行PCR检测。将获得的阳性菌株在含50 mg/L 卡那霉素抗生素的液体LB培养基中培养,取菌液离心去除上清,用IM培养基稀释至OD600值为0.15~0.20,再在相同条件下培养4~6 h,至其OD600值为0.6~0.8。用农杆菌菌液稀释红曲霉孢子至10个/mL,取200 μL涂布于铺有0.45 μm硝酸纤维素膜的Co-IM平板上。25 ℃暗培养3 d,将长出的红曲霉菌落和硝酸纤维素膜一起揭下,倒置在含20 mg/L潮霉素和300 mg/L头孢霉素的培养基上筛选。待农杆菌无生长后揭下硝酸纤维素膜,挑取抗性红曲霉单菌落,利用Hyg和GUS引物(表1)进行PCR检测,对菌丝体进行GUS染色验证。
1.4 色素和洛伐他汀的检测将野生菌株(WT)和过表达菌株(Mrr2-1、Mrr2-2)的孢子悬液接种在沙氏液体培养基中,于28 ℃、140 r/min振荡培养14 d。过滤收集菌丝体,45 ℃干燥后粉碎。测定红曲色素时精密称取0.100 g菌丝体粉末于10 mL具塞试管中,加入10 mL 70%乙醇摇匀,60 ℃水浴1 h,取出冷却后补足至10 mL,过滤,将续滤液倒入25 mL容量瓶中定容,在410、465和 505 nm处分别测定黄、橙、红色素,并计算色价:色价(U/g)=吸光度×稀释倍数×浸提溶剂体积/样品质量。测定洛伐他汀时取1 mL发酵液于50 mL三角瓶中,加入9 mL 70%乙醇混匀。放入28 ℃恒温振荡器140 r/min振荡1 h后取出,加入2 mL离心管中,以4 200 r/min 离心5 min,取上清液,测定237 nm处吸光度来判断洛伐他汀含量。
1.5 桔霉素测定精密称取0.15 g干燥菌丝体加入10 mL甲醇,超声处理30 min后,70 ℃水浴1 h,用0.45 μm 滤膜过滤。色谱条件:C18柱 (4.6 mm×150 mm,5 μm),流动相为2% 醋酸水(磷酸溶液调节 pH至 2.5)∶乙腈=46∶54,流速1.0 mL/min;柱温28 ℃;检测器为PDA二极管阵列检测器。检测波长330 nm,进样量20 μL。
1.6 荧光定量检测按照试剂盒说明书提取液态培养14 d的红曲霉菌株的RNA,参照SYBR Green试剂盒进行RT-qPCR分析。用于基因表达分析的特异性基因CtnA(GenBank:AB243687)、CtnC(GenBank:AB243687)、CtnD(GenBank:EU309474)、CtnE(GenBank:EU309474)、Mrr2、pksPT(GenBank: JF832916)、MpigE(GenBank: KF285431)、Actin(AJ417880)如表1所示。qPCR 反应体系包括2 μL cDNA模板、10 μL 2×Talent qPCR PreMix、0.6 μL 10 μmol/L的正反向引物,ddH2O补足至20 μL。使用StepOne软件(ABI Applied Biosystems,USA)分析表达数据,采用 2-ΔΔCt法计算相对于内参基因Actin的转录水平。
1.7 数据统计及显著性分析试验数据以Graghpad prism软件分析,以“平均值±标准偏差”(Mean±SD)表示。分析方法为单因素方差分析、多重比较、Turkey检验。
2 结果与分析
2.1Mrr2基因克隆和序列分析从紫色红曲霉基因组中扩增了一个1 428 bp的DNA片段。Softberry在线工具分析Mrr2序列由5个开放阅读框(ORF)和4个内含子组成(图1 A)。CD-search预测Mrr2结构域发现,Mrr2属于(HP) super-family (HP_PGM_like),HP超家族结构域的保守催化核心是His残基,在反应过程中被磷酸化。主要包括辅助因子依赖和辅助因子独立的磷酸甘油酸变位酶(分别为dPGM和BPGM)、果糖-2,6-二磷酸酶(F26BP)、Sts-1、SixA和相关蛋白。利用MEGA 11软件进行同源性分析(图1 B)发现,Mrr2与M.ruber预测序列mrr2的同源性达100%,与Aspergillusclavatus的未知序列相似性达83.23%。

图1 Mrr2基因的序列结构(A)和同源性(B)分析Fig.1 Sequence structure (A) and homology (B) analysis of the Mrr2 gene
2.2Mrr2过表达菌株的获得过表达载体pGUS-Mrr2包含Mrr2与GUS形成的融合基因,经冻融法转化农杆菌AGL1感受态,对抗性平板上的农杆菌菌落进行PCR检测,得到抗性菌落,再与紫色红曲霉孢子悬液共培养,获得的抗性红曲霉菌株转接到含有潮霉素和头孢霉素的平板上进行筛选,对阳性红曲霉菌株及野生型的菌丝体进行GUS染色分析,可以清晰看到菌丝细胞内容物呈蓝色,而野生型细胞为透明无色或淡黄色(图2),表明转基因菌株能够正常表达GUS基因。利用Hyg和GUS引物进行PCR验证,均能扩增出正确的目的片段(图3),表明获得了转化成功的红曲霉菌株。对过表达菌株连续传代5次,能够稳定遗传,表明抗性菌株具有良好的稳定性。与野生菌株相比,过表达Mrr2的红曲霉菌株菌落直径较大,色素分泌偏多,气生菌丝蓬松、浓密且长(图4)。但后期区分不明显,可能是随着时间的延长,营养物质被消耗。推测Mrr2过表达以后能够促进红曲霉的生长。
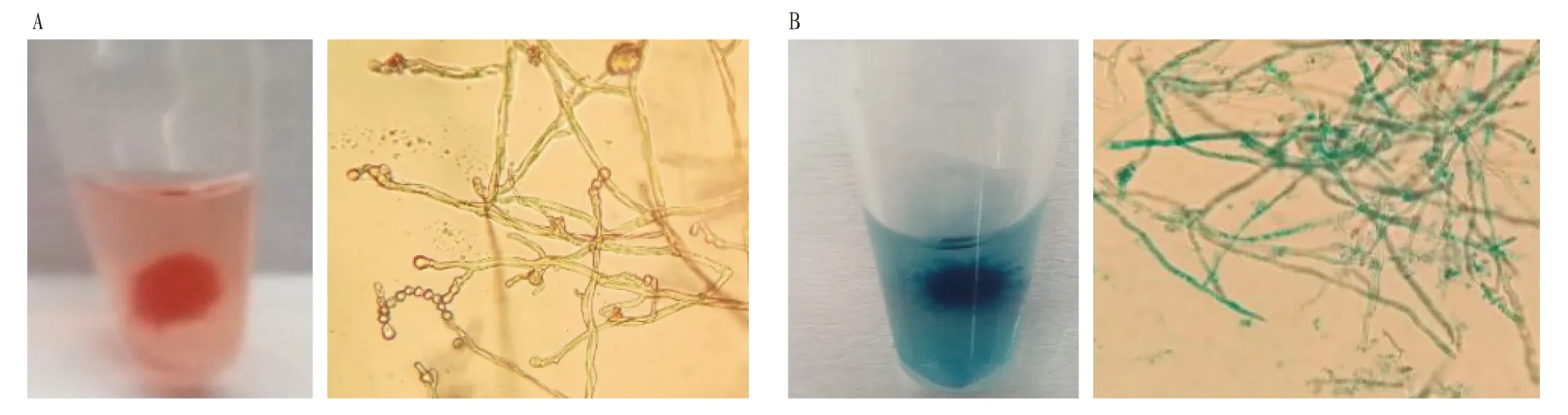
图2 野生型菌株(A)和过表达菌株(B)的GUS染色Fig.2 GUS staining of wild-type strain (A) and overexpressed strain (B)
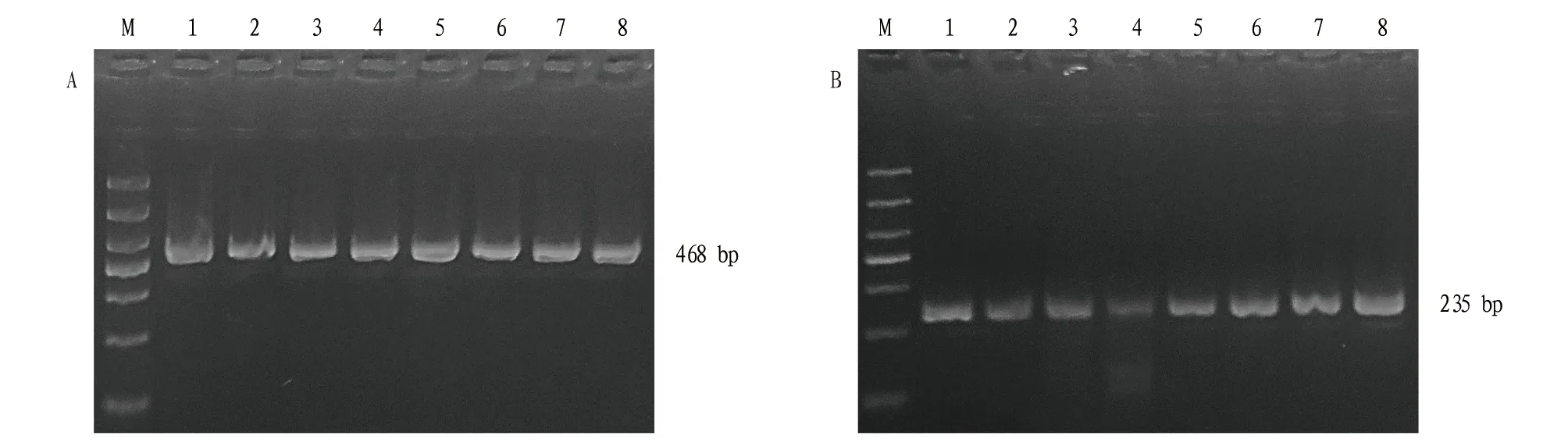
注:M为DL1000 DNA Marker;1~8为过表达菌株。Note:M represents DL1000 DNA Marker; 1-8 are overexpressed strains.图3 Hyg(A)和GUS(B)引物PCR检测Fig.3 Hyg (A) and GUS (B) primer PCR detection
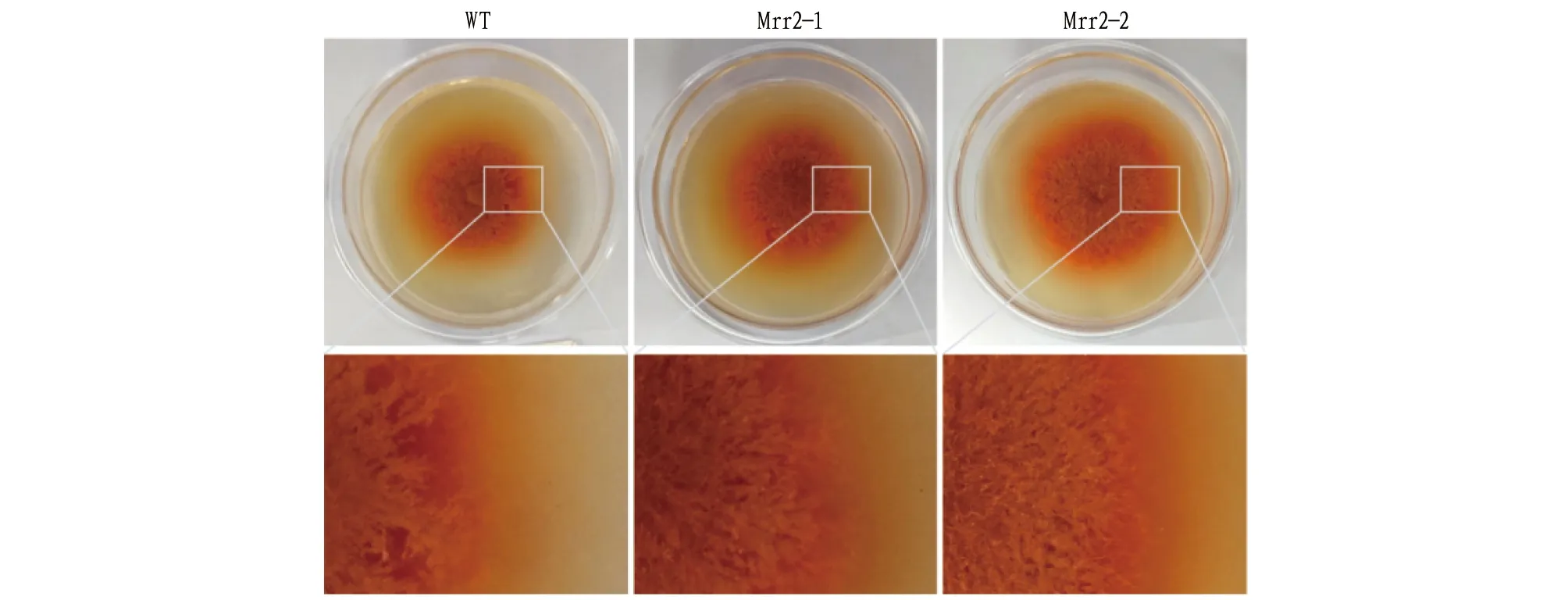
注:WT为野生菌株;Mrr2-1、Mrr2-2为过表达菌株。Note: WT is a wild strain; Mrr2-1 and Mrr2-2 are overexpressed strains.图4 Mrr2过表达红曲霉菌株的菌落特征Fig.4 Colony characteristics of Monascus strain overexpressed with Mrr2
2.3 色素和桔霉素分析采用HPLC检测桔霉素含量,与野生型菌株相比,胞内桔霉素产量增加了65%~151%,Mrr2过表达的菌株内红、黄、橙3种色素分别增加了20%~25%、14%~15%和12%~42%,胞外洛伐他汀含量有显著增加(图5~6)。胞外桔霉素略有增加,可能是发酵时间延长,部分菌体自溶,导致胞内桔霉素释放到发酵液中的原因。
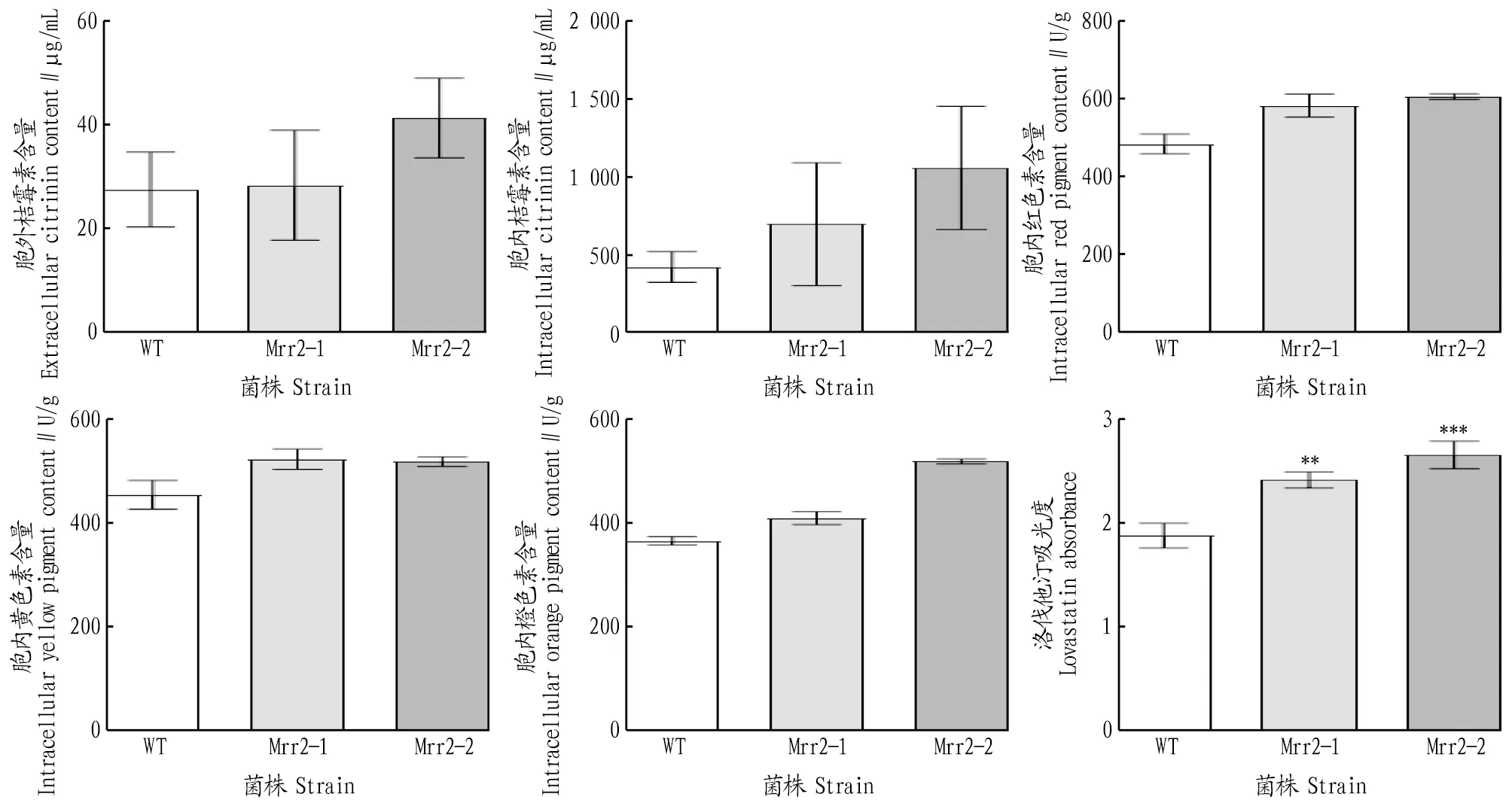
图6 过表达菌株胞内外化学成分的检测Fig.6 Detection of intracellular and extracellular chemical components of overexpressed strains
2.4 RT-qPCR分析为了检测Mrr2及其他桔霉素代谢相关基因的转录水平变化,经RT-qPCR分析结果显示,过表达菌株中Mrr2的转录表达量明显成倍增加,与桔霉素合成相关的CtnA、CtnD、CtnE、pksPT以及色素相关基因MpigE的转录有明显增加(图7),表明Mrr2的高表达引起其他桔霉素和色素合成相关基因的表达变化。
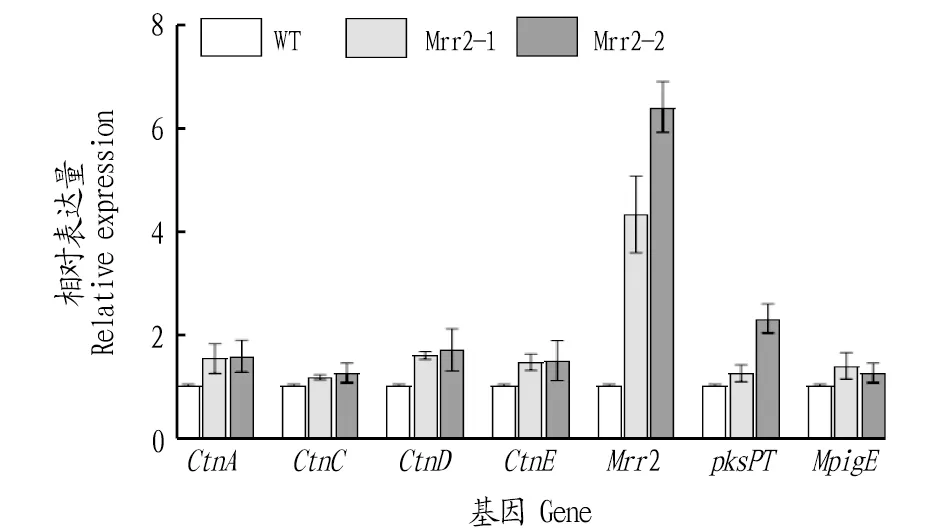
图7 Mrr2过表达菌株的RT-qPCR检测Fig.7 RT-qPCR detection of Mrr2 overexpressed strains
3 讨论与结论
桔霉素是一种由不同种类的曲霉、青霉和红曲霉菌等产生的真菌毒素[17],对人和动物都有肝肾毒性和基因毒性作用,对人类和动物健康构成了严重的风险,引起了人们对食用污染食物和饲料的担忧。因此研究桔霉素的合成调节机制对于消减和防控桔霉素污染有重要意义。
2010年,Jia等[18]通过农杆菌介导的转化成功破坏了紫色红曲霉SM001中的pksCT基因,导致该菌株基本丧失了产生桔霉素的能力。同样CtnB突变体也几乎不产生桔霉素[19],但是CtnG基因的破坏在降低了桔霉素的同时也降低了色素的产生[20]。用去除内含子的mpl6和mpl7共转化携带pksCT、npgA、mpl1、mpl2和mpl4的毕赤酵母菌株,在甲醇诱导下成功生产出桔霉素[21]。此外,G蛋白Gα亚基基因(Mga1)、Gβ亚基基因(Mgb1)或Gγ亚基基因(Mgg1)的破坏增强了M.ruber中桔霉素和色素的生成[22-23]。然而,mrskn7基因突变株在M.ruber中或Ash2基因突变株在M.purpu-reus中产生的真菌毒素较少[24-25]。以上研究为后续筛选高产莫纳可林K、低产桔霉素的红曲霉菌株提供理论依据[26]。而至今对桔霉素的合成调控网络依然没有研究清楚。
红曲霉Mrr2基因是一个功能未知的变位酶基因,推测在红曲霉代谢调控中有重要作用,为研究红曲霉Mrr2基因对桔霉素合成的影响,该研究通过农杆菌转化获得了Mrr2过表达的红曲霉菌株。与野生型的次级代谢产物和菌落形态相比较,发现过表达Mrr2基因对桔霉素的合成有促进作用,增加了桔霉素和色素的胞内积累,胞外洛伐他汀含量也明显增加。过表达菌株的菌落颜色较野生型转色快,菌丝蓬松且致密。RT-qPCR结果显示,过表达Mrr2对CtnA、CtnD、CtnE、pksPT、MpigE的转录有一定的促进作用,初步证明了过表达Mrr2对桔霉素的合成有正向调控作用,为丰富和完善桔霉素的合成调控途径提供理论依据,对红曲产品的安全生产具有一定的指导意义。
