润燥灵对干燥综合征患者外周血单个核细胞白细胞介素-17调控作用研究
2023-11-01胡小钰罗泽红黄芳琴曾苹马武开
胡小钰 罗泽红 黄芳琴 曾苹 马武开

【摘 要】目的:探讨解毒化瘀药润燥灵对干燥综合征患者外周血单个核细胞(PBMCs)白细胞介素-17(IL-17)的调控作用。方法:选取符合诊断标准的干燥综合征患者30例,抽取静脉血20 mL,分离提取PBMCs,加入10 ng·mL-1的白细胞介素-1β(IL-1β)、10 ng·mL-1的IL-6、1 ng·mL-1的转化生长因子-β(TGF-β)、1 ng·mL-1的肿瘤坏死因子-α诱导CD4+ T细胞分化成Th17细胞。将细胞分为空白对照组,IL-17刺激组,IL-17抑制组和润燥灵高、中、低剂量组。采用CCK-8检测润燥灵对干燥综合征患者Th17细胞的抑制率;ELISA法检测IL-17A、IL-17F、IL-23、TGF-β的分泌,qRT-PCR检测IL-17A、IL-17F mRNA的表达水平。结果:CCK-8检测结果显示,经润燥灵处理24 h、48 h后,Th17细胞增殖能力下降。ELISA法检测结果显示,与IL-17刺激组比较,IL-17抑制组及润燥灵高、中剂量组IL-17A、IL-17F、IL-23浓度明显下降,差异有统计学意义(P < 0.05)。RT-PCR检测结果示,与IL-17刺激组比较,IL-17抑制组和润燥灵各剂量组IL-17A、IL-17F mRNA表达量显著下调,差异有统计学意义(P < 0.05)。结论:中药润燥灵能够抑制IL-17A、IL-17F、IL-23的分泌,增加TGF-β抑炎因子的分泌,从而抑制Th17细胞炎症反应。
【关键词】 干燥综合征;润燥灵;解毒化瘀药;CD4+ T细胞;Th17细胞;白细胞介素-17On the Regulatory Effect of Runzaoling(潤燥灵)on Interleukin-17 in Peripheral Blood Mononuclear
Cells of Patients with Sjögren's Syndrome
HU Xiao-yu,LUO Ze-hong,HUANG Fang-qin,ZENG Ping,MA Wu-kai
【ABSTRACT】Objective:To explore the regulatory effect of the detoxifying and stasis-resolving
drug Runzaoling(润燥灵)on interleukin-17(IL-17)in peripheral blood mononuclear cells(PBMCs)
of patients with Sjögren's syndrome.Methods:Thirty patients with Sjögren's syndrome who met the diagnostic criteria were selected.20 mL of venous blood was drawn,from which PBMCs were separated and extracted.IL-1β
(10 ng·mL-1),IL-6(10 ng·mL-1),TGF-β(1 ng·mL-1)and tumor necrosis factor-α(1 ng·mL-1)were added to induce CD4+ T cells to differentiate into Th17 cells.The cells were divided into a blank control group,the
IL-17 stimulation group,the IL-17 inhibition group,and the high,medium,and low dose groups of Runzaoling.CCK-8
was used to detect the inhibitory rate of Runzaoling on Th17 cells in patients with Sjögren's syndrome;ELISA was used for the detection of the secretion of IL-17A,IL-17F,IL-23 and TGF-β;and qRT-PCRwas used to detect the expression level of IL-17A and IL-17F mRNA.Results:
CCK-8 results showed that after being treated with Runzaoling for 24 and 48 hours,the proliferation ability of Th17 cells decreased.The ELISA results showed that compared with the IL-17 stimulation group,the concentrations of IL-17A,
IL-17F,and IL-23 in the IL-17 inhibition group and the high and medium dose groups of Runzaoling decreased significantly,with a statistically significant difference(P < 0.05).The RT-qPCR detection results showed that compared with the IL-17 stimulation group,the expression of IL-17A and IL-17F mRNA in the IL-17 inhibition group and each dose group of Runzaoling significantly down-regulated,with a statistically significant difference(P < 0.05).Conclusion:Chinese medicine Runzaoling can inhibit the secretion of IL-17A,IL-17F,and IL-23,and increase the secretion of anti-inflammatory factors TGF-β,to inhibit the inflammatory response of Th17 cells.
【Keywords】 Sjögren's syndrome;Runzaoling(润燥灵);detoxifying and blood stasis resolving drug;
CD4+ T cell;Th17 cell;interleukin-17
干燥综合征(Sjögren's syndrome,SS)是一种以淋巴细胞增殖和进行性外分泌腺损伤为特征的慢性炎症性自身免疫性疾病。SS主要侵犯泪腺、唾液腺等外分泌腺,并可累及多系统[1]。SS全球患病率为0.05%~1%,我国为0.33%~0.77%,主要见于45~55岁女性,男女比例约为1∶9[2]。SS的发病机制尚不完全清楚。辅助性T细胞17(Th17)是一种新发现的CD4+ T细胞亚群,通过分泌白细胞介素(IL)-17A、IL-17F、IL-6、肿瘤坏死因子-α(TNF-α)等细胞因子,在自身免疫性疾病、肿瘤、慢性炎症等疾病过程中发挥重要作用[3]。Th17细胞和调节性T细胞(Treg)在SS发生、发展过程中起着重要作用[3]。Th17细胞以分泌IL-17A和IL-17F为主,并通过调节Th1介导炎症反应。Th17细胞不仅参与SS的发生、发展,而且与病情活动呈正相关。其中,IL-17A和IL-17F是该家族中最具特色的细胞因子。一旦IL-17A和IL-17F被激活,就会触发强烈的炎症反应,诱导潜在的促炎细胞因子产生,从而促进炎症反应和中性粒细胞的增殖、成熟和积聚,介导SS唾液腺炎症反应和组织损伤[4]。
中医学无SS的具体病名记载,根据SS的临床表现,大多数医家将其归为“燥痹”“燥毒”等范畴,其病机为“阴虚为本,燥热为标”,久病则燥热入血,灼血成毒、成瘀,虚、瘀、毒相互交结,虚实夹杂,缠绵难愈。润燥灵方是课题组长期用于治疗SS的有效经验方。前期实验研究证实,润燥灵方不仅能增加SS小鼠颌下腺指数及饮水量,改善模型小鼠颌下腺淋巴细胞浸润等病理改变,而且能够下调SS模型小鼠血清Th1/Th2和IL-17水平,调节Th17/Treg细胞平衡[5-6]。临床研究显示,润燥灵在改善SS患者临床症状、降低炎性指标等方面也具有一定优势[7-8]。故本课题在前期临床和实验研究的基础上,进一步观察解毒化瘀药润燥灵对SS患者IL-17的调控作用,进一步探讨润燥灵治疗SS的作用机制和潜在治疗靶点。
1 临床资料与实验材料
1.1 一般资料 选取2020年11月至2021年12月
在贵州中医药大学第二附属医院就诊的门诊及住院SS患者30例,其中男6例,女24例;年龄18~75岁,平均(52.53±11.74)岁。
1.2 诊断标准 按照2016年美国风湿病学会(ACR)/欧洲抗风湿病联盟(EULAR)制定的原发性SS分类标准[2]。
1.3 纳入标准 ①符合上述诊断标准;②年龄18~75岁;③患者自愿并签署知情同意书。
1.4 排除标准 ①合并类风湿关节炎、系统性红斑狼疮等其他风湿病者;②妊娠期或哺乳期妇女;③伴有精神性疾病者;④合并心脑血管、糖尿病、呼吸系统、造血系统、肿瘤等疾病者;⑤肝肾功能损害者;⑥入组前3个月应用糖皮质激素或其他免疫制剂者。
1.5 药 物 润燥灵颗粒来源于贵州中医药大学第二附属医院药剂科,药物组成有肿节风、山银花、六月雪、赤芍、三七、黄精、玄参等。称取12 g润燥灵颗粒,溶解于20 mL含0.5%DMSO的DMEM培养基中,30 μm过滤器除去杂质,0.45 μm过滤器和0.22 μm过滤器过滤除菌,即为润燥灵母液,置于4 ℃冰箱保存备用。
1.6 主要试剂和仪器 CCK-8(李记生物,批号LCA2001);Anti-Human CD28和CD3(联科生物,批号AH028、AH003);IL-1β、IL-6、TNF-β和TNF-α(Genscript,批号ZO2922-10、ZO3034-10、ZO3411-10、ZO1001-10);人IL-17A、IL-17F、IL-23和TGF-β ELISA试剂盒(联科生物,批号EK117/2-02、EK1196-01、EK123-03、EK981-01);RNA提取试剂盒(天漠生物,批号TR121-50)。实时荧光定量PCR仪(美国Thermo,型号7500);精密恒温培养箱(上海一恒,型号BPH-9042);超净工作台(苏州苏洁净化设备有限公司,型号SJ-CJ-2D);-80 ℃冰箱(中科美菱,型号DW-HL388);电子分析天平(舜宇恒平科学仪器有限公司,型号FA2004);倒置荧光显微镜(奥林巴斯,型号IX71)。
2 实验方法
2.1 外周血单个核细胞(PBMCs)的提取 采用肝素抗凝真空采血管抽取静脉血20 mL,转移至50 mL离心管;加入Ficoll淋巴细胞分离液,置于离心机以2000 r·min-1离心25 min,离心半径10 cm;汲取白色絮状层即PBMCs,用RPMI 1640培养基(含10% FBS)重悬细胞,活细胞计数,置恒温细胞培养箱。
2.2 诱导分化Th17细胞 培养皿中加入含5 μg·mL-1的Anti-Human CD28和Anti-Human CD3的PBS溶液,4℃包被24 h;并将分离获得的PBMCs加入预先包被的培养皿中,加入10 ng·mL-1的IL-1β、10 ng·mL的IL-6、1 ng·mL-1的TGF-β、1 ng·mL-1的TNF-α诱导分化Th17细胞72 h,采用流式细胞仪进行鉴定[9]。
2.3 CCK-8檢测润燥灵对Th17细胞活性的影响 将Th17细胞接种于96孔板,每孔100 μL;将润燥灵浓度设为0.1,0.5,1,1.5,2.5,5,10 mg·mL-1(根据润燥灵的CCK-8检测计算出IC50值确定给药剂量)。每组3个复孔,同时设空白孔(含培养基、CCK-8溶液,不含细胞、药物),对照孔(含培养基、细胞、CCK-8溶液,不含药物)。放置于37 ℃、体积分数为5%的CO2恒温培养箱中培养24 h和48 h后,加入10 μL CCK-8溶液,孵育4 h,终止培养,采用酶联免疫吸附测定法(ELISA法)检测OD 450 nm吸光值。
2.4 细胞分组及药物干预 调整细胞悬液浓度为2×106·mL-1,将悬浮生长的Th17细胞接种在6孔板,根据2.3中结果,筛选出润燥灵的给药浓度,将细胞分为6组,分别为空白对照组,IL-17刺激组,IL-17抑制组,润燥灵高、中、低剂量组。空白对照组加等体积PBS液,IL-17刺激组加2.5 μmmol·L-1的SR 0987,IL-17抑制组加入1 μmmol·L-1的GSK 2981278,润燥灵高、中、低剂量组分别加入2.5,1.5,1 mg·mL-1润燥灵溶液。置于37 ℃、体积分数为5%的CO2恒温培养箱中培养24 h。
2.5 ELISA法检测IL-17A、IL-17F、IL-23和TGF-β含量 按试剂盒说明书对IL-17A、IL-17F、IL-23和TGF-β的含量进行检测。将标准品稀释为7个不同浓度梯度的标准品溶液,每孔加入
50 μL稀释的检测抗体。300 r·min-1振荡,室温孵育2 h,倒去液体,洗板6次。每孔加入100 μL辣根过氧化物酶标记的链霉亲和素,300 r·min-1振荡,孵育45 min。加入100 μL显色底物,孵育30 min。加入终止液,置于酶标仪上检测各孔在450 nm波长处的OD值。建立相应拟合曲线,OD值得出各样品IL-17A、IL-17F、IL-23和TGF-β浓度。
2.6 qRT-PCR法检测IL-17A、IL-17F mRNA的表达 按试剂盒说明书提取RNA,IL-17A、IL-17F引物序列在NCBI GenBank数据库中查找,其引物由日本宝生物公司合成。IL-17A,上游引物CCACGAAATCCAGGATGCCCAAAT,下游引物ATTCCAAGGTGAGGTGGA-TCGGTT;IL-17F,上游引物GTCACGTAACATCGAGAGCCG,下游引物TGTCTTCCTTTCCTTGAGCATTG;GAPDH,上游引物TCGGAGTCA-ACGGATTTGGTC,下游引物GCCATGGGTGGAATCATATTGG。以GAPDH表达量为标准,采用2-△△CT进行分析IL-17A、IL-17F mRNA的相对表达量。
2.7 统计学方法 采用GraphPad Prism 8软件进行统计分析。计量资料符合正态分布并且满足方差齐性,采用t检验或one-way ANOVA分析;不符合正态分布采用非参数(秩和)检验;每组实验重复3次及以上。以P < 0.05为差异有统计学意义。
3 结 果
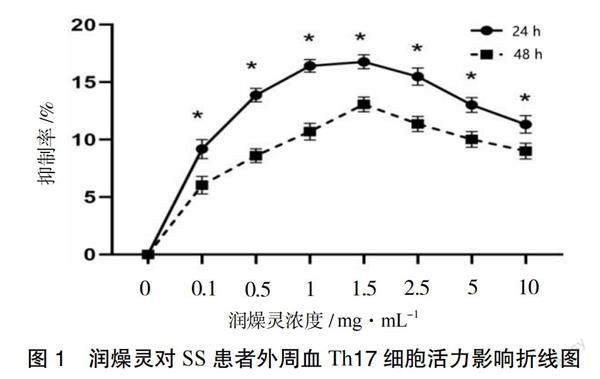
3.1 润燥灵对SS患者外周血Th17细胞活力的影响 采用CCK-8检测不同浓度润燥灵对Th17细胞干预24 h和48 h后活力的影响,结果显示,随着药物浓度的升高,细胞抑制率逐渐上升,当达到1.5 mg·mL-1时细胞抑制率最高。根据润燥灵不同浓度对Th17细胞增殖的抑制作用,最终筛选2.5,1.5,1 mg·mL-1作为高、中、低剂量组,见图1。
3.2 ELISA法检测润燥灵对SS患者外周血IL-17A、IL-17F、IL-23及TGF-β含量的影响 与空白对照组比较,IL-17抑制组和润燥灵高、中、低剂量组IL-17A、IL-17F含量均下降,TGF-β含量上升;润燥灵高、中剂量组IL-23含量下降(P < 0.05)。与IL-17刺激组比较,IL-17抑制组及润燥灵高、中、低剂量组IL-17A、IL-17F、IL-23含量均下降,TGF-β含量上升(P < 0.05)。與IL-17抑制组比较,润燥灵高、中剂量组IL-17A含量下降,润燥灵低剂量组IL-17A含量上升(P < 0.05);润燥灵中剂量组IL-17F、IL-23含量下降(P < 0.05)。见表1。
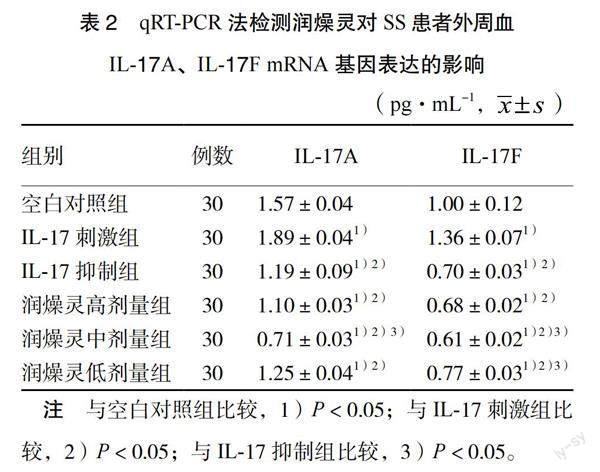
3.3 qRT-PCR法检测润燥灵对SS患者外周血IL-17A、IL-17F mRNA基因表达的影响 与空白对照组比较,IL-17刺激组IL-17A、IL-17F mRNA表达量显著上升,IL-17抑制组和润燥灵各剂量组IL-17A、IL-17F mRNA表达量显著下降(P < 0.05)。与IL-17刺激组比较,IL-17抑制组和润燥灵各剂量组IL-17A、IL-17F mRNA表达量显著下降(P < 0.05)。与IL-17抑制组比较,润燥灵中剂量组IL-17A、IL-17F mRNA表达下降,润燥灵低剂量组IL-17F mRNA表达上升(P < 0.05)。见表2。
4 讨 论
传统观点认为,SS病因以“阴虚为本,燥热为标”,治疗以滋阴润燥为主,但效果欠佳。随着近年来对SS发病机制的不断了解,越来越多的研究认为SS的发病除阴虚燥热外,“毒”“瘀”在其发病过程中起着重要作用[10]。“燥毒”病名源自《素问·五常政大论篇》“太阴在泉,燥毒不生”,提示燥邪损伤气血津液,蕴久成毒,进一步煎灼津液,津伤血滞,加重病情。在前期的研究中,课题组应用解毒化瘀生津药治疗SS取得了良好疗效[5-7],进一步说明燥毒灼津伤血的理论基础。《金匮要略》云:“病人胸满,唇痿舌青,口燥,但欲漱水不欲咽,无寒热,脉微大来迟,腹不满,其人言我满,为有瘀血也。”首次提出了瘀血致燥的发病机制,说明燥证的发病除阴虚、燥毒外,还与瘀血有关。周倩云等[11]从“虚、毒、瘀”角度出发,认为气虚无力推动气血津液运行是SS发病的基础,津亏燥邪蕴久成燥毒,瘀毒互结,导致津液输布障碍成为发病的主要因素。朱跃兰等[12]认为,伤津耗液可由内、外燥邪引起,导致津液输布代谢障碍,血行瘀滞,脉道不利,瘀血乃成,燥邪日久则燥热内盛,津液受损亦盛,化燥成毒,故SS的发病关键因素是瘀、毒两者相互作用。在前期的研究中,课题组根据SS的发病特点,提出SS发病的主要原因是阴虚、瘀血、燥毒相互为患[13],最终导致毒蕴血瘀成为发病的关键因素,治疗当解毒、活血、生津,在此理论指导下组成润燥灵方。该方在滋阴润燥生津的同时,又有清热解毒化瘀之效;其不仅遵从传统的养阴生津的治疗原则,而且加用活血化瘀药物,更是配以益气行津的治法,使气机调畅,津液布达,燥邪可去。前期临床研究证实,润燥灵可以改善SS患者口、眼干燥症状,缓解病情进展[13]。动物实验研究表明,润燥灵不仅能增加SS小鼠颌下腺指数及饮水量,改善模型小鼠颌下腺淋巴细胞浸润等病理改变,还能下调SS模型小鼠血清IL-17和Th1/Th2水平,调节Th17/Treg细胞平衡[5-6]。
SS确切的病因和发病机制尚不完全明确,新近发现的Th17细胞亚群有别于Th1细胞及Th2细胞,在SS发病机制中发挥着十分重要的作用。研究表明,Th17细胞以分泌IL-17A、IL-17F为主,而IL-17又可介导并调节Thl细胞的炎症反应[14];TGF-β主要由Treg细胞分泌,其可调节效应T细胞的异常活化和抑制炎性因子的释放[15]。TGF-β是一种抗炎细胞因子,它与类似跨膜的受体酪氨酸激酶家族的受体结合,从而调节多种细胞反应过程[15]。IL-17被认为在自身免疫性炎症和导致宿主防御进展中发挥重要作用,并且在很多变态反应和自身免疫疾病的发病机制中起着关键作用,包括类风湿关节炎、系统性红斑狼疮、银屑病、多发性硬化症、克罗恩病和同种异体移植排斥反应[16]。在SS患者的唾液腺和动物模型中,IL-17表达升高,其表达上调与疾病严重程度密切相关,而通过基因治疗在外分泌腺中阻断IL-17可以缓解自身免疫性疾病的临床症状[17]。有研究显示,SS患者外周血Th17细胞表达较健康对照组显著升高,IL-17A、IL-17F mRNA水平在PBMCs中也较健康对照组增高,表明SS发病与Th17细胞、IL-17A和IL-17F相关,且处于激活状态[9]。更有研究表明,SS患者Th17细胞及IL-17的蛋白和mRNA在颌下腺及外周血中的水平均明显上调,且Th17细胞的增高与Treg细胞的减少和IL-23的升高有关[18]。IL-23对于调节转录激活因子3(STAT3)活化的Th17细胞的扩增和维持非常重要,促进Th17细胞分化,并且还存在于腺体浸润中[19]。
本研究通过ELISA和qRT-PCR检测证实,IL-17刺激组能够增加炎症因子的释放,给予IL-17抑制剂进行干预后,炎性因子的分泌显著降低;解毒化瘀药润燥灵能够有效下调IL-17A、IL-17F基因的表达水平,减少促炎因子IL-17A、IL-17F、IL-23分泌,增加TGF-β抑炎因子分泌,抑制Th17细胞诱导的炎症反应,从而延缓SS病情进展。
参考文献
[1] 菲尔斯坦.凯利风湿病学[M].10版.栗占国,译.北京:北京大学医学出版社,2020:1336.
[2] 中国医师协会风湿免疫科医师分会.原发性干燥综合征诊疗规范[J].中华内科杂志,2020,59(4):269-276.
[3] 周明欢,李学峰,卢放根.Th17细胞与炎症性肠病[J].实用医学杂志,2009,25(22):3731-3732.
[4] 黄钊炜,黄芳琴,马武开,等.白细胞介素17在干燥综合征发病机制中的作用[J].中国实用医刊,2020,47(24):121-124.
[5] 马武开,侯雷,曾苹,等.润燥灵对干燥综合征模型小鼠免疫调节及抗炎作用研究[J].风湿病与关节炎,2017,6(8):5-9,14.
[6] 侯雷,曾苹,和秀丽,等.润燥灵对干燥综合征模型小鼠Th17/Treg细胞的影响[J].中药药理与临床,2017,33(2):158-162.
[7] 元晓龙,侯雷,曾苹,等.润燥灵汤治疗干燥综合征30例临床疗效观察[J].贵阳中医学院学报,2018,40(2):43-45,90.
[8] 马武开,唐芳.润燥灵汤对干燥综合征患者唾液流率及电解质影响的研究[J].环球中医药,2010,3(6):464-465.
[9] 吴琛.原发性干燥综合征Th17细胞研究[D].北京:北京协和医学院,2011.
[10] 黄芳琴,黄钊炜,马武开,等.重视毒、瘀在干燥综合征发病中的作用[J].风湿病与关节炎,2021,10(4):34-36,44.
[11] 周倩云,吳素玲.从“虚、毒、瘀”论治干燥综合征思路探析[J].四川中医,2017,35(9):28-29.
[12] 朱跃兰,侯秀娟,韦尼.干燥综合征从燥毒瘀辨证论治[J].北京中医药大学学报,2009,32(6):416-418.
[13] 马武开.化瘀解毒法治疗干燥综合征临床分析[J].中国中医药信息杂志,2003,10(9):60-61.
[14] ALUNNO A,CARUBBI F,BISTONI O,et al.Tregulatory and T helper 17 cells in primary Sjögren'ssyndrome:facts and perspectives[J].Mediators Inflamm,2015,2015(3):243723-243732.
[15] MASSAGUÉ J.TGF-β signalling in context[J].Nat Rev Mol Cell Biol,2012,13(10):616-630.
[16] CAPONE A,VOLPEE.Transcriptional regulators of T helper 17 cell differentiation in health and autoimmune diseases[J].Front Immunol,2020,12(11):348-353.
[17] MIELIAUSKAITE D,DUMALAKIENE I,RUGIENE R,et al.Expression of IL-17,IL-23 and their receptors in minor salivary glands of patients with primary Sjögren's syndrome[J].Clin Dev Immunol,2012(3):187258-187266.
[18] 陆妍,陈祎,王亚南,等.半夏芩连汤对干燥综合征模型NOD小鼠Th17/IL-17免疫炎性途径的影响[J].中国中西医结合杂志,2015,35(5):612-617.
[19] PATEL DD,KUCHROO VK.Th17 cell pathway in human immunity:lessons from genetics and therapeutic interventions[J].Immunity,2015,43(6):1040-1051.
收稿日期:2023-04-08;修回日期:2023-05-26
基金项目:国家自然科学基金项目(81973835,81860820);贵州省高层次创新型人才培养计划——“百”层次人才项目(黔科合平台人才〔2016〕5650);贵州省中医风湿免疫病临床研究中心
项目(黔科合平台人才〔2020〕2202号)
作者单位:贵州中医药大学,贵州 贵阳 550001
通信作者:马武开 贵州省贵阳市云岩区飞山街83号,walker55@163.com