大蒜体细胞胚发生及不同发育阶段的形态解剖学特征
2023-10-31邢晓东李梦倩蒋芳玲
李 萍,刘 敏,邢晓东,李梦倩,张 蒙,周 蓉,蒋芳玲,吴 震
(南京农业大学 园艺学院/农业农村部华东地区园艺作物生物学与种质创制重点实验室,南京 210095)
大蒜(AlliumsativumL.)为1a或2a生草本植物,其鳞茎、花薹和嫩叶不仅可作蔬菜食用,还可入药,是世界范围内重要的食药兼用作物。大蒜通常不育,因其不能形成种子而通过鳞茎或者气生鳞茎进行无性繁殖,长期无性繁殖易造成病毒积累,导致产量和品质下降,给大蒜生产带来不利影响[1]。由于植物组织培养具有显著的脱除病毒效果,因而有希望成为大蒜脱除病毒、恢复种性的有效手段[2]。
相较于其他组织培养途径,体细胞胚发生途径具有再生植株结构完整、繁殖系数高和遗传稳定性强等诸多优点。已有研究表明,可可[3]、木薯[4]、甘蔗[5]和大蒜[1]等植物可通过体细胞胚发生途径有效脱除病毒。在蓝桉[6]、香菜[7]、唐菖蒲[8]、大蒜[9]等植物中,已证实通过体细胞胚发生途径形成的植株遗传稳定。因此,建立高效稳定的大蒜体细胞胚发生体系,对于高效脱除病毒,乃至进行大蒜种质资源创新,均具有重要意义。同时,通过对体细胞胚发生过程中的形态解剖学特征进行观察,明确其发生阶段和典型特征,有助于更全面了解体细胞胚发生过程,从而提高体细胞胚发生及植株再生效率[10]。目前,虽然国内外学者已初步诱导获得大蒜体细胞胚和再生植株,但总的来说,大蒜通过体细胞胚发生和成苗体系还不够成熟,关于大蒜体细胞胚发生过程中的细胞超微结构特征还未见报道,需要做进一步研究。
本试验在课题组前期工作基础上,以大蒜品种 ‘二水早’ 为试材,研究不同外植体、不同植物生长调节剂及其组合对大蒜体细胞胚发生过程的影响,同时进行形态、组织和超微结构特征观察,旨在确立大蒜体细胞胚发生的最佳诱导和培养条件,明确大蒜体细胞胚发生的不同阶段及其形态解剖学特征,为建立基于体细胞胚发生途径的大蒜试管苗高效培养体系提供理论依据和技术 支撑。
1 材料与方法
1.1 植物材料与培养
以大蒜品种 ‘二水早’ 为材料,分别以大蒜花序轴、鳞茎盘、发芽叶基及气生鳞茎和蒜瓣的无菌试管苗根尖、根段、嫩叶为外植体。供试大蒜 ‘二水早’ 在南京农业大学园艺学院保存,种植于南京农业大学牌楼教学科研基地。10月上旬进行大蒜播种,从第2年3月下旬开始,在蒜薹的花茎发育相对高度(花茎高度/假茎高度)为1,花序轴上表面直径为0.3~0.5 cm时,陆续采收蒜薹,备用。第2年6月上旬收获大蒜鳞茎和气生鳞茎。挑选健康、大小一致的蒜薹、蒜瓣和气生鳞茎作为外植体材料进行试验。
接种前对外植体进行消毒处理,方法如下:剪下带2 cm左右花茎的蒜薹总苞(以花序轴为外植体),剥去蒜瓣或气生鳞茎外层的表皮,先置于饱和洗衣粉溶液中浸泡30 min,流水冲洗15~30 min,然后在超净工作台用75%酒精消毒90 s,无菌水清洗1次。再用2%次氯酸钠溶液消毒,其中,气生鳞茎消毒4~6 min,蒜薹和蒜瓣消毒8~12 min。再用无菌水清洗5次,最后置于无菌滤纸上吸干表面水分,待用。
蒜瓣和气生鳞茎无菌试管苗培养:(1)蒜瓣无菌苗:将消毒蒜瓣去除贮藏叶和营养叶,切去蒜瓣底部约1 mm的木栓化组织,留下3~5 mm的带茎尖的鳞茎盘,按十字型切成大小均匀的4份,接种到B5+ 2.0 mg/L6-BA + 0.1 mg/L NAA + 0.65%琼脂 + 3%蔗糖(pH为5.8)的培养基中培养无菌试管苗;(2)气生鳞茎无菌苗:将消毒的气生鳞茎接种到MS + 0.65%琼脂 + 3%蔗糖(pH为5.8)的培养基中培养无菌试管苗。培养条件均为:温度(25±1)℃,光周期12 h/12 h,光照强度40~50 μmol/(m2·s)。
1.2 植物生长调节剂和外植体对大蒜胚性愈伤组织诱导的影响
1.2.1 2,4-D 以大蒜花序轴、鳞茎盘和发芽叶基为外植体,诱导胚性愈伤组织,设置0、1.0、 2.0、3.0和4.0 mg/L 5个2,4-D质量浓度,共15种处理组合。以B5培养基为基本培养基,除不同质量浓度2,4-D外,均加入质量浓度为0.5 mg/L的KT,0.7%琼脂和3%蔗糖,pH调为5.8,接种后在(25±1)℃下黑暗培养。
以花序轴为外植体:取大蒜消毒总苞,剥去外层总苞片,去除退化的花原基残留物,切取带2~3 mm花茎的花序轴,纵切分成均匀2份接种于培养基;以鳞茎盘为外植体:取消毒蒜瓣,去除贮藏叶和营养叶,切去蒜瓣底部约1 mm的木栓化组织,保留3~5 mm带茎尖的鳞茎盘,按十字型切成大小均匀的4份接种于培养基;以蒜瓣发芽叶基为外植体:取消毒蒜瓣,去除贮藏叶及茎盘部分,留下发芽叶基部约5 mm,纵切均匀分成2份接种于培养基。每个培养皿接种4份外植体,每个处理接种15个培养皿,3次重复。培养过程中观察和记录胚性愈伤组织诱导和生长状态,60 d后统计胚性愈伤组织诱导率。
1.2.2 毒莠定(Picloram,PIC) 以鳞茎盘为外植体,探究不同质量浓度PIC对大蒜胚性愈伤组织诱导的影响。设置0、1.0、2.0、4.0和8.0 mg/L 5个PIC质量浓度,共5种处理。以B5培养基为基本培养基,除不同质量浓度PIC外,均加入质量浓度为0.1 mg/L的NAA,0.7%琼脂和3%蔗糖,pH调为5.8。外植体接种前的处理同 “1.2.1”。每个培养皿接种4份外植体,每个处理接种10个培养皿,3次重复。接种后在 (25±1) ℃下进行黑暗培养。培养过程中观察和记录胚性愈伤组织诱导和生长状态,60 d后统计胚性愈伤组织诱导率。
1.2.3 外植体 以蒜瓣和气生鳞茎诱导的无菌试管苗的根尖、根段和嫩叶为外植体,分别接种在B5 + 3.0 mg/L 2,4-D + 0.5 mg/L KT+0.7%琼脂 + 3%蔗糖(pH为 5.8)的培养基中,进行胚性愈伤组织诱导。无菌试管苗的根尖、根段和嫩叶均切割为长5 mm的小段。每个培养皿接种 4~6份外植体,每个处理接种10个培养皿,3次重复。接种后在(25±1)℃进行黑暗培养。培养过程中观察和记录胚性愈伤组织诱导和生长状态,60 d后统计胚性愈伤组织诱导率。
1.3 不同质量浓度组合2,4-D和6-BA对大蒜体细胞胚萌发的影响
胚性愈伤组织在原培养基上继续培养,经 1~2月至大量球形胚形成。以发育状态良好的球形胚为材料,以MS培养基为基本培养基,添加不同质量浓度2,4-D和6-BA,其中2,4-D质量浓度设置 0.25、1.0和3.0 mg/L,6-BA质量浓度设置 0.5、2.0和4.0 mg/L,共9种处理组合。培养基中均加入0.7%琼脂和3%蔗糖,pH调为5.8。每个培养皿接种0.3 g球形胚,3次重复,接种后在(25±1)℃下黑暗培养。待观察到体细胞胚发育成熟,开始萌发时,将体细胞胚转移至无植物生长调节剂的MS培养基中,采用光照培养,光周期为12 h/12 h,光照强度为40~50 μmol/(m2·s)。培养过程中观察体细胞胚发育状况并拍照,30 d后统计体细胞胚的萌发数,并计算萌发系数。
1.4 大蒜体细胞胚发生不同阶段的形态解剖学特征
将大蒜花序轴接种在B5+ 3.0 mg/L 2,4-D + 0.5 mg/L KT + 0.7% 琼脂 + 3% 蔗糖(pH为 5.8)的培养基上,在(25±1)℃下黑暗培养。培养过程中分别利用体视显微镜、正置荧光显微镜和透射电镜观察体细胞胚发生过程,明确大蒜体细胞胚发生不同阶段的变化特点,并确定其形态、组织和超微结构特征。
1.4.1 形态学特征观察 取大蒜体细胞胚发生过程不同时期的培养物,置于Leica DFC7000T体式显微镜下进行形态观察并拍照,确定体细胞胚发生不同阶段的形态特征。
1.4.2 组织学观察 采用常规石蜡切片法制备大蒜体细胞胚发生不同时期培养物的组织切片。培养材料先固定在FAA(V甲醛∶V冰醋酸∶V70%乙醇=1∶1∶18)溶液中,立即抽真空使其沉入试管底部,固定24 h后,进行系列乙醇逐级脱水,二甲苯透明,石蜡包埋,切片(厚度为8 μm),甲苯胺蓝染色和中性树胶封片等操作,最后将切片置于Leica DFC450C正置荧光显微镜下观察并拍照。
1.4.3 超微结构观察 根据形态组织学特征,取外植体、愈伤组织、初期胚性愈伤组织、后期胚性愈伤组织和球形胚五个阶段的培养物,迅速投入电镜固定液(2.5%戊二醛溶液)中固定,立即抽真空使其沉入试管底部,室温放置2 h,然后转入 4 ℃冰箱。固定好后送由武汉赛维尔生物科技有限公司制片,制片过程包括脱水,渗透,包埋,利用Leica UC7超薄切片机60~80 nm超薄切片,铀铅双染色等一系列步骤,最后将切片置于Hitachi H-7650透射电镜下观察并拍照。
1.5 试管鳞茎的形成和植株生长状态观察
体细胞胚萌发形成的试管植株,经90 d培养后可形成试管鳞茎。将试管鳞茎在4 ℃冰箱冷藏1个月打破休眠,然后播种到经过高压灭菌后的复合基质中,复合基质由草炭、珍珠岩、蛭石按体积比2∶1∶1配制。植株生长过程中定期浇水和营养液。播种15 d后统计试管鳞茎的萌发率, 45 d后统计试管鳞茎苗的成活率。
1.6 调查项目与方法
胚性愈伤组织诱导率=产生胚性愈伤组织的外植体数/接种的外植体数×100%
体细胞胚萌发系数=萌发苗数/接种的球形胚鲜质量
试管鳞茎萌发率=萌芽的试管鳞茎数/播种的试管鳞茎总数×100%
试管鳞茎苗成活率=存活的试管鳞茎苗数/萌芽的试管鳞茎总数×100%
2 结果与分析
2.1 植物生长调节剂和外植体对大蒜胚性愈伤组织诱导的影响
2.1.1 2,4-D的影响 2,4-D质量浓度不同,大蒜花序轴、鳞茎盘和发芽叶基的胚性愈伤组织诱导率和形成状态存在差异(表1)。以花序轴为外植体,2,4-D质量浓度从1.0升高到3.0 mg/L,胚性愈伤组织诱导率由37.22%提高至82.22%,当2,4-D质量浓度为4.0 mg/L时,胚性愈伤组织诱导率为81.11%,与3.0 mg/L差异不显著,但其诱导形成的胚性愈伤组织的量较少。以鳞茎盘为外植体,在2,4-D质量浓度为2.0和3.0 mg/L时,胚性愈伤组织诱导率较高,分别为 89.21%和89.50%,但2,4-D质量浓度为3.0 mg/L时,形成胚性愈伤组织的量较少。对于发芽叶基,在2,4-D质量浓度为 2.0和3.0 mg/L时,胚性愈伤组织诱导率较高,分别为82.52%和 83.40%,且形成的胚性愈伤组织的量较多。在不添加2,4-D的培养基中,3种外植体均未能诱导形成胚性愈伤组织。

表1 大蒜不同外植体在不同质量浓度2,4-D处理下的胚性愈伤组织诱导Table 1 Embryogenic callus induction of different garlic explants under different mass concentrations of 2,4-D
2.1.2 PIC的影响 不同质量浓度PIC诱导大蒜鳞茎盘形成胚性愈伤组织的情况见表2。随着PIC质量浓度的升高,胚性愈伤组织诱导率先升后降。当PIC质量浓度为4.0 mg/L时,胚性愈伤组织诱导率最高,为67.5%。培养基中未添加PIC,不能诱导外植体形成胚性愈伤组织。PIC质量浓度为2.0和4.0 mg/L,诱导形成胚性愈伤组织的量多,表面较光滑,呈颗粒状。PIC质量浓度为1.0和8.0 mg/L,诱导形成的胚性愈伤组织的量少,呈颗粒状,表面较粘稠。

表2 大蒜鳞茎盘在不同质量浓度PIC处理下的胚性愈伤组织诱导Table 2 Embryogenic callus induction of garlic bulb disc under different mass concentrations of PIC
2.1.3 外植体的影响 由表3可知,气生鳞茎和蒜瓣无菌试管苗不同部位诱导形成胚性愈伤组织的效果存在差异。以气生鳞茎和蒜瓣无菌试管苗根尖为外植体,其胚性愈伤组织诱导率均显著高于根段和嫩叶。其中,以气生鳞茎无菌试管苗根尖为外植体,胚性愈伤组织诱导率最高,达 96.00%,蒜瓣无菌试管苗根尖次之,为80.00%。无菌试管苗不同部位诱导形成的胚性愈伤组织,外观形态上均表现为表面光滑、呈颗粒状,气生鳞茎无菌试管苗根尖和根段诱导形成的胚性愈伤组织的量 较少。
2.2 不同质量浓度的2,4-D和6-BA组合对大蒜体细胞胚萌发的影响
不同质量浓度2,4-D和6-BA组合对大蒜体细胞胚发育和成熟萌发有显著影响(表4)。2,4-D 0.25 mg/L+ 6-BA 0.5 mg/L的组合,体细胞胚萌发系数最高,达35.56个/g。随着2,4-D和6-BA质量浓度的升高,体细胞胚萌发系数降低。当2,4-D质量浓度升至3.0 mg/L时,不能诱导体细胞胚萌发成苗。以上结果说明,高质量浓度的2,4-D和6-BA不利于大蒜体细胞胚的发育,促进大蒜体细胞胚成熟萌发的适宜植物生长调节剂组合为:2,4-D 0.25 mg/L + 6-BA 0.5 mg/L。
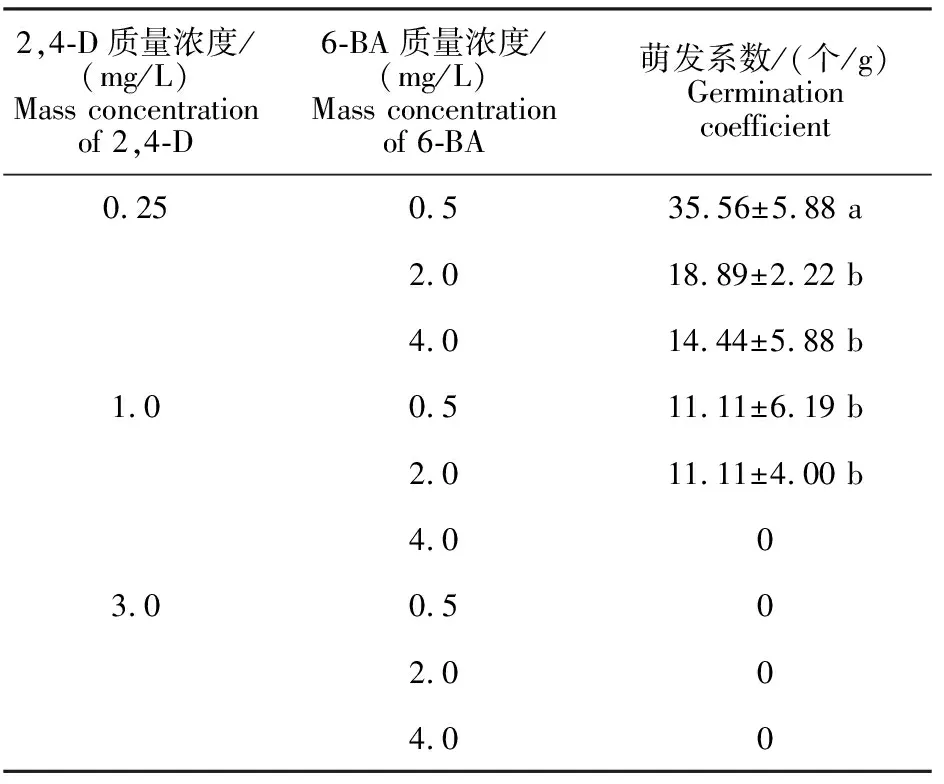
表4 大蒜体细胞胚在不同质量浓度2,4-D和6-BA组合处理下的萌发系数Table 4 Germination coefficient of garlic somatic embryos under different mass concentration combinations of 2,4-D and 6-BA
2.3 大蒜体细胞胚发生过程中的形态解剖学特征观察
2.3.1 形态学特征 以花序轴(图1-A)为外植体,在胚性愈伤组织诱导培养基上培养7 d后,其顶端出现密集的点状突起。培养至第13天,花序轴顶端形成一层半透明的物质,表面不光滑,为愈伤组织(图1-B)。至第20天,愈伤组织的局部开始出现表面光滑、半透明的颗粒状突起,表明胚性愈伤组织开始形成。培养至第27天,在愈伤组织的局部形成明显的颗粒状突起,为初期胚性愈伤组织(图1-C)。随着培养时间继续延长,形成的颗粒状突起不断增多,体积不断变大。至第60天,颗粒状突起几乎完全覆盖外植体,形成了大量胚性愈伤组织,为后期胚性愈伤组织(图1-D)。培养至第90天,胚性愈伤组织进一步发育,形成半透明、表面光滑的球状体,即为球形胚。培养至第120天,可观察到大量球形胚的形成(图1-E)。球形胚逐渐与母体产生生理隔离,最后可以从母体剥落分离(图1-F)。此后,球形胚进一步发育,形成梨形胚(图1-G)、子叶形胚(图1-H),最后可观察到子叶形胚萌发成苗,形成具有芽和根的完整植株(图1-I)。

A.外植体; B.愈伤组织; C.初期胚性愈伤组织; D. 后期胚性愈伤组织; E、F. 球形胚; G.梨形胚; H.子叶形胚; I.体细胞胚萌发形成的小植株。白色箭头所指处,CA为愈伤组织,EC为胚性愈伤组织,GE为球形胚
2.3.2 组织学特征 以花序轴为外植体,观察大蒜体细胞胚发生不同阶段的组织学特征,结果见图2。在愈伤组织形成阶段,外植体表层组织(图2-A)经脱分化后,形成体积较大、形状不规则的薄壁细胞(图2-B),它们排列疏松,高度液泡化,细胞核很小或观察不到细胞核。在初期胚性愈伤组织阶段,薄壁细胞进一步形成胚性细胞团,这些细胞比薄壁细胞小,排列紧密,细胞核大而明显(图2-C),具有较强的分裂能力,可以不断进行细胞分裂(图2-D)。后期胚性愈伤组织,随着薄壁细胞不断转化为胚性细胞及胚性细胞的分裂,形成多个由大量胚性细胞构成的原胚,原胚呈颗粒状(图2-E),其组织学观察的发育阶段与形态学观察结果一致。在球形胚阶段,组成球形胚的细胞体积比较小,呈近圆形,细胞排列规则,细胞核大而明显。球形胚尚未观察到维管束的形成(图2-F)。
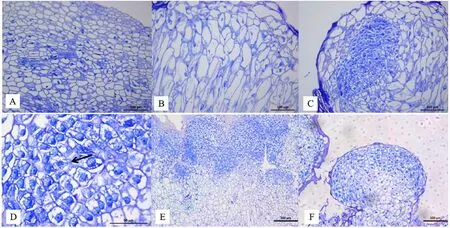
A.外植体(×20); B. 愈伤组织(×20); C. 初期胚性愈伤组织(×20); D. 初期胚性愈伤组织(×63); E. 后期胚性愈伤组织 (×10); F. 球形胚(×10)。图中黑色箭头所示为正在分裂的细胞。图A~C、F标尺为100 μm;图D标尺为50 μm;图E标尺为200 μm
2.3.3 超微结构特征 依据通过形态组织学特征划分的体细胞胚发生不同阶段,观察大蒜体细胞胚发育不同阶段在细胞超微结构水平上的特征,结果见图3。在愈伤组织形成阶段,细胞高度液泡化,细胞核小且被挤到了一侧,细胞器种类少,细胞质稀薄,局部有线粒体分布,细胞排列疏松,存在细胞间隙,为典型的薄壁细胞(图3-A、3-B)。在初期胚性愈伤组织阶段,细胞核大,细胞质浓稠,细胞器比较丰富,原来的中央大液泡消失,出现较多的小液泡,存在大量线粒体,还观察到内质网和高尔基体等细胞器,细胞之间有胞间连丝分布(图3-C、3-D);在后期胚性愈伤组织阶段,出现细胞核向细胞一端偏移的现象,另一端有大液泡的形成,细胞质少且贴壁分布,细胞质中有线粒体和前质体存在(图3-E、3-F)。在球形胚阶段,细胞核大而明显,有较多小液泡,细胞质浓稠且有前质体和较多线粒体的分布(图3-G、3-H)。

A.愈伤组织(×700); B. 愈伤组织(×2 500); C. 初期胚性愈伤组织(×2 000); D. 初期胚性愈伤组织(×6 000); E. 后期胚性愈伤组织(×1 200); F. 后期胚性愈伤组织(×3 000); G. 球形胚(×500); H. 球形胚(×5 000);v. 液泡; n. 细胞核; m. 线粒体; g. 高尔基体; e. 内质网; p. 前质体; pd. 胞间连丝
2.4 经大蒜体细胞胚发生途径的试管鳞茎形成与植株生长状态
通过体细胞胚发生途径获得的再生植株(图4-A),继续培养90 d后,可形成试管鳞茎(图4-B、4-C)。将试管鳞茎置于4 ℃冰箱冷藏30 d打破休眠,播种在经过高压灭菌的由草炭、珍珠岩、蛭石按2∶1∶1比例配制的复合基质中。播种并浇足水,之后在基质表面干燥时浇水,每隔7 d浇施1次营养液。播种15 d后进行统计,试管鳞茎的出芽率为70.73%;45 d后统计,试管鳞茎苗(图4-E)成活率为96.55%(表5)。

A.体细胞胚发生途径形成的试管苗; B.试管鳞茎的形成; C.试管鳞茎; D.试管鳞茎萌发; E.试管鳞茎苗的生长

表5 大蒜体细胞胚发生途径获得的试管鳞茎萌发成苗情况Table 5 Statistics on germination of garlic bulblets obtained by somatic embryogenesis
3 讨 论
体细胞胚发生是大多数植物生命周期中的独特过程,已成为植物生物技术的重要工具,主要应用于商业化的大规模繁殖和作物改良[11]。植物体细胞胚发生可分为间接发生和直接发生两种:前者是由外植体先形成胚性愈伤组织,再由胚性愈伤组织发育形成体细胞胚,是最常见的体细胞胚发生方式;后者是外植体不经过愈伤组织阶段而直接形成体细胞胚[12]。据报道,Sata等[13]通过直接发生途径获得了大蒜体细胞胚,而其他有关大蒜体细胞胚发生的研究几乎都是通过间接发生途径。
生长素被认为是影响植物体细胞胚发生最关键的因素之一,许多植物体细胞胚发生的启动都需要外源添加生长素类物质。2,4-D是一种合成的生长素,可强烈诱导细胞去分化,用于诱导胚性愈伤组织的2,4-D可以单独使用或组合使用,这取决于植物的种类。在拟南芥中,单独添加2,4-D可诱导形成胚性愈伤组织[14],大蒜胚性愈伤组织的诱导通常是2,4-D与KT或2,4-D与6-BA组合[15-17],施加2,4-D质量浓度通常在1.0~4.0 mg/L。本研究利用2,4-D和KT组合诱导大蒜胚性愈伤组织,2,4-D质量浓度在2.0和3.0 mg/L时,大蒜胚性愈伤组织诱导效果较好,不同外植体之间略有差异。胚性愈伤组织诱导培养基中施加2,4-D会增加培养物的内源激素水平并使细胞产生氧化胁迫,从而诱导体细胞获得胚胎发生能力[18]。另外,在香蕉[19]和郁金香[20]等植物中,PIC在其胚性愈伤组织的诱导中发挥着重要作用,而2,4-D、PIC和NAA都被认为影响百合胚性愈伤组织诱导的关键因素[21-22],本试验发现PIC诱导大蒜胚性愈伤组织的效果不如2,4-D。
外植体是影响植物体细胞胚发生的又一个关键因素。本研究比较了多种大蒜外植体胚性愈伤组织诱导的差异,结果表明,大蒜 ‘二水早’ 的花序轴、鳞茎盘和发芽叶基均为较好的胚性愈伤组织诱导外植体,蒜瓣和气生鳞茎无菌试管苗的根尖比根段和嫩叶更易诱导胚性愈伤组织。这可能与外植体的生理状态和其响应诱导条件的程度有关,细胞分裂旺盛、内源激素较多的部位较易获得胚性愈伤组织[23]。大蒜外植体的选择受其生育期影响较大,由于蒜薹的抽薹期比较短,所以在大蒜抽薹后,可以取大量花序轴用于胚性愈伤组织的诱导。当收获大蒜鳞茎后,则可以用鳞茎盘诱导胚性愈伤组织。然而,随着贮藏时间的延长,蒜瓣中的营养物质会不断被消耗,鳞茎盘也随之越来越薄,但发芽叶却在蒜瓣贮藏过程中不断形成,此时可以用发芽叶基替代鳞茎盘诱导胚性愈伤组织。虽然蒜瓣和气生鳞茎的无菌试管苗根尖均有较高的胚性愈伤组织诱导率,但其还需经过试管苗的诱导,步骤较繁琐,而且根尖本身比较小,诱导形成的胚性愈伤组织相对较少。综合分析认为,花序轴、鳞茎盘和发芽叶基更适合作为诱导大蒜胚性愈伤组织的外植体。

形态学结合组织学和超微结构特征观察能对体细胞胚发生过程的研究更全面。体细胞胚间接发生途径通常包含愈伤组织诱导、胚性愈伤组织转化、体细胞胚形成和发育、体细胞胚成苗等过程[28]。以大蒜花序轴为外植体,根据形态和组织学特征,本研究将体细胞胚发生早期过程划分为外植体、愈伤组织、初期胚性愈伤组织、后期胚性愈伤组织和球形胚5个阶段。通过观察发现,大蒜愈伤组织呈半透明状态,表面不光滑,组成愈伤组织的细胞为典型的薄壁细胞,符合愈伤组织的特点。大蒜胚性愈伤组织在外观形态上呈颗粒状,表面光滑,易与愈伤组织区分,与Fereol等[24]和程雅琪[17]所观察到的大蒜胚性愈伤组织及与Ramakrishnan等[29]和Wu等[30]所观察到的洋葱胚性愈伤组织形态结果一致。本研究把胚性愈伤组织分为初期胚性愈伤组织和后期胚性愈伤组织两个阶段,石蜡切片和超微切片结果表明,初期胚性愈伤组织细胞核大而明显,细胞器较丰富,出现较多的小液泡,局部有胞间连丝分布,与小麦[31]、棉花[32]和石刁柏[33]胚性细胞超微特征类似,丰富的细胞器有利于活跃的细胞代谢,胞间连丝在植物细胞发育、物质运输和信号传导中发挥重要作用。后期胚性愈伤组织存在细胞核向一端偏移的现象,这些细胞可能之后会进行不对称分裂,分裂为顶细胞和基细胞,但它们都承袭胚性细胞的胚性[34]。球形胚具有大的细胞核,存在较多小液泡,细胞质浓稠且有前质体和较多线粒体的分布,可为体细胞胚的进一步分裂与分化奠定基础。植物体细胞胚发生过程与其合子胚发生类似,双子叶植物体细胞胚发生大致经历原胚、球形胚、心形胚、鱼雷胚和子叶形胚阶段。单子叶植物只有一片子叶,在球形胚之后,一般不再形成心形胚和鱼雷形胚,但不同种类单子叶植物具有各自的发育特征,如唐菖蒲[35]、菠萝[36]和白鹤芋[37],其体细胞胚发育过程也有差异。本研究观察到大蒜球形胚可以继续发育形成梨形胚和子叶形胚,最后萌发成具有根和叶的完整植株。
4 结 论
大蒜花序轴、鳞茎盘、发芽叶基均为诱导大蒜胚性愈伤组织的适宜外植体,用于胚性愈伤组织诱导的最适宜2,4-D质量浓度分别为3.0、2.0、2.0和3.0 mg/L,诱导率分别为82.22%、 89.21%、82.52%和83.40%。在2,4-D 0.25 mg/L+ 6-BA 0.5 mg/L条件下,体细胞胚的萌发系数最高,达35.56个/g。以花序轴为外植体,根据形态和组织学特征,可将大蒜体细胞胚发生早期过程划分为外植体、愈伤组织、初期胚性愈伤组织、后期胚性愈伤组织和球形胚5个阶段,各阶段具有各自典型特征。球形胚可继续发育形成梨形胚、子叶形胚,最后萌发成小植株。由大蒜体细胞胚萌发形成的植株,培养90 d后可形成试管鳞茎,将其播种在由草炭、珍珠岩、蛭石按2∶1∶1体积比配制的复合基质中,试管鳞茎的萌发率为70.73%,试管鳞茎苗的成活率达96.55%。
