分蘖洋葱伴生番茄根际微生物对番茄黄萎病抗性的影响
2023-10-31李红玉吴凤芝
李 爽,李红玉,吴凤芝
(东北农业大学 园艺园林学院,哈尔滨 150030)
番茄(SolanumlycopersicumL.)是中国重要蔬菜作物之一,在生产过程中由于土地资源匮乏,设施栽培进行长期连作,导致番茄黄萎病(Verticilliumwilt)发生普遍,造成产量和品质下降。番茄黄萎病属于土传病害,防治措施主要有抗病品种选育,化学防治,生物防治,嫁接防治[1-4]。以上防治措施虽然在一定程度上能够有效控制番茄黄萎病,但是这些措施各有利弊,不能作为长期有效的防治措施。因此,采用合理的栽培方式才是控制番茄黄萎病的有效手段。
在现代农业中,植物多样性种植提高了集约化农业的可持续发展,间作是植物多样性种植方式中的一种,可以提高农作物生产力和有效抑制植物土传病害[5-6]。近年来大量研究表明,间作能显著降低病害的发生[7-11]。小麦根系分泌物和小麦伴生土壤微生物提高西瓜根系木质素生物合成、防御相关基因的表达和β-1,3-葡聚糖酶活性,提高西瓜对枯萎病抗性[8]。印度芥菜和芝麻菜作为绿肥增加黄瓜根际有益微生物丰富度,提高防御相关基因(CHI,GLU,PAL和PR1)的表达,提高黄瓜枯萎病抗性[12]。花生/苍术间作显著提高了土壤微生物多样性,降低了苗期和成熟期立枯病和根腐病的发病率[13]。小麦/蚕豆间作显著提高蚕豆根际土壤细菌、真菌、放线菌的数量及其总量,显著降低蚕豆枯萎病发病率和病情指数[14]。
植物-土壤反馈是指土壤微生物组成和丰度的变化对后继作物生长、发育和健康的影响[14-16]。植物根际微生物是植物健康和生产力的关键决定因素,被认为是植物防御地下病害的主要驱动力[17]。生物炭改变土壤微生物群,富集对病原菌具有拮抗作用的有益菌群(芽孢杆菌和溶菌),从而对尖孢镰刀菌产生抑制作用。Gong等[18]研究表明,在100%土壤含水量条件下,一茬水芹轮作提高黄瓜根际潜在有益微生物的相对丰度,降低了潜在病原真菌(FusariumandMonographellaspp.)的相对丰度,不同程度的淹水导致黄瓜根际土壤微生物群落的多样性、结构和组成存在差异,对黄瓜生长产生正反馈作用。Gao等[15]研究表明小麦填闲通过改变土壤养分有效性和调节土壤微生物群落多样性促进黄瓜幼苗生长。Li等[8]研究发现小麦/西瓜间作后的土壤降低了西瓜枯萎病发病率和病情指数。
目前,分蘖洋葱/番茄间作可以有效抑制番茄黄萎病[19],并且提高了番茄根际微生物多样性[9],但分蘖洋葱伴生番茄根际微生物对番茄植株根系防御酶和防御基因的影响有待进一步深入研究。本研究以分蘖洋葱和番茄为研究对象,探讨分蘖洋葱伴生番茄根际土壤微生物对减轻黄萎病的作用,并结合防御酶和抗性相关基因阐明分蘖洋葱伴生番茄提高番茄黄萎病抗性机制,为间套作栽培管理抑制作物病害提供理论依据。
1 材料与方法
1.1 材 料
番茄(SolanumlycopersicumL.):品种为‘东农708’,由东北农业大学番茄育种实验室提供。
分蘖洋葱(Alliumcepavar.agrogatumDon.):品种为‘绥化’,由东北农业大学设施蔬菜生理与生态课题组保存。
番茄黄萎病病原菌菌株为Verticilliumdahliae,生理小种1,由东北农业大学番茄育种中心许向阳教授馈赠。
试验土壤为番茄连作土壤,土壤基本化学性状:NH4+-N 14.49 mg·kg-1,NO3--N 44.9 mg·kg-1,有效磷 269.55 mg·kg-1,速效钾186.06 mg·kg-1,EC值0.29 mS·cm-1(土壤质量∶蒸馏水体积=1∶2.5),pH 6.06 (土壤质量∶蒸馏水体积=1∶5)。
1.2 试验设计
1.2.1 制备根际土 试验在温室中进行,采用盆栽试验,将番茄连作土装入14 cm × 16 cm的塑料盆中,每盆土壤质量为1 000 g。试验处理为番茄单作(Tomato monoculture,TM)和分蘖洋葱伴生番茄(Tomato intercropping,TI)。每个处理设置3次重复,每个重复30盆。番茄常规育苗,四叶一心定植,每盆1株番茄,番茄伴生处理是在番茄幼苗定植时在距番茄幼苗5 cm位置处种植大小均匀的3株分蘖洋葱鳞茎。定植20 d后采用抖根法取分蘖洋葱伴生番茄(TI)和番茄单作(TM)的根际土,将土壤样品过2 mm筛。将过筛后的所有土壤置于4 ℃保存,用于植物-土壤反馈试验。
1.2.2 根际微生物对番茄黄萎病病情指数和发病率的影响 为了明确番茄单作和伴生根际土壤微生物对番茄黄萎病抗性的影响,进行植物-土壤反馈试验,试验在温室中进行,将未种植过茄科植物的大田土壤过2 mm筛,经121 ℃灭30 min,间隔24 h进行下一次灭菌,灭菌条件相同,共灭菌3次。将番茄单作和番茄伴生根际土接种到灭菌后的土壤中,混合均匀,其接种量为土壤总质量的6%(相对干质量)。20 ℃下培养3 d,培养期间保持田间最大持水量的60%左右。根据接种根际土壤微生物的差异,共设置4个处理(表1)。

表1 试验处理及代号Table 1 Treatment and code in this experiment
将四叶一心的番茄幼苗定植在不同根际土处理的盆中,缓苗后在番茄茎基部采用灌根法接种,接数量浓度为1×106mL-1的孢子悬液20 mL。接种5 d、10 d和15 d后调查病情指数和发病率。
1.2.3 根际微生物对番茄黄萎病抗性的影响 将四叶一心的番茄幼苗定植在盆(14 cm×16 cm)中,同时种植大小均匀的3株分蘖洋葱鳞茎,定植20 d后将伴生番茄和单作番茄整株从土中小心取出,取出后的单作番茄和伴生番茄分为两部分,一部分带有番茄根际土种植在沙子和土壤体积比为1∶1的土壤中,处理为具有伴生番茄根际土(Intercropping rhizosphere soil with tomato plant,WTI)和具有单作番茄根际土(Monoculture rhizosphere soil with tomato plant,WTM);另一部分将番茄根用自来水冲洗干净,然后用灭菌水冲洗3次,再将番茄种植在沙子和土壤体积比为1∶1的土壤中,处理为无伴生番茄根际土(Intercropping rhizosphere soil without tomato plant,NTI)和无单作番茄根际土(Monoculture rhizosphere soil without tomato plant,NTM),沙子和土壤灭菌条件与“1.2.2”相同,共灭菌3次。缓苗后接种20 mL数量浓度为1×106mL-1的V.dahliae。在接种0 h、24 h、48 h、96 h后对番茄根系进行取样,将取得的番茄根系放入液氮中速冻,-80 ℃保存,测定防御酶活性及抗病相关基因。
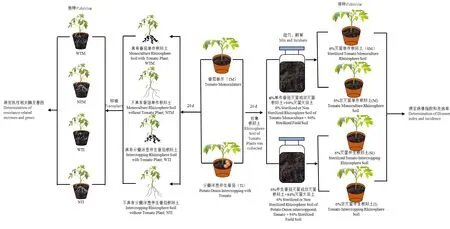
图1 试验示意图Fig.1 Test schematic plot
1.3 测定项目及方法
1.3.1 病情指数和发病率调查 番茄黄萎病发病程度分为0~5级共6个等级,采用Shittu[20]的方法测定(表2)。

表2 番茄黄萎病发病程度和症状Table 2 Severity and symptoms of tomato Verticillium wilt
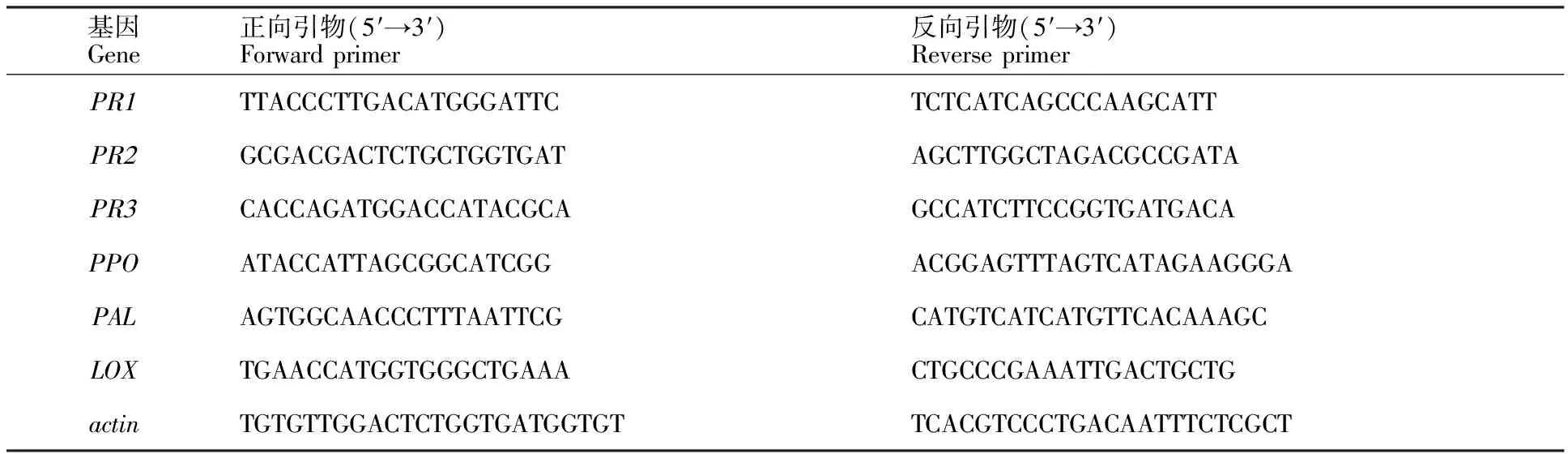
表3 用于qRT-PCR分析的基因和引物Table 3 Genes and primers used in real-time qRT-PCR analysis
1.3.2 抗性基因的测定 用TRIZOL试剂按说明书提取番茄根系总RNA[21]。用分光光度计和1.2%琼脂糖凝胶电泳检测总 RNA 的产量和质量。
采用 BioTeKe super RT Kit(百泰克,北京)按照说明书进行 cDNA 的合成,得到的 cDNA可以直接用于后续 PCR 反应。
使用 2×Plus SYBR real-time PCR mixture(天根,北京),在 IQ5real-time PCR 系统(Bio-Rad Lab,LA,USA)上分析PR1、PR2、PR3、PPO、PAL、LOX这5种防御相关基因表达。
1.3.3 防御酶活性测定 采用NBT(四锉氮蓝)法测定SOD活性[22];采用邻苯二酚比色法测定PPO活性[23];参照Gao[22]方法测定PAL活性;采用昆布多糖的方法测定β-1,3-葡聚糖酶活性[24]。
1.4 数据分析
采用Microsoft Excel 2020整理原始数据和作图,采用IBM SPSS Statistics 21.0软件对发病情况、抗性相关基因和防御酶活性数据进行差异显著性分析,方差分析采用Turkey’s HSD,在P<0.05水平下分析。
2 结果与分析
2.1 分蘖洋葱伴生土壤微生物对番茄黄萎病发病率和病情指数的影响
如图2所示,在接种V.dahliae的10 d和 15 d后,灭菌土壤处理的番茄黄萎病病情指数(图2-A)和发病率(图2-B)均无显著差异,而非灭菌土壤处理(M,I)的番茄黄萎病病情指数和发病率均显著低于灭菌土壤处理(SM,SI),且非灭菌的分蘖洋葱伴生番茄根际土壤处理(I)的番茄黄萎病病情指数和发病率显著低于非灭菌番茄单作根际土壤处理(M)(P<0.05)。非灭菌分蘖洋葱伴生番茄根际土壤处理(I)与非灭菌番茄单作土壤处理(M)病情指数和发病率分别为66.9与76.7和80.3%与88.1%,说明伴生土壤微生物在减轻番茄黄萎病中发挥重要作用。
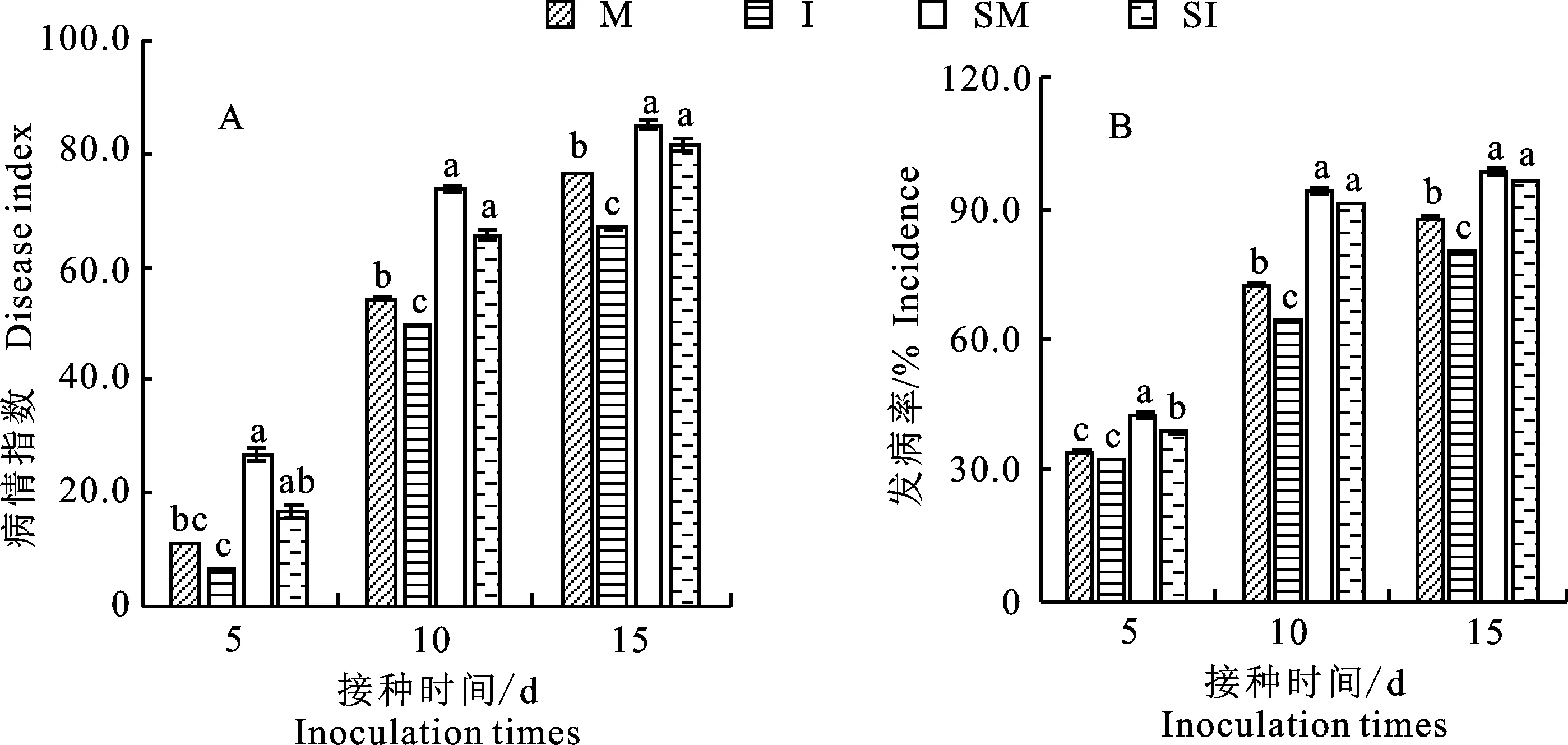
图中误差线为标准误差,不同小写字母代表不同处理间差异显著(P<0.05)。下同
2.2 根际土壤微生物对抗性基因表达的影响
具有伴生根际土壤(WTI)处理的番茄根系PR1相对表达量在接种 0 h、24 h、48 h后显著高于番茄单作根际土壤(WTM)处理,分别上调 2.49倍、2.26倍、2.00倍;在接种V.dahliae0 h~48 h,具有番茄根际土壤处理PR1相对表达显著高于无番茄根际土壤处理(图3-A)。
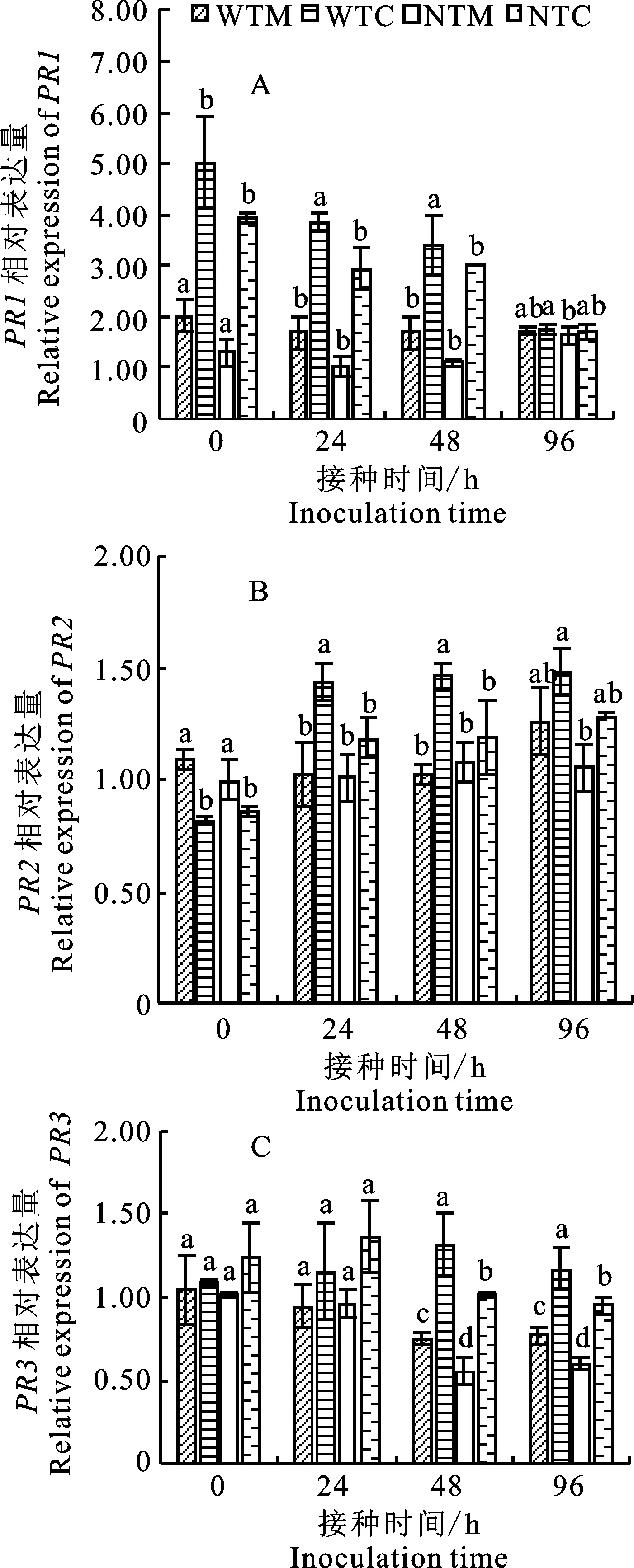
图3 分蘖洋葱伴生土壤微生物处理下番茄根系PR基因的表达Fig.3 Relative expression of PRs in roots of potato onion incropping with tomato
具有番茄伴生根际土壤(WTI)处理番茄根系PR2相对表达量在接种V.dahliae24 h和 48 h后显著高于番茄单作根际土壤(WTM)处理,分别上调1.40倍和1.43倍;在接种V.dahliae24 h和 48 h后,具有番茄根际土壤处理PR2相对表达显著高于无番茄根际土壤处理,而无番茄单作根际土壤处理(NTM)和无番茄伴生根际土壤处理(NTI)的PR2相对表达量无显著差异(图 3-B)。
具有番茄伴生根际土壤(WTI)处理的番茄根系PR3相对表达量在接种V.dahliae48 h和96 h后显著高于番茄单作根际土壤(WTM)处理,分别上调1.74倍和1.52倍;在接种V.dahliae48 h和96 h后,具有番茄根际土壤处理PR3相对表达显著高于无番茄根际土壤处理 (图3-C)。
防御酶基因LOX、PAL、PPO相对表达量如图4所示。具有番茄伴生根际土壤(WTI)处理LOX相对表达量在接种V.dahliae96 h后显著高于具有番茄单作根际土壤处理(WTM),上调1.37倍;在接种V.dahliae48 h后,具有番茄根际土壤处理LOX相对表达量显著高于无番茄根际土壤处理,而无番茄根际土壤(NTM和NTI)处理间LOX相对表达量无显著差异(图4-A)。
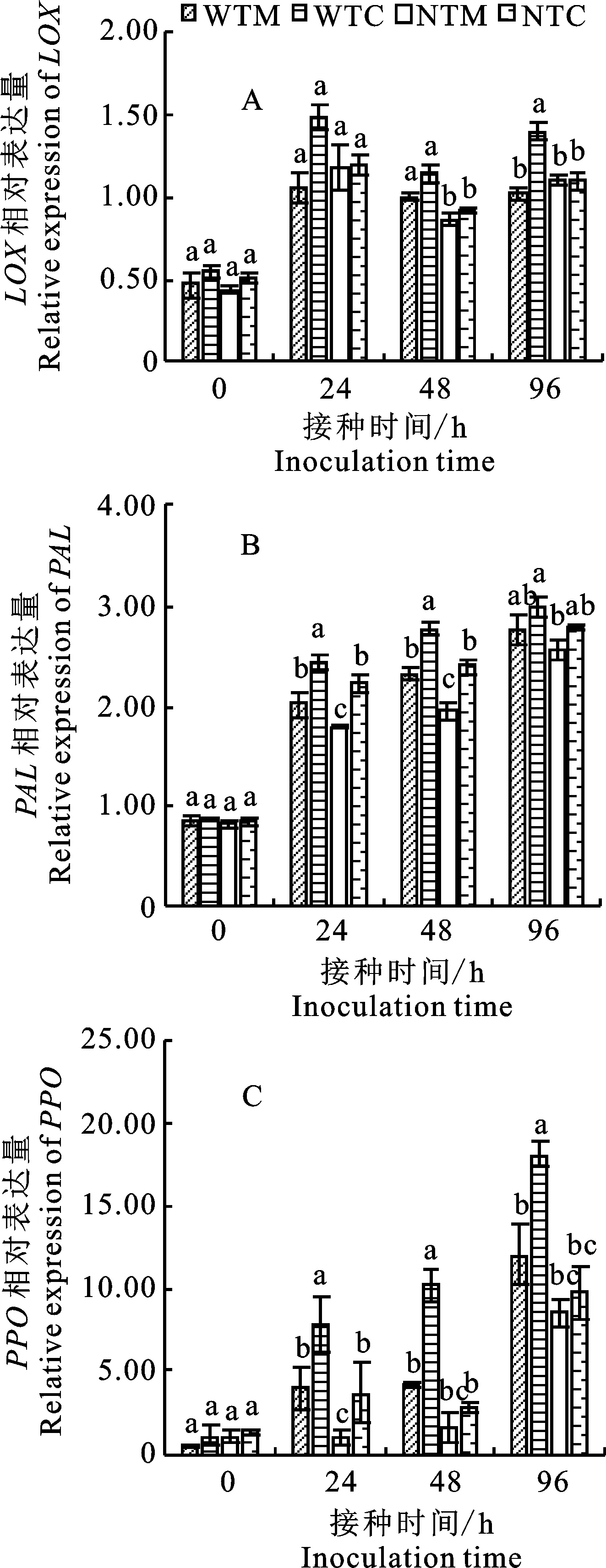
图4 分蘖洋葱伴生土壤微生物处理下对番茄根系PAL、LOX和PPO基因的表达Fig.4 Relative expression of PAL,LOX and PPO in roots of potato onion incropping with tomato
在接种V.dahliae24 h和48 h后,具有番茄伴生根际土壤(WTI)处理的番茄根系PAL相对表达量显著高于具有番茄单作根际土壤(WTM)处理,分别上调1.20倍和1.19倍,并且具有番茄根际土壤处理PAL相对表达量显著高于无番茄根际土壤处理;在接种96 h,无番茄根际土壤(NTM和NTI)处理间PAL相对表达量无显著差异(图4-B)。
在接种 24 h、48 h和96 h后,具有伴生根际土壤(WTI)处理的番茄根系PPO相对表达量显著高于具有单作根际土壤(WTM)处理,分别上调1.98倍、2.41倍和1.51倍;无番茄根际土壤(NTM和NTI)处理间PPO相对表达量无显著差异(图4-C)。
2.3 根际土壤微生物对防御酶活性的影响
在接种V.dahliae48 h和96 h后 ,具有番茄根际土壤处理的番茄根系PAL活性和PPO活性显著高于无番茄单作根际土壤处理,并且具有番茄伴生根际土壤处理(WTI)的番茄根系PAL活性和PPO活性显著高于具有番茄单作根际土壤处理(WTM);在96 h后达到最大值,PAL活性和PPO活性分别为1.20 U·mg-1·h-1与0.97 U·mg-1·h-1和0.38 U·g-1·min-1与0.42 U·g-1·min-1(图5-A,5-B)。
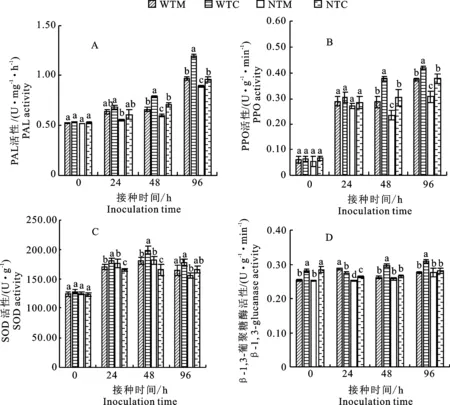
图5 分蘖洋葱伴生土壤微生物处理下番茄根系防御酶的活性Fig.5 Defensive enzyme activity in roots of potato onion incropping with tomato
具有番茄伴生根际土壤(WTI)处理的番茄根系SOD活性在接种V.dahliae24 h和 48 h以后显著高于具有番茄单作根际土壤(WTM)处理,并在接种 48 h后 SOD活性达到最大值,分别为181.04 U·g-1和199.06 U·g-1,而无番茄根际土壤(NTM和NTI)处理间SOD活性无显著差异(图5-C)。
在接种V.dahliae0 h,48 h和96 h后,具有番茄伴生根际土壤(WTI)处理β-1,3-葡聚糖酶活性显著高于番茄单作根际土壤(WTM)处理, 并且在接种V.dahliae96 h后达到最大值,分别为0.31 U·g-1·min-1和0.28 U·g-1·min-1。在接种48 h和96 h后,无番茄根际土壤(NTM和NTI)处理间β-1,3-葡聚糖酶活性无显著差异。(图5-D)。
3 讨 论
长期连作产生连作障碍,导致土传病害发生,黄萎病是重要的土传病害之一,严重影响了番茄的产量和质量,造成巨大经济损失,是食品安全面临主要挑战之一[25-26]。多项研究表明,间作可以有效控制作物土传病害[27-29],其中分蘖洋葱伴生可以有效控制番茄黄萎病[19]。根际微生物是植物-土壤-植物病原菌的第一道防线[30-32]。最近的研究表明,间套作系统中植物之间的相互作用诱导土壤中有益微生物在根部富集,从而诱导植物系统抗性。小麦/蚕豆间作可显著提高土壤微生物活性和多样性,提高蚕豆对枯萎病抗性,促进蚕豆生长[27-28]。小麦/黄瓜间作提高了黄瓜根际中有益微生物(Pseudomonas,Haliangium和Archangiumspp.)的相对丰度,降低黄瓜枯萎病的严重程度[29,33]。分蘖洋葱伴生番茄提高了番茄根际有益微生物(Bacillus和Pseudomonas)的相对丰度,降低了潜在植物病原菌(Cladosporium和Pseudallescheria)的相对丰度[9,34]。本研究通过植物-土壤反馈试验明确了分蘖洋葱伴生土壤微生物抑制番茄黄萎病的能力。接种V.dahliae10 d和15 d后,接种分蘖洋葱伴生番茄的土壤降低了番茄黄萎病病情指数和发病率(图2-A,2-B)。说明伴生土壤微生物发挥了作用,但这种作用是否与分蘖洋葱伴生对番茄土壤微生物群落多样性和组成的改变以及有益微生物在根部富集有关,有待进一步研究。
病程相关蛋白(PR)在寄主植物发病过程中被诱导,并在感染组织中系统或局部积累,通常导致系统获得抗性(SAR)的发展,从而抵抗相同或类似病原体的进一步感染。本研究结果表明,接种V.dahliae后具有分蘖洋葱伴生土壤微生物的番茄根系PR1表达量显著高于番茄单作,并在接种V.dahliae24 h后PR1表达量达到最大值(图3-A),与Fu等[19,35]研究结果一致。β - 1,3 -葡聚糖酶(glucanase)是参与植物抵御病原菌攻击防御机制的致病相关蛋白(PRs),本研究结果表明,在接种V.dahliae后具有分蘖洋葱伴生土壤微生物的番茄根系PR2和PR3表达量及β - 1,3 -葡聚糖酶活性显著高于番茄单作(图3-B,图5-D),与García-Cristobal等[36]在水稻中的研究结果一致。
众所周知,在病原菌侵染植物过程中,LOX在植物免疫力方面发挥着重要作用。LOX是在茉莉酸(JA)合成中起作用的关键酶,而茉莉酸(JA)是PAL/PPO诱导抗性中的正向调节因子[37]。本研究中分蘖洋葱伴生的番茄根系中LOX基因相对表达量显著高于其他处理(图4-B),与Mariutto等[38]研究结果一致。接种分蘖洋葱伴生的番茄土壤可以提高番茄根系PAL和PPO表达量和增强PAL和PPO活性(图4-A, 4-C,5-A,5-B),与曾玥等[39]和孙蓝笛[40]研究结果一致。
病原菌侵染植物后,破坏植物体内ROS代谢平衡,导致细胞结构破坏,代谢系统紊乱,严重会威胁植物健康,而过氧化物酶(POD)是清除植物体内过多活性氧的关键酶[41-42]。植物通过产生活性氧(ROS)对抗病原体的攻击,其复杂的平衡是通过组织良好的抗氧化清除途径实现的[43]。本研究表明,与番茄单作土壤微生物处理相比,分蘖洋葱伴生番茄土壤微生物增强了番茄根系SOD酶活性(图5-C),SOD通过有效清除活性氧,减轻氧化胁迫而提高植物对非生物胁迫的抗性[44]。
4 结 论
在V.dahliae染的过程中,分蘖洋葱伴生土壤微生物降低了番茄黄萎病的发病率和病情指数;同时提高了番茄根系中PAL、PPO、SOD、β-1,3-葡聚糖酶活性和提高LOX、PPO、PAL、PR(PR1、PR2和PR3)表达量。因此,分蘖洋葱伴生番茄根际微生物通过致病相关蛋白和氧化胁迫的协同作用启动防御反应,增强番茄对黄萎病的抗性。
