根皮素前体脂质体制备及其体内药动学研究
2023-10-30崔晓鸽陈四清
禹 瑞,杨 璞,崔晓鸽,陈四清
(1.郑州澍青医学高等专科学校,河南 郑州 450064; 2.河南中医药大学,河南 郑州 450046)
根皮素主要存在于草莓、梨、苹果等果蔬中,具有抗菌、抗氧化、降血糖、心血管保护等活性[1],可有效抑制肝癌细胞增殖,促进细胞凋亡[2],并且毒性极小[3],具有开发成护肝、抗肝癌新药的潜力。但该成分溶解度为26.51 μg/mL[4],油水分配系数(lgP) 为1.22[5],在胃肠道中容易被破坏[6],体内稳定性差,并且它也是多药耐药相关蛋白2 (MRP2)、P-gp 蛋白底物[6],导致其口服生物利用度仅为8.676%[6],目前已有胶束[7]、磷脂复合物[4-5]、纳米结构脂质载体[8]、醇质体[9]等相关报道。
前期报道,脂质体囊材主要由磷脂组成,生物相容性高,可增加药物溶解度、稳定性,并促进其吸收[10-11]; 磷脂具有保护肝功能、抗肝癌的协同作用[12],可使肝癌高危患者受益,是一种药辅两用材料,但前者混悬液储存稳定性较差,而后者在处方中极易发生氧化[4]。前体脂质体可有效解决脂质体稳定性问题[13-14],并且储存方便,故本实验制备根皮素前体脂质体,并考察其体内药动学,以期为该制剂后续开发提供依据。
1 材料
1.1 仪器 AUY220 型电子分析天平(日本岛津公司); 安捷伦1100 型高效液相色谱仪(美国安捷伦公司); Zetasizer Nano Z 型激光粒度仪(英国马尔文仪器有限公司); CD-X15 型实验室超声仪(深圳市亦为实业有限公司); HB10 型旋转蒸发仪(德国IKA 公司); SH-2-001 型磁力搅拌器、HH-1型恒温水浴锅、HY-5 型恒温振荡器(常州市亿能实验仪器厂); HM-D12 型氮气吹扫仪(山东恒美电子科技有限公司); HS-100 型离心机(德国THF科学仪器公司)。
1.2 试剂与药物 根皮素对照品(批号110366-202009,纯度98.2%,中国食品药品检定研究院); 根皮素原料药(批号191022,纯度97.0%,武汉福鑫化工有限公司)。胆固醇(批号20201012,亳州克拉玛尔生物科技有限公司); 大豆磷脂(批号20210420,磷脂酰胆碱含量90%,上海艾韦特医药科技有限公司); 甘露醇(批号190516,山西锦洋药用辅料有限公司); 蔗糖(批号200118,湖南九典制药股份有限公司)。
1.3 动物 清洁级SD 大鼠,雌雄兼具,体质量180~200 g,由河南省动物实验中心提供,动物生产许可证号SCXK (豫) 2020-0001,实验室饲养至220~240 g 时进行实验。
2 方法与结果
2.1 根皮素含量测定
2.1.1 色谱条件 Phenomenex C18色谱柱(4.6 mm×250 mm,5 μm); 流动相乙腈-水(35 ∶65); 体积流量1.0 mL/min; 柱温30 ℃; 检测波长285 nm;进样量10 μL。
2.1.2 线性关系考察 称取根皮素对照品20 mg,置于100 mL 量瓶中,乙腈超声溶解定容,得200 μg/mL 贮备液,精密量取适量,流动相依次稀释至 5、2.5、1、0.1、0.25、0.05 μg/mL,在“2.1.1” 项色谱条件下各进样10 μL 测定。以对照品峰面积(Y) 对其质量浓度(X) 进行回归,得方程为Y=13.152 5X+0.896 0 (r=0.999 6),在0.05~5 μg/mL 范围内线性关系良好。
2.1.3 供试品溶液制备 取前体脂质体约0.1 g(根皮素含量约为1.15 mg),置于10 mL 量瓶中,加入pH 为6.8 的PBS 缓冲液8 mL,固定于振荡器(100 r/min) 上振荡至无不溶性颗粒产生,定容,0.45 μm 微孔滤膜过滤,取0.5 mL 至50 mL 量瓶中,加流动相(功率250 W) 超声处理5 min,稀释定容至刻度,摇匀,即得。
2.1.4 方法学考察 取0.05、1、5 μg/mL 对照品溶液适量,在“2.1.1” 项色谱条件下进样测定6 次,测得根皮素峰面积RSD 分别为0.40%、0.29%、0.46%,表明仪器精密度良好。取供试品溶液适量,于0、2、6、12、24、48 h 在“2.1.1”项色谱条件下进样测定,测得根皮素含量RSD 为0.60%,表明溶液在48 h 内稳定性良好。取同一份前体脂质体,按“2.1.3” 项下方法平行制备6份供试品溶液,在“2.1.1” 项色谱条件下进样测定,测得根皮素含量RSD 为1.52%,表明该方法重复性良好。取前体脂质体粉末0.05 g,共9 份,分为低、中、高3 组,分别加入贮备液1.5、3、4.5 mL,按“2.1.3” 项下方法制备供试品溶液,在“2.1.1” 项色谱条件下进样测定,测得根皮素平均加样回收率分别为100.79%、99.26%、101.24%,RSD 分别为0.63%、1.16%、0.57%。
2.2 前体脂质体制备 采用载体沉积法[14-15],取根皮素原料药20 mg 及处方量大豆磷脂、胆固醇,置于圆底烧瓶中,加入20 mL 无水乙醇超声处理3 min 至溶解澄清,作为有机相。取处方量载体(乳糖) 过120 目筛,置于茄形瓶中,并固定于旋转蒸发仪上,将有机相通过导管分3 次加到载体中(以防止载体材料发生粘连),得混悬液,45 ℃减压旋蒸除去无水乙醇,即得。临用前取约0.1 g,加入pH 为6.8 的PBS 缓冲液10 mL 振荡15 min,过0.45 μm 微孔滤膜,作为混悬液。
2.3 包封率、粒径、Zeta 电位测定 取前体脂质体混悬液2 mL,置于超滤离心管中(截留分子量10 kDa),13 500 r/min 离心15 min,取超滤液,测定游离根皮素量(W1); 另取2 mL,按“2.1.3”项下方法测定总根皮素量(W0),计算包封率,公式为包封率= [(W0-W1)/W0] ×100%。取前体脂质体混悬液0.1 mL,加入蒸馏水5 mL,摇匀后取适量至比色皿中,在粒度分析仪上测定其粒径、PDI; 另取适量至Zeta 电位专用器皿中,测定其Zeta 电位。
职工论坛是院内文化的体现。院内职工可随时在企业号内参与论坛活动,在论坛上发布一些正能量、学术性等的文字、图片、小视频等内容,增强大家相互学习的积极性,提高医院的创效能力;此外,院内职工还可直接通过企业号查看及收发邮件,并提供职工信箱、职工诉求等渠道。
2.4 处方优化 采用Box-Behnken 响应面法。
固定根皮素用量20 mg,前期预实验发现磷脂与胆固醇比例、脂(磷脂+胆固醇) 药比、载(乳糖) 脂比对包封率影响较大,故分别作为自变量X1、X2、X3,因素水平见表1,再以包封率为因变量Y优化处方,平行3 次,结果见表2。

表1 因素水平Tab.1 Factors and levels
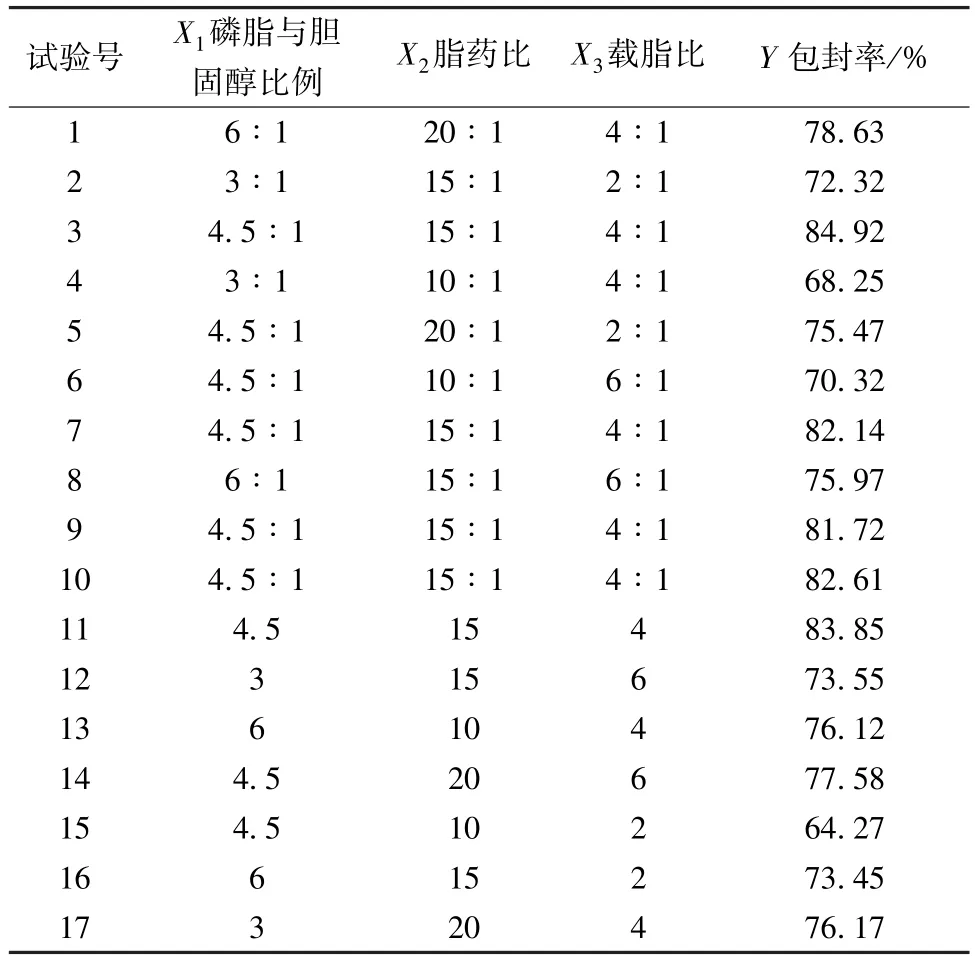
表2 试验设计与结果(n=3)Tab.2 Design and results of tests (n=3)

图1 各因素响应面图Fig.1picture_figure_titleResponse surface plots for various factors

表3 方差分析Tab.3 Analysis of variance
2.5 验证试验 由图1 可知,最优处方为磷脂与胆固醇比例4.82 ∶1,脂药比16.48 ∶1,载脂比4.2 ∶1,包封率为83.88%,为了便于操作,将其修正为磷脂与胆固醇比例4.8 ∶1,脂药比16.5 ∶1,载脂比4.2 ∶1。按优化处方平行制备3 批样品,加入水相制成混悬液,按“2.3” 项下方法测定包封率,测得其数值为83.06%,与预测值83.88%接近(相对偏差为-0.98%)。再按“2.3”项下方法测得平均粒径为216.84 nm (图2),PDI为0.117,Zeta 电位为-22.76 mV (图3)。另外,前脂质体中根皮素含量为1.15%。

图2 根皮素前体脂质体粒径分布Fig.2 Particle size distribution of phloretin proliposomes

图3 根皮素前体脂质体Zeta 电位Fig.3 Zeta potential of phloretin proliposomes
2.6 形态观察 取前体脂质体混悬液适量,蒸馏水稀释50 倍,混匀后滴2 ~3 滴至铜网上,铺展,1.5%磷钨酸染色,晾干,在透射电镜 (13 000倍) 下观察其形态,结果见图4。由此可知,该制剂基本呈球形或椭圆形,并且粒径小于在激光粒度仪下观察时,这是因为在前者需先进行干燥,失水后其粒径会变小。

图4 根皮素前体脂质体透射电镜图Fig.4 Transmission electron microscopy image of phloretin proliposomes
2.7 体外释药研究 参考文献[8] 报道,取前体脂质体粉末适量(根皮素含量均为8 mg),加入5 mL 模拟胃液制成混悬液,置于透析袋中(截留分子量8 ~12 kDa),扎紧; 另取8 mg,直接分散于溶出介质中。设定介质为1 000 mL 模拟胃液,温度为37 ℃,搅拌桨转速为75 r/min,于0、0.25、0.5、0.75、1、1.5、2、3、4、6、8、10、12、18 h各取样5 mL,并及时补充5 mL 空白介质,0.45 μm 微孔滤膜过滤,测定累积释放度,同法考察在模拟肠液中的释药情况,结果见图5。由此可知,原料药在模拟胃液、模拟肠液中的累积释放度分别为15.17%、9.89%,而前体脂质体分别提高至90.24%、64.60%。
2.8 晶型分析 取根皮素、空白辅料(不含药物,辅料比例同前体脂质体)、物理混合物(药物与辅料比例同前体脂质体)、根皮素前体脂质体粉末适量,进行X 射线粉末衍射 (XRPD) 分析,设定扫描范围 (2θ) 为3° ~45°,扫描速度为4°/min,结果见图6。由此可知,原料药在6.9°、9.7°、14°、27.3°等处出现特征晶型峰; 物理混合物中仍可见根皮素晶型峰,表明简单混合未使原料药晶型发生变化; 前体脂质体图谱中仅见空白辅料晶型峰,原料药特征晶型峰均消失,表明它转变为无定形物质[16-17]。
2.9 稳定性研究 取前体脂质体及其混悬液适量,置于恒温恒湿箱中(温度25 ℃,相对湿度55%),于0、15、30、45、60、75、90 d 取样,测定包封率,结果见图7。由此可知,混悬液在60 d 时包封率降低至10%以下,而前体脂质体仍在80%以上,表明后者稳定性良好。

图7 不同时间点根皮素前体脂质体及其混悬液包封率(n=3)Fig.7 Encapsulation efficiencies of phloretin proliposomes and their suspension at different time points (n=3)
2.10 体内药动学研究
2.10.1 分组、给药与采血 取根皮素及其前体脂质体粉末适量,加入pH 为6.8 的PBS 缓冲液振荡15 min 制成药液 (根皮素质量浓度5 mg/mL)。12 只大鼠随机分为2 组,禁食过夜,按40 mg/kg剂量灌胃给药,其中根皮素采血点为0.25、0.5、1、1.5、1.75、2、3、4、5、6、8 h,其前体脂质体采血点为0.25、0.5、1、1.25、1.5、2、3、5、6、8、12 h,采血量均约为0.25 mL,置于肝素浸润离心管中,3 500 r/min 离心2 min。
2.10.2 血浆样品处理 参考文献[4,6] 报道,将血浆样品置于37 ℃水浴中解冻,精密吸取0.1 mL至空白离心管中,加入1 mL 乙腈密封后涡旋5 min,4 ℃、10 000 r/min 离心5 min,取上清液至离心管中,45 ℃氮气吹干,0.1 mL 乙腈复溶,12 000 r/min 离心5 min,取10 μL 上清液。
2.10.3 线性关系考察 取根皮素对照品适量,空白血浆制成质量浓度分别为1 600、800、400、200、100、20 ng/mL 的血浆对照品溶液,按“2.10.2” 项下方法处理,在“2.1.1” 项色谱条件下进样测定。以对照品峰面积(Y) 对其质量浓度(X) 进行回归,得方程为Y=1.323 6X+14.28(r=0.996 5),在20 ~1 600 ng/mL 范围内线性关系良好。
2.10.4 方法学考察 取空白血浆、灌胃给药12 h后血浆样品、血浆对照品溶液(20 ng/mL) 适量,在“2.1.1” 项色谱条件下进样测定,结果见图8,可知根皮素分离度理想,表明该方法专属性良好。取20、400、1 600 ng/mL 血浆对照品溶液适量,同一天内在“2.1.1” 项色谱条件下进样测定6次,测得根皮素峰面积RSD 分别为6.60%、7.18%、5.32%,表明该方法日内精密度良好; 同法每天测定1 次,连续6 d,测得根皮素峰面积RSD 分别为8.04%、5.43%、6.19%,表明该方法日间精密度良好。取同一份血浆样品,按“2.10.2” 项下方法平行制备6 份供试品溶液,在“2.1.1” 项色谱条件下进样测定,测得根皮素峰面积RSD 为3.68%,表明该方法重复性良好。取同一份血浆样品,在温度25 ℃、相对湿度55%下于0、2、4、6、12、24 h 在“2.1.1” 项色谱条件下进样测定,测得根皮素峰面积RSD 为6.01%,表明样品在24 h 内稳定性良好。取20、500、1 500 ng/mL血浆对照品溶液适量,在“2.1.1” 项色谱条件下进样测定,测得根皮素平均加样回收率分别为94.10%、92.53%、97.85%,RSD 分别为5.16%、7.61%、6.08%。

图8 根皮素HPLC 色谱图Fig.8 HPLC chromatograms of phloretin
2.10.5 结果分析 血药浓度-时间曲线见图9,再采用DAS 2.0 软件中的非房室模型计算主要药动学参数,结果见表4。由此可知,与原料药比较,前体脂质体tmax缩短(P<0.05),Cmax、AUC0~t、AUC0~∞升高(P<0.01),相对生物利用度增加至2.44 倍,而t1/2无明显变化(P>0.05)。

图9 根皮素血药浓度-时间曲线(n=6)Fig.9 Plasma concentration-time curves for phloretin(n=6)
表4 根皮素主要药动学参数(±s,n=6)Tab.4 Main pharmacokinetic parameters for phloretin (±s,n=6)

表4 根皮素主要药动学参数(±s,n=6)Tab.4 Main pharmacokinetic parameters for phloretin (±s,n=6)
注: 与根皮素比较,**P<0.01。
参数单位根皮素根皮素前体脂质体tmaxh1.78±0.281.18±0.22*t1/2h3.72±0.663.51±0.72 Cmaxng·mL-1503.49±152.771 190.61±355.94**AUC0~tng·mL-1·h1 303.26±174.783 186.11±550.34**AUC0~∞ng·mL-1·h1 384.50±188.393 292.74±578.81**
3 讨论
前期预实验发现,包封率随着胆固醇比例增加先升后降,可能是由于适量胆固醇可增加脂质体稳定性、包封率,但其用量过大时会引起膜超负荷[18],导致包封率反而降低,最终选择磷脂与胆固醇比例3 ∶1 ~6 ∶1 进行优化。脂药比对脂质体包封率也有较大影响,脂质(胆固醇+磷脂) 用量过小时不能有效包裹药物,导致包封率较低,而过大时会导致材料浪费,最终选择10 ∶1 ~20 ∶1 进行优化。载体用量过低时,前体脂质体重建困难[19],而过高时其本身形成的冰晶会破坏脂质体,导致包封率降低[20],最终选择2 ∶1 ~6 ∶1 进行优化。另外,磷脂本身具有保护肝功能、抗肝癌的协同作用[12],可作为“药辅合一” 材料[21]。
本实验发现,根皮素前体脂质体在模拟胃液中的累积释放度高于模拟肠液中,可能是一方面前体脂质体在前者中的稳定性不佳[21],原料药释放更容易,而另一方面原料药在碱性介质中不稳定[6],影响了在模拟肠液中的累积释放度; 前体脂质体tmax显著缩短,可能与其释药速率较快有关[22]; 前体脂质体Cmax、相对生物利用度升高,可能是由于它可降低原料药粒径,从而促进后者溶出[15,20];前体脂质体增加了原料药在胃肠液中的稳定性,提高了其进入血液循环的量。另外,无定形药物往往具有更高的吸收程度[7,11]; 药物粒径较小时可增加与胃肠道的接触面积,从而便于吸收[11,22]。但普通脂质体在胃肠道中的稳定性不高,并且外排蛋白(MRP2、P-gp) 的外排作用[6]最终影响了根皮素Cmax、相对生物利用度的提高程度。今后,将对脂质体表面进行修饰以增加其稳定性[23],从而更有利于吸收。
