毕赤酵母表达系统及其发酵策略
2023-10-27李成成黄义德
李成成,黄义德
(福建师范大学生命科学学院,福建 福州 350117)
毕赤酵母(Pichia pastoris)因其生长快、蛋白表达效率高,且易于进行分子遗传学操作等优良特点,被认为是工业上最重要的外源蛋白生产宿主之一。毕赤酵母表达系统作为一种优秀的真核表达系统,不仅能够有效的对外源蛋白基因进行转录和翻译,而且拥有蛋白质折叠、糖基化和分泌的必要细胞机制,可以用来生产与天然蛋白在生理、生化功能上非常接近的蛋白。外源蛋白可由醇氧化酶1(alcohol oxidase 1,AOX1)基因启动子诱导表达,并且其自身蛋白分泌很少,有利于外源蛋白表达后纯化,外源基因是和表达载体一起整合到毕赤酵母的染色体上,因此不会随细胞分裂而丢失,可稳定存在。毕赤酵母的强好氧性以及发酵产物在高密度发酵过程中积累后,不会对自身产生太多的毒副作用,因此非常适合进行大规模的高密度发酵。
1 毕赤酵母表达系统简介
1.1 毕赤酵母的遗传学特性
毕赤酵母是可以甲醇为唯一的碳源和能源的甲基营养型酵母,其基因组中含有两个编码醇氧化酶(alcohol oxidase,AOX)的基因:AOX1和AOX2。在甲醇存在下,AOX1和AOX2转录并最终产生大量的醇氧化酶,但AOX1表达更高,这种表型称为甲醇利用型(methanol utilizing plus phenotype,Mut+)(野生型)。因此,通过敲除AOX1基因,细胞在甲醇为碳源的环境中,生长速率会急剧减慢。这种表型称为甲醇利用缓慢型(methanol utilization slow phenotype,MutS)。当两个基因都敲除时,菌株无法在甲醇上生长,称为甲醇不利用型(methanol utilizing minus phenotype,Mut-)。
1.2 毕赤酵母表达系统的构成
1.2.1 宿主菌
目前用于外源蛋白表达的毕赤酵母宿主菌有:Mut+甲醇利用型GS115、X-33、SMD1165、SMD1163及SMD1168等大多宿主菌;MutS甲醇利用缓慢型KM71;Mut-甲醇不利用型MC100-3。所有这些菌株,甚至是Mut-菌株,都保留了AOX1启动子诱导高水平表达的能力[1]。SMD1163 (his4 pep4 prb1)、SMD1165(his4 prb1) 和 SMD1168 (his4 pep4)是蛋白酶缺陷菌株,这些菌株可使外源蛋白更稳定,不易被降解,但这些菌株不如野生型菌株那么有活力,也不易转化[2,3],因此只有在采取其他减少蛋白降解的措施无法达到满意的效果时,才建议使用蛋白酶缺陷菌株。GS115、KM71、MC100-3、SMD1168、SMD1165和SMD1163菌株是组氨酸营养缺陷型,可用来筛选转化带有组氨醇脱氢酶基因(histidinol dehydrogenase gene,his4)质粒的阳性菌株。常见毕赤酵母菌株、基因型和表现型如表1所示。

表1 常见毕赤酵母菌株、基因型和表现型
1.2.2 载体
毕赤酵母一般采用整合型穿梭质粒作为外源基因的表达载体。表达载体的遗传操作在大肠杆菌中进行(如载体保存、扩增和构建等),通过载体线性化电转酵母感受态细胞后,载体整合进酵母染色体中,表达外源蛋白。根据外源蛋白能否分泌表达将载体分为胞内表达载体(如pPIC3、pPSC3k、pAO815和pPICZA等)和胞外分泌型表达载体(如pPIC9、pPIC9K、pGAPZa、pHIL-S1p和YAM7SP6等)[4]。这些载体均包含三个序列元件:5′区的启动子序列(最常见的是AOX1)和3′区的转录终止序列以及一个包含单个或多个克隆位点的限制酶切序列,这是插入目的基因所必需的,这对于信使RNA的加工和多腺苷酸化至关重要。这些载体还会包含一个耐药基因,如Kan,Shble,Bsd,Amp或FLD1,它们分别对geneticin,zeocin,blasticidin,ampicillin和甲醛具有抗性[5]。同时,根据宿主菌的营养缺陷型载体还可携带如HIS4,MET2,ADE1,ARG4,URA3,URA5,GUT1基因以使转化后的酵母重新获得野生型的表型,利用这些基因或药物耐药性基因来作为选择标记,可便于筛选阳性转化子[3]。此外,根据外源蛋白是否需要诱导表达,还可分为诱导型表达载体(如pPICZ、pPIC6、pPIC9K等)和组成型表达载体(如pGAPZ、pAOS1等)[6]。
2 毕赤酵母高密度发酵策略
毕赤酵母的高密度发酵是在普通发酵的基础上,通过优化并调控细胞的发酵条件,使细胞在高细胞密度下产生更多的外源蛋白。毕赤酵母的高密度发酵一般分两个阶段进行,首先在碳源为甘油或葡萄糖的培养基中进行的生长阶段,积累足够的细胞密度和生物量,然后再将碳源切换至甲醇进行诱导表达目标蛋白的发酵阶段。这种方式可以提高外源蛋白的表达水平,并且使得毕赤酵母在较短时间内积累高浓度的目标蛋白。在影响毕赤酵母高密度发酵的因素中,培养基成分、温度、pH值、溶氧量、泡沫、甲醇的补料流加方式和培养时间等因素均会在一定程度上影响到外源蛋白的产量。
2.1 培养基成分对发酵影响
在高密度发酵中,培养基的成分会直接影响毕赤酵母细胞的生长以及外源基因的表达,同时也会影响工程菌的遗传稳定性。因此,毕赤酵母高密度发酵通常会针对不同的研究目的和外源蛋白特性,在选择或设计培养基时进行优化,以达到最佳的发酵效果。通常在进行毕赤酵母高密度发酵时,由于一些分泌型外源蛋白对蛋白酶的敏感度较高,容易被降解。针对这种情况,通常在毕赤酵母高密度发酵时,会选择添加含有蛋白胨和酵母粉的培养基,或者添加1%酪蛋白水解物以防止或降低外源蛋白的降解[7]。
在毕赤酵母高密度发酵过程中使用到的一些化学限定培养基包括有:Invitrogen公司提供的BSM培养基、d'Anjou和同事所提出的d'Anjou培养基[8]、由Stratton及其同事所制定的FM22培养基[9]和由Matthews及其同事为毕赤酵母设计了一种营养丰富的RDM培养基[10]。这些培养基经过配制均可在补料分批培养中获得高的细胞密度,但是这类培养基不适宜进行混合高温灭菌处理,否则会产生沉淀现象。在高密度发酵过程中,如果加入的微量元素含量过高同样也会导致沉淀生成,给发酵过程带来困扰,因此对培养基进行优化在毕赤酵母高密度发酵生产中是非常重要的。
此外,高水平的甲醇(浓度高于5%)对细胞活力毒性很大,可导致代谢中间产物甲醛和过氧化氢的积累,从而使得生产停止[11],另一方面,低水平的甲醇会触发外源蛋白的水解降解,导致生产力降低[12],一些研究文章中所使用过的最佳甲醇浓度有0.5%、1%、2%、2.5%、3%等[5]。山梨醇不会诱导或抑制AOX启动子,可与甲醇一起作为混合底物使用,混合底物的使用提高了生产率和细胞密度,并减少了诱导时间[13]。此外,山梨醇与甲醇的共同喂养减少了中间代谢物的毒性作用和氧消耗,同时也减少了特定蛋白酶的产生,也消除了乳酸的积累期[14]。一些研究表明甲醇/山梨糖醇共喂会增加重组蛋白的表达[15-18],根据其他研究的结果2.5%甲醇与1%山梨糖醇[19]、2%甲醇与0.5%山梨糖醇[20]和2%甲醇与1%山梨糖醇[21]被认为对摇瓶培养中外源蛋白的产量达到最高是最佳的。表2为用于毕赤酵母生长发酵的化学限定培养基。
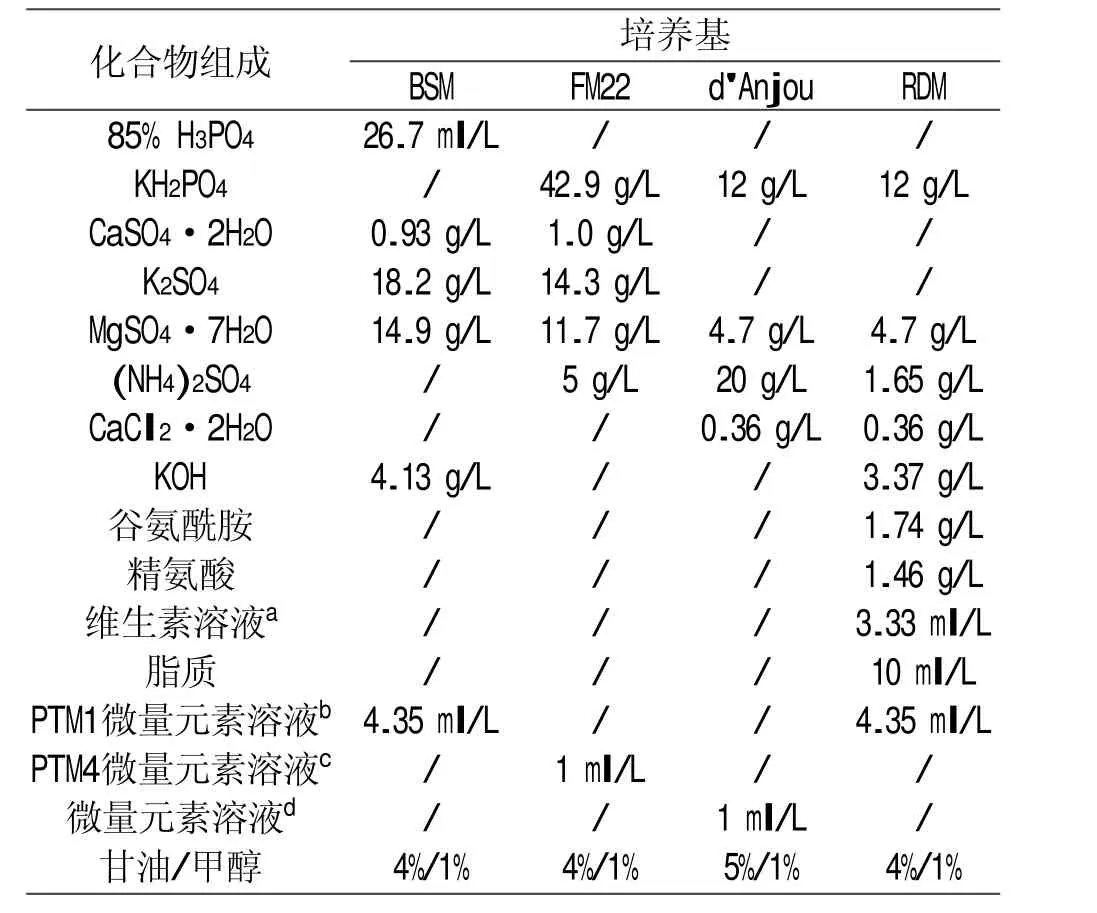
表2 用于毕赤酵母的化学限定培养基
2.2 温度对发酵的影响
温度是对毕赤酵母的生长和细胞代谢有着重要影响的因素。一般毕赤酵母所需的生长温度为28~30 ℃,高于32 ℃可能导致细胞死亡。一些研究表明,毕赤酵母在较低的培养温度下发酵可以改善靶蛋白产量,降低细胞死亡率,减少死亡后细胞内蛋白酶向培养基中释放,进而减少外源蛋白的水解[22,23],而且在较低的培养温度下,蛋白质折叠应力通常会降低,从而使得毕赤酵母能够更加有效地分泌外源蛋白[24]。
2.3 pH值对发酵的影响
pH 值在毕赤酵母的发酵过程中,不仅会影响菌体的生长状态,而且对外源蛋白的表达也会产生重要影响。pH值对毕赤酵母的影响主要包括以下方面:⑴影响细胞内酶的活性,进而影响细胞的新陈代谢,从而使外源蛋白的表达也受到影响;⑵影响细胞膜的通透性,对细胞吸收营养物质和排出代谢产物时产生一定的影响;⑶pH值会对培养基中成分和细胞的代谢产物的离解产生影响,从而对细胞吸收营养物质造成影响;⑷pH值也可能对细胞的代谢过程产生影响,使细胞代谢产物的含量发生改变[7]。另外,在高密度发酵过程中,为了减少外源蛋白被蛋白酶降解,应避开蛋白酶作用的最适pH值,将pH值设定在偏离外源蛋白等电点处,也会提高外源蛋白的收获率。
2.4 溶氧量对发酵的影响
培养基中溶氧量(DO)对于好氧微生物的生长是非常重要的。毕赤酵母的高密度发酵需要消耗大量的氧气,尤其是在利用甲醇时,溶氧不足会造成有害代谢产物在细胞中积累,产生有害影响。在高密度发酵中,使用发酵罐进行培养可以显著提高外源蛋白的表达水平,通常可高出摇瓶发酵的10~100倍,如郭永志等人使用发酵罐生产重组胰岛素比在摇瓶中的产量高了5~10倍[25],这是因为发酵罐相对于摇瓶会有更高的DO,会更有利于细胞生长及外源蛋白的表达。为了尽可能地提高培养基的溶氧量,生产上采用将纯氧和空气按照一定的比例混合这种通气方式来提高供氧,但是氧浓度太高(超过60%)细胞就会发生氧中毒,一般为保证足够的供氧DO会保持在20%~30%之间。
2.5 泡沫对发酵的影响
在高密度发酵中泡沫的产生是因为需要强烈的搅拌和曝气以及培养基中存在表面活性物质而产生,它对发酵生产的影响包括:⑴泡沫的形成会降低培养物表面的气体交换效率,因为它会在培养物和容器顶部空间的气体之间会形成屏障;⑵当气泡破裂时会产生剪切力,损害细胞和(或)任何分泌的蛋白质;⑶泡沫会将细胞和培养基带到泡沫相中,从而导致生产率降低;⑷泡沫也可能导致生产中无菌性的丧失。消泡可以采取添加消泡剂、机械搅拌或超声波的形式,最常用的方法是添加化学消泡剂,Routledge等人的研究表明添加消泡剂可以提高毕赤酵母生产的重组蛋白的总产量[26]。
2.6 甲醇的补料流加方式对发酵的影响
甲醇在毕赤酵母的发酵过程中起到两种作用:一是作为碳源提供能量,二是作为诱导剂,诱导外源蛋白的表达。因此,在发酵过程中甲醇的补加方式、用量和发酵时间都会影响到细胞的生长状态以及外源蛋白的产量。甲醇供应不足则会限制外源蛋白合成导致其表达量偏低,而如果甲醇过量则可能会对菌体造成毒性影响,进而抑制生长和表达,因此需要根据具体情况选择适宜的甲醇补加策略、用量和诱导时间,以最大化外源蛋白的表达同时保证菌体的生长和健康状态。目前,有几种方法可以用于调节甲醇的添加过程,这包括使用在线和离线甲醇监控仪器来控制流量、通过溶氧水平来控制甲醇的添加以及将甲醇与其他碳源混合后流加等,采用这些方法可以使甲醇的添加更加科学合理,从而提高外源蛋白的表达效率。
2.7 培养时间对发酵的影响
培养时间是在毕赤酵母表达系统中获得最高蛋白表达水平的最关键因素之一,在毕赤酵母表达系统中,生产时间相对较长(约100 h)。培养时间与酵母细胞的数量和目标蛋白的降解程度有关,有研究表明,巴斯德毕赤酵母细胞的最高生长密度是培养96 h,而最高蛋白表达发生在48 h[11],这表明较长的培养时间很可能会导致所表达蛋白被水解消化,也有其他的研究表明最佳蛋白质表达时间发生在培养72~96 h[20,21]。
3 展望
毕赤酵母表达系统是分子生物学中生产重组蛋白的最常用和标准工具之一,具有诸多优点,适合于工业化大规模的发酵生产,但需要一定程度的工艺优化才能实现目标蛋白的最大产量。在毕赤酵母表达系统中生产重组蛋白的最佳条件因靶蛋白而异,需要针对不同的外源蛋白采用特定的发酵工艺条件进行优化,与此同时,要寻找有效的方法来防止目标蛋白的降解,这些方法包括改进表达系统、优化培养条件、添加蛋白稳定剂、使用特定的蛋白酶抑制剂等多种途径。目前在影响毕赤酵母分泌效率因素方面的研究成果仍然很少,可以从提高蛋白质分泌性能方面着手来优化外源蛋白的表达。相信随着新的研究成果的不断出现,该系统也会越来越完善,其在分子生物学和工业应用等领域也将发挥出更大的作用。
