lncRNA RPPH1 通过调控miR-326/TCF4 信号通路影响胃癌细胞增殖和迁移的机制研究
2023-10-25邓小康雷明华
符 亮 钟 静 邓小康 雷明华
胃癌是一种起源于胃黏膜上皮细胞的消化道恶性肿瘤。胃癌的发病率和病死率目前均处于较高水平,其发生和进展受多种因素的影响,包括饮食习惯、细菌感染和遗传等[1-2]。目前胃癌的治疗方式包括手术治疗、化学治疗和靶向治疗等。近年来,研究者在肿瘤治疗领域已经取得了重大突破,但是肿瘤的复发和转移依然是胃癌治疗中的棘手问题[3],因此需要对胃癌的发生和进展机制进一步探究,寻找更有效的治疗方法。长链非编码RNA(lncRNA)是一类保守性较差、组织特异性较强、长度超过200 个核苷酸的非编码RNA。研究表明,lncRNA 具有调控肿瘤生长、转移、耐药、免疫逃逸等功能[4-5]。例如,lncRNA MEG3 可调控胃癌细胞的增殖和迁移,lncRNA EIF3J-DT 可通过调控自噬而影响胃癌化学治疗的疗效[6-7]。此外,亦有研究发现lncRNA RPPH1(下文简称RPPH1)可调控多种肿瘤的病理过程,如其可促进结直肠癌转移及M2 型巨噬细胞极化,还可促进非小细胞肺癌进展等[8-9]。目前关于RPPH1 对胃癌细胞增殖和迁移的影响的报道较少,本文对此进行探究,旨在为胃癌发生和进展的作用机制研究提供参考。
1 材料与方法
1.1 材料
收集2019 年6 月至2021 年8 月在三亚市人民医院接受胃癌根治术的30 例胃癌患者的肿瘤组织和癌旁正常组织(距肿瘤组织边缘>5 cm)标本。纳入标准:(1)经组织病理学分析确诊为胃癌;(2)为原发性胃癌,符合胃癌根治术指征并接受胃癌根治术治疗;(3)术前未行放射、化学治疗,且无远处转移;(4)均对本研究知情同意。本研究经医院医学伦理委员会批准(批件号20190508003)。
人胃癌细胞BGC-823、MGC-803、AGS、SGC-7901、MKN-45,以及人正常胃上皮细胞 GES-1 均购自国家实验细胞资源共享平台;肾上皮细胞293T购自中科院上海细胞库;LipofectamineTM2000 转染试剂盒、TRIzol 试剂盒均购自赛默飞世尔科技有限公司;5× All-In-One RT MasterMix反转录试剂盒、BlasTaqTM2× qPCR MasterMix 试剂盒均购自爱必梦生物科技有限公司;CCK-8 试剂盒、RIPA 蛋白提取试剂盒均购自沈阳万类生物科技有限公司;Transwell 小室购自康宁生物科技有限公司;双荧光素酶报告基因实验试剂盒购自汉恒生物科技(上海)有限公司;兔抗人TCF4 抗体、兔抗人GAPDH抗体、山羊抗人免疫球蛋白G(IgG)抗体均购自武汉三鹰生物技术有限公司。
1.2 细胞培养
BGC-823、MGC-803、AGS、SGC-7901、MKN-45 和GES-1 细胞均培养于含10% 胎牛血清的RPMI 1640 培养基中,293T 细胞培养于含10%胎牛血清的DMEM 培养基中。所有细胞均置于37 ℃、5% CO2的培养箱中,培养至融合度达80%时进行细胞传代。
1.3 细胞转染与分组
将MGC-803 细胞分为Control 组(转染RPPH1 siRNA 阴性对照、miR-326 inhibitor 阴性对照和TCF4 siRNA 阴性对照)、si-RPPH1 组(转染RPPH1 siRNA、miR-326 inhibitor 阴性对照和TCF4 siRNA阴性对照)、si-RPPH1+miR-326 inhibitor 组(转染RPPH1 siRNA、miR-326 inhibitor 和TCF4 siRNA 阴性对照) 及si-RPPH1+miR-326 inhibitor+siTCF4组(转染RPPH1 siRNA、miR-326 inhibitor 和TCF4 siRNA)。使用LipofectamineTM2000 转染试剂盒进行转染,按照试剂盒说明书操作,转染24 h 后取各组细胞进行后续研究。
1.4 RPPH1 和miR-326 的表达水平检测
采用实时荧光定量PCR(qRT-PCR)法检测RPPH1 和miR-326 的表达水平。使用TRIzol 试剂盒提取胃癌组织、癌旁正常组织,以及BGC-823、MGC-803、AGS、SGC-7901、MKN-45 和GES-1 细胞的总RNA,使用核酸定量仪进行总RNA 定量,取500 ng RNA,使用5× All-In-One RT MasterMix反转录试剂盒进行反应,反应条件:37 ℃ 15 min,60 ℃ 10 min,95 ℃ 3 min。 所 得cDNA 按 照BlasTaqTM2× qPCR MasterMix 试剂盒说明书进行qRT-PCR 反应,反应体系:BlasTaqTM2× qPCR MM 10 μL,正向引物 0.5 μL,反向引物 0.5 μL,DNA 模板2 μL,Nuclease-free H2O 7 μL。反应条件:95 ℃预处理3 min;之后95 ℃ 15 s,60 ℃ 1 min,72 ℃1 min,共40 个循环。分别以GAPDH 和U6 作为内参,采用2-△△Ct法计算RPPH1 和miR-326 的相对表达量。引物序列见表1。

表1 引物序列
1.5 细胞增殖能力检测
使用CCK-8 试剂盒检测细胞增殖能力。将转染后的各组MGC-803 细胞稀释至1×105个/mL,接种于96 孔板(每孔100 μL),并设置0 h、24 h、48 h和72 h对应的孔板,每组3个复孔,置于37 ℃、5%CO2条件下培养。在0 h、24 h、48 h 和72 h 取出对应的孔板,每孔加入10 μL CCK-8 试剂,混匀后使用酶标仪检测450 nm 处各孔的光密度 (OD)值。
1.6 细胞迁移和侵袭能力检测
采用Transwell 小室法检测细胞的迁移和侵袭能力。将转染后的各组MGC-803 细胞用不含血清的DMEM 培养基稀释至5×105个/mL,取200 μL接种于 Transwell 小室中,用于检测细胞迁移能力;另取200 μL 接种于铺有Matrigel 胶的Transwell 小室中,用于检测细胞侵袭能力。Transwell 小室置于含600 μL 10%胎牛血清的DMEM 培养基的24孔板中,在细胞培养箱中培养48 h,取出小室,小室底部用无水甲醛固定30 min,结晶紫染色3 min,清洗3 次后在显微镜下观察并拍照,统计细胞的迁移数目和侵袭数目。
1.7 RPPH1、miR-326 和TCF4 的靶向关系检测
采用双荧光素酶报告基因实验检测RPPH1与miR-326、miR-326 与TCF4 的靶向关系。根据starBase 数据库预测RPPH1 与miR-326 的结合位点,根据TargetScan 数据库预测miR-326 与TCF4 的结合位点。使用LipofectamineTM2000 转染试剂盒将RPPH1 质粒(RPPH1 WT)、RPPH1 突变质粒(RPPH1 MUT)、TCF4 质粒 (TCF4 WT)、TCF4 突变质粒(TCF4 MUT)转染至293T 细胞,然后将miR-326 mimic 和miR-326 mimic 阴性对照(miR-NC)分别转染至上述细胞,最后使用双荧光素酶报告基因实验试剂盒检测各组细胞荧光强度。
1.8 TCF4 的表达水平检测
采用蛋白质印迹法检测组织和细胞中TCF4的表达水平。按照RIPA 蛋白提取试剂盒说明书提取总蛋白,经蛋白定量后,每组取10 µg 蛋白,在80 V 条件下进行SDS-PAGE 凝胶电泳分离蛋白120 min,转膜90 min,PVDF 膜封闭1.5 h,加入以1 ∶1 000 比例稀释的抗TCF4 抗体、抗GAPDH抗体,4 ℃孵育过夜;TBST 清洗3 次后,加入以1 ∶2 000 比例稀释的山羊抗人IgG 抗体,室温孵育1 h,洗膜,用ECL 试剂盒显影,拍照,并进行定量分析。
1.9 统计学分析
应用GraphPad Prism 7.0 软件进行统计学分析。计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析(one-way ANOVA),2组间比较采用LSD-t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 RPPH1 在胃癌组织和胃癌细胞中的表达水平
qRT-PCR 法检测结果显示,与癌旁正常组织比较,胃癌组织中RPPH1 的表达水平显著升高(P<0.05),见图1A;与人正常胃上皮细胞GES-1比较, 人胃癌细胞BGC-823、MGC-803、AGS、SGC-7901、MKN-45 中RPPH1 的表达水平均显著升高(P均<0.001),且其在MGC-803 细胞中的表达水平最高,见图1B。
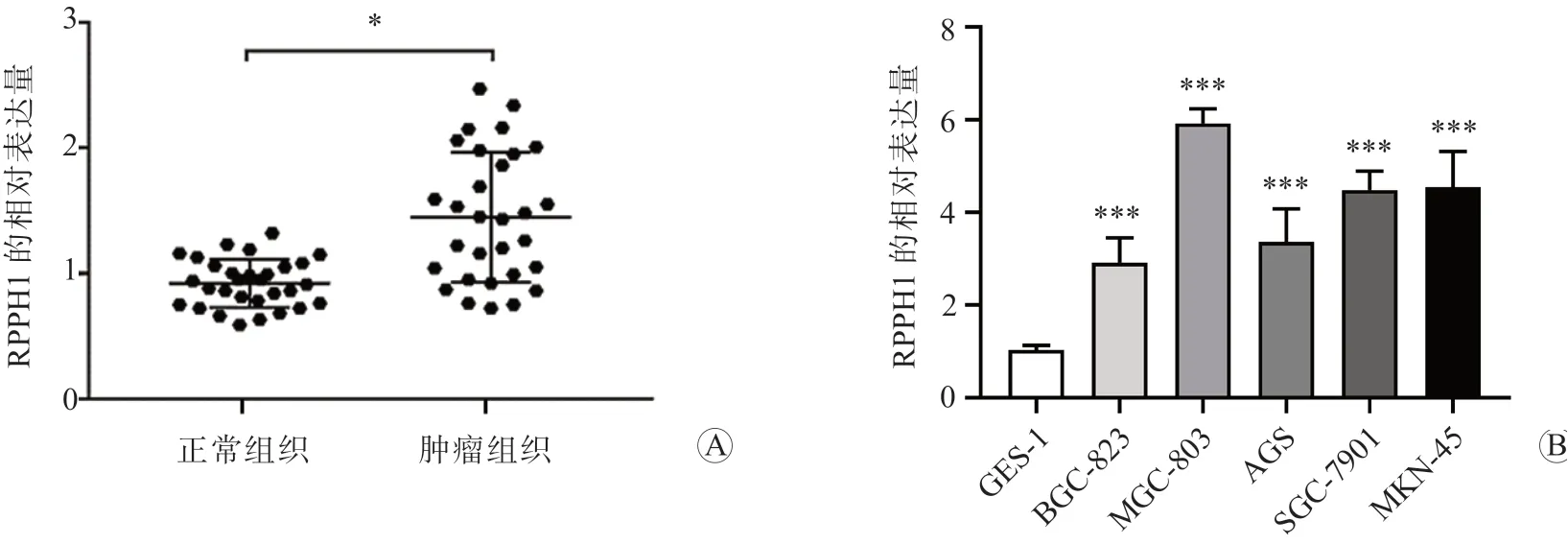
图1 不同组织及细胞中RPPH1 的表达水平比较 A 胃癌组织与癌旁正常组织比较 B 人胃癌细胞与人正常胃上皮细胞比较
2.2 RPPH1、miR-326 和TCF4 的靶向关系
RPPH1 与miR-326 的结合位点,以及miR-326与TCF4 的结合位点预测结果如图2A、图2B 所示。双荧光素酶报告基因实验检测结果显示,转染RPPH1 WT 的293T 细胞在转染miR-326 mimic后,其相对荧光强度显著低于转染miR-NC 的细胞(P<0.001);而转染RPPH1 MUT 的293T 细胞在分别转染miR-326 mimic 和miR-NC 后,两者的相对荧光强度差异无统计学意义(P<0.05),见图2C,这表明miR-326 是RPPH1 的靶基因。此外,转染TCF4 WT 的293T 细胞在转染miR-326 mimic后,其相对荧光强度显著低于转染miR-NC 的细胞(P<0.001);而转染TCF4 MUT 的293T 细胞在分别转染miR-326 mimic 和miR-NC 后,两者的相对荧光强度差异无统计学意义(P<0.05),见图2D,这表明TCF4 是miR-326 的靶基因。qRT-PCR法检测结果显示,与Control 组比较,si-RPPH1 组中miR-326 的表达水平显著升高,差异有统计学意义(P<0.001),见图2E。蛋白质印迹法检测结果显示,与Control 组比较,si-RPPH1 组中TCF4 的表达水平显著降低(P<0.001);与si-RPPH1 组比较,si-RPPH1+miR-326 inhibitor 组中TCF4 的表达水平显著升高(P<0.001),见图2F、图2G。
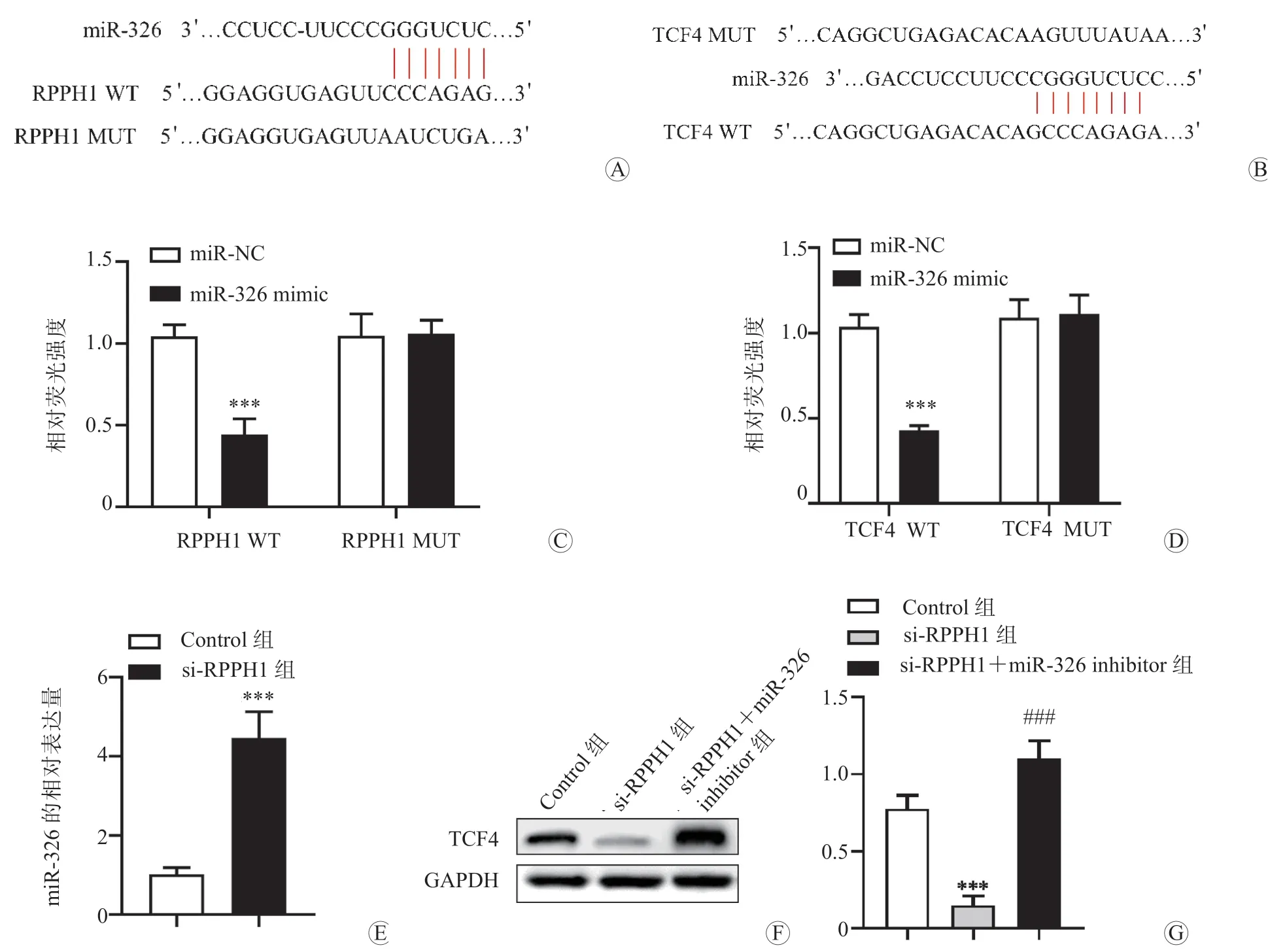
图2 RPPH1 对miR-326/TCF4 信号通路的影响 A RPPH1 与miR-326 的结合位点 B TCF4 与miR-326 的结合位点 C RPPH1 与miR-326 的靶向关系 D TCF4 与miR-326 的靶向关系 E Control 组和si-RPPH1 组中miR-326 的表达水平比较 F Control 组、si-RPPH1 组和si-RPPH1+miR-326 inhibitor 组中TCF4 的蛋白电泳图 G 各组中TCF4 的表达水平比较
2.3 胃癌组织中RPPH1、miR-326 和TCF4 表达水平的相关性分析
根据qRT-PCR 法和蛋白质印迹法的检测结果,应用GraphPad Prism 7.0 软件进行分析,结果显示胃癌组织中RPPH1 与miR-326 的表达水平呈负相关(r=-0.504,P<0.001),RPPH1 与TCF4 的表达水平呈正相关(r=0.672,P<0.001),而miR-326 与TCF4的表达水平呈负相关(r=-0.499,P<0.001)。见图3。
2.4 RPPH1 对胃癌细胞增殖能力的影响
结果显示,与Control 组比较,si-RPPH1 组细胞增殖能力显著减弱(P<0.01);与si-RPPH1 组比较,si-RPPH1+miR-326 inhibitor 组细胞增殖能力显著增强(P<0.05);与si-RPPH1+miR-326 inhibitor组比较,si-RPPH1+miR-326 inhibitor+siTCF4 组细胞增殖能力显著减弱(P<0.05)。见图4。
2.5 RPPH1 对胃癌细胞迁移和侵袭能力的影响
Transwell 小室法检测结果显示,si-RPPH1 组的细胞迁移数目和侵袭数目均显著少于Control组(P均<0.01),si-RPPH1+miR-326 inhibitor 组的细胞迁移数目和侵袭数目均显著多于si-RPPH1组(P均<0.05),而si-RPPH1+miR-326 inhibitor+siTCF4 组的细胞迁移数目和侵袭数目均显著少于si-RPPH1+miR-326 inhibitor 组(P均<0.05)。见图5。
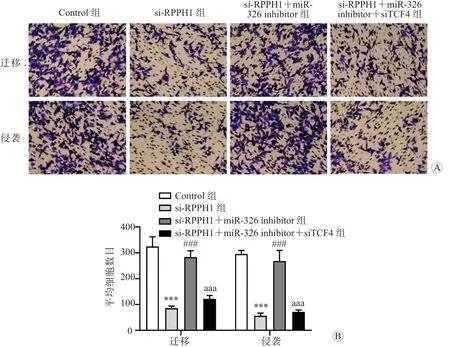
图5 各组细胞的迁移和侵袭能力比较 A 各组细胞的Transwell 小室法检测结果比较 结晶紫染色 ×400 B 各组细胞迁移和侵袭数目比较
3 讨论
lncRNA 是一类对多种肿瘤具有调控作用的非编码RNA,其调控机制涉及肿瘤的生长、转移、化学治疗耐药、放射治疗抗性及免疫逃逸等病理过程[10],其可能成为肿瘤诊断和治疗的靶点。研究表明,RPPH1 与食管癌的不良预后密切相关,并且可以调控肿瘤的放射治疗敏感性[11]。有研究报道,RPPH1 与胃癌患者的不良预后密切相关[12],但关于RPPH1 对胃癌发生和进展的影响及相关机制的研究尚不完善。本文探究了RPPH1 对胃癌细胞增殖、迁移和侵袭能力的影响及机制,旨在为胃癌的治疗提供参考。
以往研究报道,多种lncRNA 在胃癌中差异表达,如lncRNA LINC00342 和lncRNA CRNDE 在胃癌患者的肿瘤组织中呈高表达[13-14]。本研究结果显示,RPPH1 在胃癌组织中的表达水平显著高于癌旁正常组织,并且其在胃癌细胞中的表达水平亦显著高于人正常胃上皮细胞,这提示RPPH1 可能具有调控胃癌发生和进展过程的作用。lncRNA的主要调控机制之一是作为竞争性内源性 RNA(ceRNA)发挥miRNA 的“分子海绵”作用,从而抑制 miRNA 表达[15];而miRNA 发挥调控功能的机制为靶向结合信使RNA(mRNA)的3' UTR 区域,进而抑制靶基因翻译[16]。RPPH1 已被报道可在多种肿瘤中调控miRNA/mRNA 信号通路进而影响肿瘤的病理过程,如Wu 等[9]的研究发现RPPH1可通过调控miR-326/WNT2B 信号通路影响非小细胞肺癌的病程,Zhang 等[17]的研究发现RPPH1 可通过下调乳腺癌组织中miR-122 的表达而抑制肿瘤进展。本研究通过双荧光素酶报告基因实验验证了miR-326 为RPPH1 的靶基因,而TCF4 为miR-326 的靶基因,并指出RPPH1 可通过调控miR-326表达而影响TCF4 的表达水平;此外,本研究还发现胃癌组织中RPPH1 与miR-326 的表达水平呈负相关,RPPH1 与TCF4 的表达水平呈正相关,而miR-326 与TCF4 的表达水平呈负相关,这进一步提示RPPH1、miR-326 和TCF4 均与胃癌的发生和进展密切相关。Jiang 等[18]的研究表明,lncRNA LINC01270 可调控胃癌组织中miR-326 的表达水平;亦有研究发现,miR-133a-5p 可通过下调TCF4 的表达而抑制胃癌进展[19];此外,有研究表明H19/miR-152-3p/TCF4 信号通路可通过调控胃癌细胞的上皮间充质转化而影响化学治疗药物的耐药性[20]。由此推测,RPPH1 可能通过调控miR-326/TCF4 信号通路而促进胃癌的发生和进展。本研究结果表明,抑制RPPH1 表达后胃癌细胞的增殖、迁移和侵袭能力均显著减弱,而miR-326 的表达上调;如抑制RPPH1 表达的同时抑制miR-326 的表达,则胃癌细胞的增殖、迁移和侵袭能力显著增强,且TCF4 的表达上调;如抑制RPPH1 和miR-326 表达的同时抑制TCF4 表达,那么胃癌细胞的增殖、迁移和侵袭能力又将显著减弱,这提示RPPH1 可通过调控miR-326/TCF4 信号通路影响胃癌细胞的增殖、迁移和侵袭能力。
综上所述,RPPH1 在胃癌组织和胃癌细胞中均呈高表达,并可能通过调控miR-326/TCF4 信号通路影响胃癌细胞的增殖和迁移,但是RPPH1 是否能够成为胃癌诊断和治疗的新靶点还需今后进一步探究。
