CDK5RAP1 通过Wnt/β-Catenin 信号通路调控结直肠癌发生和进展的研究
2023-10-25蒋漫琦何师茜周晓倩
蒋漫琦 何师茜 杨 洪 周晓倩
结直肠癌(CRC)是消化道常见恶性肿瘤,CRC 患者的早期症状不明显,多数患者确诊时已处于晚期,从而增加了临床治疗的难度[1]。因此,亟需探索新的靶点以提高CRC 的疗效。多条信号通路失调在CRC 的发生和进展中起着重要作用。Wnt/β-连环蛋白(β-Catenin)信号过度激活可促进CRC 的发生和进展[2]。研究表明可通过抑制Wnt/β-Catenin 信号通路以抑制CRC 细胞的增殖、迁移和侵袭[3]。周期素依赖性激酶5 激活结合蛋白1(CDK5RAP1)与细菌MiaB 蛋白同源,是一种自由基S-腺苷蛋氨酸(SAM)酶[4]。CDK5RAP1与细胞凋亡间的关系已得到证实,研究发现CDK5RAP1 缺乏可以通过活性氧/c-Jun N 末端激酶(ROS/JNK)信号通路诱导乳腺癌细胞的周期停滞和凋亡[5]。目前鲜有CDK5RAP1 在CRC 发生和进展中作用的相关研究报道,本课题组的前期研究结果显示,CRC 组织中CDK5RAP1 的表达水平显著高于癌旁组织,推测其可能参与了CRC 发生和进展的调控。本研究探讨了CDK5RAP1 通过Wnt/β-Catenin 信号通路对CRC 发生和进展的影响及机制,以期为CRC 患者的临床治疗提供参考依据。
1 材料与方法
1.1 材料
选取2020 年6 月至2022 年9 月在贵阳市第一人民医院被首诊为CRC 的72 例患者的CRC 组织和癌旁组织(距肿瘤组织边缘>3 cm)。所有患者在术前均未接受化学治疗、放射治疗或其他抗肿瘤治疗。将手术切除组织分成2 份,1 份组织用于实时荧光定量RCR 法检测,另1 份用4%多聚甲醛溶液固定后用于免疫组织化学染色分析。本研究获得医院医学伦理学委员会批准,所有入选者均签署知情同意书。
本研究采用的人CRC 细胞系HCT-116、SW480、HT29、SW620、Caco-2 及人正常结直肠上皮细胞系NCM460 均购自中国科学院上海细胞库。18 只4~5 周龄BALB/C 裸鼠,雌雄各半,购自北京维通利华实验动物技术有限公司,本研究获得医院动物伦理委员会批准。
1.2 实验试剂
CCK-8 试剂盒购自上海碧云天生物技术有限公司;Wnt 激活剂HLY78 购自美国MCE 公司;Matrigel 基质胶购自美国BD 公司;TRIzol 试剂购自杭州新景生物试剂开发有限公司;Aurum Total RNA Mini Kit 试剂盒和iScript™ cDNA Synthesis Kit试剂盒均购自美国BIO-RAD 公司;Lipofectamine®3000 转染试剂购自美国Invitrogen 公司;β-Catenin、Axin1、c-Myc、CD133、CD44、SOX2、β-actin 一抗和辣根过氧化物酶(HRP)标记的羊抗兔(ab288151)二抗均购自英国Abcam 公司。
1.3 细胞培养
所有细胞均在含10%胎牛血清的RPMI-1640培养基中培养,置于5% CO2、37 °C 细胞培养箱中。
1.4 细胞转染与分组
将各CRC 细胞以1×105个/孔的密度接种至6 孔板,待细胞密度为60%~70% 时,使用Lipofectamine®3000 转染试剂分别将si-NC 和si-CDK5RAP1 转染至HCT-116 细胞中,分别将pc-NC和pc-CDK5RAP1 转染至SW480 细胞中,再培养48 h 以备后续实验。将SW480 细胞分为SW480-CON 组(正常培养细胞)、SW480-pc-NC 组(阴性对照细胞,转染CDK5RAP1 过表达质粒pc-NC)、SW480-pc-CDK5RAP1 组(过表达细胞,转染CDK5RAP1 过表达质粒pc-CDK5RAP1)和SW480-HLY78 组(SW480-pc-CDK5RAP1+20 μmol/L Wnt激活剂HLY78)[6],将HCT-116 细胞分为HCT-116-CON 组(正常培养)、HCT-116-si-NC 组(阴性对照细胞,转染CDK5RAP1 siRNA si-NC)、HCT-116-si-CDK5RAP1 组(低表达细胞,转染CDK5RAP1 siRNA si-CDK5RAP1)和HCT-116-HLY78 组(HCT-116-si-CDK5RAP1+20 μmol/L HLY78)[6]。
1.5 实时荧光定量PCR 法检测组织和细胞中CDK5RAP1 的表达情况
使用Trizol 试剂提取组织和CRC 细胞中的总RNA,测定其浓度,使用逆转录试剂盒将RNA 逆转录为cDNA,使用实时荧光定量PCR 仪进行扩增。以GAPDH 为内参,采用2-△△Ct法计算目标基因CDK5RAP1 的相对表达量。引物序列见表1。

表1 引物序列
1.6 免疫组织化学染色法检测组织中CDK5RAP1的表达情况
将组织固定、脱水、石蜡包埋、切片(5 μm 厚),将组织切片经TRIS 缓冲盐溶液预孵育后,用10%山羊血清封闭,与CDK5RAP1 一抗在4 ℃下孵育过夜,再与二抗在室温下持续孵育2 h,DAB 显色后行苏木精复染,在显微镜下观察并拍照。
1.7 CCK-8 法检测CRC 细胞增殖情况
将各组CRC 细胞以1×104个/孔的密度接种至96 孔板培养48 h,弃上清,每孔加入含10 μL CCK-8 的完全培养液100 μL,37 ℃下孵育2 h,使用酶标仪检测495 nm 处的吸光度(OD),并计算细胞存活率。实验设置空白孔(不加细胞,只加培养液)调零。细胞存活率=(OD实验-OD空白)/(OD对照-OD空白)×100%,其中OD实验为基因过表达组或基因敲低组细胞的OD 值,OD对照为CON 组细胞的OD 值,OD空白为空白孔的OD 值。
1.8 平板克隆实验检测CRC 细胞的克隆情况
将各组CRC 细胞接种至6 孔板(500 个/孔),37 ℃下培养14 d 后,用4%多聚甲醛溶液固定30 min,用0.5%结晶紫染色,水洗,干燥,肉眼计数克隆的细胞数。细胞克隆率=细胞克隆数/细胞接种数×100%。
1.9 Transwell 实验检测CRC 细胞的侵袭能力
使用基础培养液重悬各组CRC 细胞,使其密度调整为5×105个/mL。Transwell 小室预涂有稀释后的Matrigel 基质胶(预冷基础培养液以1 ∶3 体积比稀释)。将200 μL 细胞液加入上室,下室加入500 μL 完全培养基,在37 ℃下孵育48 h 后,用4%多聚甲醛溶液固定下室细胞10 min,用0.1%结晶紫染色30 min。在显微镜下随机选取5 个视野计数细胞侵袭数量,结果取平均值。
1.10 划痕愈合实验检测CRC 细胞的迁移能力
将各组CRC 细胞以1×105个/孔的密度接种至6 孔板,置于5% CO2、37 ℃培养箱中培养24 h,用10 μL 移液枪枪头竖直向上划痕,在显微镜下拍照并记录0 h、48 h 细胞划痕宽度,计算细胞划痕愈合率。划痕愈合率=(0 h 细胞划痕宽度-48 h划痕宽度)/0 h 细胞划痕宽度×100%。
1.11 肿瘤细胞成球试验
在各组细胞中加入成球培养基,在低黏附的6 孔板中培养10 d,在显微镜下随机选取5 个视野观察细胞成球情况并拍照,使用Image J 软件计数直径≥75 μm 的肿瘤球数量,并计算成球率。成球率=肿瘤球数/接种细胞数×100%,肿瘤细胞成球率取5 个视野的平均值。
1.12 蛋白质印迹法检测组织和细胞中蛋白的表达情况
CRC 组织、癌旁组织和各组细胞使用RIPA裂解液提取总蛋白,使用BCA 法检测浓度。蛋白质变性后使用10% SDS-PAGE 分离总蛋白,转膜,5%脱脂牛奶封闭,加入β-Catenin、Axin1、c-Myc、CD133、CD44、SOX2 和β-actin 一抗,在4 ℃下孵育过夜,用HRP 偶联的二抗孵育2 h,洗涤,使用ECL 液显色,使用Image J 软件对蛋白条带灰度值进行定量分析。
1.13 裸鼠体内移植瘤实验
将18 只裸鼠随机分为对照组、si-NC 组和si-CDK5RAP1 组,每组6 只。分别向各组裸鼠右前肢腋下注射对应的HCT-116 细胞悬液,每只注射4×106个细胞,5 周后以颈椎脱臼法处死裸鼠,剥离肿瘤组织并称重观察。
1.14 统计学分析
应用SPSS 25.0 软件进行统计学分析,计量资料以均数±标准差(±s)表示,计数资料以例(%)表示。2 组间数据比较采用SNK-q检验,多组间数据比较采用单因素方差分析。P<0.05 为差异有统计学意义。
2 结果
2.1 CRC 组织和癌旁组织中CDK5RAP1 的表达情况
实时荧光定量PCR 法检测结果显示,CRC 组织中CDK5RAP1 的表达水平较癌旁组织显著升高(P<0.05);免疫组织化学染色结果显示,CRC 组织中CDK5RAP1 阳性表达率较癌旁组织显著升高(P<0.05)。见表2、图1。

表2 CRC 组织和癌旁组织中CDK5RAP1 的表达情况
2.2 各细胞中CDK5RAP1 的表达水平
如表3 所示,与NCM460 细胞相比,HCT-116、SW480、HT29、SW620、Caco-2 细胞中CDK5RAP1的表达水平均显著升高(P均<0.05), 并且CDK5RAP1 在HCT-116 细胞中表达水平最高,在SW480 细胞中表达水平最低,故分别采用HCT-116细胞和SW480 细胞构建CDK5RAP1 基因敲低和过表达的慢病毒载体稳定转染细胞株。
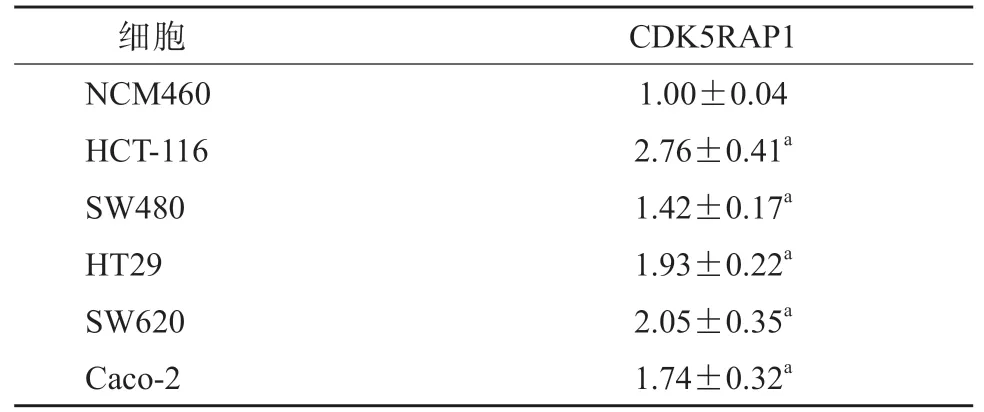
表3 各细胞中CDK5RAP1 的表达水平
2.3 各组CRC 细胞中CDK5RAP1 的表达水平
如表4 所示,SW480-pc-CDK5RAP1 组细胞中CDK5RAP1 的表达水平较SW480-CON 组和SW480-pc-NC 组细胞均显著升高(P均<0.05),SW480-HLY78 组 与SW480-pc-CDK5RAP1 组 细 胞中CDK5RAP1 的表达水平差异无统计学意义(P>0.05)。如表5 所示,HCT-116-si-CDK5RAP1 组细胞中CDK5RAP1 的表达水平较HCT-116-CON 组和HCT-116-si-NC 组细胞均显著降低(P均<0.05),HCT-116-HLY78 组与HCT-116-si-CDK5RAP1 组细胞中CDK5RAP1 的表达水平差异无统计学意义(P>0.05)。
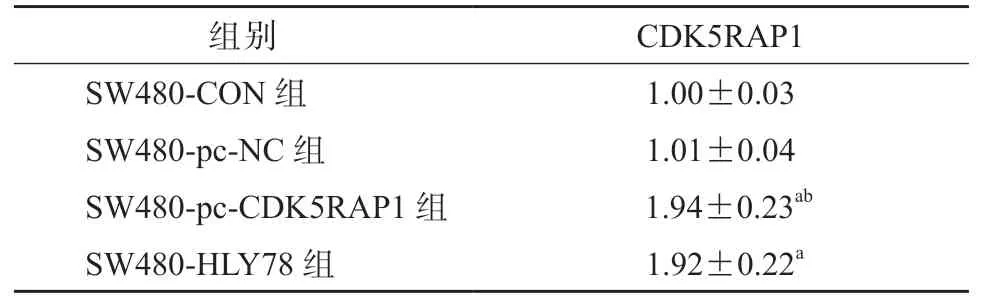
表4 各组 SW480 细胞中CDK5RAP1 的表达水平
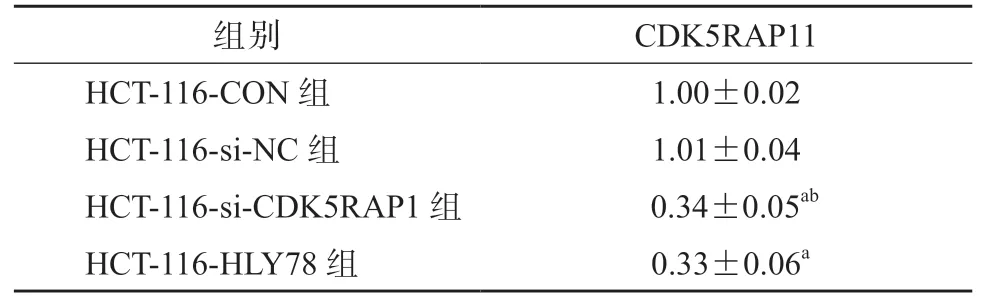
表5 各组HCT-116 细胞中CDK5RAP1 的表达水平
2.4 各组CRC 细胞的增殖和克隆情况
4SW480-pc-CDK5RAP1 组细胞存活率和克隆率较SW480-CON 组和SW480-pc-NC 组细胞均显著升高(P均<0.05),SW480-HLY78 组细胞存活率和克隆率较SW480-pc-CDK5RAP1 组细胞均显著升高(P均<0.05),见表6、图2。HCT-116-si-CDK5RAP1 组细胞存活率和克隆率较HCT-116-CON 组和HCT-116-si-NC 组细胞均显著降低(P均<0.05),HCT-116-HLY78 组细胞存活率和克隆率较HCT-116-si-CDK5RAP1 组细胞均显著升高(P均<0.05),见表7、图3。
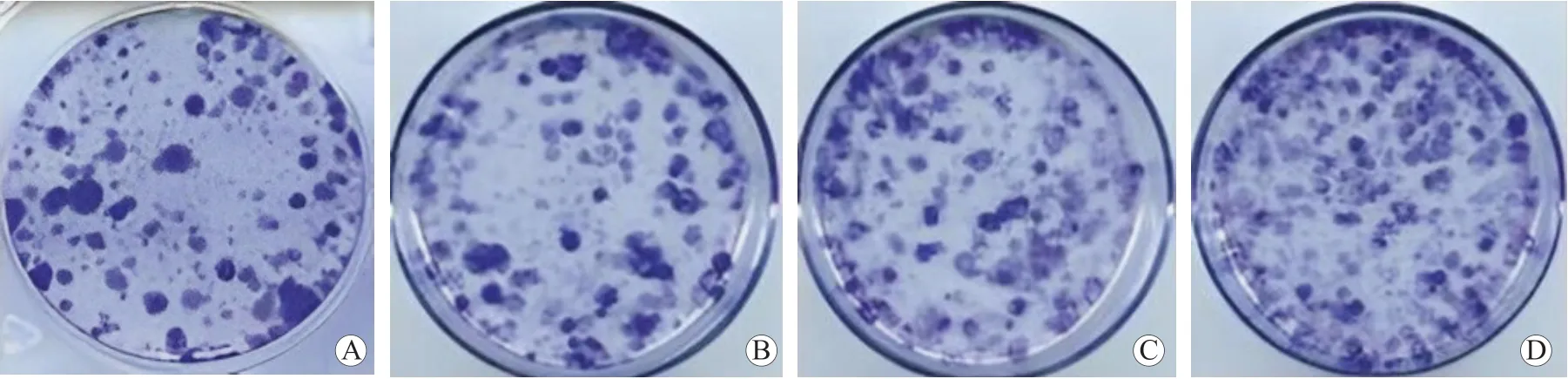
图2 各组 SW480 细胞的克隆情况 A SW480-CON 组 B SW480-pc-NC 组 C SW480-pc-CDK5RAP1 组 D SW480-HLY78 组
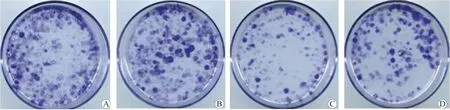
图3 各组HCT-116 细胞的克隆情况 A HCT-116-CON 组 B HCT-116-si-NC 组 C HCT-116-si-CDK5RAP1 组 D HCT-116-HLY78 组
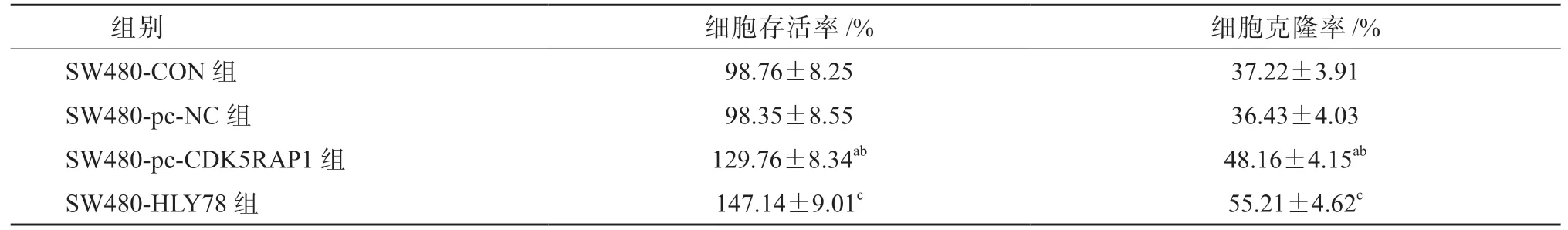
表6 各组 SW480 细胞的增殖和克隆情况
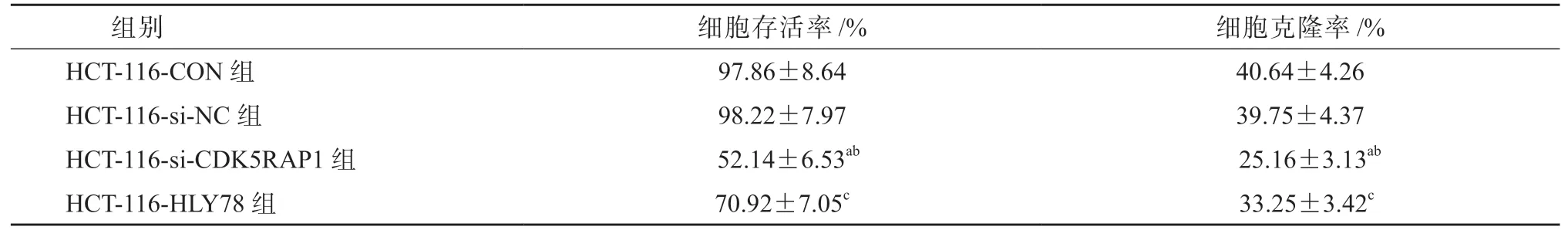
表7 各组HCT-116 细胞的增殖和克隆情况
2.5 各组CRC 细胞的迁移和侵袭情况
SW480-pc-CDK5RAP1 组的细胞划痕愈合率和细胞侵袭数量较SW480-CON 组和SW480-pc-NC 组均显著升高(P均<0.05),SW480-HLY78 组的细胞划痕愈合率和细胞侵袭数量较SW480-pc-CDK5RAP1 组均显著升高(P均<0.05),见表8、图4 和图5。HCT-116-si-CDK5RAP1 组的细胞划痕愈合率和细胞侵袭数量较HCT-116-CON 组和HCT-116-si-NC 组均显著降低(P均<0.05),HCT-116-HLY78 组的细胞划痕愈合率和细胞侵袭数量较HCT-116-si-CDK5RAP1 组均显著升高(P均<0.05),见表9、图6 和图7。

图4 各组SW480 细胞的迁移情况 ×100 A 迁移0 h B 迁移48 h
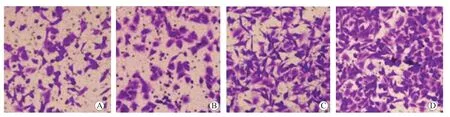
图5 各组SW480 细胞的侵袭情况 ×400 A SW480-CON 组 B SW480-pc-NC 组 C SW480-pc-CDK5RAP1 组 D SW480-HLY78 组

图6 各组HCT-116 细胞的迁移情况 ×100 A 迁移0 h B 迁移48 h
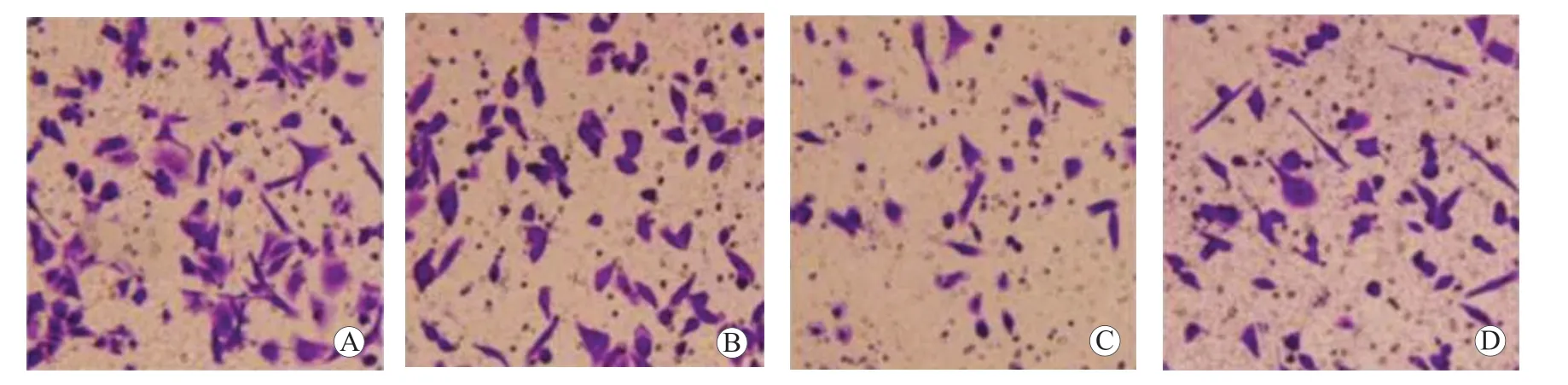
图7 各组HCT-116 细胞的侵袭情况 ×400 A HCT-116-CON 组 B HCT-116-si-NC 组 C HCT-116-si-CDK5RAP1 组 D HCT-116-HLY78 组
表8 各组SW480 细胞的迁移和侵袭情况
2.6 各组CRC 细胞的肿瘤球形成情况
SW480-pc-CDK5RAP1 组细胞的成球率较SW480-CON 组和SW480-pc-NC 组均显著升高(P均<0.05),SW480-HLY78 组细胞的成球率较SW480-pc-CDK5RAP1 组显著升高(P<0.05),见表10、图8。HCT-116-si-CDK5RAP1 组细胞的成球率较HCT-116-CON 组和HCT-116-si-NC 组均显著降低(P均<0.05),HCT-116-HLY78 组细胞的成球率较HCT-116-si-CDK5RAP1 组显著升高(P<0.05),见表11、图9。

图8 各组SW480 细胞的肿瘤球形成情况 ×100 A SW480-CON 组 B SW480-pc-NC 组 C SW480-pc-CDK5RAP1 组 D SW480-HLY78 组
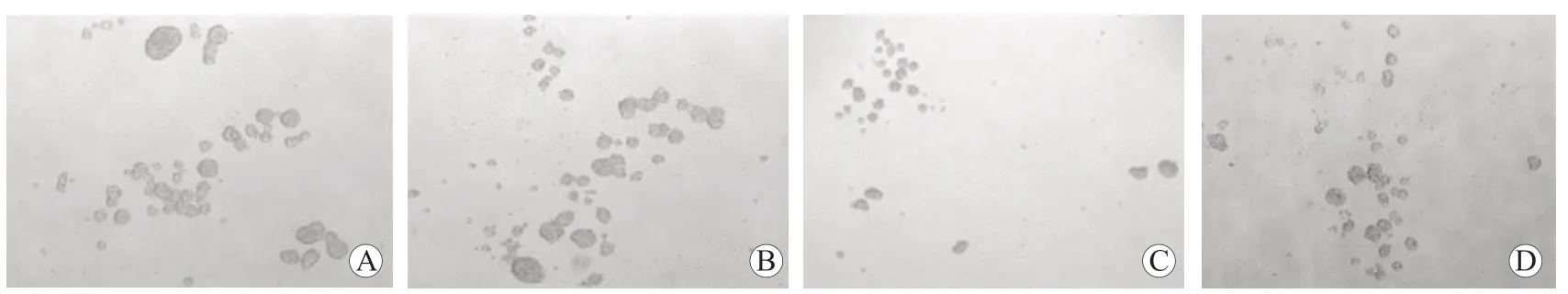
图9 各组HCT-116 细胞的肿瘤球形成情况 ×100 A HCT-116-CON 组 B HCT-116-si-NC 组 C HCT-116-si-CDK5RAP1 组D HCT-116-HLY78 组
表10 各组SW480 细胞的肿瘤球形成情况

表11 各组HCT-116 细胞的肿瘤球形成情况
2.7 各组CRC 细胞中蛋白的表达水平
与SW480-CON 组和SW480-pc-NC 组相比,SW480-pc-CDK5RAP1 组细胞中β-Catenin、c-Myc、CD133、CD44、SOX2 蛋白的表达水平均显著升高,Axin1 蛋白的表达水平显著降低(P均<0.05);与SW480-pc-CDK5RAP1 组相比,SW480-HLY78 组细 胞 中β-Catenin、c-Myc、CD133、CD44、SOX2蛋白表达水平均显著升高,Axin1 蛋白表达水平显著降低(P均<0.05);见表12、图10。与HCT-116-CON 组 和HCT-116-si-NC 组 比,HCT-116-si-CDK5RAP1 组细胞中β-Catenin、c-Myc、CD133、CD44、SOX2 蛋白表达水平均显著降低,Axin1 蛋白表达水平显著升高(P均<0.05);与HCT-116-si-CDK5RAP1 组相比,HCT-116-HLY78 组细胞中β-Catenin、c-Myc、CD133、CD44、SOX2 蛋白表达水平均显著升高,Axin1 蛋白表达水平显著降低(P均<0.05);见表13、图11。
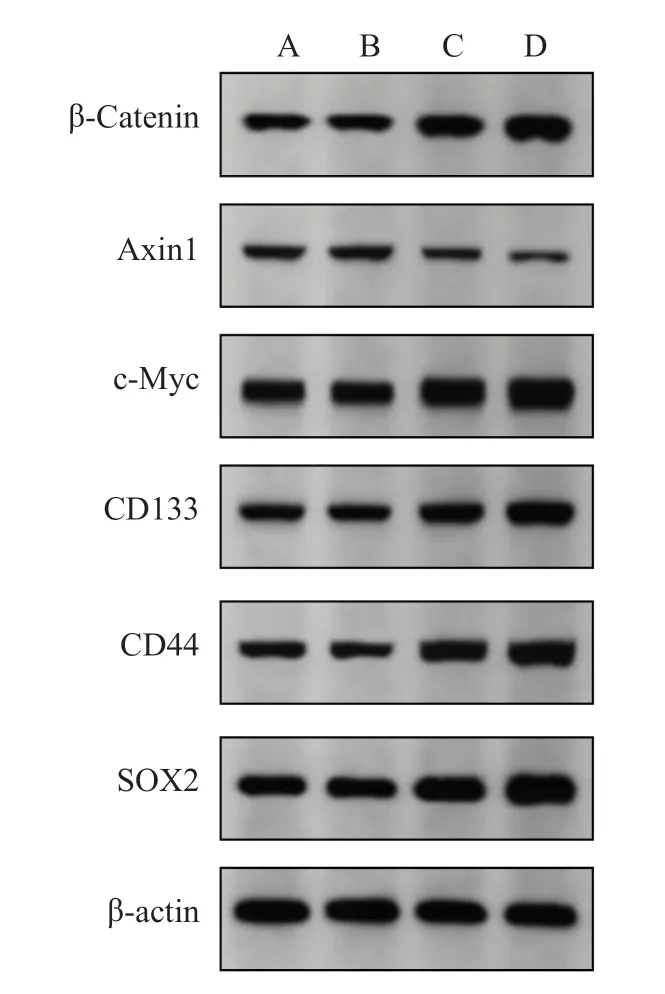
图10 各组SW480 细胞中蛋白表达水平
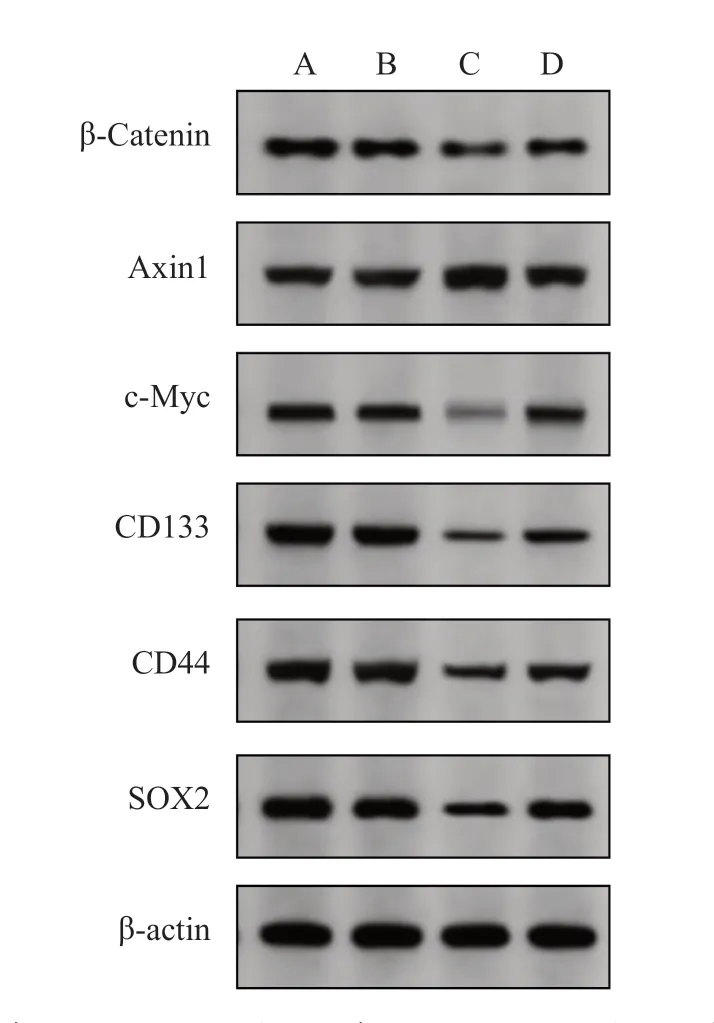
图11 各组HCT-116 细胞中蛋白表达水平
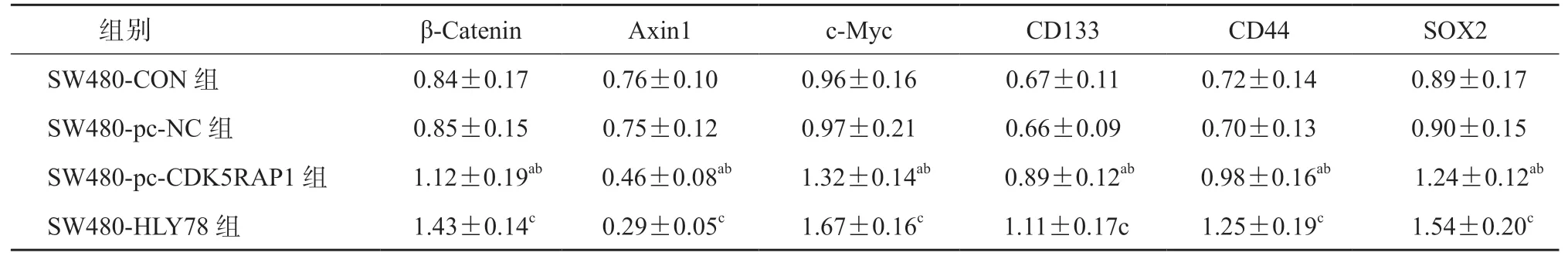
表12 各组SW480 细胞中蛋白的表达水平

表13 各组HCT-116 细胞中蛋白的表达水平
2.8 敲低CDK5RAP1 基因表达对裸鼠移植瘤的影响
如表14、图12 所示,si-CDK5RAP1 组裸鼠移植瘤的质量较CON 组和si-NC 组均显著降低(P均<0.05),体积也均显著缩小。
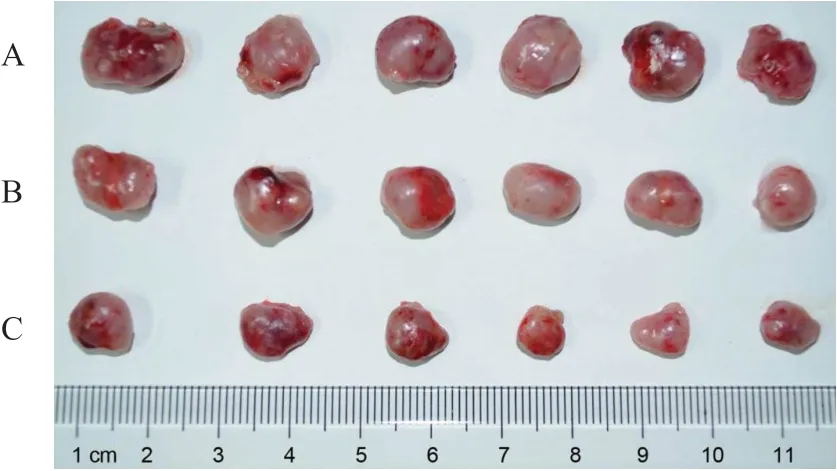
图12 各组裸鼠移植瘤的体积

表14 各组裸鼠移植瘤的质量
3 讨论
CRC 是全球常见消化道恶性肿瘤之一,尽管临床诊断和综合治疗显著延长了部分患者的生存期,但CRC 转移患者的预后仍较差[7-8]。目前靶向治疗已成为CRC 转移患者的治疗方法之一,寻找新的靶点对于改善CRC 患者的治疗结果非常重要。CDK5 是一种脯氨酸介导的丝氨酸/苏氨酸激酶,研究发现CDK5 在胃癌组织中表达下调,而CDK5 表达上调则可抑制胃癌发生[9]。此外,许多研究报道CDK5 还与前列腺癌、甲状腺髓样癌、肝细胞癌、肺癌及CRC 均有相关性[10]。CDK5RAP1是CDK5 的内源性抑制剂,CDK5RAP1 过表达可显著抑制CDK5 的活性[11]。Yamamoto 等[12]的研究发现,DK5RAP1 可以维持胶质瘤起始细胞(GIC)的自我更新能力、未分化状态及致瘤潜力。本研究结果显示,CRC 组织中CDK5RAP1 的表达水平较癌旁组织显著升高,各CRC 细胞中CDK5RAP1 的表达水平也均显著高于正常结直肠上皮细胞,且CDK5RAP1 在HCT-116 细胞中表达水平最高,在SW480 细胞中表达水平最低,表明CDK5RAP1在CRC 组织和细胞中呈高表达。为进一步探索CDK5RAP1 在CRC 中的作用,本研究选用HCT-116细胞和SW480 细胞分别构建了CDK5RAP1 基因敲低和过表达的慢病毒载体稳定转染细胞株,结果显示CDK5RAP1 基因过表达时,SW480 细胞的存活率、细胞克隆率、细胞划痕愈合率及细胞侵袭数量均显著升高;CDK5RAP1 基因敲低时,HCT-116 细胞的存活率、细胞克隆率、细胞划痕愈合率及细胞侵袭数量均显著降低,表明CDK5RAP1 在CRC 中起着促癌作用,CDK5RAP1 表达下调可抑制CRC的发生和进展。为了探索CDK5RAP1 在机体内的作用,本研究将稳定转染的HCT-116 细胞皮下注射到裸鼠体内,5 周后发现CDK5RAP1 低表达的si-CDK5RAP1 组裸鼠的移植瘤质量明显低于CON 组,表明CDK5RAP1 参与了裸鼠体内CRC 的发生。
Wnt/β-Catenin 信号通路与细胞的增殖、分化、迁移和存活相关[13]。该信号通路异常激活是CRC发生和进展的关键驱动因素,可促进肿瘤的生长和复发[14]。β-Catenin 是Wnt/β-Catenin 通路的关键调控因子,β-Catenin 进入细胞核与转录因子(TCF)结合,激活下游基因(CD44 和c-Myc)的转录,从而增强CRC 的干性并促进CRC 进展[15]。Axin1 是Wnt/β-Catenin 信号通路的重要负向调节剂,Axin1低表达会导致β-Catenin 和下游癌基因过度转录,从而促使肿瘤发生。多种肿瘤中存在Axin1 表达下调,如肝细胞癌、结直肠癌、前列腺癌和胃癌,诱导Axin1 表达上调是Wnt/β-Catenin 信号通路依赖性肿瘤的新疗法[16-18]。CD133 和CD44 是人CRC 干细胞的重要标志物,CD133 是肿瘤干细胞上表达的五跨膜糖蛋白,CD44 参与肿瘤细胞的增殖、黏附和迁移[19]。SOX2 可驱动肿瘤干细胞的特性,促进肿瘤发生和侵袭,Jiang 等[20]的研究发现miR-30-5p 过表达可显著降低HEK293 和Caco2 细胞的CD133 和SOX2 表达,并可降低CRC 干细胞中Wnt/β-Catenin信号转导靶基因(Axin2 和Myc)的表达水平。本研究也发现CDK5RAP1 高表达可使SW480 细胞的成球率及β-Catenin、c-Myc、CD133、CD44、SOX2的蛋白表达水平升高,并可使Axin1 的蛋白表达水平降低,而敲低CDK5RAP1 表达则可使HCT-116细胞的成球率及β-Catenin、c-Myc、CD133、CD44、SOX2 的蛋白表达水平降低,并可使Axin1 的蛋白表达水平升高,该结果表明CDK5RAP1 可调节细胞的干性,并提示CDK5RAP1 可通过调控Wnt/β-Catenin 信号通路参与CRC 的发生。本研究还发现加入Wnt 激活剂HLY78 后,HLY78 可进一步促进CDK5RAP1 高表达的SW80 细胞的增殖、迁移、侵袭及干性,也可逆转CDK5RAP1 低表达对HCT-116 细胞增殖、迁移、侵袭和干性的抑制,进一步验证了CDK5RAP1 可靶向Wnt/β-Catenin 信号通路参与CRC 的发生和进展。
综上所述,CDK5RAP1 在CRC 中呈高表达,可促进CRC 细胞的增殖、迁移、侵袭和干性,而敲低CDK5RAP1 表达可通过Wnt/β-Catenin 信号通路抑制CRC 细胞的增殖、迁移、侵袭和干性。目前CDK5RAP1 靶向Wnt/β-Catenin 信号通路的直接作用靶点尚未明确,今后的研究将对此进行深入探索,为CDK5RAP1 在CRC 的临床靶向治疗提供理论依据。
