柠檬酸铁铵对悬浮HEK293细胞转染的影响机制探究
2023-10-25陈中元王玉红代为俊张艳敏叶倩刘旭平谭文松赵亮
陈中元 王玉红 代为俊 张艳敏 叶倩 刘旭平 谭文松 赵亮,
(1.华东理工大学生物工程学院,上海 200237;2.青岛易邦生物工程有限公司,青岛 266114;3.上海倍谙基生物科技有限公司,上海 201203)
HEK293细胞转染技术在调控基因表达和蛋白质生产等生物学实验中应用广泛,前景广阔[1]。其中PEI介导的HEK293细胞转染技术[2]广泛应用于基因治疗载体大规模生产[3]和临床实验药品生产领域[4-5],是获得大量目标产物较为经济、高效的手段[6]。无血清全悬浮HEK293细胞培养过程具有高密度、易操作、易放大等优势,在该悬浮培养工艺的基础上进行外源DNA的转染,有利于快速获得大量目标产品,已成为当前的发展趋势[7]。在转染过程中达到较高的转染效率,是实现高产量、高滴度的前提[8]。然而悬浮HEK293细胞转染效率较低,限制了该技术大规模应用[9]。在实际操作中,为消除悬浮HEK293细胞转染过程中生长培养基的抑制作用,最常见的方法是转染前进行离心并更换培养液[10],但该方法存在易污染、难放大等缺点,不适合规模化生产。截至目前,对贴壁HEK293细胞转染效率影响因素的研究已较为深入[11],但对影响悬浮HEK293细胞转染效率的培养基关键组分研究报道相对较少。因此亟待探究悬浮HEK293细胞培养基中影响转染效率的关键组分,并分析其影响转染效率的原因,据此开发合适的转染培养基以及最优转染工艺。使HEK293细胞转染技术更加便捷可行,成为商业化生产中的首选。
近年来对转染效率的研究大多集中在转染过程的影响因素上。对细胞状态的研究发现,良好的细胞状态是成功转染的关键因素之一,转染时使细胞处于指数生长期可提高转染效率[12-15]。van Gaal[16]发现转染前PEI与DNA的孵育液将影响转染效率,转染效率高低取决于DNA和PEI的比例、孵育时间以及孵育液pH值、离子强度和体积。此外,研究表明培养基的组分也是影响转染效率的重要因素。例如Pham等[17]在2003年发现,大多数蛋白胨(酪蛋白来源)会影响细胞的转染效率,随后在2004年发现防止细胞聚集所添加的肝素或硫酸葡聚糖等会干扰PEI-DNA复合物进入细胞,极大地降低转染效果[18]。Eberhardy等[19]在2009年发现,铁的不同添加方式对CHO细胞转染效率存在显著影响。对培养基中抑制转染的组分浓度、添加方式等进行优化,是提高转染效率的关键。由于蛋白胨、肝素、硫酸葡聚糖并非细胞生长必需的物质,在转染培养基开发时一般选择将其去除。但铁元素是无血清培养基中必须添加的物质[20]。与其他铁供体相比,柠檬酸铁铵成分明确,可提高细胞存活率,并且其添加可以显著提高抗体产量,因此柠檬酸铁铵在培养基开发中不可或缺[21]。柠檬酸铁铵在培养基中一般单独添加,添加量在50-100 μmol/L,此浓度会强烈抑制细胞的转染过程。为解决此问题,Capella Roca等[22]采用转染前离心换液的方式,解除其抑制作用。但这仅限于实验室水平的研究,因为离心换液等操作在大规模生产中难以适用,且存在较大的污染风险。综上,一般采用离心换液和转染工艺优化的方式来提高转染效率,但悬浮HEK293细胞转染技术若想大规模应用,离心换液并不现实。因此,培养基组分对转染效率影响的深入研究仍是绕不开的话题。
本文从实验室自主研发的悬浮HEK293细胞生长培养基(Celers101培养基)出发,首先对该培养基中影响悬浮HEK293细胞转染效率的组分柠檬酸铁铵进行研究,然后对其如何影响转染过程和目的基因表达的原因进行分析,并据此提出转染时培养基关键组分更可行的添加方式。本研究深入地认识悬浮HEK293细胞的转染过程,了解DNA进入细胞过程中的影响因素,为悬浮HEK293细胞转染培养基的理性设计与开发及转染工艺的优化提供参考。
1 材料与方法
1.1 材料
1.1.1 实验材料与主要试剂 HEK293贴壁细胞由浙江理工大学提供,后经本实验开发的无血清培养基驯化为HEK293悬浮细胞;绿色荧光蛋白的表达质粒由浙江理工大学提供;FAM标记的DNA购买自北京擎科生物科技有限公司;柠檬酸铁铵、柠檬酸钾、柠檬酸钠、柠檬酸、柠檬酸铁、柠檬酸铁铵、氯化铁、转铁蛋白、EDTA钠铁均购自Sigma公司;DMEM培养基(产品编号:FG0110103)、Celers101培养基(产品编号:TP0102901)购自上海倍谙基生物科技有限公司;PEIMax(产品编号:24765-100)购自美国PolyScience公司;细胞凋亡和细胞周期试剂盒(细胞周期与细胞凋亡检测试剂盒,产品编号:C1052)购自上海碧云天生物技术有限公司。
1.1.2 仪器 倒置荧光显微镜:Olympus;流式细胞仪:Beckman Coulter;Size/Zeta电位仪:AntonPaar;细胞计数仪:Counter Star;0.22 μm滤膜:Millipore。
1.2 方法
1.2.1 培养基及溶液的配制 将Celers101培养基粉末加入对应体积的超纯水中充分搅拌溶解20 min,按照配制说明依次加入其他物质,再向已充分溶解的溶液中添加实验所需的特定组分(根据不同实验添加对应组分,对照组不添加),搅拌20 min后调节pH至7.0-7.4,渗透压在300-320 mOsm/kg。通过0.22 μm滤膜过滤除菌,在4℃冰箱中避光保存。
PEI溶液(1 mg/mL):称取10 mg PEIMax试剂,加入到9 mL超纯水中待其溶解后,定容至10 mL,pH调节至6.9-7.1。通过0.22 μm滤膜过滤除菌后,用灭菌的1.5 mL离心管进行分装。在4℃冰箱中保存。
PEI-DNA复合物配制:按照20 mL细胞培养体系计算,将60 μL PEI溶液和20 μg质粒溶液分别添加至两份DMEM培养基中(控制反应总体积均为500 μL),移液器吸打混匀后静置10 min,然后用移液枪再把两溶液混匀静置10 min,即可用于后续实验。
1.2.2 质粒转染 将指数生长期的悬浮HEK293细胞离心后重悬于20 mL新鲜的Celers101培养基中(根据实验添加对应组分,对照组不添加),细胞密度控制为1×106cells/mL,然后将提前配好的PEIDNA复合物转移至细胞培养液中完成转染。转染后的细胞放入培养箱,摇床130 r/min继续培养48 h,通过荧光显微镜拍照或通过流式细胞仪检测细胞转染效率。
1.2.3 细胞凋亡及细胞周期测定 将指数生长期的悬浮HEK293细胞离心后重悬于20 mL含80 μmol/L柠檬酸铁铵(Control组不添加)的Celers101培养基,细胞密度控制为1×106cells/mL,放在摇床上培养48 h后离心收集细胞,根据试剂盒步骤进行细胞周期、细胞凋亡比例测定。
1.2.4 琼脂糖凝胶阻滞实验 配制PEI-DNA复合物时,将柠檬酸铁铵(终浓度为80 μmol/L)加入DMEM培养基中作为实验组。制作1%(m/V)琼脂糖凝胶,把配制好的PEI-DNA复合物加入点样孔中进行琼脂糖凝胶电泳,电压为120 V,30 min后用凝胶成像系统观察并拍照记录。
1.2.5 PEI-DNA复合物粒径与Zeta电位分析 将配制好的PEI-DNA复合物加入到20 mL含80 μmol/L柠檬酸铁铵(Control组不添加)的Celers101培养基中,置于摇床上130 r/min培养1 h,用Size/Zeta电位仪分别测定粒子粒径和表面电位。
1.2.6 转染后细胞中PEI-DNA复合物数量的分析 将指数生长期的悬浮HEK293细胞离心后更换为20 mL含80 μmol/L柠檬酸铁铵(Control组不添加)的Celers101培养基,用FAM标记的DNA配制PEIDNA复合物进行转染实验,转染30 min后PBS洗3遍,取样通过流式细胞仪分析荧光强度。
1.2.7 转染后目的基因表达状态的观察 将40 mL指数生长期的悬浮HEK293细胞进行转染实验。转染3 h后等分为两份,1 000 r/min离心5 min,用20 mL含80 μmol/L柠檬酸铁铵(Control组不添加)的Celers101培养基重悬,摇床130 r/min继续培养48 h,通过流式检测细胞转染效率和平均荧光强度。
2 结果
2.1 培养基中柠檬酸铁铵对转染效率的抑制作用
在Celers101培养基中添加柠檬酸铁铵对HEK293细胞转染影响的结果如图1所示,图中表达绿色荧光蛋白的细胞视为成功转染的细胞。结果(图1-A)表明,添加柠檬酸铁铵的实验组视野绿色荧光微弱,表达绿色荧光蛋白的阳性细胞数量少,可知其转染效率较低,即细胞在含柠檬酸铁铵的培养基中其转染过程受到抑制。因此,培养基中柠檬酸铁铵的添加对细胞转染具有明显抑制作用。

图1 添加柠檬酸铁铵对HEK293细胞转染的影响Fig.1 Effects of adding ferric ammonium citrate on HEK293 cell transfection
2.2 柠檬酸铁铵浓度对悬浮HEK293细胞转染效率的影响
进一步考察不同浓度柠檬酸铁铵对细胞转染效率的影响,结果(图2)表明,细胞在不同浓度柠檬酸铁铵的培养基中转染效率差异显著,当柠檬酸铁铵浓度为10 μmol/L和20 μmol/L时,细胞转染效率接近100%;随着柠檬酸铁铵浓度的提高,转染效率逐渐降低;直到柠檬酸铁铵浓度为80 μmol/L时,细胞转染效率接近0。因此,柠檬酸铁铵对悬浮HEK293细胞转染效率具有明显的抑制作用,且随浓度的升高而增强,柠檬酸铁铵浓度不高于20 μmol/L时对HEK293细胞转染不产生抑制作用。

图2 浓度柠檬酸铁铵对转染效率的影响Fig.2 Effect of ferric ammonium citrate concentration on transfection efficiency
2.3 柠檬酸铁铵影响转染过程和目的基因表达的原因分析
2.3.1 柠檬酸铁铵影响转染的原因 含柠檬酸、柠檬酸钠、柠檬酸钾、氯化铁、转铁蛋白、EDTA钠铁的实验组与含柠檬酸铁铵、柠檬酸铁的实验组转染效率存在显著差异(图3)。含柠檬酸、柠檬酸钠、柠檬酸钾、氯化铁、转铁蛋白、EDTA钠铁的实验组转染效率均大于80%,而含柠檬酸铁铵、柠檬酸铁的实验组转染效率小于20%,说明细胞在含柠檬酸铁铵、柠檬酸铁的培养基中转染受到抑制。

图3 不同柠檬酸根供体和铁供体对转染效率的影响Fig.3 Effects of different citrate donors and iron donors on transfection efficiency
柠檬酸铁铵属于一种复盐,是柠檬酸铁和柠檬酸铵的混合物,其中两个物质的占比因合成条件不同而异。实验结果表明,虽然柠檬酸、柠檬酸钠、柠檬酸钾都含有柠檬酸根,氯化铁、转铁蛋白、EDTA钠铁都含有铁离子,但以上物质添加均未对HEK293细胞转染造成明显抑制作用;只有柠檬酸铁铵、柠檬酸铁对细胞的转染过程存在显著抑制作用。这表明柠檬酸根和铁离子同时存在时才会抑制HEK293细胞转染,而柠檬酸根或者铁离子单独存在并不会抑制转染。
2.3.2 柠檬酸铁铵对转染过程中细胞状态的影响 结果(图4-A)表明,在含柠檬酸铁铵的实验组中,细胞处于G0/G1期、S期、G2/M期的比例与对照组相比,差异均不显著。因此柠檬酸铁铵对细胞状态未存在明显抑制作用。
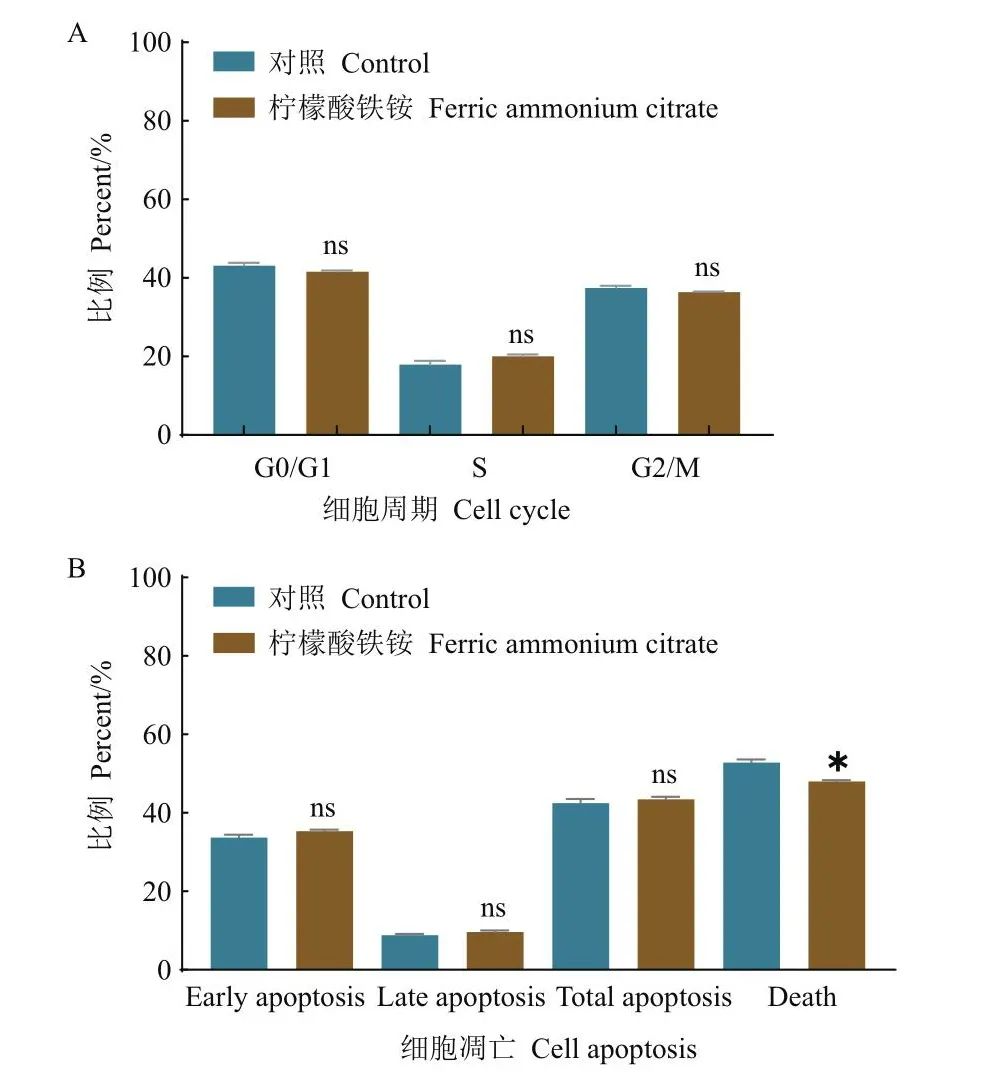
图4 柠檬酸铁铵对细胞周期(A)和细胞凋亡(B)的影响Fig.4 Effect of ferric ammonium citrate on cell cycle(A)and apoptosis(B)
柠檬酸铁铵对细胞凋亡影响的实验结果如图4-B所示。在含柠檬酸铁铵的实验组中,早期凋亡、晚期凋亡的细胞比例与对照组相比,差异均不显著。在Celers101培养基中细胞死亡比例为52.8%,而在含有柠檬酸铁铵的Celers101培养基中细胞死亡比例为47.98%。其中死亡细胞包括细胞凋亡和细胞坏死,实验组细胞死亡比例略低于对照组,可能由于坏死细胞水平略低。上述结果显示,柠檬酸铁铵对细胞周期和细胞凋亡水平均无显著影响,可能有利于降低细胞坏死水平。
2.3.3 柠檬酸铁铵对PEI-DNA复合物形成的影响 当PEI与DNA质量比为0.2时,样品的电泳结果均出现了明显的DNA条带(图5)。随着PEI添加量逐渐升高,泳道中的条带清晰度逐渐变小。当PEI为DNA质量比3倍时,实验组和对照组的泳道均没有条带。

图5 柠檬酸铁铵对PEI与DNA结合的影响Fig.5 Effects of ferric ammonium citrate on the binding of PEI to DNA
PEI对DNA的质量比越大,与DNA结合越紧密,过量地PEI将DNA包裹起来,电泳时表现为向正极迁移的DNA条带清晰度逐渐减少至消失。当PEI与DNA质量比为0.2时,PEI无法完全包裹DNA,造成电泳后条带明显。质量比为1.2时,实验组和对照组的条带有比较明显的差别。当质量比为3时(即细胞转染实验的用量),实验组和对照组对应的泳道中均没有条带。因此,柠檬酸铁铵对PEI和DNA结合程度的影响与PEI和DNA的比例有关,且当PEI的添加量提高到DNA的3倍(细胞转染实验的用量)时,实验组和对照组的DNA与PEI均充分结合,柠檬酸铁铵未影响此时PEI和DNA的结合。
加入柠檬酸铁铵的实验组PEI-DNA复合物的粒径(图6-A)与对照组存在显著差异。对照组有一部分复合物粒径在100-500 nm范围内,而含有柠檬酸铁铵的实验组复合物粒径均大于500 nm;根据图6-C可知,含有柠檬酸铁铵的实验组复合物平均粒径是对照组的2倍左右。

图6 柠檬酸铁铵对复合物的粒径分布(A)、表面电位分布(B)、平均粒径(C)变化和平均电势(D)变化的影响Fig.6 Changes of particle size distribution(A), zeta potential distribution(B), average particle size(C)and average potential(D)after ferric ammonium citrate(FAC)added
图6-B的实验结果表明,含有柠檬酸铁铵的实验组复合物电势峰值略低于对照组,其复合物电势分布曲线峰形更“细长”,这说明添加柠檬酸铁铵后使复合物粒子电势分布更加集中。根据图6-D可知,实验组和对照组的复合物平均电势均为正值,两组实验数值差异不显著。
实验组转染后细胞中复合物的数量与对照组差异显著(图7)。含柠檬酸铁铵的实验组细胞平均荧光强度仅为对照的14.07%,说明柠檬酸铁铵使细胞内复合物数量明显减少。

图7 柠檬酸铁铵对转染后细胞中复合物数量的影响Fig.7 Effects of FAC on the number of complexes in transfected cells
2.3.4 柠檬酸铁铵对转染后目的基因表达的影响 结果表明,在转染3 h后加入柠檬酸铁铵,细胞转染效率(图8-A)和细胞平均荧光强度(图8-B)同对照组相比均无显著差异。因此,柠檬酸铁铵的添加未影响复合物在进入细胞后的蛋白表达相关过程。

图8 柠檬酸铁铵在转染后对细胞的转染效率(A)和平均荧光强度(B)的影响Fig.8 Effects of FAC on the cell transfection efficiency(A)and mean fluorescence intensity(B)after transfection
3 讨论
3.1 柠檬酸铁铵对悬浮HEK293细胞转染的抑制作用及解决方案
截至目前,培养基组分对悬浮HEK293细胞转染效率影响的文献报道较少。在对CHO细胞的研究中,Eberhardy等[19]发现了柠檬酸铁铵的抑制作用,与本研究结论一致。这表明柠檬酸铁铵对不同细胞转染过程的抑制作用可能具有普适性。但本文结果表明,抑制浓度探究结果与Eberhardy等[19]在CHO细胞中的结论有显著差异,柠檬酸铁铵对贴壁CHO细胞的转染效率的影响十分显著,仅1 μmol/L的柠檬酸铁铵就会显著抑制细胞转染效率,但根据本文实验发现,HEK293细胞的转染过程对其浓度的敏感性较低。这种差异一方面可能是贴壁细胞与悬浮细胞的差异造成的,另一方面可能与细胞膜控制不同粒径的物质进出差异有关[23]。
由于柠檬酸铁铵对CHO细胞转染效率的显著抑制作用,Eberhardy等[19]在文中找到两种策略,第一种策略为转染前通过离心换液的方式去除环境中多余的柠檬酸铁铵,转染后再补加以维持细胞的产物表达过程;第二种策略则是换用其他铁添加剂。但这两种方式在实际执行中均有不足之处,离心和补加不适合大规模转染过程,在实际执行中有耗时、耗能、需专业设备、影响细胞状态、增加污染风险等缺点;根据Bai等[21]研究发现,细胞对铁元素利用分为转铁蛋白结合形式和非转铁蛋白结合形式。细胞首先利用转铁蛋白形式的铁元素,当此形式不存在时利用后者。在非转铁蛋白结合形式中,铁元素需与柠檬酸盐螯合,否则无法被细胞有效吸收,使细胞正常生长。本文研究结果表明,氯化铁、EDTA钠铁、转铁蛋白均未影响细胞转染。但氯化铁、EDTA钠铁中的铁元素不易被细胞利用。因此若换用其他铁添加剂,以转铁蛋白效果最佳。但转铁蛋白为动物源性成分,需考虑批次间稳定性和长时间存放不稳定易失活等问题。因此如何在实际问题中找到铁添加剂对CHO细胞转染过程的最优解仍是难题,而悬浮HEK293细胞不存在此类困扰。通过本文研究,将培养基中柠檬酸铁铵浓度控制在20 μmol/L内可解决该问题。
3.2 柠檬酸铁铵影响转染过程和目的基因表达的原因分析
本文分别从柠檬酸铁铵对细胞状态、PEI-DNA复合物形成、转染后目的基因表达几方面进行探究。结果表明柠檬酸铁铵对细胞周期和细胞凋亡水平均无显著影响,可能有利于降低细胞坏死水平,这说明柠檬酸铁铵不会使细胞状态变差,和Eberhardy等[19]在CHO细胞中的结论一致。在转染一段时间后补充柠檬酸铁铵, 不仅不会抑制细胞转染效率, 还可以为细胞提供铁元素, 反而有利于产物的表达过程。柠檬酸铁铵作为哺乳动物细胞培养中常见的铁添加剂,铁离子与DNA复制和一些酶的活性有关,对细胞的生长起促进作用[24]。这为转染工艺优化提供了新思路,在转染后适当补充柠檬酸铁铵可成为提高产物表达的方法之一。
Size/Zeta电位仪测量实验结果表明柠檬酸铁铵改变了PEI-DNA复合物的粒径和电势,大量研究表明转染试剂PEI与DNA结合时,复合物的粒径在100-500 nm范围内且携带正电荷是其进入细胞的必要条件[25]。粒径过大会导致其进入细胞难度变大,粒径过小不利于DNA在细胞内释放,而复合物电势较低或变为负值均会影响其与细胞膜的结合作用[26]。因此,柠檬酸铁铵抑制HEK293细胞转染主要是由于其影响PEI-DNA复合物的形成过程,使复合物进入细胞的难度增加。
综上所述,本文将柠檬酸铁铵对悬浮HEK293细胞的抑制浓度和抑制作用进行了系统的探究,消除了HEK293细胞转染工艺优化过程中添加铁化合物的诸多顾虑,也为后续PEI介导的转染过程分析以及目标产物产量提高的工艺优化提供了新路径。
4 结论
本研究表明柠檬酸铁铵对悬浮HEK293细胞转染过程的抑制作用明显,其抑制作用随浓度的升高而增强,抑制作用是由于柠檬酸铁铵使PEIDNA复合物的粒径变大,复合物进入细胞的难度增加,从而使进入细胞的复合物数量减少造成的。对于HEK293细胞,柠檬酸铁铵仍是最优的铁添加剂,控制转染时柠檬酸铁铵浓度在20 μmol/L内即可解决其对转染过程的抑制作用。且在转染后3 h,补加柠檬酸铁铵不影响转染后目的基因表达。
