RuO2/BiOCl复合光催化剂的制备及其固氮性能研究
2023-10-25刘建新樊彩梅
田 野,闫 哲,刘建新,樊彩梅
(太原理工大学化学工程与技术学院,太原 030024)
0 引 言
与传统工业化Haber-Bosch法(15~25 MPa,300~550 ℃)[1]相比,太阳能固氮的反应条件温和且节能环保,是一种有前景且可持续发展的绿色能源技术之一[2-4]。近年来,缺陷设计,特别是氧空位(oxygen vacancies, OVs)缺陷设计,已经广泛应用于光催化固氮领域[5-7]。OVs具有丰富的局域电子,因此可以作为电子捕集中心来有效捕获和激活N2[8]。如Zhang等[9]制备了含有丰富氧空位且暴露(001)面的BiOBr,表现出优异的固氮性能。Ye等[10]合成了直径为5 nm的Bi5O7Br纳米管,发现其表面暴露的位点有利于在可见光诱导下产生OVs,促使更多的N2转化为NH3。
通常情况下,构建OVs需要特殊的加工条件,如光还原、特殊溶剂、超薄层化等[11-13]。此外,由于晶体结构在制备过程中遭到破坏,缺陷也就会自然存在于纳米颗粒的表面和接触界面上[14],特别是对于复合光催化剂来说,组分间的接触会造成晶体结构破坏且可产生丰富的缺陷[15]。然而,这种类型的缺陷往往会被忽视,并且是否能像经过特殊加工构建的缺陷一样充当N2的活化中心也还未知。目前,相关研究中,由组分间接触产生的缺陷并未广泛应用于光催化固氮领域。
BiOCl具有特殊的片层结构,层间存在的静电场使其可以快速分离光生电子-空穴对,同时兼具良好的可见光响应能力和优异的光催化性能[16-17]。与其他无机半导体材料相比,BiOCl的比表面积较大且价格低廉,因此常被用作催化剂的载体及复合材料。Yang等[18]采用水热法原位构建了Bi2S3/BiOCl纳米颗粒并诱导BiOCl组分形成薄片,促进了光生载流子的分离,从而增强了复合催化剂对罗丹明B的降解率。Wang等[19]采用溶剂热法制备了S-BiOCl用于降解罗丹明B,经过12 min的光照后,其降解率可达到99%。RuO2具有较好的化学稳定性和导电性,是一种典型的氧化半反应助催化剂。Ma等[20]采用水热法制备了Pt-RuO2/Zn2GeO4并对其进行光催化分解水反应评估和机理研究,结果表明RuO2促进了O2的生成。
本文通过简单的水解法制备了具有丰富OVs的RuO2/BiOCl复合催化剂,且没有经过特殊处理。在模拟太阳光的条件下,以甲醇作为牺牲剂,对合成的RuO2/BiOCl进行光催化测试,研究其光催化固氮性能并探讨机理。
1 实 验
1.1 试 剂
钌(Ⅳ)氧化物(RuO2,分析纯,纯度≥99.9%,上海阿拉丁生化科技股份试剂有限公司);氯化铋(BiCl3,分析纯,纯度≥99.9%,国药集团);氯化铵(NH4Cl,分析纯,纯度≥99.5%,天津市光复科技发展有限公司);酒石酸钾钠(C4O6H4KNa,分析纯,纯度≥99.0%,天津市科密欧化学试剂有限公司);无水乙醇(C2H5OH,分析纯,纯度≥99.7%,天津市光复科技发展有限公司);无水甲醇(CH3OH,分析纯,纯度≥99.5%,天津市光复科技发展有限公司);Nessler试剂(化学纯,纯度≥98.0%,天津福晨化学试剂有限公司);氮气(N2,纯度为99.9%,山西泰安荣盛燃气有限公司),实验用水为蒸馏水。
1.2 催化剂的制备
首先将一定量的RuO2和2 g BiCl3缓慢加入到30 mL去离子水中,并在室温下搅拌2.5 h,所用RuO2的比例分别为0.1%、0.2%、0.3%、0.4%和0.5%(质量分数)。静置1 h后,用乙醇和蒸馏水多次离心洗涤。最后将样品放置在60 ℃干燥箱中干燥12 h,得到负载不同质量分数RuO2的RuO2/BiOCl催化剂,记为x%RuO2/BiOCl(x=0.1,0.2,0.3,0.4,0.5)。不含RuO2的BiOCl催化剂在相同条件下制备。
1.3 催化剂的表征
采用Rigaku D/max-2500型X射线衍射仪(Rigaku D/max-2500 Series of X-ray Diffraction)分析样品的结构和组成,Cu Kα辐射,λ=1.54 Å,扫描范围为10°~80°,扫描速率为8 (°)/min,电压为40 kV,电流为30 mA;采用Perkin-Elmer Optima 3300DV型电感耦合等离子体原子发射光谱(ICP-AES, Perkin-Elmer Optima 3300DV Series of Inductively Coupled Plasma Atomic Emission Spectra)测试样品中RuO2的负载量;采用JEOL-2011型透射电子显微镜(TEM, JEOL-2011 Series of Transmission Electron Microscopy)表征样品形貌和晶格结构;采用Cary-300型光致发光光谱仪(Cary-300 Series of Photoluminescence Spectroscopy)测试样品的光学性能,室温下氙灯作为激发源;采用ESCALAB-250型X射线光电子能谱(XPS, ESCALAB-250 Series of X-ray Photoelectron Spectroscopy)分析样品的元素组成,激发源Al靶Kα射线(hν=1 486.6 eV),由相对表面电荷引起的结合能偏移是以表面不定碳的C 1s峰为参照;采用Nanosem 430型场发射扫描电子显微镜(SEM, Nanosem 430 Series of Scanning Electron Microscopy)观察样品的表面形貌;采用UV-3600型紫外-可见分光光度计(UV-Vis DPS, UV-3600 Series of UV-Vis Diffuse Reflectometry Spectroscopy)分析样品的光学性质;采用ADANI型电子顺磁共振谱(EPR, ADANI Series of Electron Paramagnetic Resonance)监测样品氧空位的变化,所有测量都是在室温(298 K)下进行。
1.4 固氮性能测试

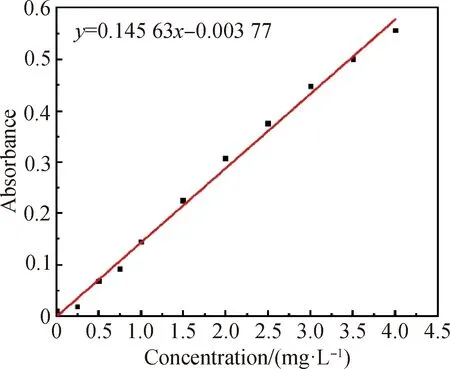
图1 纳氏法氨氮标准曲线Fig.1 Standard curve of ammonia nitrogen by Nessler’s reagent method
基于上述分析,催化剂的固氮性能通过在300 W氙灯照射下的产氨量来评估。具体操作步骤为:首先,称取50 mg催化剂置于双壁石英反应器中,再加入100 mL体积分数2%的甲醇水溶液,超声分散10 min;黑暗条件下将N2(80 mL/min)通入上述溶液中并持续搅拌30 min后,用300 W的氙灯照射。在光照1 h后,取10 mL上述溶液并离心得到液体样品,使用纳氏试剂分光光度法测定氨的浓度。
2 结果与讨论
2.1 光催化剂的表征
图2为纯BiOCl和x%RuO2/BiOCl(x=0.1,0.2,0.3,0.4,0.5)的XRD图谱,测试的结果与BiOCl标准卡(PDF#3-1126)一致,表明成功制备了四方晶相的BiOCl。此外,x%RuO2/BiOCl(x=0.1,0.2,0.3,0.4,0.5)和BiOCl相比并没有明显的差别,表明RuO2的引入不会改变载体BiOCl的结构。同时,在0.2%RuO2/BiOCl的XRD图谱中没有观察到RuO2的衍射峰,这可能是复合催化剂中RuO2负载量过低的缘故。
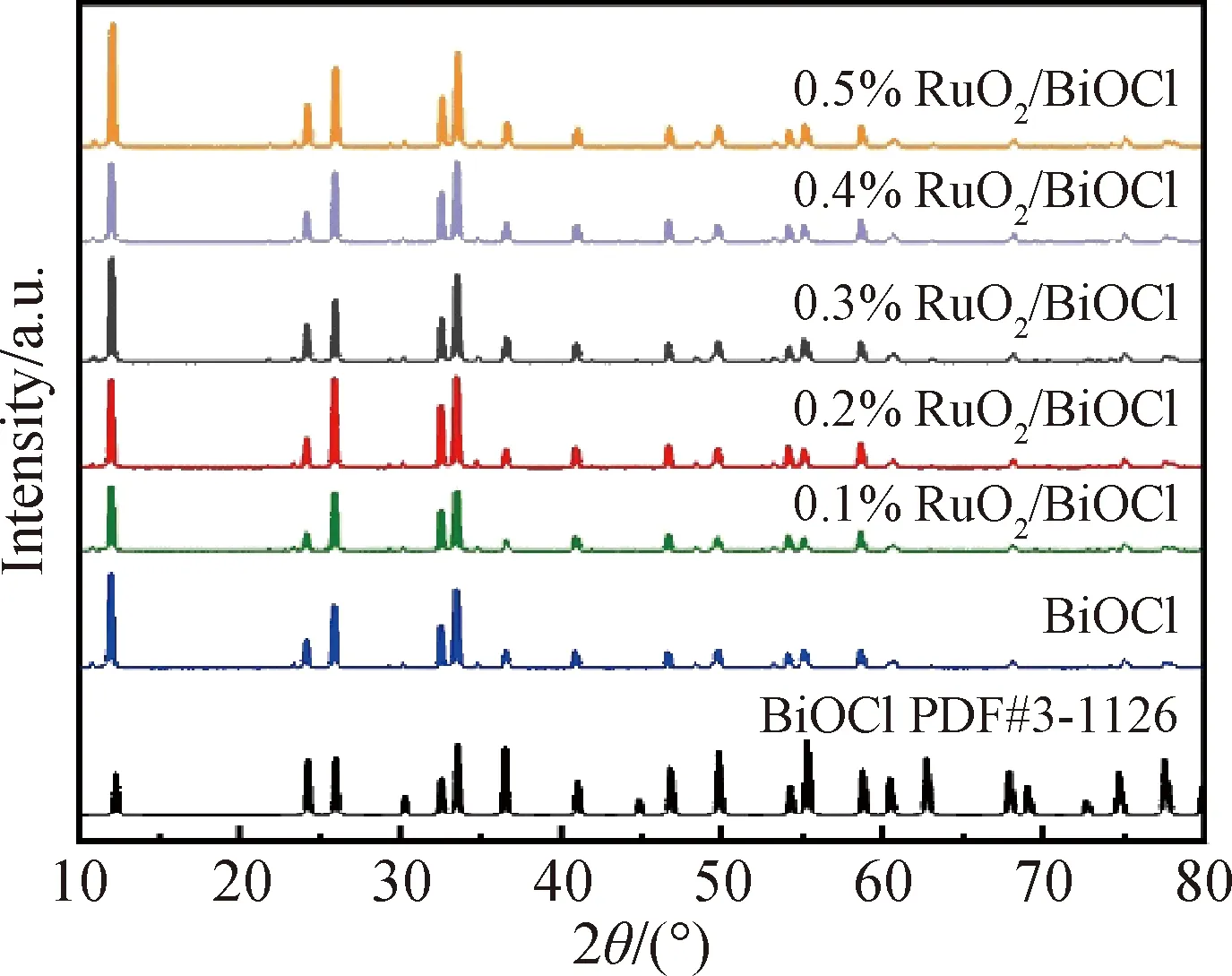
图2 x%RuO2/BiOCl(x=0.1,0.2,0.3,0.4,0.5)和BiOCl的XRD图谱Fig.2 XRD patterns of the prepared samples of x%RuO2/BiOCl (x=0.1, 0.2, 0.3, 0.4, 0.5) and BiOCl
图3(a)、(b)分别为BiOCl和0.2%RuO2/BiOCl催化剂的SEM照片。如图3(a)所示,合成的BiOCl为明显的片层结构且边缘较为清晰,其直径为3~7 μm,厚度约为0.2 μm。从图3(b)中可以看到,负载的RuO2对BiOCl的形态没有很大影响,与图3(a)的结果相似。图3(c)为0.2%RuO2/BiOCl的EDS图,复合催化剂中O、Cl、Ru和Bi元素分布均匀,证实了0.2%RuO2/BiOCl复合催化剂的成功合成及RuO2成功负载到BiOCl表面。图4所示为0.2%RuO2/BiOCl的TEM和HRTEM照片。图中可观察到RuO2纳米粒子负载于BiOCl纳米片的表面。通过测量可得,黑色纳米颗粒的晶格间距为0.313 nm,对应于四方RuO2的(110)晶面(d=0.313 nm,JCPDS 43-1027)[21]。此外,图4中连续的晶格条纹间距为0.257 nm,这对应于四方BiOCl的(110)面。因此,TEM照片进一步证实了RuO2被负载在BiOCl的表面。

图3 所制备样品的SEM照片及EDS图Fig.3 SEM images and EDS of the prepared samples
XRD、SEM和TEM表征结果说明了复合催化剂中RuO2均匀分布在BiOCl上,但各元素具体的价态并不明确。为了进一步确定样品表面各原子的化学状态,对0.2%RuO2/BiOCl进行了XPS分析。图5(a)为0.2%RuO2/BiOCl的全谱图,可以看出所制样品由Bi、Cl、Ru和O元素组成;图5(b)为0.2%RuO2/BiOCl的Bi 4f高分辨图谱,从中可以看出样品在159.4和164.8 eV处出现两个峰,这分别对应于Bi 4f7/2和Bi 4f5/2[22],结果与Bi3+特征峰的位置一致;在图5(c)中,位于198.2和199.7 eV的特征峰分别为Cl 2p3/2和Cl 2p1/2;图5(d)是O 1s的XPS图,其峰值位于530.1 eV;此外,样品中Ru 3d7/2在281.1 eV和Ru 3d5/2在284.6 eV处有两个特征峰[23],如图5(e)所示,可归于Ru4+。结合上述TEM和XPS表征分析结果可以得出:在0.2%RuO2/BiOCl催化剂中,Ru元素以RuO2的形式存在于载体BiOCl的表面。为了进一步确定复合催化剂中RuO2的实际含量,对其进行了电感耦合等离子体原子发射光谱法分析,如表1所示,发现催化剂中RuO2的实际负载量为0.15%,与理论值相差0.05%,这可能是因为在催化剂制备过程中,RuO2没有完全负载到BiOCl表面。

表1 0.2%RuO2/BiOCl的ICP-AES分析Table 1 ICP-AES analysis of 0.2%RuO2/BiOCl
图6(a)为BiOCl和x%RuO2/BiOCl(x=0.1,0.2,0.3,0.4,0.5)的UV-Vis DRS光谱。从图中可以看出所制催化剂均在400 nm处出现了一条吸收边。根据公式αhν=A(hν-Eg)n/2,其中α、h、ν、Eg与A分别为吸附系数、普朗克常数、光频率、带隙能与常数(BiOCl为间接带隙半导体,所以n为4),可以得到催化剂(αhν)1/2与hν之间的关系,如图6(b)所示,通过计算可得催化剂的带隙能均在3.1 eV左右,这是载体BiOCl的吸收带隙[24]。由于OVs的存在,负载不同质量分数RuO2的BiOCl在400~600 nm的可见光区域均有明显的吸收[25],这是一个反常的现象,因为RuO2/BiOCl的合成并不涉及任何特殊处理OVs的过程。因此,为了进一步查找原因,本文采用EPR表征来监测BiOCl和0.2%RuO2/BiOCl的制备过程。如图7(a)所示,在314.1 mT处有一个明显的氧空位特征信号,这表明催化剂中存在氧空位。其中,在BiOCl的合成过程中存在微弱的氧空位,且峰值强度并没有发生明显的变化,而从图7(b)中观察到0.2%RuO2/BiOCl的OVs信号强度明显高于BiOCl,且随着催化剂合成时间的增加而逐渐增强。由于0.2%RuO2/BiOCl的制备过程中没有特殊加工处理OVs,所以推测在催化剂合成中RuO2和BiOCl之间的相互作用产生了一定量的氧缺陷。随着RuO2晶体的生长和重新排列,氧缺陷的数量持续增加,直到合成反应结束。
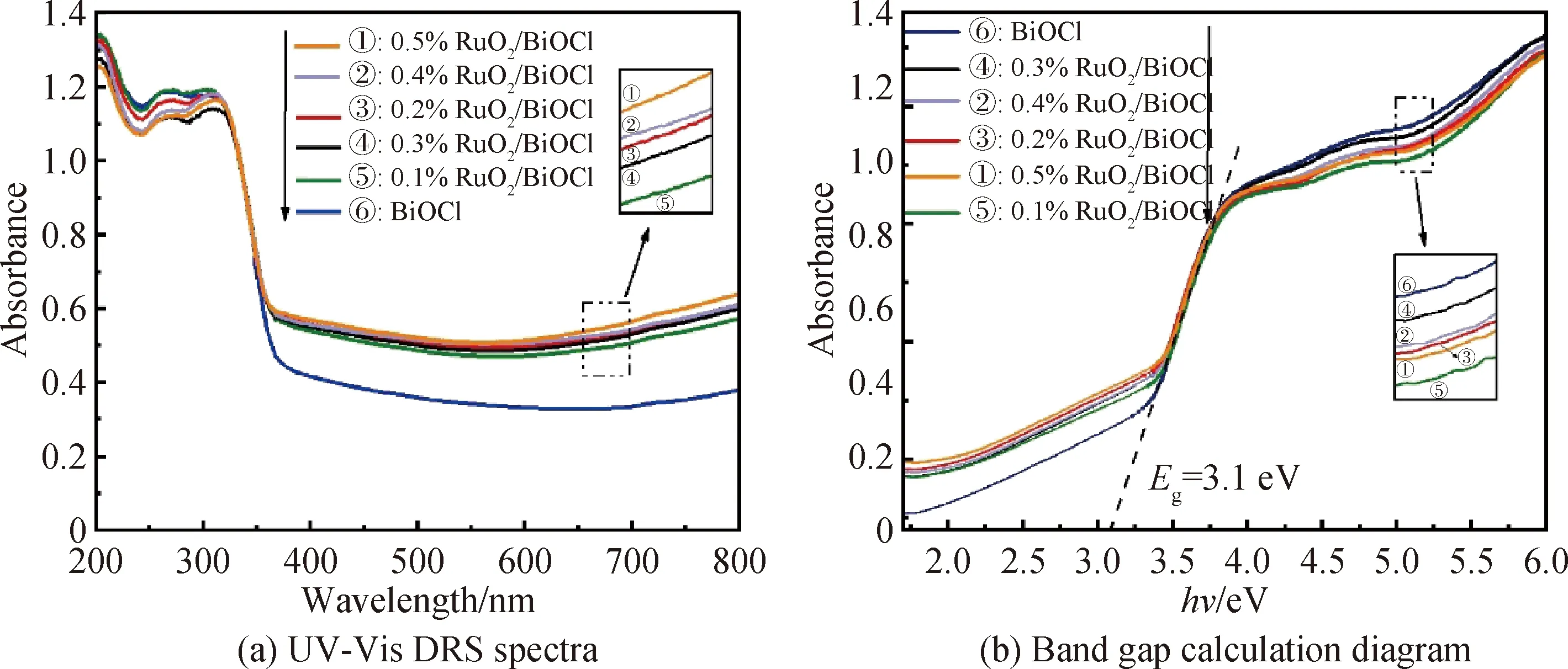
图6 BiOCl和x%RuO2/BiOCl(x=0.1,0.2,0.3,0.4,0.5)的UV-Vis DRS光谱和带隙计算图Fig.6 UV-Vis DRS spectra and band gap calculation diagram of BiOCl and x%RuO2/BiOCl (x=0.1, 0.2, 0.3, 0.4, 0.5)
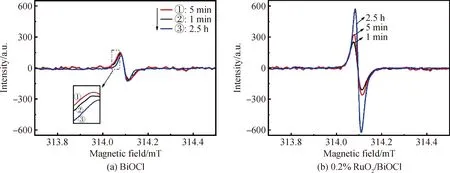
图7 BiOCl和0.2%RuO2/BiOCl的EPR图谱Fig.7 EPR spectra of BiOCl and 0.2%RuO2/BiOCl
通过光致发光(photoluminescence, PL)光谱对所制催化剂的电子-空穴分离效率进行分析[26],如图8所示。从图中对比可得x%RuO2/BiOCl(x=0.1,0.2,0.3,0.4,0.5)在400 nm处的峰强度均低于纯BiOCl,表明复合催化剂中光生载流子的分离效率较高,其中0.2%RuO2/BiOCl最佳。这进一步证实了RuO2的存在可以加速空穴的传输和消耗,抑制光生电荷的复合。
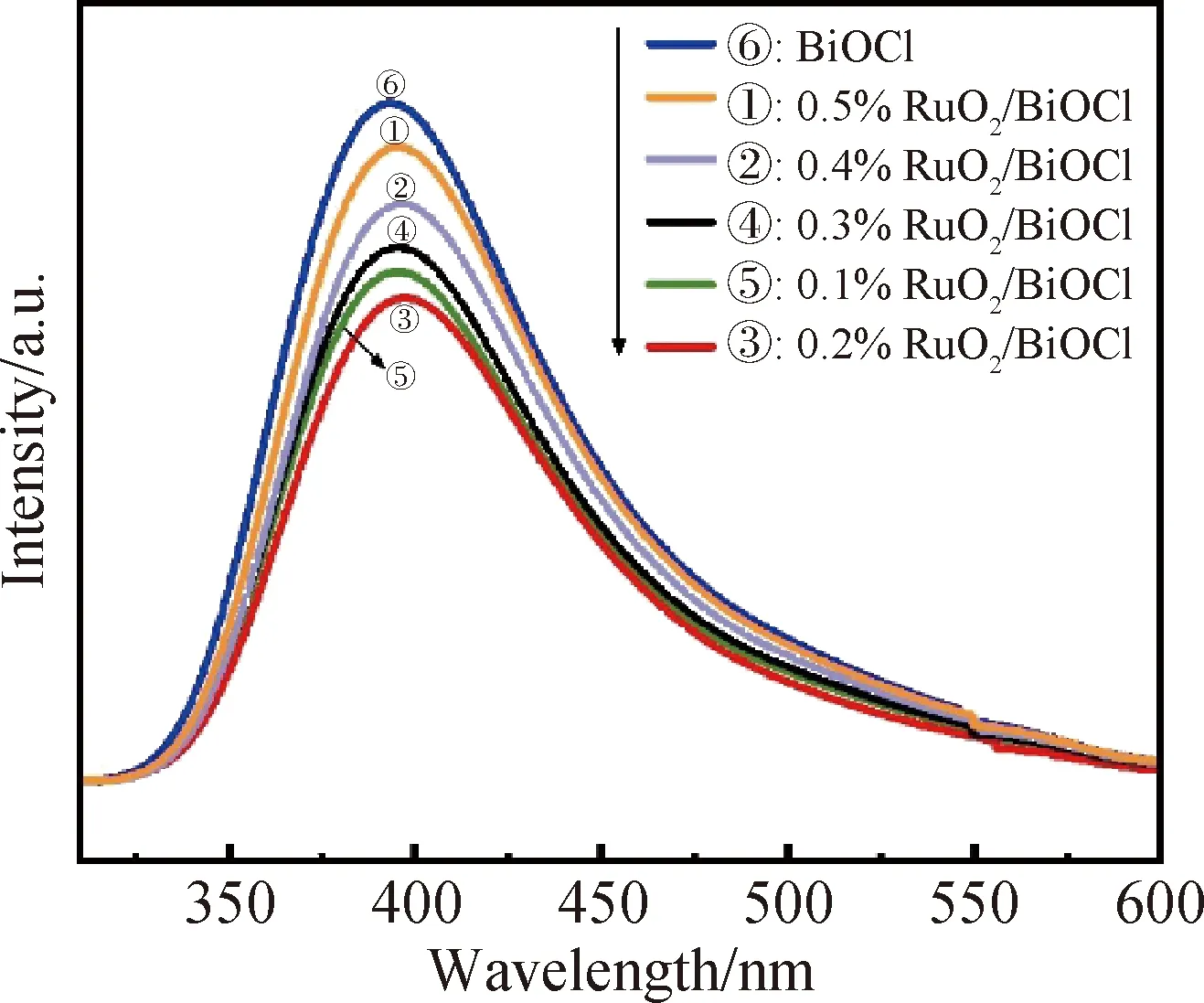
图8 BiOCl和x%RuO2/BiOCl(x=0.1,0.2,0.3,0.4,0.5)的PL光谱Fig.8 PL spectra of BiOCl and x%RuO2/BiOCl (x=0.1, 0.2, 0.3, 0.4, 0.5)
2.2 光催化活性测试

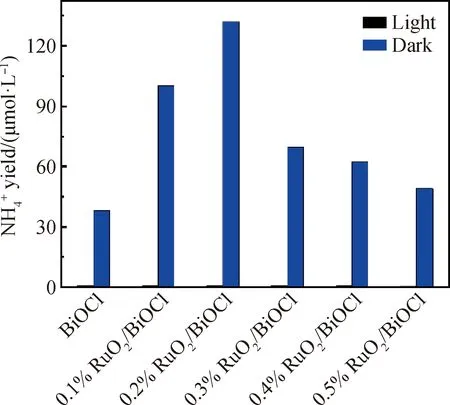
图9 催化剂在黑暗和模拟阳光下的固氮性能Fig.9 Nitrogen photofixation performance of catalysts under dark and simulated sunlight
基于以上分析结果,可以合理推测出0.2%RuO2/BiOCl的光催化固氮机理图,如图10所示。图10(a)为0.2%RuO2/BiOCl的分子模型示意图,图10(b)为0.2%RuO2/BiOCl的光催化固氮机理图,其机理如下:在模拟太阳光照射下,自由电子会从能级高的地方自发向能级低的地方迁移,使得BiOCl价带上的电子受到激发,自发从价带跃迁至导带上并在价带上留下空穴;RuO2NCs在反应过程中可迅速转移产生的空穴,促进电子空穴对的有效分离[27],空穴可以被甲醇进一步消耗。另外,随着RuO2晶体的持续生长和重新排列,复合催化剂的氧缺陷逐渐增多,有利于加快N2的吸附和活化[28],从而提高催化效率。
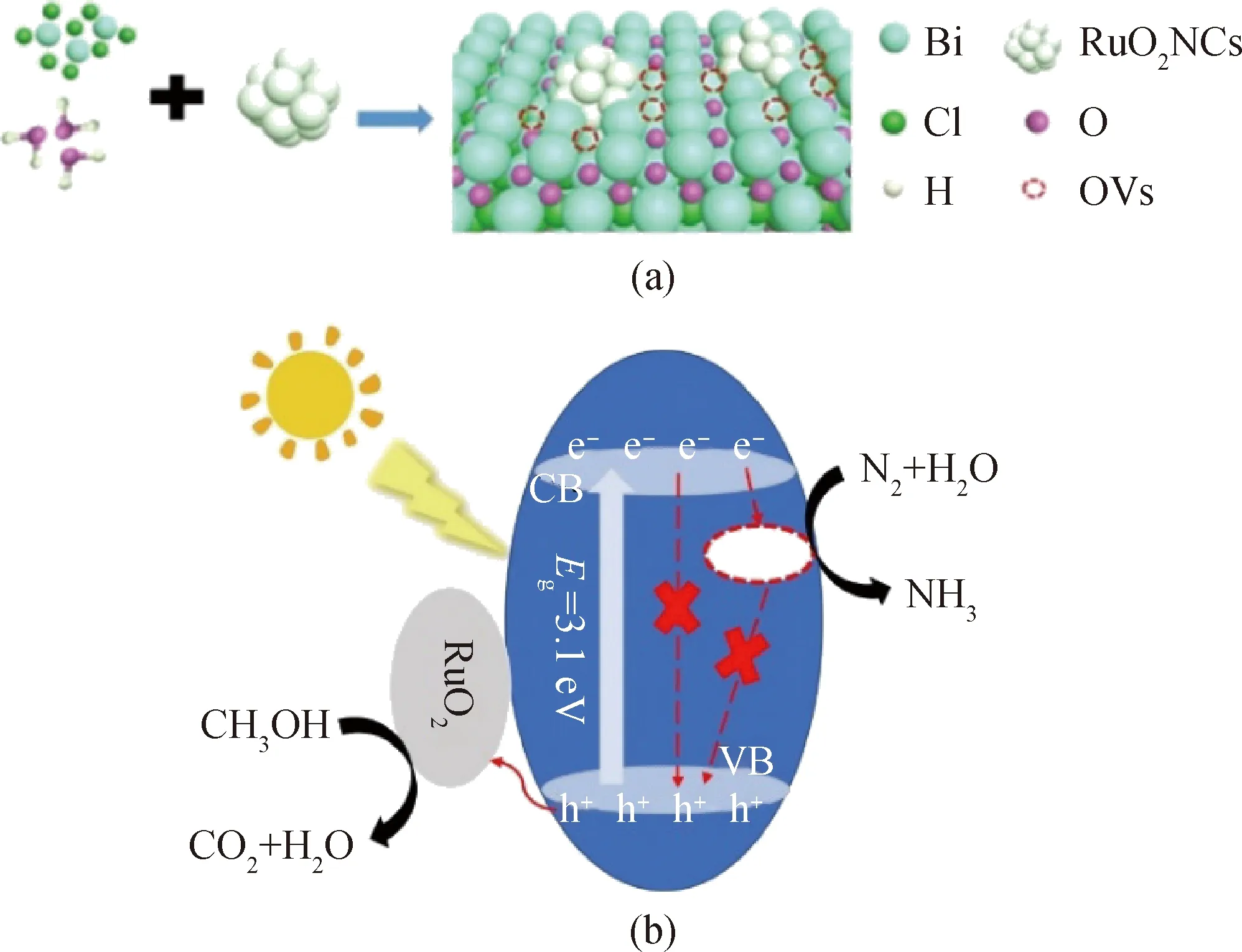
图10 0.2%RuO2/BiOCl的分子模型示意图(a)和光催化固氮机理示意图(b)Fig.10 Schematic diagram of molecular model (a) and photocatalytic nitrogen fixation mechanism (b) of 0.2%RuO2/BiOCl
3 结 论
本文通过简单水解法成功制备了具有丰富氧缺陷的RuO2/BiOCl复合催化剂,利用XRD、SEM、TEM、XPS、ICP-AES、UV-Vis DRS、EPR、PL等测试表征手段对光催化剂的组分、形貌、结构及光催化性能进行分析,得出以下结论:
1)通过水解法制备了不同配比的RuO2/BiOCl复合催化剂。所制备的催化剂分布均匀,结构良好,直径大小在3~7 μm,并且复合所得催化剂的结构没有发生明显变化。
2)RuO2/BiOCl复合催化剂表现出优异的光催化活性。其中,0.2%RuO2/BiOCl的光催化固氮活性为131.9 μmol/L,是纯BiOCl的3.5倍。
3)结合以上表征和固氮机理分析表明,0.2%RuO2/BiOCl良好的光催化性能主要归因于:RuO2和BiOCl组分间接触产生的氧空位有效促进了固氮反应中的控速步骤,即N2的活化;RuO2纳米粒子能够提高光生载流子的分离效率。两者之间的协同作用促使固氮活性显著提升。
