基于化学计量学的三七伤药片质量控制方法研究
2023-10-25赵振霞刘永利
赵振霞 雷 蓉 耿 莲 朱 靖,2 刘永利*
1.河北省药品医疗器械检验研究院,河北省中药质量评价与标准研究重点实验室,河北 石家庄 050227;2.河北医科大学,河北 石家庄 050017
三七伤药片由三七、制草乌、雪上一枝蒿、冰片、骨碎补、红花、接骨木、赤芍等组成,具有舒筋活血,散瘀止痛功效,是临床骨伤科疾病中一种常用的中成药,用于治疗跌打损伤、风湿瘀阻、关节痹痛,急慢性扭伤损伤等[1]。现代药理学研究[2-3]表明三七伤药片还具有镇痛、抗炎,改善血液流变性的作用,因此在临床上更是得到了广泛应用。为控制药品质量及提高临床用药的安全性,本文对三七伤药片中主要药味的质量控制方法进行研究。该品种收载于《中国药典》2020年版一部,鉴别项仅收载了三七中三七皂苷R1、人参皂苷Rg1和赤芍中芍药苷的薄层色谱鉴别,对方中药味控制较少,且未有对处方中君药三七进行含量测定,难以全面控制其内在质量[4],因此,研究参照相关文献[5-8]建立了三七伤药片中3种药味的薄层色谱鉴别方法,并建立了三七中五种皂苷类成分的含量测定方法,再结合化学计量学分析影响三七伤药片质量的主要因素,为后续三七伤药片质量标准的建立提供可靠的技术保障。
1 仪器与材料
1.1 仪器 Ultimate 3000高效液相色谱仪(包括四元泵和紫外检测器,美国赛默飞公司);KQ-800KDE型超声波清洗器(昆山市超声仪器有限公司);SYG-1-6数显恒温水浴锅(天津市泰斯特仪器有限公司);FED56电热恒温干燥箱(德国宾德公司);Mettler XPE26电子天平(瑞士梅特勒公司,0.001 mg)、Mettler XS105电子天平(瑞士梅特勒公司,0.01 mg);Milli-Q 型超纯水净化系统(美国 Millipore 公司)。
1.2 材料 冰片(批号:110713-201706)、骨碎补(批号:121169-202105)、柚皮苷(批号:110722-201714)、赤芍(批号:121093-201804)、芍药苷(批号:110736-202145)、三七皂苷R1(批号:110745-201921)、人参皂苷Rg1(批号:110703-20235)、人参皂苷Re(批号:110754-202104)、人参皂苷Rb1(批号:110704-202230)、人参皂苷Rd(批号:111818-201302),上述对照品及对照药材均购买于中国食品药品检定研究院;17批次三七伤药片样品购自药店,详细信息见表1;乙腈(色谱纯,德国Merck公司),水为超纯水;其余试剂均为分析纯。

表1 17批次三七伤药片样品信息表
2 方法与结果
2.1 鉴别研究
2.1.1 冰片的TLC鉴别 取不同生产企业的三七伤药片样品三批(批号:20190813、191003、20191224)各40片,采用刮片法除去外层糖衣,置研钵内研细后转移至150 mL锥形瓶中,加入试剂乙醚20 mL,盖紧瓶塞,室温放置20 min后,超声处理(功率为250 W,频率为40 kHz)10 min,过滤,滤液低温挥干,残渣加三氯甲烷1 mL使其溶解,作为样品溶液。按《中国药典》2020年版一部三七伤药片标准中【处方】比例与【制法】项下制备工艺,制备缺冰片药味的阴性样品,按“样品溶液”项下方法制备阴性样品溶液。取冰片对照品 1.052 mg,加三氯甲烷1 mL使其溶解,作为对照品溶液。吸取上述制得的三批样品溶液、阴性样品溶液及对照品溶液各5 μL,分别点于同一块硅胶G薄层板上,以甲苯-乙酸乙酯(19∶1)为展开剂,展开,取出,晾干,喷以显色剂1%香草醛硫酸溶液,在105 ℃加热至斑点显色清晰。结果:样品色谱中,在与冰片对照品色谱相应的位置上,显相同颜色的斑点,且斑点清晰、分离度好,阴性样品无干扰(如图1所示),说明方法可行、专属性良好。
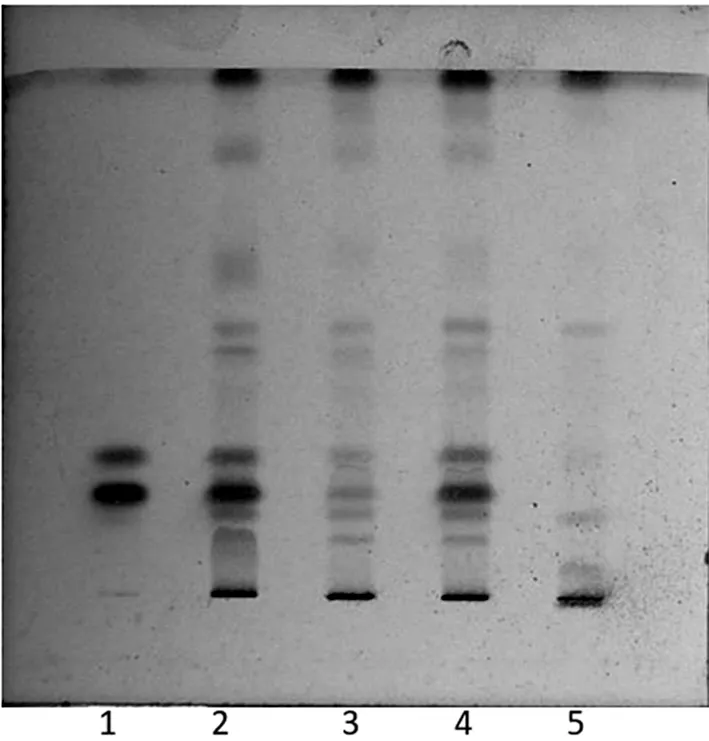
1.冰片;2~4.样品;5.阴性样品
2.1.2 骨碎补的TLC鉴别 取不同生产企业的三七伤药片样品三批(批号:20190813、191003、20191224)各15片,采用刮片法除去外层糖衣,置研钵内研细后转移至150 mL锥形瓶中,加入试剂甲醇50 mL,82 ℃水浴条件下加热回流提取1 h,过滤,将滤液蒸干后,残渣加入水溶液20 mL使其溶解,然后用水饱和的正丁醇溶液振摇提取3次,每次用量均为25 mL,合并正丁醇提取液,再用正丁醇饱和的水洗涤2次,每次用量均为 25 mL,正丁醇液置100 ℃水浴锅上,蒸干,残渣加入甲醇 1 mL 使其溶解,作为样品溶液。按《中国药典》2020年版一部三七伤药片标准中【处方】比例与【制法】项下制备工艺,制备缺骨碎补药味的阴性样品,按照“样品溶液”项下方法制备阴性样品溶液。取骨碎补对照药材2.0235 g,置150 mL锥形瓶中,加入乙醇15 mL,超声处理(功率为 250 W,频率为40 kHz)20 min,过滤,滤液置100 ℃水浴锅上,蒸干,残渣加入甲醇1 mL使其溶解,作为对照药材溶液。另取柚皮苷对照品1.357 mg,加甲醇1 mL使其溶解,作为对照品溶液。照薄层色谱法试验,吸取上述制得的三批样品溶液和阴性样品溶液各10 μL、骨碎补对照药材和柚皮苷对照品溶液各5 μL,分别点于同一块硅胶G薄层板上,以甲苯-乙酸乙酯-甲酸-水(1∶12∶2.5∶3)的上层溶液为展开剂,展开,取出,晾干,喷以显色剂三氯化铝试液,热风吹干后,置紫外光灯(365 nm)下检视。结果:样品色谱中,在与骨碎补对照药材和柚皮苷对照品色谱相应的位置上,显相同颜色的斑点,且斑点清晰、分离度好,阴性样品无干扰(如图2所示),说明方法可行、专属性良好。
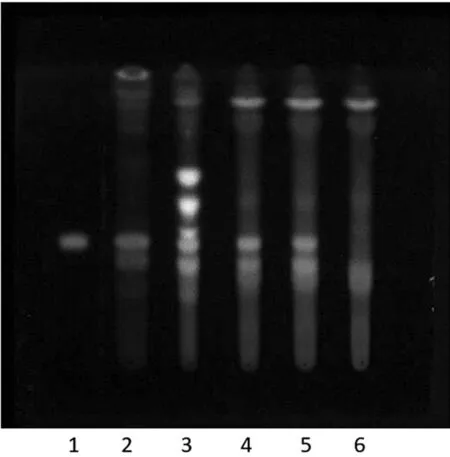
1.柚皮苷;2.骨碎补;3~5.样品;6.阴性样品
2.1.3 赤芍的TLC鉴别 同骨碎补的TLC鉴别制备样品溶液。按《中国药典》2020年版一部三七伤药片标准中【处方】比例与【制法】项下制备工艺,制备缺赤芍药味的阴性样品,按“样品溶液”项下方法制备阴性样品溶液。取赤芍对照药材1.0827 g,置150 mL锥形瓶中,加入试剂乙醇15 mL,超声处理(功率为250 W,频率为40 kHz)20 min,过滤,滤液蒸干,残渣加甲醇1 mL使其溶解,作为对照药材溶液。再取芍药苷对照品1.079 mg,加甲醇1 mL使其溶解,作为对照品溶液。照薄层色谱法试验,吸取三批样品溶液和阴性样品溶液各5 μL、赤芍对照药材和芍药苷对照品溶液各 2 μL,分别点于同一块硅胶G薄层板上,以三氯甲烷-乙酸乙酯-甲醇-甲酸(40∶5∶10∶0.2)为展开剂,展开,取出,晾干,喷以显色剂5%香草醛硫酸溶液,在105 ℃加热至斑点显色清晰。结果:样品色谱中,在与赤芍对照药材色谱和芍药苷对照品色谱相应的位置上,显相同颜色的斑点,且斑点清晰、分离度好,阴性样品无干扰(如图3所示),说明方法可行、专属性良好。

1.芍药苷;2.赤芍;3~5.样品;6.阴性样品
2.2 三七中5种成分含量测定
2.2.1 色谱条件 采用资生堂MGII C18(4.6 mm×250 mm,5 μm)色谱柱,流动相:以乙腈为流动相A,水为流动相B。梯度洗脱:0~15 min,A保持20%;15~35 min,A 20%→22%;35~50 min,A 22%→24%;50~110 min,A 24%→40%,流速为 1.0 mL/min,柱温为25 ℃,检测波长为203 nm。
2.2.2 溶液的制备
2.2.2.1 混合对照品溶液 取待测五种皂苷类对照品,三七皂苷R17.529 mg、人参皂苷Rg125.306 mg、人参皂苷Re 5.145 mg、人参皂苷Rb125.179 mg和人参皂苷Rd 7.504 mg置同一25 mL量瓶中,加入甲醇约20 mL超声处理(功率为 250 W,频率为40 kHz)10 min使溶解,取出,放冷至室温后,用甲醇稀释并定容至刻度,摇匀,即得混合对照品溶液。
2.2.2.2 样品溶液 取三七伤药片样品(批号:20181202)20片,采用刮片法除去外层糖衣,精密称定重量后,置研钵内研细,取3.0045 g,置150 mL锥形瓶中,精密加入甲醇提取液50 mL,称定重量,82 ℃水浴条件下加热回流提取1 h,放冷,再称定重量,用甲醇补足回流过程中损失的重量,摇匀,过滤,精密量取续滤液25 mL置蒸发皿中,水浴100 ℃条件下蒸干,残渣加入水溶液25 mL使其溶解,用乙酸乙酯振摇提取2次,每次用量均为20 mL,弃去乙酸乙酯液,水液继续用水饱和的正丁醇溶液振摇提取4次,每次用量均为25 mL,合并正丁醇提取液,水浴100 ℃条件下蒸干,残渣加甲醇使其溶解并转移至5 mL量瓶中,加甲醇稀释至刻度,摇匀,过滤,取续滤液,即得样品溶液。
2.2.2.3 阴性样品溶液 按《中国药典》三七伤药片标准中【处方】比例与【制法】项下制备工艺,制备缺三七药味的阴性样品,按“样品溶液”项下方法制备阴性样品溶液。
2.2.3 专属性试验 取混合对照品溶液、样品溶液及阴性样品溶液,按照“2.2.1”项下的色谱条件,分别取10 μL注入高效液相色谱仪,进行分析,并记录色谱图,如图4所示。在样品色谱图中,分别显示与5种待测对照品保留时间一致的色谱峰,各色谱峰之间分离度良好,阴性样品色谱图中无相应的色谱峰,说明方法可行,且除三七外的其它药味不干扰三七伤药片中待测成分的测定,方法专属性良好。
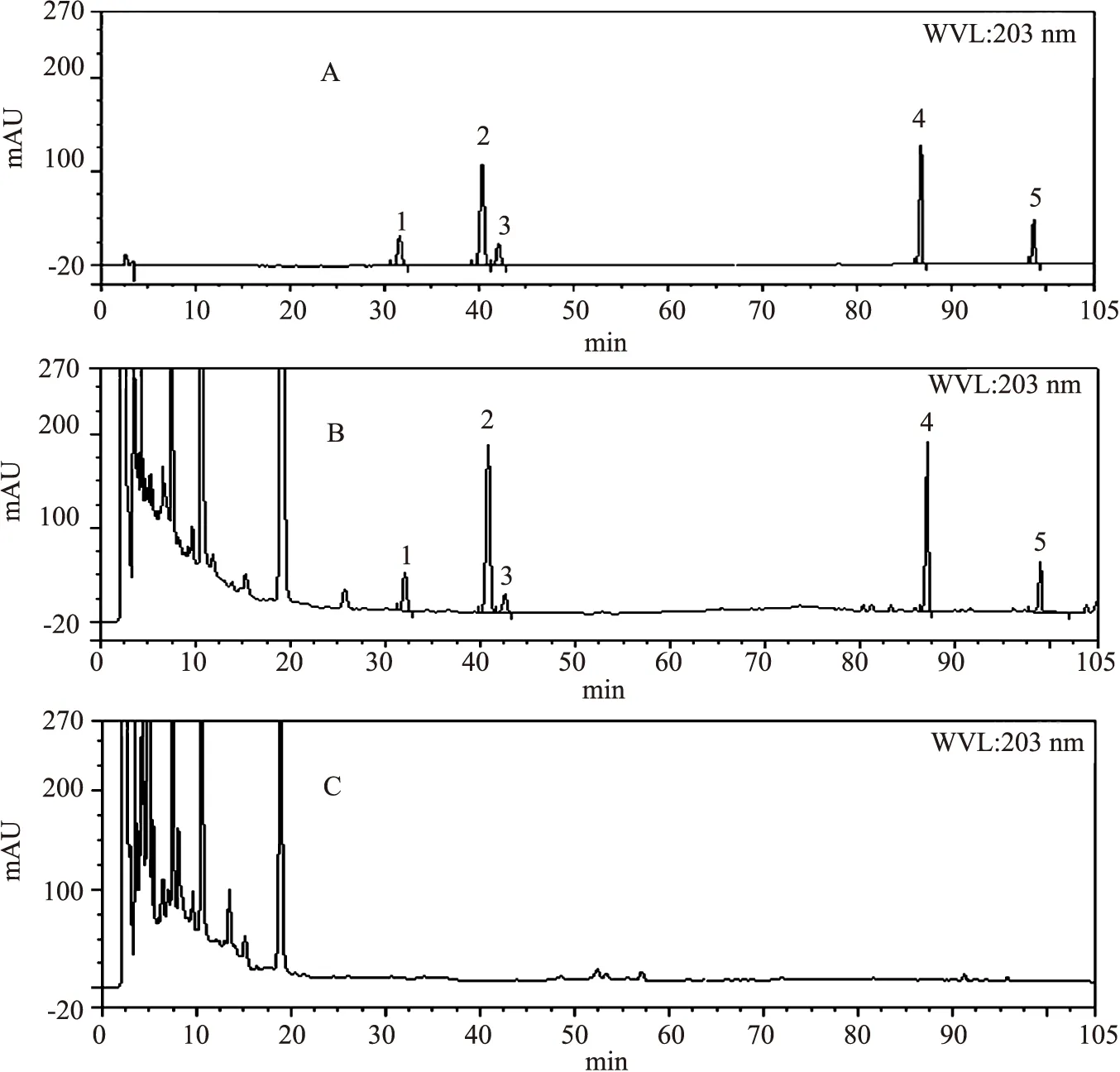
1.三七皂苷R1;2.人参皂苷Rg1;3.人参皂苷Re;4.人参皂苷Rb1;5.人参皂苷Rd;A.混合对照品;B.三七伤药片样品;C.阴性样品
2.2.4 线性关系考察 精密称取三七皂苷R131.18 mg、人参皂苷Rg189.98 mg、人参皂苷Re 23.40 mg、人参皂苷Rb191.08 mg及人参皂苷Rd 32.42 mg置同一10 mL量瓶中,加入甲醇约8 mL,超声处理(功率为250 W,频率为40 kHz)15 min使溶解,取出,放冷至室温后,用甲醇稀释并定容至刻度,摇匀,即得混合对照品储备液。精密吸取上述对照品储备液0.1 mL、0.2 mL、0.5 mL、1.0 mL、5.0 mL,分别置于5个10 mL量瓶中,加甲醇稀释并定容至刻度,摇匀,即得系列浓度的混合对照品溶液。精密吸取上述系列溶液各10 μL,分别注入高效液相色谱仪,按照“2.2.1”项下的色谱条件测定,以对照品进样量(μg)为横坐标(x),峰面积积分值为纵坐标(y),绘制标准曲线,求得回归方程。结果见表2。
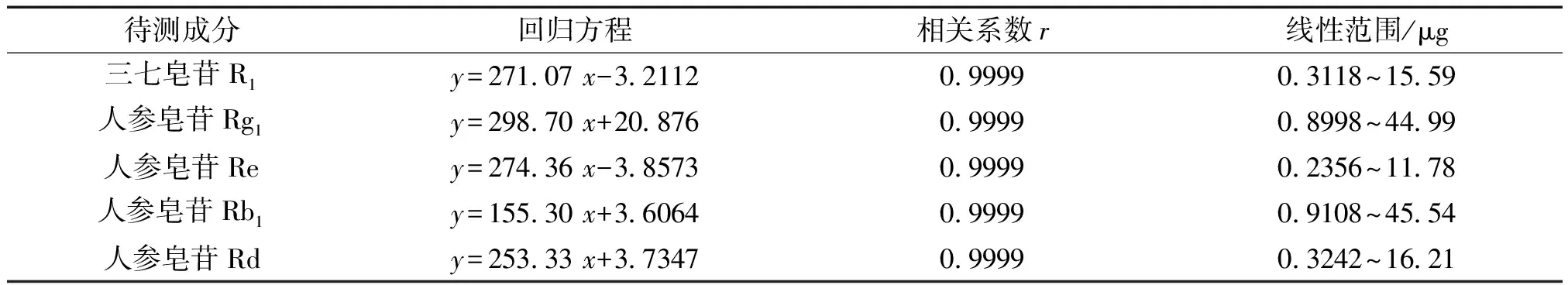
表2 各成分线性关系
2.2.5 稳定性试验 取按照“2.2.2”项下方法制备的批号为20181202的样品溶液,分别在配制后0 h、3 h、7 h、13 h、19 h、24 h按照“2.2.1”项下色谱条件进样测定,记录上述6个时间点5种成分色谱峰峰面积积分值,并计算各成分的RSD值,结果三七皂苷R1、人参皂苷Rg1、人参皂苷Re、人参皂苷Rb1和人参皂苷Rd的RSD值分别为1.2%、1.0%、0.9%、0.4%、1.0%,结果表明本实验制得的三七伤药片供试品溶液在24 h内稳定。
2.2.6 重复性试验 取同一批样品(批号:20181202),采用刮片法除去外层糖衣,置研钵内研细,取1.5 g、3.0 g、4.5 g各三份,精密称定每份重量,按照“2.2.2”项下方法分别制备样品溶液,按照“2.2.1”项下色谱条件进样测定,记录每一份样品中各成分峰面积积分值,计算5种皂苷类成分的含量及其RSD值,详细结果见表3,表明本实验建立的方法重复性良好。
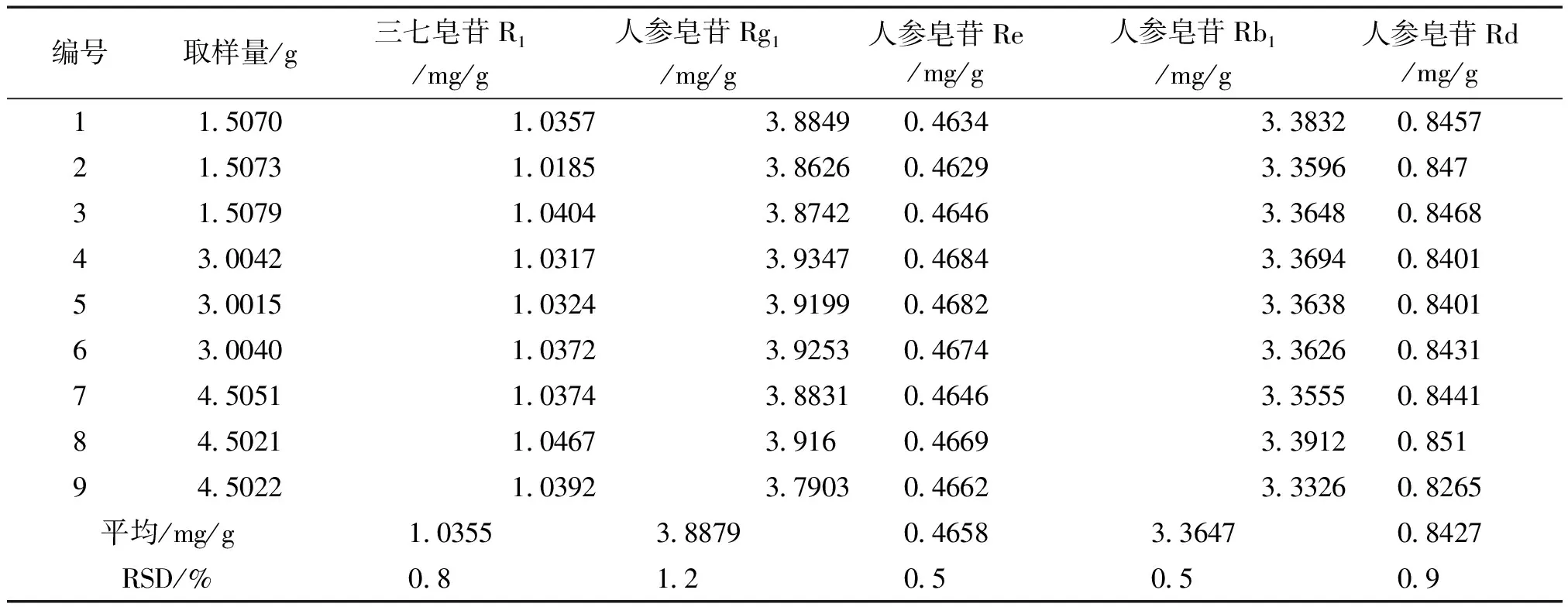
表3 各成分重复性试验结果 (n=9)
2.2.7 加样回收率试验 精密称取经重复性试验测定,含量已知的三七伤药片样品(批号:20181202)粉末9份,每份重量约1.5 g,每三份分为一组,分别加入用甲醇配制的低、中、高三个浓度的混合对照品溶液,按照“2.2.2”项下方法分别制备回收率测定用样品溶液,按照“2.2.1”项下色谱条件进样测定,计算每份样品中待测成分回收率及其平均值和RSD值,详细结果见表4,表明所建立的方法回收率良好。
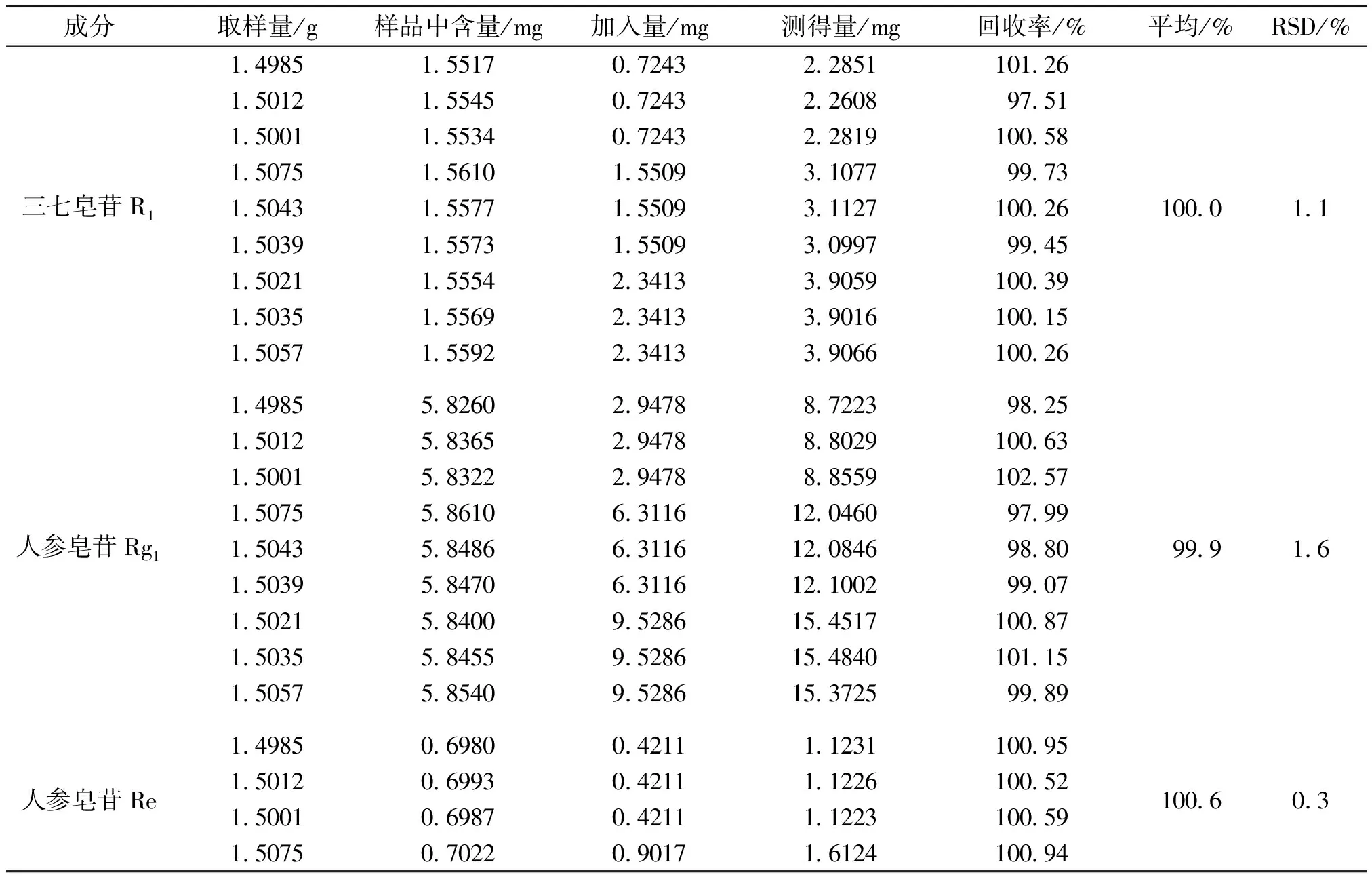
表4 三七伤药片5种成分加样回收率试验结果 (n=9)
2.3 样品测定 取收集到的17批三七伤药片样品,按上述建立的方法进行试验,结果显示17批样品,3个TLC鉴别均有相应的斑点检出,5种皂苷成分含量测定结果详见表5。
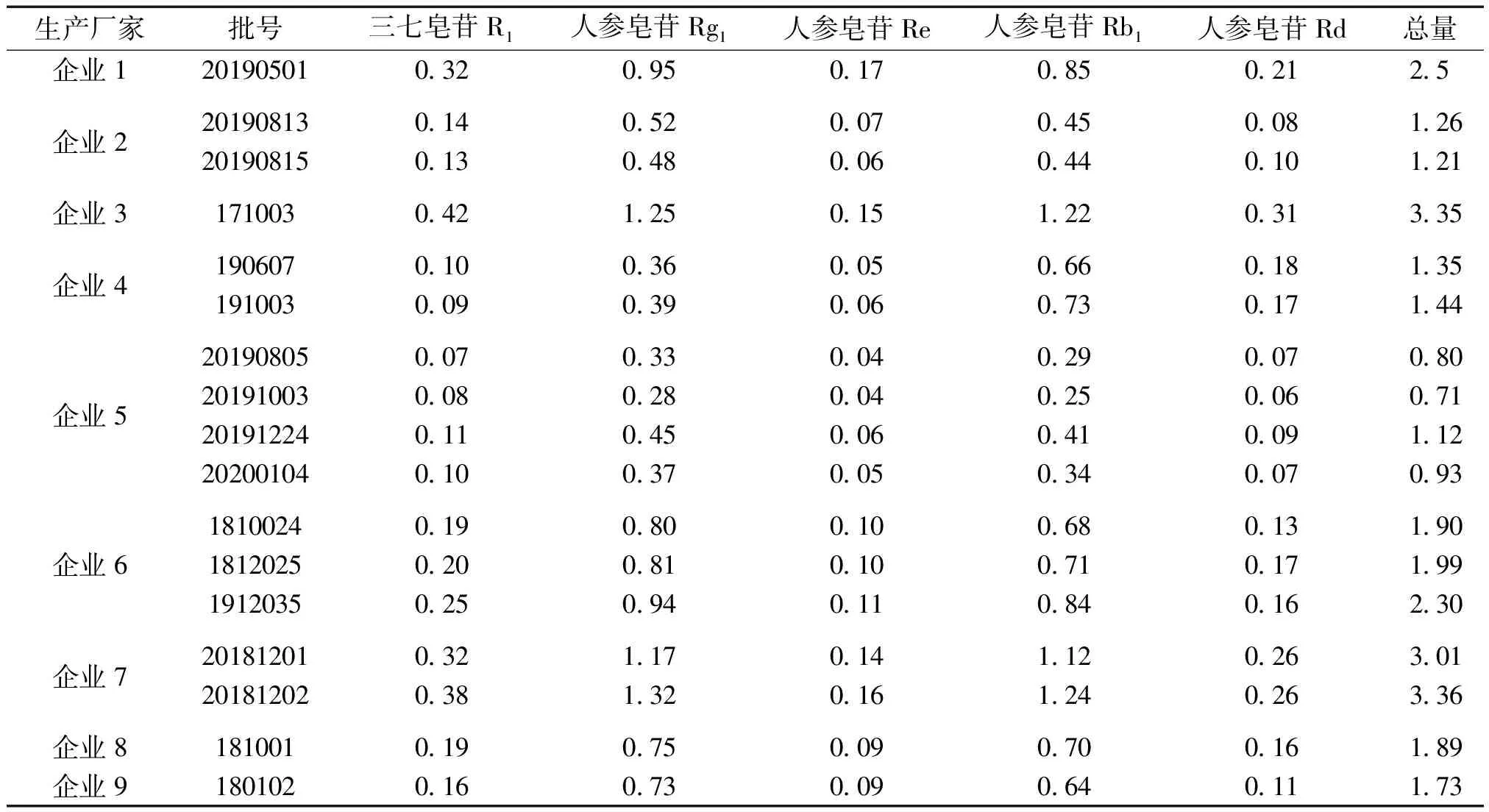
表5 三七伤药片含量测定结果 (mg/片,n=2)
2.4 基于化学计量学的三七伤药片质量分析 从以上的样品检验结果可看出,收集到的17批样品,3个薄层鉴别均有相应的斑点检出,全部符合规定,从鉴别的角度尚不能对样品的品质优劣做出区分,于是针对三七中皂苷类成分的含量进行了化学计量学的相关分析。
2.4.1 主成分分析(PCA) 将9个生产企业生产的共计17批次三七伤药片样品中五种皂苷成分的含量测定结果导入SIMCA 14.1软件进行PCA分析,所有的数据都落在95%置信区间,且累积方差贡献率R2X[1]与R2X[2]之和大于80%,说明所拟合的PCA得分图有很好的参考性。17批样品的二维PCA得分图见图5,从PCA得分图可看出,17批样品大致被分为了4类,同一企业的样品基本都可聚到一类,但企业间样品差距较大,企业3和企业7的样品中皂苷成分的含量较高,聚为一类;而企业2和企业5的样品含量较低,同样聚为一类。

图5 不同生产企业含量测定PCA得分图
2.4.2 正交偏最小二乘法-判别分析(OPLS-DA) 为了进一步寻找三七伤药片的差异质量标志物,以皂苷类成分的含量为变量,使用数据统计软件SIMCA 14.1对17批样品进行OPLS-DA分析,建立OPLS-DA模型,模型得分图如图6所示。由图6可见,在95%的置信区间内,OPLS-DA能有效的将样品进行区分,且与PCA的分类结果基本一致。OPLS-DA模型中变量重要性投影值(variable importance for the projection,VIP值)可直观反映出具有统计学意义的差异质量标志物,根据VIP>1.0的原则,筛选差异组分,结果共找到2个成分,按照VIP值大小依次为三七皂苷R1(1.2131)>人参皂苷Rd(1.1260)。如图7所示。

图6 不同生产企业含量测定OPLS-DA得分图
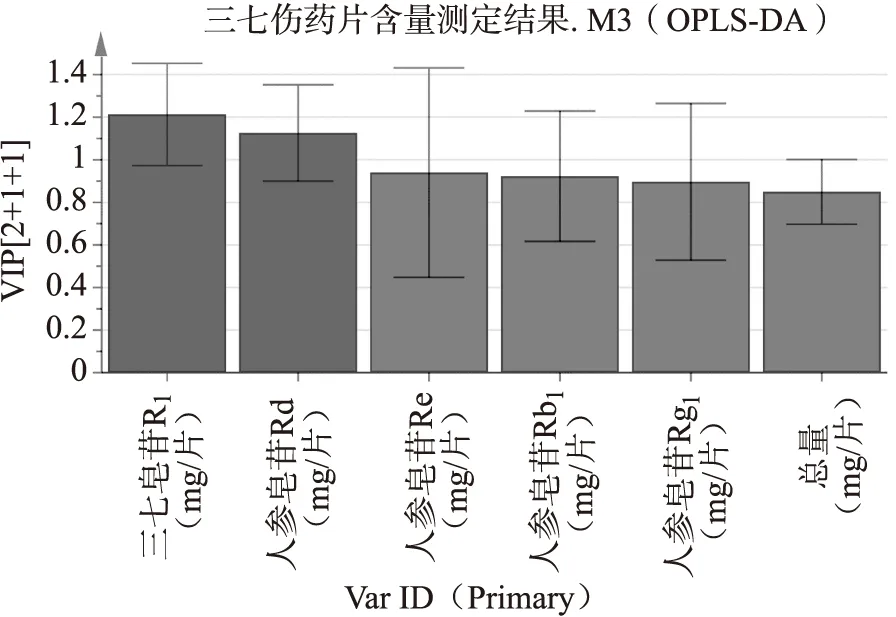
图7 测定成分的VIP值图
3 讨论
3.1 薄层鉴别方法研究 参考2020年版《中国药典》一部及相关文献[9-11],对组方中各味药进行TLC鉴别方法的探索,结果三七、红花等药味的鉴别方法因分离度较差、斑点不清晰等原因暂未列入质量标准;制草乌、雪上一枝蒿为毒性药味,需对其进行严格控制,既要对毒性较大的双酯型生物碱进行限量检查,又要对主要的药效成分单酯型生物碱进行含量测定,后续对其进行了HPLC方法的一系列研究工作。本文采用TLC法建立了方中冰片、骨碎补、接骨木、赤芍3味药的薄层色谱鉴别方法,经过多次试验选定薄层鉴别条件,结果方法简便易行,斑点清晰圆整,分离度好,阴性无干扰,试验过程中笔者还对多个厂家生产的薄层板(青岛海洋化工厂、烟台化学工业研究所、德国Merck公司)进行了考察,结果均能很好地分离,表明所建立方法有较好的耐用性,可作为三七伤药片的质量控制方法。
3.2 流动相及供试品溶液制备方法的选择 由于本品为复方制剂,成分复杂,为使三七皂苷R1、人参皂苷Rg1、人参皂苷Re、人参皂苷Rb1和人参皂苷Rd各色谱峰分离度达到要求,且峰形良好,本实验参照相关文献[12-15]对色谱条件及样品溶液的制备方法都进行了优化。预实验中分别以乙腈-水、乙腈-0.1%磷酸水溶液、乙腈-0.1%冰醋酸、甲醇-水、甲醇-0.1%磷酸水溶液(梯度洗脱)作为流动相进行试验,结果采用乙腈-水溶液时,色谱峰分离效果好,峰形较佳;在提取方式的选择上,比较了直接提取、正丁醇萃取净化处理、大孔吸附树脂柱净化处理的方法,结果采用正丁醇萃取净化处理的方法,可较大程度去除杂质峰的干扰;选择供试品溶液提取溶剂时,将50%甲醇、70%甲醇、甲醇、乙醇作对比,结果甲醇提取效率最高。所建立的方法,被测成分色谱峰峰形良好,相互之间无干扰,具有重现性好、灵敏度高、选择性强、耐用性好等特点,是控制三七伤药片质量的有效方法。
3.3 含量测定结果分析 本文采用HPLC法测定三七伤药片制剂中5种皂苷类成分的含量,通过化学计量学的分析可知,同一厂家生产的不同批次样品中,5种成分含量基本相当,一致性较好,而不同厂家生产的样品含量差异较大,且三七中的专属性成分三七皂苷R1是影响其质量的关键因素,因此亟需建立三七伤药片中君药三七的含量测定方法,且指标成分的选择不能仅限于五加科植物中共有的皂苷类成分人参皂苷Rg1、人参皂苷Re和人参皂苷Rb1等,而必须对三七的专属性成分三七皂苷R1加以控制,以确保其临床疗效的稳定。产品的质量与所用药材质量、生产工艺等都有密切关系,要提高产品质量,不但要监控原料的质量,而且还要对生产工艺进行优化、确保质量的稳定均一,所以建立能真正表征药品品质的质量标准显得尤为重要[16],质量控制体系的建立应以体现产品的质量为核心。
综上所述,研究同时建立了三七伤药片中3味药的薄层色谱鉴别方法及三七多指标成分的含量测定方法,建立的质量控制方法涉及药味多,质控成分种类多,能相对全面地控制三七伤药片的质量,保证临床用药的安全性与有效性。本次试验过程中,笔者同时对系列品种三七伤药胶囊与三七伤药颗粒进行了研究,对该系列制剂通用标准的建立具有指导意义,同时对全面控制产品质量的稳定性和临床疗效的一致性具有重要意义。
