非梗阻性无精子症与正常人睾丸间质细胞差异表达基因及核心基因的生物信息学分析
2023-10-24薛雨非师帅柳祖波余蔓妮
薛雨非,师帅,柳祖波,余蔓妮
(金华市人民医院生殖中心,金华 321000)
大约10%~15%的育龄夫妇罹患不孕不育,其中男性不育约占35%~50%[1]。男性不育与性功能障碍、精索静脉曲张、生殖系统感染、内分泌、梗阻性无精子症(OA)、非梗阻性无精子症(NOA)等密切相关[2]。NOA在男性中的发病率约为1%,占不育男性的10%~15%,是男性不育最为重要的病因之一[3]。NOA研究较多的包括染色体异常、Y染色体微缺失和表观遗传学等,但大约70%的NOA原因仍然是未知的。NOA患者睾丸的病理特征是没有或很少生精细胞,但10%的患者通过手术可以发现生精细胞,并通过辅助生殖技术可能获得生育[4]。
精子发生依赖于睾丸细胞微环境的稳定,睾丸的微环境改变可能会影响生育能力[5]。目前我们对睾丸细胞微环境的了解有限,微环境细胞的异质性,以及在分子水平上NOA患者与正常可生育人群之间细胞类型的差异知之甚少,这都影响我们对NOA发病机制的理解。单细胞RNA测序的快速发展使我们能够更好研究睾丸的单个细胞群。以往的大多数研究都针对生殖细胞群本身,较少研究睾丸的微环境体细胞群[6]。最近一项关于青春期人类睾丸单细胞转录组的研究揭示了睾丸体细胞的发育变化[7];另一项单细胞转录组的研究揭示了睾丸支持细胞在NOA中的关键作用。尚未见有关睾丸间质细胞群和NOA的关联性研究[8]。
为探讨睾丸间质细胞群在NOA患者睾丸精子发生障碍中的作用,本文通过整合分析GEO数据库的多个单细胞测序数据,鉴定出在NOA患者中占比较高的细胞,然后分析这类细胞在NOA患者和正常可生育人群之间的差异表达基因,紧接着对差异表达基因进行GO和KEGG分析,最后通过差异表达基因构建PPI网络和鉴定出核心基因。本研究结果有助于探讨睾丸细胞微环境对精子发生的作用和潜在的NOA发病新机制,为后续NOA细胞微环境研究和核心基因功能研究奠定基础。
资料和方法
一、数据来源
GEO(http://www.ncbi.nlm.nih.gov/geo)是一个全球免费的公共基因组数据库,包含丰富的基因表达数据和单细胞测序数据。本次研究的基因表达转录组数据来源于GSE149512数据集,选取无生精障碍的人群为正常组,NOA患者为NOA组。
二、研究方法
1.单细胞测序数据的细胞聚类和注释以及差异表达基因的筛选:运用R软件(版本4.02)中的Seurat包(版本4.0)整合分析GSE149512的数集,经过一系列的数据过滤、质控、归一化、主成份分析,并采用非线性降维UMAP的方法进行细胞聚类分析。通过Find All Markers函数,获取细胞聚类的Marker基因,并查询Human Cell Landscape(HPL)数据库进行细胞注释,并绘制差异表达基因的可视化热图。
2.差异表达基因的GO功能富集和KEGG通路分析:运用Cytoscape软件(3.6.1版)的ClueGO和CluePedia插件对差异表达基因的进行GO功能富集和KEGG通路分析。
3.蛋白-蛋白互作(PPI)网络的构建和关键基因的鉴定:通过String数据库(http://string-db.org),构建差异表达基因的PPI网络,并且把互作综合评分定为大于等于0.4;随后,将String分析后的数据导入Cytoscape软件,再次可视化PPI网络;然后,运用CytoHubba插件中的5种运算方法(Degree、DMNC、EPC、MCC、MNC)识别PPI网络中的核心基因;选取75个核心基因(每种算法中前15个核心基因)绘制韦恩图。
结 果
一、单细胞测序数据集的整合分析
整合GSE149512数据集,最终形成1个由39 392个细胞、40 210个基因、31个聚类细胞构成的数据集(图1A)。其中,NOA组有17 415个细胞,正常组有21 977个细胞,聚类细胞的分布情况见图2B。通过Find All Markers函数识别出聚类细胞的Marker基因,结合HPL数据库,31个聚类细胞鉴定为10种类型睾丸细胞(图1C)。NOA组的细胞主要由体细胞构成,其睾丸间质细胞占比最高,为44.4%(7 736/17 415)(图1D、E)。
二、两组间睾丸间质细胞中的差异表达基因分析
睾丸间质细胞主要由5个聚类细胞(聚类0、3、5、15、22)和11 284个细胞构成,其中NOA组的睾丸间质细胞主要由聚类0和聚类3细胞构成(图2A、B)。接着,提取数据集的睾丸间质细胞继续分类,经过质控、标准化,降维后出现10个睾丸间质细胞聚类(图2C),并显示出NOA组和正常组中的睾丸间质细胞有显著差异(图2D、E)。我们进一步通过条件为P<0.01、avg LogFC>1的过滤方式,分析两组睾丸间质细胞的差异表达基因情况,总共得到145个差异表达基因:与正常组相比较,NOA组上调的基因82个,下调的基因63个。热图显示30个差异显著的基因(图2F)。
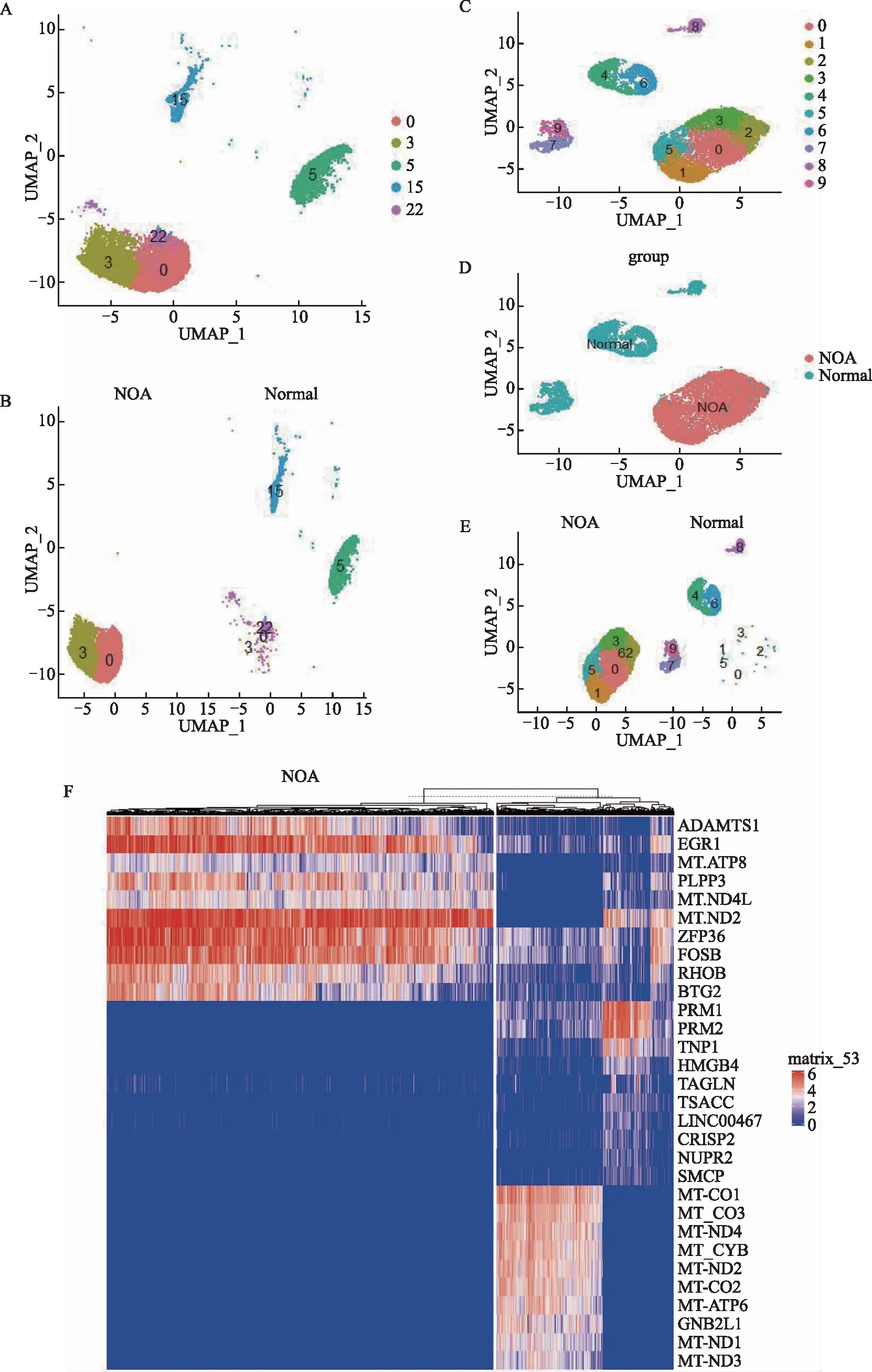
A:整合数据中的睾丸间质细胞的分布;B:两组间睾丸间质细胞的分布;C:再聚类后的睾丸间质细胞的分布;D:两组间细胞聚类的分布;E:两组间睾丸间质细胞的差异;F:热图。图2 睾丸间质细胞在NOA和正常人群中的差异表达基因分析
三、差异表达基因的GO和KEGG富集分析
为了探究睾丸间质细胞在正常人群和NOA人群的差异,我们对差异表达基因进行了GO和KEGG富集分析。GO富集分析结果显示,在生物学过程方面,睾丸间质细胞发挥作用较多,且在免疫抗原提呈功能方面也发挥着重要作用;在细胞组分方面,主要在细胞膜、胞质和核糖体中发挥作用;在分子功能方面,主要发挥细胞周期蛋白激酶的调控、核苷核酸的链接等作用。KEGG通路分析结果显示,主要通过病毒感染,炎症细胞因子等通路发挥显著作用(图3)。

A:生物学过程分析结果;B:细胞组分分析结果;C:分子功能分析结果;D:KEGG通路分析结果。图3 差异表达基因的GO和KEGG分析
四、构建差异表达基因的PPI网络和鉴定核心基因
我们将这些差异表达基因映射到STRING数据库中构建PPI网络,然后,将这些交互网络数据重新导入到Cytoscape软件中,最终构成了158个点和2 132条边的PPI网络(图4A);我们通过CytoHubba插件中的5种分类算法,获取每种算法Top 15的核心基因(图4B~F);最后,整合这些基因,在3种算法以上重叠出现的基因有以下 10个:RPS2、RPS3、RPS9、RPS11、RPS12、RPS27A、RPL7、RPL8、RPL37、UBA52,这10个基因被认为是核心基因(表1、图4 G),这些基因基本属于核糖体蛋白类基因,其中RPS11基因在4种算法中均有出现。
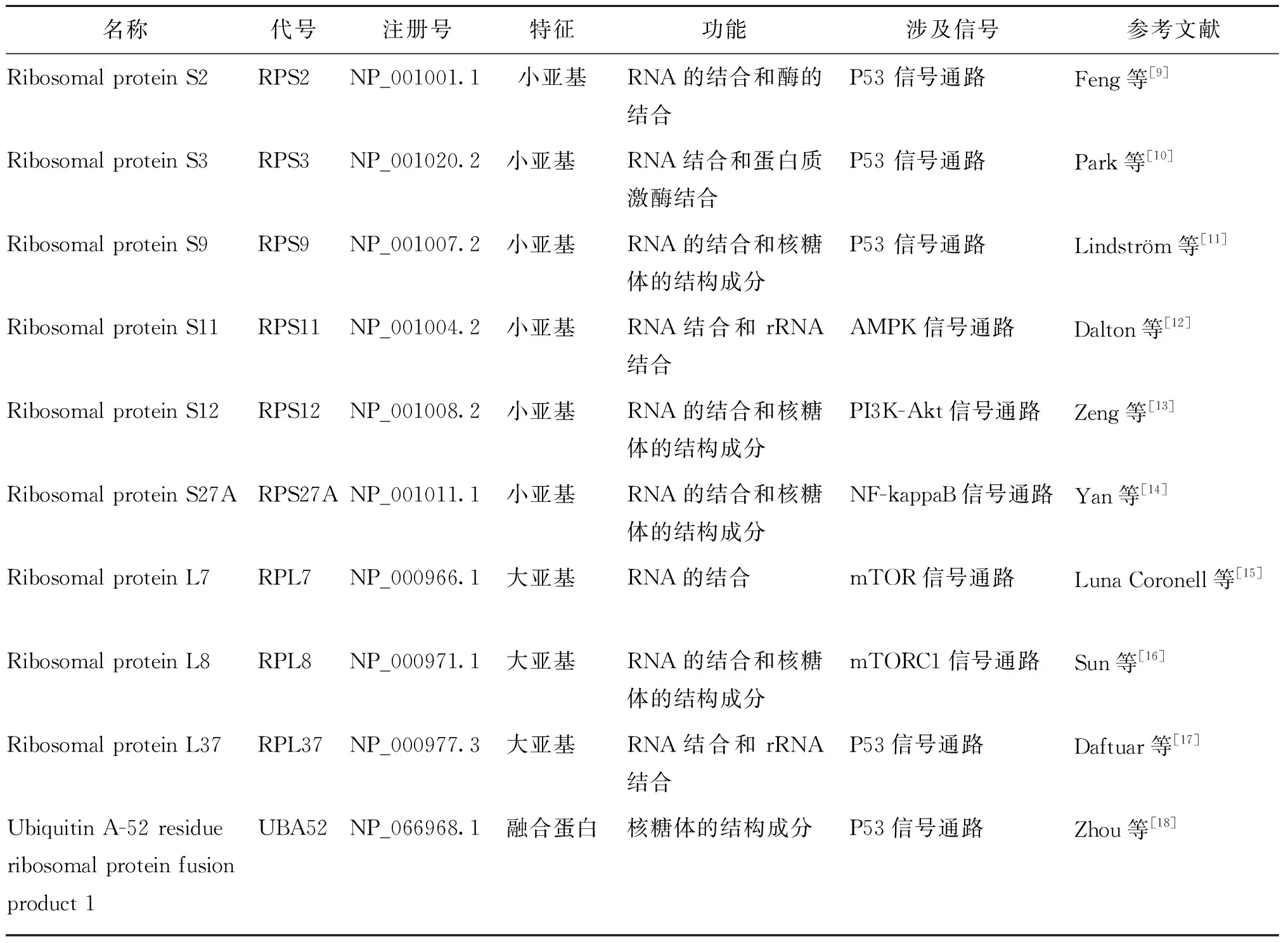
表1 10个核心基因的信息汇总列表
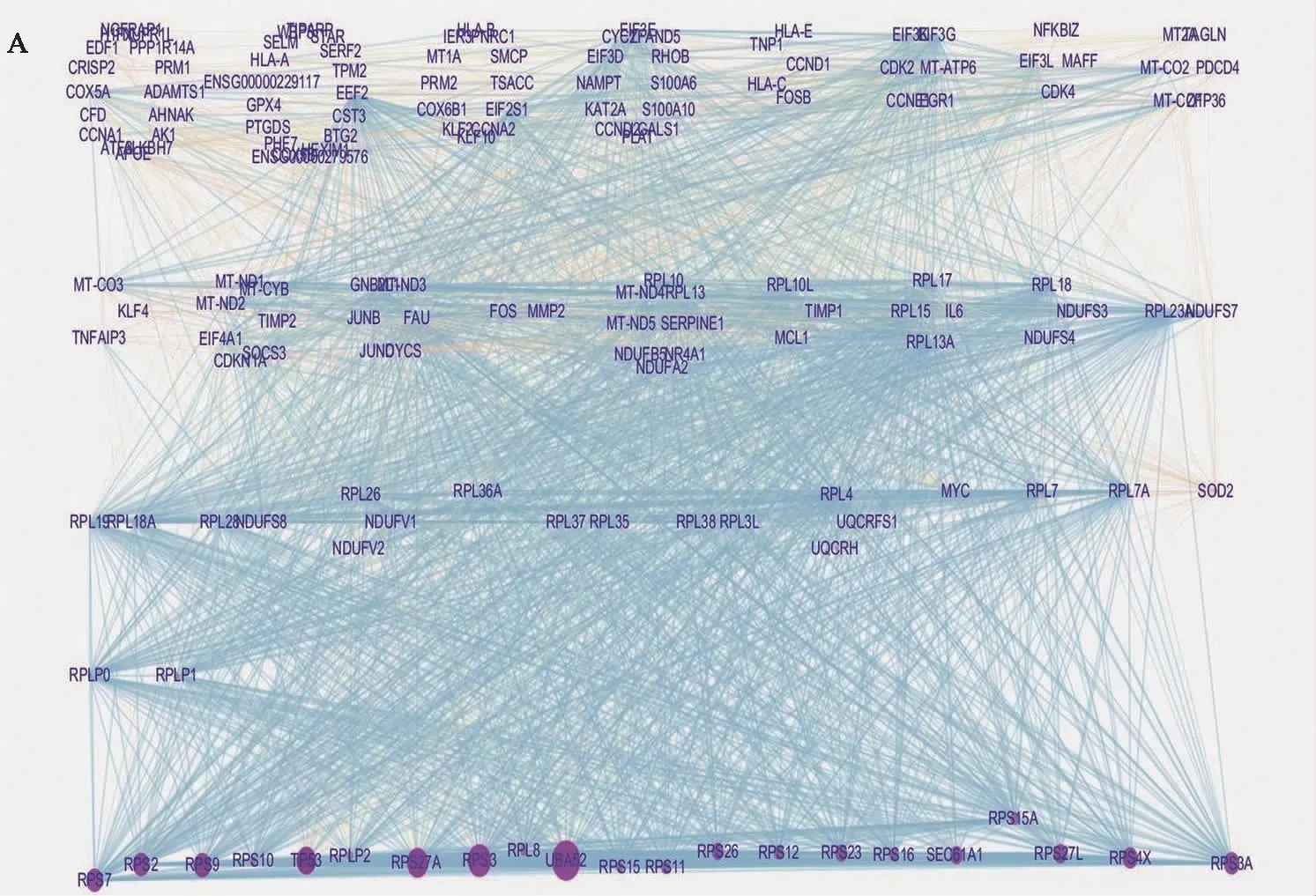
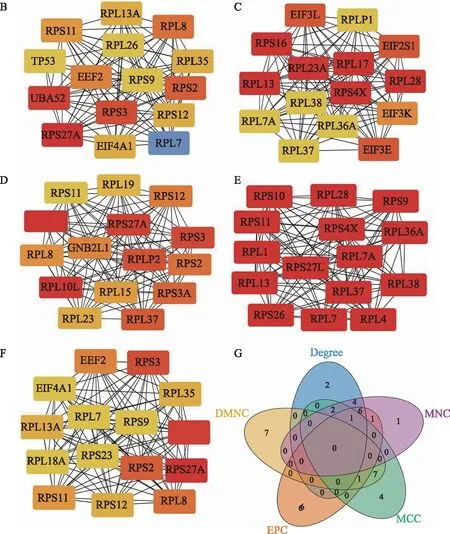
A:PPI网络图(紫色圆圈基因是候选关键基因);B:依据Degree算法遴选出的前15基因;C:依据DMNC算法遴选出的前15基因;D:依据EPC算法遴选出的前15基因;E:依据MCC算法遴选出的前15基因;F:依据MNC算法遴选出的前15基因;G:韦恩图。图4 PPI网络的构建和核心基因的鉴定
讨 论
一、NOA患者不易早期诊断
睾丸体细胞微环境对生殖细胞的作用,就像土壤对种子发芽的作用一样,为精子发生提供必要的支持和营养成分[19]。尽管越来越多的证据表明人类睾丸体细胞群具有高度异质性,但是我们对睾丸微环境内稳态的认识仍很有限,影响了对男性不育的理解[20]。在我们国内的相关研究中,生育障碍的男性大约23.5%是由于染色体异常和Y染色体微缺失造成的,大部分的NOA患者存在病因未明的现状[21]。但是大部分患者诊断为NOA时,已经到了育龄阶段,很少在青春期能诊断明确,因此关键差异表达基因有潜力为NOA的早期诊断提供有力的手段。
二、睾丸间质细胞在精子发生中起到重要作用
睾丸体细胞群包括间质细胞、肌样细胞、巨噬细胞和支持细胞,构成睾丸的细胞微环境或生态位,在正常精子发生过程中起重要作用[22]。睾丸间质细胞是睾丸间质的重要组成部分[23-24],通过分泌雄性激素参与调控精子发生,并可以通过影响白介素1α、转化生长因子β(TGFβ)、抑制素、胰岛素样生长因子1(IGF1)、胰岛素样肽3(INSL3)、雌激素和甲状腺激素等生长因子和类固醇激素发挥关键作用[25-26]。睾丸间质细胞发育不良和不发育为睾丸间质细胞先天性发育不良和不发育,不能合成与分泌睾酮,致使生殖管道与外生殖道女性化,已被认为是男性假两性畸形的原因之一。成年型的睾丸间质细胞不发育亦被描述,其发病率尚不清。睾丸间质细胞功能受损可导致雄激素分泌异常,并影响性别分化、性腺发育和精子发生。我们研究发现,GSE149512资料库中关于睾丸间质细胞的数据占比非常高(44.4%),间接证明了其在精子发生中的重要性。
三、两组睾丸间质细胞存在差异
分析NOA和正常人群睾丸间质细胞间共有145个差异表达基因,其中上调的基因82个、下调的基因63个。GO富集分析结果显示,这些差异表达基因主要在细胞质的核糖体中发挥细胞周期蛋白激酶的调控、核苷核酸的链接等分子功能。KEGG通路分析显示,主要富集在炎症细胞因子等通路。随后继续使用差异表达基因构建PPI网络,整合5种算法的前15个基因,最终获取到10个核心基因,这10个基因主要是核糖体蛋白相关的基因。核糖体是高度复杂的翻译机器,已被证明在调节蛋白质合成方面具有异质性,其主要通过共翻译方式调控男性生殖细胞特异性蛋白的折叠,这些蛋白对精子的形成至关重要。在我们的研究中,RPS11出现的频次最高,预示着RPS11可能通过睾丸间质细胞影响精子的发生。RPS11是核糖体小亚基40S的组成部分,属于核糖体蛋白S17p家族,由RPS11基因所编码,主要存在于真核生物中[27]。该基因与小核糖核酸基因U35B共同转录,后者位于第3内含子中。正如编码核糖体蛋白的基因所特有的那样,这个基因有多个加工过的假基因,分散在整个基因组中。其相关机制是肽链延长和CAP帽结合形成复合物后激活mRNA,并随后与43S结合发挥其作用。目前鲜见报道RPS11和男性不育之间的相关性研究,Bansal等[28]研究表明,与正常对照组比较,弱精子症组的RPS11显著降低,无精子症组显著升高。本文结果与上述结果一致,并精准提示,RPS11基因的差异表达主要体现在睾丸间质细胞。
本文的不足主要是只分析了NOA组比例最高的睾丸间质细胞,未能全面分析睾丸体细胞,此外通过生物信息学鉴定的核心基因亦未通过实验验证。后期我们将针对这些不足,更加全面的分析NOA和正常人群在不同睾丸体细胞的差异表达基因,及其相关功能验证。
