贝莱斯芽胞杆菌SH-1471可湿性粉剂研制及其对番茄枯萎病的防治效果
2023-10-21申云鑫李铭刚施竹凤赵江源李者芬杨明英陈齐斌杨佩文
申云鑫,李铭刚,施竹凤,赵江源,王 楠,李者芬,杨明英,陈齐斌,杨佩文*
(1.云南农业大学植物保护学院,昆明 650201;2.云南省农业科学院农业环境资源研究所,昆明 650205;3.云南省微生物研究所,昆明 650091)
由尖孢镰刀菌Fusariumoxysporum引起的番茄枯萎病,可通过侵染番茄根部并在维管束繁殖,引起维管束阻塞,导致植株萎蔫、枯死[1]。具有危害损失大、防治困难等特点,还可危害瓜类、茄类、豆类等多种经济作物。目前针对番茄枯萎病主要使用咯菌腈、恶霉灵、咪鲜胺等化学农药进行防治,而化学农药处理易造成环境污染、农药残留等问题,严重危害人类与环境健康[2]。
在可持续发展和生态文明建设的背景下,随着《农药工业“十三五”发展规划》、《“十四五”全国农业绿色发展规划》等政策的推出,大力助推了生物农药产业的发展[3-5]。但目前新生物农药仍面临着研发难度大、生产工艺以及推广应用等方面的问题[6-8]。因此,加强对新生物农药产品的研发以及生产工艺优化,是推进其产业化、商业化的重要措施之一,且对推进农业绿色发展、实现绿色防控具有重大意义。截至2022年,全国已登记的118 个芽胞杆菌属微生物可湿性粉剂(Wettable powder)中,贝莱斯芽胞杆菌Bacillus velezensisWP 仅占1 个(来源于中国农药信息网:http://www.icama.org.cn/fwb/index.jhtml)。近年来,有关贝莱斯芽胞杆菌防治植物病害的研究报道日益增加,但缺乏对其可湿性粉剂研发的相关报道,以及缺乏对其进行商业化、产业化的开发利用。研究表明,贝莱斯芽胞杆菌具有无致病性、抗逆性强,产抑菌次级代谢产物种类丰富、抗菌谱广以及可提高作物生长性能和抗病力等特点,已成为植物病害生物防治的理想微生物之一[9,10]。贝莱斯芽胞杆菌L-1 可抑制引起梨纹病的贝伦格葡萄座腔菌和粉红单端孢菌的生长,且可长期定殖于植株内部[11,12];分离自水稻OryzasativaL叶片的贝莱斯芽胞杆菌E69,在高效防治叶瘟病的同时,可定殖于作物茎、叶以及维管束等部位,从而达到病害持续防控的目的[13];从多花黄精根部分离的贝莱斯芽胞杆菌ZJU-3,不仅具有产表面活性素、泛革素和伊枯草菌素等脂肽类抑菌化合物的功能,而且可产生吲哚乙酸、激动素、玉米素和赤霉素等植物促生激素[14];贝莱斯芽胞杆菌8-4 能够有效抑制马铃薯疮痂病的病原链霉菌Streptomycesgalilaeus生长,且能提高马铃薯的产量[15]。总体来说,贝莱斯芽胞杆菌在生物防治、药物研发、食品发酵和工业酶制剂等领域是当前研究的热点菌株[16,17],但由于其在菌种资源、生产工艺和定殖能力等方面存在问题,导致其缺乏规模化和商业化应用[18]。此外,国内外对于贝莱斯芽胞杆菌WP 的研发相关报道较少,亟需加强对贝莱斯芽胞杆菌WP 生产工艺的探索和优化并进行实际生防试验进行研究。
贝莱斯芽胞杆菌SH-1471 分离自健康烟草根际土壤,其对番茄枯萎病菌具有良好的拮抗作用,且具有srfA、fenB、ituA、ituD、bymA等抗生素的合成基因,以及产蛋白酶、纤维素酶、解磷、固氮、分泌铁载体的能力[19],具有广阔的应用前景。为使其可更加高效地应用于农业生产中作物病害的生物防治,并有效实现产业化发展,本文以其为研究对象,通过试验对其载体、润湿剂、分散剂、稳定剂、紫外保护剂及其复配比例进行筛选,研制贝莱斯芽胞杆菌SH-1471 WP,根据可湿性粉剂质量检测标准检测其各项指标,测定其贮存稳定性,并采用室内盆栽试验模型测定SH-1471 WP 对番茄枯萎病的防治效果,为贝莱斯芽胞杆菌SH-1471 WP 的开发及进一步推广应用奠定基础。
1 材料与方法
1.1 试验材料
1.1.1 菌种 供试菌种:贝莱斯芽胞杆菌 SH-1471 由云南省农业科学院农业环境资源研究所于健康烟草根际土壤分离、鉴定与保存,于2022 年6 月20 日保藏于中国典型培养物保藏中心(保藏编号:CCTCC NO:M 2022923,专利号:ZL 2022 1 1479280.X)。
供试病原物:文中涉及的指示病原物番茄枯萎病菌由云南省农业科学院农业环境资源研究所分离、鉴定与保存。
1.1.2 培养基 NA 培养基:蛋白胨10 g/L,牛肉粉3 g/L,氯化钠5 g/L,琼脂15 g/L,pH 7.0~7.4,蒸馏水1 L;种子培养基(本实验室优化所得):蔗糖10 g/L,豆粉10 g/L,硫酸镁2.5 g/L,酵母膏5 g/L,蒸馏水1 L;发酵培养基:麸皮10 g/L,玉米粉30 g/L,黄豆粉30 g/L,KH2PO40.3 g/L,Na2HPO44 g/L,蒸馏水1 L,pH 7.0~7.2。
1.1.3 载体和助剂 载体:膨润土、滑石粉、高岭土、硅藻土、白炭黑、凹凸棒土、高岭土、轻质碳酸钙等。润湿剂:洗衣粉、皂角粉、D425、木质素磺酸钠、羧甲基纤维素钠CMC-Na(Carboxymethylcellulose)、十二烷基硫酸钠SDS(Sodium sulfate)、十二烷基苯磺酸钠DBS (Dodecyl benzene sulfonate)、吐温-60 等。分散剂:NNO、聚乙烯醇(PEG8000)、木质素磺酸钙。稳定剂:磷酸氢二钾(K2HPO4)、羧甲基纤维素钠(CMC-Na)、海藻酸钠、黄原胶、轻质碳酸钙、十二烷基苯磺酸钠(DBS)。紫外保护剂:糊精、抗坏血酸VC(Vitamin C)、海藻酸钠、十二烷基苯磺酸钠(DBS)。文中涉及所有载体和助剂均购自上海源叶生物科技有限公司。
1.2 种子液制备
将培养好的解淀粉芽胞杆菌SH-1471 菌株用接种针划线培养接种于NA 固体培养基上,28 ℃倒置培养24 h,获得单菌落。挑取单菌落接种于装有100 mL 种子培养基的250 mL 锥形瓶中,30 ℃、200 r/min(本实验室优化所得)振荡培养24 h,得到种子液。
1.3 发酵培养
取贝莱斯芽胞杆菌SH-1471 菌株种子液,以6%的接种量接入发酵培养基,30 ℃,200 r/min 振荡培养2 d,得到菌株发酵液。
1.4 可湿性粉剂载体和助剂的筛选
1.4.1 可湿性粉剂载体筛选及母粉制备 载体吸附能力测定:分别取无菌供试载体100 g 置于三角瓶,将SH-1471 菌株发酵液缓慢倒入三角瓶中,玻璃棒同时搅拌至载体呈流动状且不结块、不溢水,记录所倒入发酵液的体积V,并计算载体最大吸附量:H=V/0.1(Kg/L)。润湿时间和悬浮率测定:将菌株发酵液与各载体均匀混合,经进风温度175 ℃,出风温度60 ℃进行喷雾干燥后制成母粉,并参照1.4.4 中质量检测标准中的方法,分别测定润湿时间、悬浮率。最综合考虑润湿时间、悬浮率、吸附容量以及成本等择优选择载体类型。
1.4.2 可湿性粉剂助剂筛选 润湿剂和分散剂筛选:将贝莱斯芽胞杆菌SH-1471 母粉分别与待选润湿剂(12%)和分散剂(12%)经超微粉碎机粉碎混合均匀后加工制成可湿性粉剂,每个处理设置3 个重复,参照1.4.4 中质量检测标准中的方法测定润湿时间和悬浮率,并测定胞子萌发率,结合润湿时间、悬浮率和胞子萌发率选择最佳润湿剂和分散剂。
润湿剂和分散剂最佳质量配比筛选:结合润湿时间和悬浮率分别挑选出润湿剂和分散剂,以润湿剂与分散剂:1:9、2:8、3:7、4:6、5:5、6:4、7:3、8:2、9:1 的含量与贝莱斯芽胞杆菌SH-1471 母粉经超微粉碎机粉碎,混合均匀后加工制成可湿性粉剂,每个处理设置3 个重复,测定润湿时间、悬浮率和胞子萌发率,结合润湿时间和悬浮率以及胞子萌发率选择最佳配比。
润湿剂和分散剂总用量对可湿性粉剂性能的影响:将筛选所得湿润剂和分散剂经超微粉碎机粉碎混匀,按上述比例均匀混合后过325 目筛,分别以2%、4%、6%、8%、10%、12%、14%、16%、18%的用量与贝莱斯芽胞杆菌母粉均匀混合,测定润湿时间、悬浮率和胞子萌发率。综合考虑制剂润湿性、悬浮率以及胞子萌发率,筛选出湿润剂和分散剂的最佳用量。
稳定剂筛选:将贝莱斯芽胞杆菌SH-1471 母粉与润湿剂、分散剂及待选稳定剂(1%、2%、3%)经超微粉碎机粉碎混合均匀后加工制成可湿性粉剂,以不加稳定剂为对照每个处理设置3 个重复;采用《农药可湿性粉剂产品标准编写规范》(GB/T 19136-2003)中的试验方法进行加速贮藏稳定性测定:热贮(54±2)℃,14 d 后测定芽胞含量的变化,计算芽胞损失率(%)=(储藏前芽胞含量-储藏后芽胞含量)/储藏前芽胞含量×100。
紫外保护剂筛选:将贝莱斯芽胞杆菌SH-1471 母粉与已筛选所得的润湿剂、分散剂、稳定剂及待筛选紫外保护剂(0.5%、1.0%、1.5%)经超微粉碎机粉碎混合均匀后加工制成可湿性粉剂,以不加保护剂为对照,稀释涂布在平板上,在254 nm 紫外灯(20W)距离40 cm 处照射12、24 h 后,计算芽胞存活率,筛选出最佳紫外保护剂。
1.4.3 可湿性粉剂研制 将贝莱斯芽胞杆菌SH-1471 发酵液与粉碎后的1.2.3 中筛选所得载体、润湿剂、分散剂、稳定剂、紫外保护剂等按优化后的配比同时混合,边搅拌边进行喷雾干燥制成可湿性粉剂。
1.4.4 可湿性粉剂质量检测 标准硬水的配制:称取无水氯化钙0.304 g,带结晶水的氯化镁0.139 g,放入1000 mL 容量瓶中,用蒸馏水溶解、稀释至刻度。
(1)含孢量测定:参考《中华人民共和国农业行业标准》(NY/T 2293.1-2012)进行含孢量测定。
(2)悬浮率测定:参考《农药可湿性粉剂悬浮率的测定》(GB/T 14825-2006)为本试验参考标准。
(3)润湿时间测定:参考《可湿性粉剂润湿性的测定》(GB/T 5451-2001)为本试验参考标准。
(4)细度测定:参考《农药可湿性粉剂悬浮率的测定》(GB/T 16150-1995)为本试验参考标准。
(5)含水率测定:参考《农药水分测定》(GB/T 1600-2001)为本试验参考标准。
(6)pH 测定方法:参考《农药pH 值的测定》(GB/T 1601-1993)为本试验参考标准。
(7)杂菌率测定:将可湿性粉剂样品梯度稀释后,分别涂布在NA 和PDA 培养基上,在PDA 平板上检测真菌杂菌数,在NA 平板上检测细菌杂菌数,细菌与真菌总和所占总比例为杂菌率。
1.4.5 制剂稳定性的测定 称取一定量的贝莱斯芽胞杆菌WP 分别在低温(4 ℃±2 ℃)条件下以及室温(25 ℃)下连续贮存180 d,并每10 d 使用平板计数法检测并计算贝莱斯芽胞杆菌WP 的芽胞存活率。
番茄枯萎病发病情况调查分组标准如下:0:无症状;1:一片或两片叶子变黄;2:三片或者四片真叶变黄叶片萎蔫下垂;3:五片或六片真叶变黄或真叶萎蔫下垂;4:全株严重萎蔫以致枯死。
病情指数=(各级病株数×该病级值)/(总株数×最高级值)×100;
防效(%)=(对照组病情指数-处理组病情指数)/对照组病情指数×100。
1.5 数据统计与统计
数据采用单因素方差分析、多重比较及独立样本t检验分析比较处理间的显著性差异。选择Excel 和SPSS Statistics 20.0 软件进行数据统计分析,以及采用Origin 2018 和GraphPad Prism 8 软件制图。
2 结果与分析
2.1 载体筛选
以吸附容量、润湿时间和悬浮率为指标进行载体筛选结果如表1,7 种载体在吸附容量上具有显著差异,其中白炭黑的吸附容量最高,为3.7 mL/g,其次为硅藻土、凹凸棒土和高岭土,吸附容量分别为2.8、2.6 和1.9 mL/g;高岭土的润湿时间最短,为15.7 s,其次为硅藻土和白炭黑,分别为17.8 和18.4 s,凹凸棒土和膨润土的润湿时间最长,分别为61.6 和75.5 s;高岭土和硅藻土的悬浮率最高,均超过70%,分别为79.5%和66.5%,故选择高岭土作为贝莱斯芽胞杆菌SH-1471 可湿性粉剂的载体。
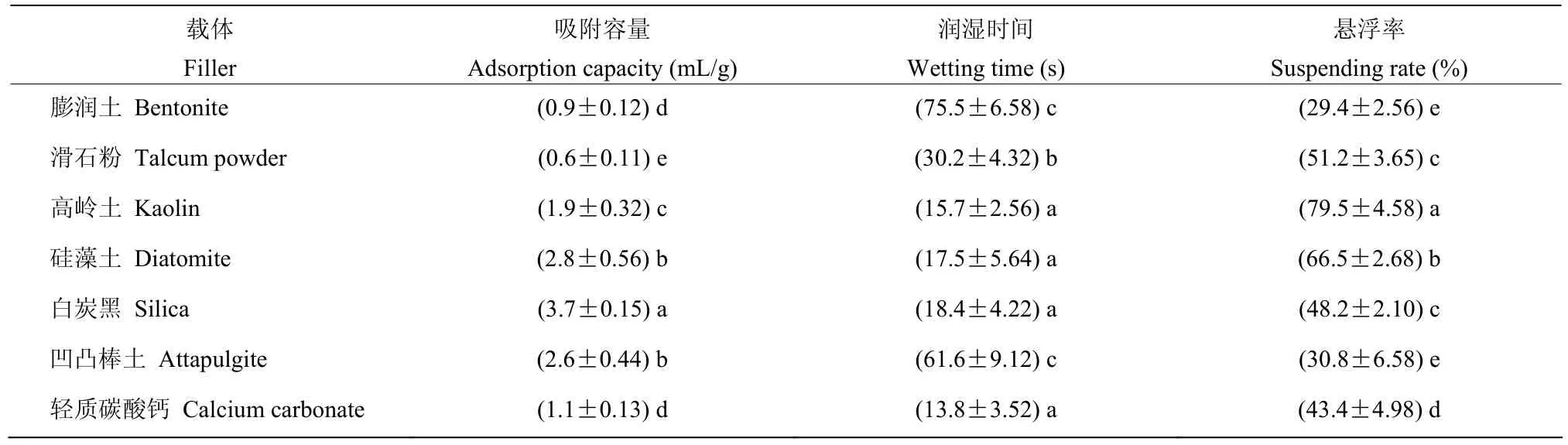
表1 SH-1471 WP 载体筛选结果Table 1 Screening results of SH-1471 WP vector
2.2 润湿剂和分散剂的筛选
将待选润湿剂和分散剂以12%的含量与选定的载体、发酵液混合均匀,喷雾干燥制成可湿性粉剂,检测其润湿时间和悬浮率,结果如表2 所示,以润湿时间为指标,润湿剂中木质素磺酸钠、十二烷基苯磺酸钠(DBS)、洗衣粉及羧甲基纤维素钠(CMC-Na)的润湿时间最短,依次为11.8、12.2、16.8 和17.8 s;分散剂中NNO、木质素磺酸钙及聚乙烯醇(PEG 8000)的润湿时间最短,分别为13.1、15.6 和15.8 s;以悬浮率为指标,NNO 的悬浮率最高,达90.9%,其次为木质素磺酸钠,达84.9%,再次为三聚磷酸钠,达84.8%,十二烷基硫酸钠(SDS)、拉开粉、木质素磺酸钙、皂角粉、洗衣粉和吐温-60 的悬浮率均超过70%,以木质素磺酸钠和羧甲基纤维素钠作为润湿剂时,活菌数最高为2.79×109CFU/g,以NNO 为分散剂时,活菌数最高为2.58×109CFU/g。综合润湿时间、悬浮率和活菌数,选择NNO 作为分散剂、木质素磺酸钠作为润湿剂。
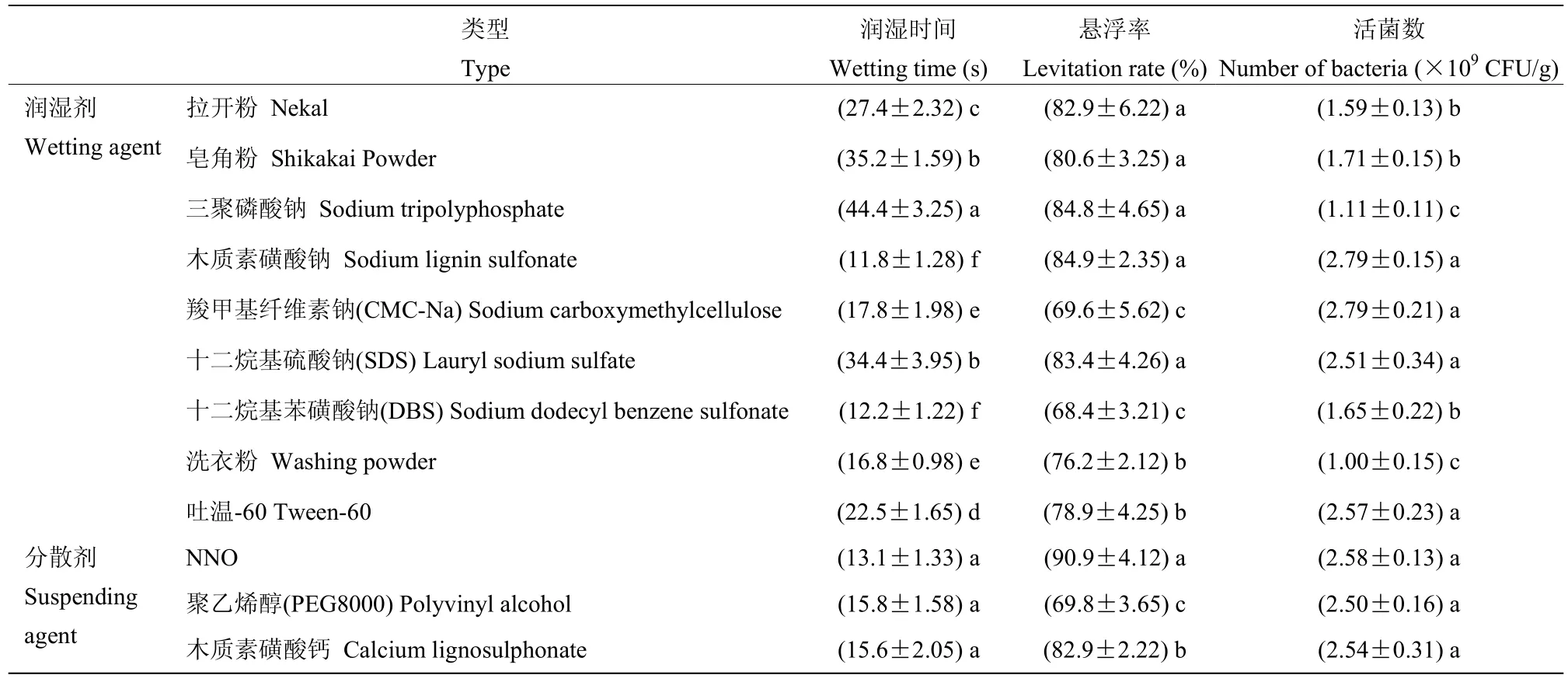
表2 SH-1471 WP 润湿剂、分散剂筛选结果Table 2 Screening results of wetting agent and dispersant for SH-1471 WP
2.3 润湿剂与分散剂配比筛选
由表3 可知,润湿时间随着润湿剂木质素磺酸钠含量增多而降低,悬浮率随着分散剂NNO 的含量降低而降低,其润湿时间最高为12.3 s,已达标准,当木质素纤维素钠:NNO 为1:9 时,润湿时间为12.3 s,悬浮率最高为88.6%,芽胞含量为2.73×109CFU/g;当木质素磺酸钠:NNO 为2:8 时,润湿时间为10.1 s,悬浮率为87.2%,芽胞含量为2.86×109CFU/g。结合润湿时间、悬浮率及芽胞含量结果,故确定木质素磺酸钠:NNO 的比例为2:8。
科文学院拟将新教学楼北区3层及4层的8个多媒体教室的320台电脑开通视频点播系统,以便学生点播优秀的视频课件.为此,在网络中心增加1台视频服务器,并将其命名为Video Destination,通过6类双绞线千兆连接到核心交换机CS6509上,利用OPNET Modeler提供的Video Conferencing业务进行仿真.

表3 润湿剂与分散剂最佳配比筛选结果Table 3 Screening results of optimum ratio of wetting agent and dispersant
2.4 润湿剂和分散剂总用量的筛选
由表4 可知,随着润湿剂和分散剂总用量的增加,贝莱斯芽胞杆菌WP 的润湿时间逐渐变短,当二者总用量仅为2%时,制剂润湿时间为21.6 s,显著高于其他用量,当二者总用量为12%时,润湿时间最短为10.1 s;说明增加润湿剂和分散剂总用量对贝莱斯芽胞杆菌WP 的润湿时间的变短具有促进作用;且随着润湿剂和分散剂总用量的增加,其悬浮率具有明显的提高,当用量为2%时,悬浮率仅为51.4%,当用量提高至18%时,悬浮率达89.9%,表明增加润湿剂和分散剂总用量对其润湿性和悬浮率均有促进作用,但随着润湿剂和分散剂总用量的提高,制剂中芽胞存活率会有一定的损失,总用量为18%时,芽胞含量仅为2.42×109CFU/g,相比低浓度具有一定的损失。结合润湿时间、悬浮率以及芽胞存活率,本试验中选择润湿剂和分散剂总用量为10%,此时贝莱斯芽胞杆菌WP 的润湿时间为10.3 s,悬浮率为88.6%,芽胞含量为2.92×109CFU/g。

表4 润湿剂和分散剂总用量筛选结果Table 4 Screening results of total dosage of wetting agent and dispersant
2.5 稳定剂筛选
结合表5 的试验结果可知,与CK1(不加稳定剂,不热储)和CK2(不加稳定剂,热储)相比,稳定剂的添加,可降低高温胁迫下的芽胞热储损失率,在(54±2)℃下储存7 d 时,与CK2(不加稳定剂,热储7 d)相比,加了稳定剂后贝莱斯芽胞杆菌SH-1471 可湿性粉剂的芽胞损失率均降低,其中以稳定剂2%黄原胶的保护效果最好,可将热储损失率降低至14.01%,当(54±2)℃下储存14 d 时,在添加2%黄原胶作为保护剂,可使热储损失率降低至30.74%。结合生物相容性和热储实验结果,选择黄原胶2%作为贝莱斯芽胞杆菌SH-1471 可湿性粉剂的稳定剂。

表5 SH-1471 WP 稳定剂筛选结果Table 5 Screening results of SH-1471 WP stabilizer
2.6 紫外保护剂筛选
由表6 可知,与CK1(不加紫外保护剂,不照射)和CK2(不加紫外保护剂,照射)相比,紫外保护剂的添加,可降低紫外胁迫下的芽胞存活率,当添加1%的紫外保护剂,在254 nm 紫外灯(20W)距离40 cm处照射12、24 h 后,以1%抗坏血酸(VC)为紫外保护剂时的存活率最高,照射12 h 时存活率为71.43%,照射24 h 时存活率为59.52%,其次为糊精(1%)和海藻酸钠(1%),12 h 的存活率分别为65.31%和38.14%,24 h 的存活率分别为36.73%和4.24%。而十二烷基苯磺酸钠(DBS)的存活率最低。结合紫外保护效果与生物相容性试验结果,选择1%抗坏血酸(VC)作为贝莱斯芽胞杆菌SH-1471 可湿性粉剂的紫外保护剂。
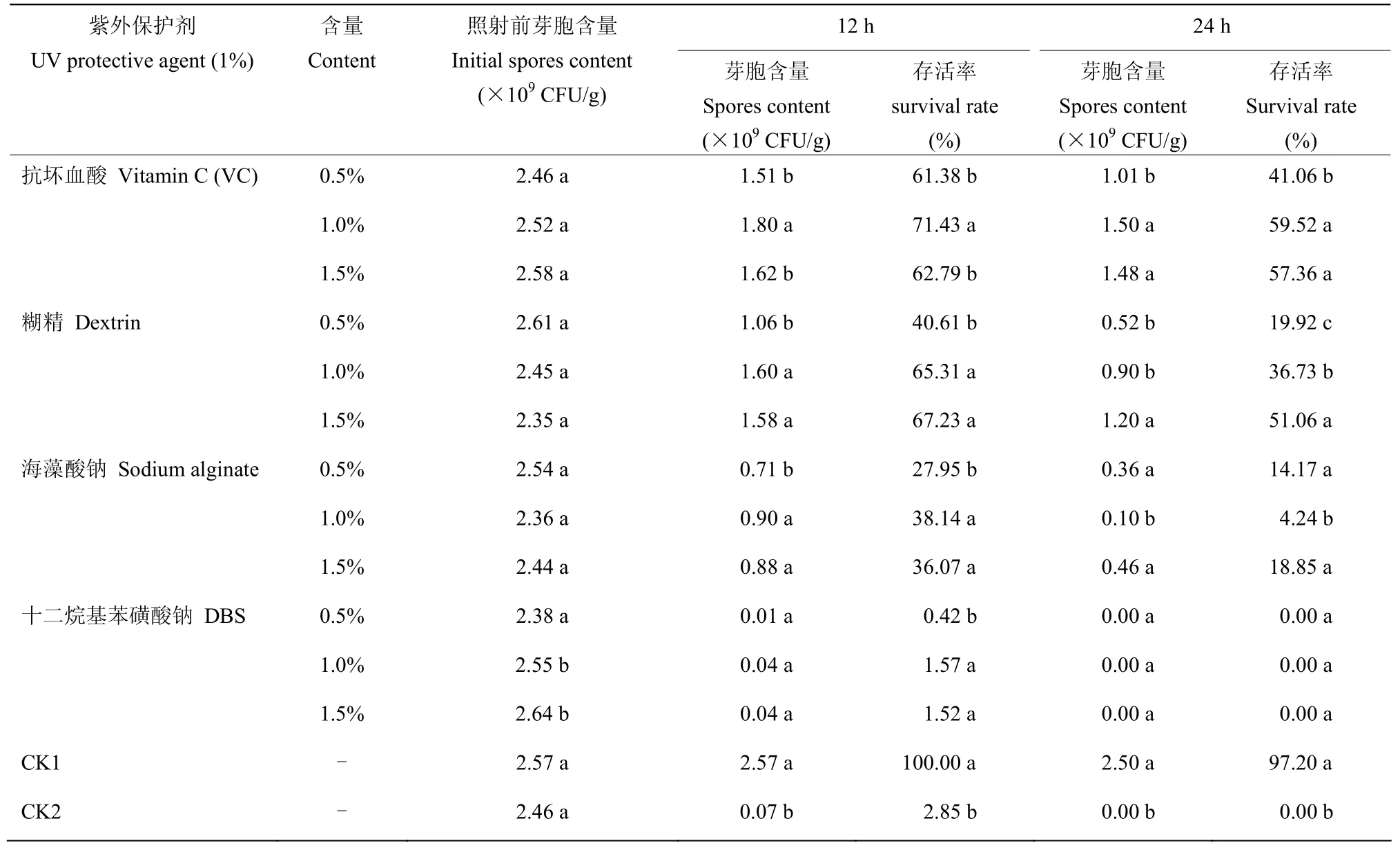
表6 SH-1471 WP 紫外保护剂筛选结果Table 6 Screening results of SH-1471 WP UV protectant
2.7 质量检测
将贝莱斯芽胞杆菌SH-1471 发酵液与筛选所得并粉碎载体、润湿剂、分散剂、稳定剂、紫外保护剂等按优化后的配比同时混合,边搅拌边进行喷雾干燥制得贝莱斯芽胞杆菌SH-1471 WP。对贝莱斯芽胞杆菌SH-1471 WP 进行质量检测结果如表7 所示,根据检测测量值与质量检测标准值,贝莱斯芽胞杆菌SH-1471 WP 细度、润湿时间、悬浮率、干燥减量、pH、活菌数以及杂菌率均符合质量检测标准值,可应用于植物病害的生物防治。

表7 SH-1471 WP 质量检测结果Table 7 SH-1471 WP quality test results
2.8 储藏存活率检测
贝莱斯芽胞杆菌SH-1471 可湿性粉剂经室温4 ℃、25 ℃连续储藏180 d,每10 d 测定依次芽胞存活率,测定结果如图1 所示,贝莱斯芽胞杆菌SH-1471 可湿性粉剂在4 ℃下,180 d 后芽胞存活为87.65%,而在室温25 ℃下储藏180 d 结果表明,其芽胞存活率为82.45%。该结果表明,低温对菌株的存活率影响较小,而高温对菌株的存活率有一定的影响。
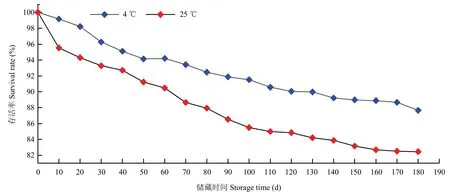
图1 SH-1471 WP 连续180 d 储藏结果Fig.1 SH-1471 WP continuous 180 d storage results
2.9 室内盆栽防效测定
室内盆栽防效实验结果如表8 所示,采用拌土+灌根、拌土和灌根三种方式评价贝莱斯芽胞杆菌SH-1471 可湿性粉剂对番茄枯萎病的防治效果,与CK1(单接病原菌)相比,贝莱斯芽胞杆菌SH-1471 WP 灌根+拌土对番茄枯萎病的防效最好,发病率仅为4.2%,防治效果可达93.7%,防效显著优于3% 多抗霉素WP;其次为拌土,发病率仅为8.6%,防治效果为85.8%;灌根处理下发病率为9.2%,防治效果为83.3%。

表8 SH-1471 WP 盆栽防治效果Table 8 Potting control effect of SH-1471 WP
3 讨论
可湿性粉剂是我国微生物农药的主要剂型,在病虫害绿色防控中发挥越来越大的作用,因其相比于液体制剂和其他固体制剂具有生产成本低,有效成分含量高,湿润性好、易于运输和贮运,且防病范围更广等特点,在生产上得到广泛应用[20]。其通常由载体、润湿剂、悬浮剂、分散剂、稳定剂以及保护剂等组成,并以有效成分含量、悬浮率、润湿时间、干燥减量、细度以及pH 等作为质量检测指标进行产品研发以及工艺优化[21]。
载体在可湿性粉剂中所占比例最大,探究载体与菌株之间的生物相容性是极其重要的。本研究发现,高岭土和硅藻土与菌株的生物相容性最好,显著高于白炭黑、滑石粉等。Chiou 等[22]则发现,以高岭土为载体,可提高芽胞存活率。王剑等[23]和孙丽丽等[24]等[的研究结果与本研究相同,以硅藻土为载体时,制剂芽胞存活率较高。而陈茹等[25]研究则表明,当使用硅藻土为WP 的载体时,其孢子萌发率会受到抑制。由此可知,尽管大部分载体为惰性材料,但不同菌株对同种载体的适应能力不同,且同种载体对不同菌株的生物相容性亦存在差异。因此,菌株与载体的生物相容性测定尤为重要。
悬浮率和润湿时间是评价农药可湿性粉剂质量的重要指标,直接影响制剂的操作便利性和混合均一稳定性[26]。本研究结果发现,木质素磺酸钠可显著缩短制剂的润湿时间,仅为11.8 s,且不对菌株有抑制作用,而十二烷基苯磺酸钠(DBS)的润湿时间为12.2 s,且菌株孢子萌发率大幅下降,表明其对菌株具有一定的毒害作用。相同地,钱一鑫等[27]试验结果十二烷基苯磺酸钠(DBS)可缩短制剂润湿时间至11 s,但对菌株芽胞含量会造成一定的损失。本制剂在加入NNO 作为分散剂时,悬浮率得到显著提高,达90.9%,显著优于张成等[28]的木霉菌TrichodermavirideT069 可湿性粉剂悬浮率(73.04%),以及且显著优于刘盼西等[29]的海洋芽胞杆菌B.marinus可湿性粉剂的悬浮率(73.13%);基于此基础,本研究还进行了润湿剂与分散剂的比例优化和总用量优化,最终确定总用量为10%,比例为2:8 时,以此制剂润湿时间最短,悬浮率最佳,且芽胞含量最高。
稳定剂有利于制剂芽胞含量在长时间内处于稳定状态,紫外保护剂可减少自然条件下紫外线对芽胞造成的不利影响[30]。本研究结果表明,黄原胶(2%)可降低菌株在温度(54±2)℃下储藏的损失率,仅为14.01%,以羧甲基纤维素钠作为稳定剂时,热储损失率高达49.38%。优于李舒雯等[31]以羧甲基纤维素钠作为稳定剂时的内生短短芽胞杆菌B.endophytes可湿性粉剂的芽胞损失率(49%)。表明同一物质对不同菌株的保护机制和保护效果不同,与张正一等[32]和张成等[28]的试验结果类似,本研究以抗坏血酸(VC)(1%)作为紫外保护剂时,可提高菌株在紫外照射下的存活率。贝莱斯芽胞杆菌SH-1471 WP 在25℃下储藏180 d 后的存活率为82.45%,今后可进一步对其配方进行优化,以提高其在室温条件下的储藏稳定性及其环境适应能力。此外,室内盆栽试验结果表明本制剂可有效降低番茄枯萎病的发病率,防效达93.7%,防效高于3%多抗霉素。而罗嫚等[33]的研究表明,咪鲜胺和咯菌腈对番茄枯萎病的防治效果分别为52.5%、53.33%,表明贝莱斯芽胞杆菌WP 对番茄枯萎病具有良好的防治效果。
前期研究表明菌株SH-1471 还具有解磷、固氮等活性,可进一步进行盆栽试验验证其在促进植物生长以及提高作物抗逆性等方面的活性,并结合大田试验验证,探究和挖掘其生防、促生功能,以便发挥其在农业病害防治和作物促生增产中的应用价值。
