螟黄赤眼蜂携带球孢白僵菌防治大豆食心虫
2023-10-21徐文静李启云张正坤
赵 宇,刘 佳,路 杨,隋 丽,徐文静,杜 茜,李启云*,张正坤*
(1.吉林省农业科学院植物保护研究所/吉林省农业微生物重点实验室/农业农村部东北作物有害生物综合治理重点实验室,公主岭 136100;2.吉林省农业科学院大豆研究所,长春 130033)
大豆食心虫LeguminivoraglycinivorellaMatsumura 是大豆生产中的主要害虫,不仅蛀入豆荚和豆粒,导致大豆产量下降,还能够显著影响大豆外观和品质,一般年份虫食率在5%~10%,发生严重年份虫食率高达30%~60%,给我国粮食生产造成巨大的经济损失[1,2]。东北地区是国内大豆的主产区,大豆种植面积和产量连年增加,大豆食心虫的有效防治对保证大豆产量和品质具有重要意义。通过化学杀虫剂熏蒸和喷雾防治大豆食心虫成虫和蛀前幼虫,取得了良好的防治效果[3]。但由于大豆作为主要蛋白质和食用油来源,化学农药对食品安全具有不利影响,并且过量应用会破坏生态环境。生物防治是化学防治的主要替代手段,在提高产品的质量安全水平,增强农产品市场竞争方面发挥了重要作用[4]。
球孢白僵菌Beauveriabassiana和赤眼蜂Trichogramma是大豆食心虫生物防治的重要技术[5]。球孢白僵菌能够寄生大豆食心虫幼虫并形成僵虫,其气生孢子能够继续感染其他幼虫,具有持续防控的作用。而赤眼蜂可寄生大豆食心虫虫卵,使幼虫难以孵化,从而实现防治的目的[6]。但球孢白僵菌不能感染大豆食心虫虫卵,而大豆食心虫孵化即钻蛀,如果不及时用药,防治效果较低;而赤眼蜂作为寄生蜂,不能寄生大豆食心虫幼虫,一旦错过最佳放蜂时间或环境因素就会导致寄生率低,并且对害虫幼虫无法实现控制。
利用害虫天敌如赤眼蜂携带球孢白僵菌实现“精确制导”防治亚洲玉米螟OstriniafurnacalisGuenée[7,8]和水稻二化螟ChilosuppressalisWalker[9]已被证明具有协同增效的防治效果,但利用赤眼蜂携带球孢白僵菌防治大豆食心虫还未见报道。本研究拟筛选对大豆食心虫具有高毒力的球孢白僵菌菌株,并利用螟黄赤眼蜂T.chilonis携带球孢白僵菌分生孢子,进行大豆食心虫的协同增效防控,以期在不增加防治成本的基础上,提高防治效率。
1 材料与方法
1.1 材料
1.1.1 供试菌株 2017 年9 月下旬在吉林省农业科学院大豆研究所试验地(124°82′27′′ E,43°50′45″ N)大豆食心虫蛀荚严重植株下土壤中采集自然发生的大豆食心虫僵虫,分离并鉴定球孢白僵菌菌株,4 ℃保存在沙土管中备用。
1.1.2 供试赤眼蜂 供试螟黄赤眼蜂和赤眼蜂中间寄主柞蚕AntheraeapernyiGuerin-Meneville 卵由公主岭吉农绿色农业高新科技发展有限公司饲养并提供。
1.1.3 供试昆虫 供试昆虫为2017 年秋季在吉林省农业科学院大豆研究所试验地采集的自然脱荚的大豆食心虫老熟幼虫,选取发育整齐一致的幼虫用于球孢白僵菌高毒力菌株的筛选。
供试大豆食心虫虫卵获取方法参考林英等[10]。2018 年8 月初大豆食心虫雌虫盛发期,每天15:00 于大豆试验田网扫大豆食心虫成虫,将搜集的成虫每20 头接入备有清水保鲜的装有5 个顶荚的大豆茎保湿的透明接虫杯。将杯子放入温度(26±1)℃、相对湿度(60±5)%、光周期14L:10D 的环境条件下,24 h 后去除成虫,体视镜下观察计数,将着卵量达到约50 粒的豆荚重新水培并移入1 个新的透明接虫杯用于寄生率测定。
1.1.4 供试大豆品种 大豆品种为矮杆耐密植大豆品种吉密豆3 号,中早熟,株高65 cm~75 cm[11],由吉农高新技术发展股份有限公司选育并提供。
1.2 球孢白僵菌菌种分离及鉴定
将从田间采集的大豆食心虫幼虫僵虫浸泡在70%酒精水溶液(v/v),表面消毒处理30 s,无菌水清洗后的虫体接种于PDA 培养基中,26 ℃暗培养。7~10 d 后待僵虫四周长出真菌孢子后,进行单孢分离并再次接种于PDA 固体培养基中培养。选取与球孢白僵菌菌落生长形态相似的分离物分别进行菌落、孢子及菌丝形态学观察[12]。采用CTAB 法提取各分离物的基因组总DNA,采用真菌通用引物 ITS 1(5′-TCCGTAGGTAGGTGAACCTGCGG-3′)和ITS 4(5′-TCCTCCGCTTATTGATATGC-3′)进行ITS 序列扩增,扩增结果送交吉林省库美生物科技有限公司进行测序。将测序结果提交GenBank 数据库进行比对鉴定[13]。随机选取8 个菌落生长速度较快且产孢量高的球孢白僵菌菌种,分别命名为BbLGNA1~8,在PDA 培养基上扩繁,获得分生孢子进行毒力测定。
1.3 对大豆食心虫高毒力球孢白僵菌菌种筛选
球孢白僵菌菌株的毒力测定采用浸渍法[14]。将供试球孢白僵菌分离物的分生孢子分别配制成浓度为1×107个孢子/mL 的孢子悬液,将田间采集大豆食心虫老熟幼虫,浸泡在孢子悬浮液中约30 s,取出后用无菌滤纸吸干虫体表面多余液体,然后移入放有无菌滤纸的1.5 mL 灭菌离心管中。以无菌水浸渍作为空白对照,26 ℃保湿培养,光周期12L:12D,每天观察记录幼虫死亡情况,待幼虫死亡90%以上时,计算致死中时间(LT50),作为毒力测定依据。每个球孢白僵菌分离物重复3 次,每个重复20 头幼虫。
1.4 助剂及球孢白僵菌对赤眼蜂出蜂量影响及载菌量的测定
参考杨芷等[8]的方法。分别配制无菌水(H2O)、0.1%(w/v)葡萄糖(Glu)、0.1%(w/v)淀粉(SS)、0.1%(w/v)马铃薯葡萄糖(PDS)和0.1%(v/v)吐温-80(T-80)溶液,均匀喷雾于赤眼蜂寄生后的柞蚕卵表面使其润湿即可,然后将柞蚕卵置于球孢白僵菌孢子粉(1×1011个孢子/g)中滚动使其均匀沾菌,同时设置不沾菌赤眼蜂寄生后的柞蚕卵为对照(Control)。将处理后的柞蚕卵放在培养皿中,封口膜封口,在(26±1)℃,RH(60±10)%,光周期14L:10D 的养虫室内培养,每个处理5 次重复,每次重复1 粒柞蚕卵。并且在24 h 后将培养皿放入-20 ℃冰箱,待各处理赤眼蜂全部死亡后,记录赤眼蜂羽化数量。从每个重复中各取两只蜂体分别放入1.5 mL 离心管中,加入100 μL 0.1%(v/v)吐温-80 后振荡混匀,在显微镜下利用血球计数板观察并统计孢子数量,计算每只赤眼蜂载菌量。
1.5 携带球孢白僵菌对赤眼蜂寄生率影响的测定
分别设置载菌赤眼蜂和非载菌赤眼蜂处理。每个处理3 个接虫杯,每个接虫杯中放置5 个豆荚,每个豆荚约50 粒虫卵,每个接虫杯释放5 只羽化12 h 的充分交配的雌蜂。放蜂24 h 后,将带有卵块的豆荚移入新的接虫杯,待孵出幼虫后,统计寄生率。
赤眼蜂寄生率=(卵块卵粒数―幼虫孵化数)/ 卵块卵粒数×100%。
1.6 载菌赤眼蜂对大豆食心虫田间防效
分别设置不防治对照、赤眼蜂处理及载菌赤眼蜂处理,每个处理1 hm2,间隔500 m。试验于2019 年和2020 年在吉林省农安县亿家农村合作社(44°43′27″ N,125°18′48″ E)进行。大豆垄宽63 cm,株距12 cm,播种为穴播,每穴1 株,每年6 月下旬施用底肥,施用量为尿素50 kg/hm2、磷酸二铵100 kg/hm2和氯化钾50 kg/hm2,出苗后进行人工除草等田间管理,不使用化学农药。将湿润的柞蚕卵与球孢白僵菌分生孢子粉混合,每亩300 个被寄生柞蚕卵(寄生螟黄赤眼蜂数量约60~80 头/卵)与0.7 g 利用液固两相发酵培养的球孢白僵菌BbLGNA4 菌株高孢粉(1×1011个孢子/g)混合,90 r/min 摇动5 s,使柞蚕卵表面均匀吸附球孢白僵菌孢子粉,随即放入放蜂球(专利号:ZL 201720555354.1),每个放蜂球100 卵。根据监测结果,分别于2019 年8 月15 日和2020 年8 月17 日进行第一次放蜂,间隔7 d 分别进行第二次放蜂,每次放蜂约20 万头。放蜂时将该放蜂球均匀分散放置于田间地表背光处。9 月末大豆收获前根据罗宝君[3]的方法,采取5 点取样法进行虫食率调查,计算防治效果。
虫食率=(虫食粒数/调查总粒数)×100%。
防治效果=(空白对照虫食率―防治田虫食率)/空白对照虫食率×100%。
1.7 数据统计与分析
采用SPSS 17.0 软件对数据进行描述性统计及方差齐性检测,并通过Duncan 氏方法进行多重比较及显著性分析,利用Graphpad 8.0.2 软件做图。
2 结果与分析
2.1 高毒力球孢白僵菌菌株筛选
从田间采集的大豆食心虫幼虫僵虫体表分离虫生真菌(图1A),随机选取菌落和孢子形态与球孢白僵菌相近的真菌菌落进行单孢分离培养,并进行分子生物学鉴定。在鉴定为球孢白僵菌的菌株中,选择菌落生长速度较快的8 个菌株进行生物学测定。结果表明,菌株BbLGNA1,BbLGNA4 和BbLGNA6 在1×107个孢子/mL 供试浓度下对大豆食心虫老龄幼虫的LT50显著低于其他供试菌株,分别为(6.39±0.16)d,(6.21±0.11)d 和(6.87±0.13)d(图1B)。后续试验选择菌株BbLGNA4 作为赤眼蜂载菌试验的供试菌株。
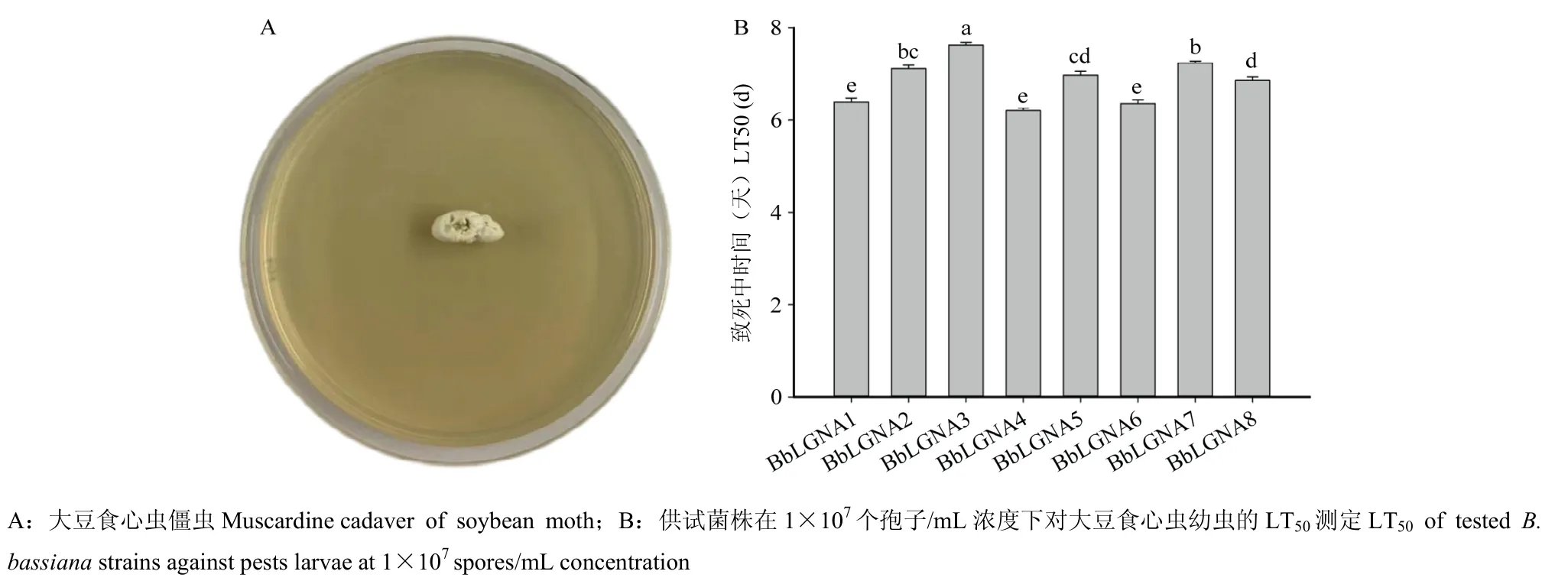
图1 球孢白僵菌对大豆食心虫老龄幼虫的高毒力菌株筛选Fig.1 Screening of high virulence strains of B.bassiana against soybean moth larvae
2.2 载菌赤眼蜂羽化量及载菌量
利用不同助剂进行柞蚕卵附着后,调查24 h 羽化量,结果表明,所有处理及对照羽化量均在60~80 头之间,且差异不显著(P>0.05)(图2),表明助剂及球孢白僵菌对螟黄赤眼蜂羽化无影响。羽化后的螟黄赤眼蜂单头蜂载菌量结果表明,0.1%SS 溶液和0.1% Glu 溶液处理载菌量显著高于其他处理和对照,均达到3.56×104个孢子/蜂以上(表1),在此基础上,我们选择0.1% SS 溶液作为载菌助剂进行后续试验。
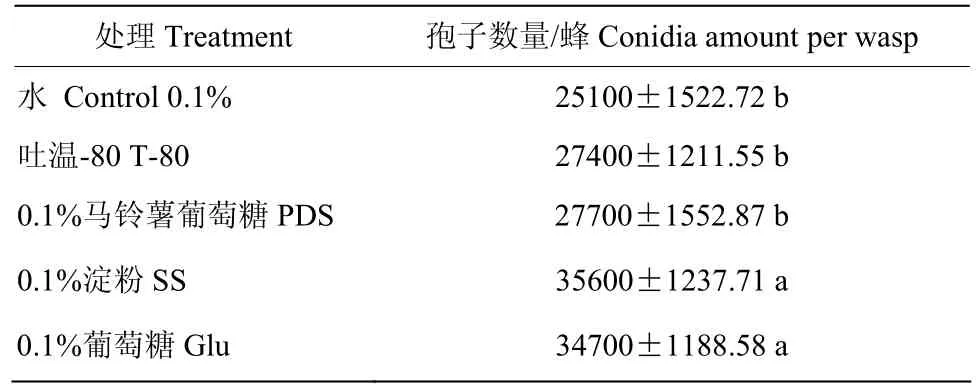
表1 不同助剂处理柞蚕卵后螟黄赤眼蜂载菌量Table 1 Fungal conidia carrying amount of T.chilonis treated by different assistant
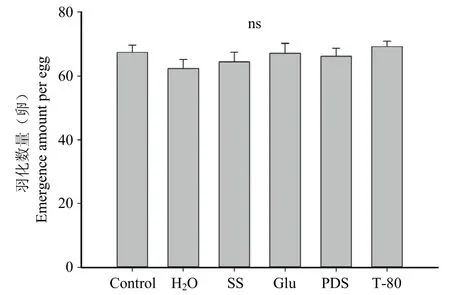
图2 不同助剂和球孢白僵菌对螟黄赤眼蜂羽化的影响Fig.2 Effects of different assistant and B.bassiana on emergence of T.chilonis
2.3 球孢白僵菌对螟黄赤眼蜂寄生率的影响
利用SS 溶液作为载菌助剂处理柞蚕卵羽化的赤眼蜂载菌后,与对照相比,对大豆食心虫卵的寄生率分别为(55.07±3.81)%和(56.80±4.00)%,且差异不显著(F=0.30,p>0.05)。表明球孢白僵菌对螟黄赤眼蜂寄生大豆食心虫虫卵无影响(图3)。
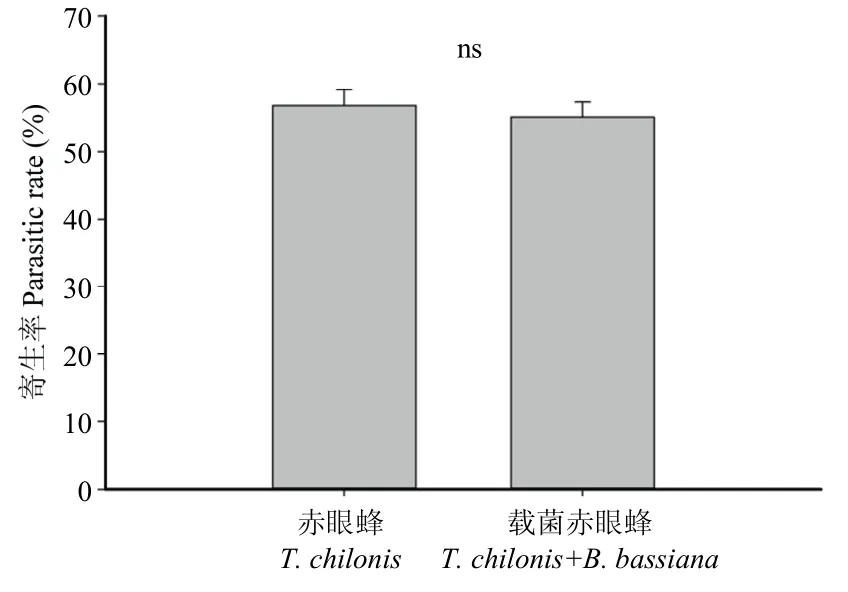
图3 球孢白僵菌对螟黄赤眼蜂寄生率的影响Fig.3 Effect of B.bassiana on parasitic rate of T.chilonis
2.4 载菌赤眼蜂对大豆食心虫田间防效
分别在2019 年和2020 年进行螟黄赤眼蜂载球孢白僵菌防治大豆食心虫的田间防治试验。两年试验结果表明,赤眼蜂和载菌赤眼蜂对大豆食心虫均有较好的防治效果。2019 年对照田虫食率为(24.89±2.74)%,单独使用赤眼蜂防治虫食率为(10.30±1.96)%,而载菌赤眼蜂防治虫食率为(7.36±0.98)%,各处理间差异显著(F=107.50,P<0.05)(图4A);2020 年对照田虫食率为(13.6±1.42)%,单独使用赤眼蜂防治虫食率为(5.92±0.78)%,而载菌赤眼蜂防治虫食率为(4.79±0.88)%。其中,赤眼蜂单独防治和载菌赤眼蜂防治,虫食率显著低于对照田(F=101.12,P<0.05),而前两者之间差异不显著(P>0.05)(图4B)。校正防效计算结果表明,2019 年单独使用赤眼蜂防治效果为58.64%,而载菌赤眼蜂防治效果为70.44%,较单一使用赤眼蜂防治提高11.80%;2020 年单独使用赤眼蜂防治效果为56.44%,而载菌赤眼蜂防治效果为64.75%,较单一使用赤眼蜂防治提高8.31%。
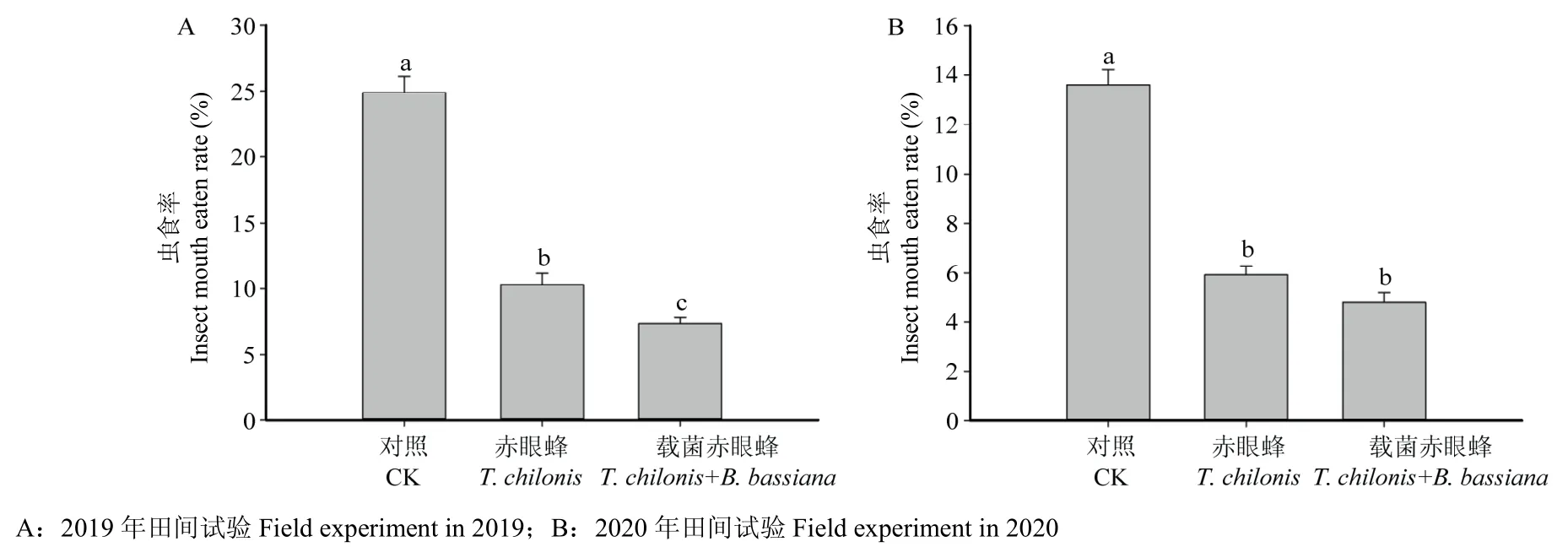
图4 赤眼蜂和载菌赤眼蜂防治大豆食心虫田间试验的虫食率Fig.4 Insect mouth-eaten rate of T.chilonis and T.chilonis carrying B.bassiana in field experiment on controlling soybean moth
3 讨论
球孢白僵菌和赤眼蜂是鳞翅目害虫生物防治的两种重要手段。球孢白僵菌是一类广谱性昆虫病原真菌,具有环境友好、容易大量制备等诸多优点,防治鳞翅目害虫是以幼虫期为主[15,16];而赤眼蜂通过触角上的嗅觉器官主动寻找寄主,并产卵于寄主卵内,幼虫取食卵黄引起寄主死亡,主要防治鳞翅目害虫卵期[17,18]。将二者联合应用,能够实现大豆食心虫卵期和幼虫期的双重防控。但大豆食心虫孵化后很快钻蛀[19],这对赤眼蜂放蜂时间和白僵菌应用时间都提出了很高的要求,并且分别应用该两种技术,会导致材料成本和劳动成本的提高。杨芷等[23]利用松毛虫赤眼蜂携带球孢白僵菌进行亚洲玉米螟的防治,载菌赤眼蜂较单一使用赤眼蜂防效在被害株数、蛀孔数和活虫数等防效指标上分别提高了28.1%,22.8%和24.5%。Wang 等[9]证明稻螟赤眼蜂T.japonicum不仅成功将球孢白僵菌带到水稻二化螟为害处起到协同增效作用,同时球孢白僵菌对稻螟赤眼蜂并无明显不利影响,反而一定程度上促进其发育。本研究中,经过两年田间试验,螟黄赤眼蜂携带球孢白僵菌对大豆食心虫防治效果分别提高了11.80%和8.31%,表明利用螟黄赤眼蜂携带高毒力球孢白僵菌,较单一使用赤眼蜂显著提高防治效果,在实现协同增效的同时,不增加材料成本和劳动成本。
球孢白僵菌是一种虫生真菌,并且赤眼蜂对生物胁迫和非生物胁迫较为敏感,明确球孢白僵菌对赤眼蜂羽化和寄生的影响非常必要[20]。孙光芝等[21]的研究表明赤眼蜂载菌以后,白僵菌对赤眼蜂羽化率无明显影响,也不影响赤眼蜂对玉米螟卵的寄生。Potrich 等[22]的研究也证明白僵菌对赤眼蜂孵化率、雌雄比,以及寄生效果没有影响,并且白僵菌不会干扰寄生雌蜂的寿命。杨芷等[23]也证明球孢白僵菌对松毛虫赤眼蜂羽化、发育等无不良影响。本研究结果也表明,0.1% SS 和0.1% Glu 溶液对螟黄赤眼蜂羽化无影响,进一步研究结果表明以SS 助剂进行载菌对螟黄赤眼蜂寄生大豆食心虫卵无显著影响,并且载菌量也高于其他助剂,达到了3.56 万个孢子/蜂。本实验室前期[23]通过松毛虫赤眼蜂T.dendrolimi可以携带绿色荧光蛋白(Green Fluorescent Protein,GFP)标记的球孢白僵菌孢子至亚洲玉米螟卵表面,并实现对幼虫的感染。徐庆丰等[24]研究表明,2944 个球孢白僵菌孢子即可实现对大豆食心虫幼虫100%感染。因此,螟黄赤眼蜂可以将球孢白僵菌孢子携带至大豆食心虫卵表面,从而感染未被赤眼蜂寄生而孵化的幼虫。
赤眼蜂和球孢白僵菌对防治靶标均具有一定的专一性,因此,选择高效的蜂种和菌种是提高载菌赤眼蜂防效的必要条件。罗宝君[3]比较了松毛虫赤眼蜂、玉米螟赤眼蜂和螟黄赤眼蜂对大豆食心虫的寄生和田间防治效果,证明螟黄赤眼蜂寄生率和防效优于其他两种赤眼蜂;程媛等[25]选用螟黄赤眼蜂和性诱剂联合防治大豆食心虫,其防治效果达到了66.08%;温玄烨等[26]研究表明利用米蛾卵繁育的黏虫赤眼蜂T.leucaniae对大豆食心虫的寄生率和防效要优于螟黄赤眼蜂和玉米螟赤眼蜂。米蛾卵适用于单头蜂寄生,柞蚕卵可以实现赤眼蜂大量寄生,而黏虫赤眼蜂在应用柞蚕卵作为中间寄主进行繁育和田间应用过程中,其寄生率和羽化率较低[27],因此,我们选用寄生率和羽化率高的柞蚕卵作为中间寄主的螟黄赤眼蜂作为应用蜂种。球孢白僵菌同样具有寄主专化性,不同寄主来源的球孢白僵菌由于其遗传分化导致了针对某一害虫毒力的不同[28],而即使来源于同一寄主的菌株在毒力上也表现一定差异[29]。李乐等[12]研究结果表明,来源于同一寄主的球孢白僵菌菌株毒力与生长速度呈正相关性。本研究中,我们从大豆食心虫僵虫分离到了球孢白僵菌分离物,并根据生长速度选取了8 个菌种进行高毒力菌株筛选,获得了3 个高毒力菌株,LT50分别为6.21 d,6.39 d 和6.87 d。陶淑霞等[30]从大豆食心虫僵虫分离到的球孢白僵菌菌株,筛选到了一株高毒力菌株,其LT50为6.54 d。因此,本研究筛选到的3 株高毒力菌株为将来大豆食心虫田间防治提供了生防资源。
综上,本研究筛选到了对大豆食心虫具有高毒力的球孢白僵菌菌株,并证明球孢白僵菌对螟黄赤眼蜂羽化和寄生大豆食心虫虫卵无不利影响,通过高载菌量助剂筛选,创建了螟黄赤眼蜂携带球孢白僵菌协同增效田间防治大豆食心虫技术体系,在不增加防治成本的前提下,提高了防治效果,具有重要的经济、生态和社会意义。
