基于代谢组学分析GSH对霞多丽葡萄酒代谢产物的影响
2023-10-21梁红敏高德艳全巧玲郭亚芸史红梅
梁红敏,高德艳,全巧玲,王 聪,郭亚芸,史红梅,*
(1.山东省葡萄研究院,山东 济南 250100;2.哈密市食品药品检验所,新疆 哈密 839000;3.山东农业工程学院食品科学与工程学院,山东 济南 250100)
还原型谷胱甘肽(reduced glutathione,GSH)是一种重要的抗氧化剂,作为亲核物质直接与反应性亲电试剂结合,维护食品和饮料的氧化稳定性[1-3]。在白葡萄酒生产工艺中添加GSH对保持品种特性和颜色稳定性具有有益影响,GSH已受到世界各国学者和酿酒师的广泛关注。
目前国外关于GSH对葡萄酒影响的研究较多,多见于GSH对葡萄酒酒精发酵阶段及瓶储阶段的影响,而国内研究较少。梁晓芳等[4]发现在干白葡萄酒模拟氧化过程中,GSH可以保护干白葡萄酒的颜色,延长存放时间。Roussis[5]和Ugliano[6]等在葡萄酒瓶储前,采取添加外源食品级GSH的方法可以防止葡萄酒的氧化和香气的丧失,GSH水平在酒的贮藏过程中降低,但它对重要的芳香化合物如酯类、单萜烯类和挥发性硫醇具有保护作用。Webber等[7]在装瓶时加入GSH会减少乙醛的积累,并在贮藏12 个月后保持芳香的复杂性和新鲜度。也有研究表明,在某些条件下GSH这些抗氧化剂可能不能提供预期的保护,甚至破坏白葡萄酒的最终颜色[8]。GSH对葡萄酒中多酚类、芳香类等物质的影响及其作用机制尚不完全明确,对葡萄酒的氧化稳定性的影响也依赖于GSH的使用剂量及添加方式(包括添加时间、添加步骤等)。针对不同的葡萄品种、产品类型和酿造工艺,确定合适的GSH添加时间和用量非常重要,同时也需要综合运用多种分析技术探索GSH对葡萄酒品质影响的机制。
代谢组学是近年来组学领域研究热点之一。Romanini等[9]通过高分辨率质谱进行非靶向代谢组学分析,对瓶装白葡萄酒的氧化程度进行研究,对氧化水平和化合物进行了鉴定。Nikolantonaki等[10]采用感官和超高分辨率质谱代谢组学研究发现,谷胱甘肽对陈年霞多丽葡萄酒氧化稳定性的影响与葡萄酒中含N和S的化合物如氨基酸、芳香族化合物和肽等物质的抗氧化代谢有关系。在白葡萄酒发酵完成后加入GSH对装瓶前陈酿期间的影响尚不清楚,本研究以发酵结束后的霞多丽葡萄酒为研究对象,采用化学参数、广泛靶向代谢组学与挥发性代谢组学相结合的技术研究在低SO2浓度下,不同添加量GSH对葡萄酒主要指标及代谢物的影响,并对其作用机理进行探讨,从而为GSH在白葡萄酒生产中的应用提供理论依据。
1 材料与方法
1.1 材料与试剂
霞多丽白葡萄于2021年10月采自山东蓬莱龙湖农业种植有限公司。
葡萄酒专用酵母(EC1118) 安琪酵母股份有限公司;没食子酸(gallic acid,GAE)标准品、儿茶素标准品、福林-酚试剂 美国Sigma公司;GSH(分析纯,纯度>98%) 北京索莱宝科技有限公司。
1.2 仪器与设备
8890-7000D气相色谱-质谱联用仪 美国安捷伦公司;Nexera X2超高效液相色谱-串联质谱(配有应用生物系统4500 qtrap) 日本岛津公司;雷磁pHS-3C型pH计上海仪电科学仪器股份有限公司;UV5200紫外-可见分光光度计 上海元析仪器有限公司;TDL-5型高速离心机 上海安亭科学仪器厂。
1.3 方法
1.3.1 霞多丽白葡萄酒发酵工艺流程
霞多丽白葡萄除梗、压榨取汁,分别添加0.02 g/L果胶酶,0.08 g/L SO2(焦亚硫酸钾),10~12 ℃澄清24 h,添加0.20 g/L的酵母EC1118于18~20 ℃低温发酵,还原糖低于2 g/L时发酵结束,此时酒的理化指标为乙醇体积分数12.67%,还原糖1.36 g/L,挥发酸0.40 g/L(以乙酸计),总酸5.49 g/L(以酒石酸计),pH值为3.36,游离SO215.78 mg/L。发酵完成15 d后倒罐进行罐储实验。霞多丽白葡萄酒分装于12 L的不锈钢桶中,满罐储存,分别添加0、5、10、15、20、30 mg/L GSH,每组实验做3 个重复。以添加0 mg/L GSH的酒样作为对照,添加完成1 个月后第1次取样,每月取样1 次,共取样5 次。每月测定基本理化指标、总酚、总黄酮等。第5个月另取差异较为明显的处理(T)和对照组酒样(CK)进行广泛靶向代谢组学和挥发性代谢组学分析,每组做3 个生物学重复。
1.3.2 理化指标的测定
挥发酸、总酸、p H 值、游离二氧化硫按照GB/T 15038—2006《葡萄酒、果酒通用分析方法》进行测定;总酚测定参考王华[11]的方法;总类黄酮测定参考Kim等[12]的方法;颜色指数测定参考Webber等[3]的方法,略有修改,即取4 mL酒样,于4 000 r/min离心15 min,吸取上清液在波长420 nm处测定吸光度,以吸光度表示其颜色指数。
1.3.3 广泛靶向代谢组学分析
样品提取流程:从-80 ℃冰箱中取出样品解冻,解冻后涡旋10 s。取混匀后的样品5 mL装于10 mL离心管,将离心管浸入液氮中,待样本完全冻住后将样品置入冻干机中冻干。加入500 μL 70%甲醇内标提取液,涡旋混匀15 min后4 ℃、12 000 r/min离心3 min,取上清液用0.22 μm微孔滤膜过滤,进行液相色谱-串联质谱测定。
液相色谱条件:SB-C18色谱柱(2.1 mm×100 mm,1.8 µm)对目标化合物进行分离,流动相A相为超纯水,加入0.1%甲酸,B相为乙腈,加入0.1%甲酸;流速0.35 mL/min,进样量4 μL,柱温40 ℃;洗脱程序:0~9 min,95%~5% A、5%~95% B;5% A、95% B,维持1 min;10~11.1 min,5%~95% A、95%~5% B;95% A、5% B平衡14 min。
质谱条件:电喷雾离子源温度550 ℃;离子喷雾电压5 500 V(正离子模式)/-4 500 V(负离子模式);离子源气体I,气体II和气帘气分别设置为50、60 psi和25 psi,碰撞诱导电离参数设置为高。分别用10 μmol/L和100 μmol/L聚丙二醇溶液在三重四极杆(triple quadrupole,QQQ)和LIT模式下进行仪器调谐和质量校准。通过优化的去簇电压和碰撞能,完成各个离子对的扫描与检测。代谢物定量是采用QQQ-质谱的多反应监测模式进行分析。
1.3.4 挥发性代谢组学分析
样品提取流程:从-80 ℃冰箱中取出样品,解冻后涡旋混合均匀,每个样本取1 mL于顶空瓶中,分别加入饱和NaCl溶液,10 µL(50 µg/mL)内标溶液(乙酸苄酯),进行全自动顶空固相微萃取(headspace-solid phase microextraction,HS-SPME)。
HS-SPME萃取条件:120 µm DVB/CAR/PDMS萃取头250 ℃老化5 min,样品在60℃恒温条件下,振荡5 min,顶空萃取15 min,250 ℃解吸5 min。萃取头采用SPME Arrow。
DB-5MS毛细管柱(30 m×0.25 mm,0.25 µm);升温程序:40 ℃保持3.5 min,以10 ℃/min升至100 ℃,再以7 ℃/min升至180 ℃,最后以25 ℃/min升至280 ℃,保持5 min。流速1.2 mL/min,进样口温度250 ℃,不分流进样,溶剂延迟3.5 min,载气为高纯氦气(纯度不小于99.999%)。电子电离源;电子能量70 eV;离子源温度230 ℃;四极杆温度150 ℃;质谱接口温度280 ℃;扫描方式为选择离子检测模式,定性定量离子精准扫描(GB 23200.8—2016《水果和蔬菜中500 种农药及相关化学品残留量的测定 气相色谱-质谱法》)。
1.4 数据处理
采用SPSS 22.0及Origin 2021软件进行数据处理与分析。所有实验均重复3 次,结果以±s表示。采用Waller-Duncan事后检验对数据进行显著性分析,P<0.05,差异显著。采用R语言软件(https://www.r-project.org/)对鉴定出的代谢产物进行主成分分析(principal component analysis,PCA)以及正交偏最小二乘判别分析(orthogonal partial least squares-discriminant analysis,OPLS-DA)。根据获得变量重要性投影(variable importance in projection,VIP),结合单变量分析的P值或差异倍数(fold change,FC)进一步筛选差异代谢物(significant changed metabolites,SCMs),然后将差异代谢物通过代谢通路数据库京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)(www.genome.jp/kegg)进行分析。
2 结果与分析
2.1 GSH添加量对霞多丽葡萄酒贮藏期间理化指标影响
如表1所示,随着贮藏时间的延长,各组酒样挥发酸含量略有升高,总酸含量降低,添加GSH组酒样与对照组相比,挥发酸含量无显著差异,总酸含量与对照相比略微降低,这可能是因为葡萄酒的酸类主要由有机酸组成,添加GSH后,GSH能与酒中的有机酸发生反应,导致部分酸含量降低,或者能够抑制某些醇类和醛类氧化成酸[4]。pH值在贮藏过程中变化不大,而且不随GSH添加量的变化有明显差异。
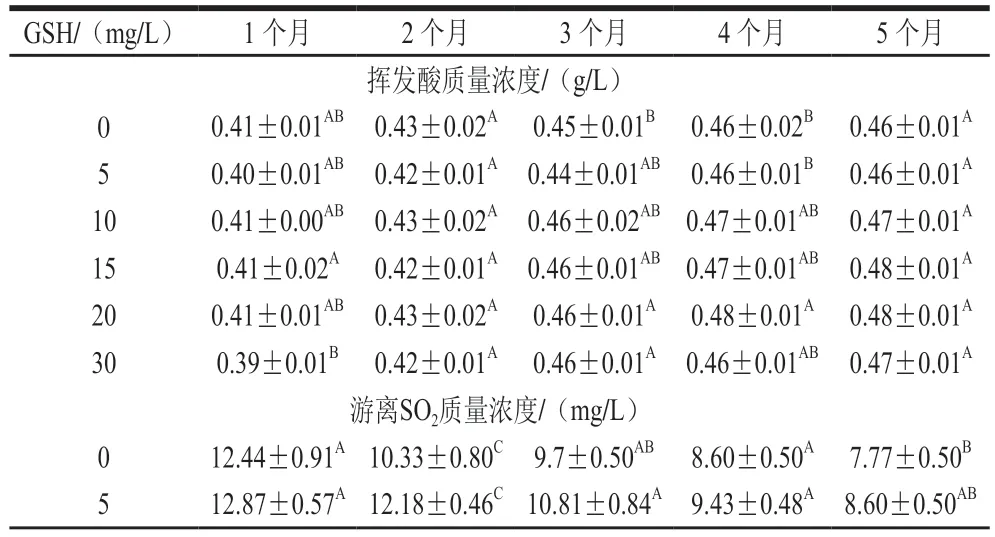
表1 GSH对霞多丽葡萄酒贮藏期间理化指标的影响Table 1 Effect of GSH on physicochemical indexes of Chardonnay wine during storage
SO2与GSH之间存在协同作用,而且在酿造酒过程中添加GSH的步骤不同,可能造成不同的影响[1,13]。由表1可知,在贮藏过程中,游离SO2含量逐渐降低,添加GSH能够延缓SO2含量的下降,贮藏5 个月后,添加20 mg/L GSH的酒样SO2含量最高。有研究表明在起泡酒的基酒中与成品起泡酒中添加GSH,游离SO2的变化不同,在基酒中添加GSH,游离SO2含量比较稳定,而在成品酒中GSH有保护游离SO2的作用[7]。因此,GSH对SO2的作用与GSH添加时间有关系,这可能与酒所处环境的稳定性有关,环境的稳定性影响酒中的溶解氧水平,进而影响GSH和SO2的协同作用[3]。
随着贮藏时间的延长,各组总酚含量、类黄酮含量逐渐升高,添加GSH的酒样总酚含量比对照组高,而总类黄酮含量没有明显差异,在第5个月时,添加30 mg/L GSH的酒样总酚含量最高。多酚含量的变化与Vaimakis[14]和Xu Junnan[15]等研究结果一致,在贮藏过程中酚类化合物的氧化有2 种即酶促氧化和非酶促氧化,贮藏期间谷胱甘肽倾向于还原环境,可以在很大程度上抑制非酶促氧化,GSH与多酚生成的邻醌类化合物发生反应,形成谷胱甘酰咖啡酰酒石酸,其具有邻二羟基苯酚结构能被测量为总酚,这可能是添加谷胱甘肽能提高总酚含量的主要原因[7,14]。
根据颜色指数的数据变化分析,不同添加量GSH都有助于防止霞多丽白葡萄酒氧化褐变,添加20 mg/L GSH的酒样颜色指数在第5个月最低。GSH防止褐变的作用主要与它和邻醌类化合物的反应性有关,邻醌类化合物是酚类化合物氧化的产物[16],其化学性质不稳定,导致邻醌类化合物之间或与蛋白质、氨基酸、酚类化合物等容易发生聚合[17],这些聚合反应可以产生深色聚合物,并导致果酒褐变。有研究表明添加30 mg/L GSH,会引起颜色加深,原因是多余的GSH可能与羰基化合物反应形成加合物,这些加合物又可能会反应形成深色聚合物,但这仍然是一个假设,需要进一步的研究证实[7]。在本研究中,添加30 mg/L GSH的酒样颜色指数低于对照组,与前人的研究结果不一致[7,14],也可能是因为装瓶之前贮藏期5 个月时间较短引起的。
2.2 GSH对霞多丽葡萄酒贮藏期间非挥发性代谢物的影响
2.2.1 对照组和GSH组样品代谢组成分总体分析
贮藏5 个月后,添加20 mg/L GSH的酒样颜色指数最低,选择添加20 mg/L GSH的酒样处理组(T)与对照组(CK)进行代谢组学分析。首先采用超高效液相色谱-串联质谱广泛靶向代谢组学技术,通过与公共数据库的串联质谱谱图信息以及MetWare自建代谢物数据库的标品进行比对,对CK组酒样与T组样品中的初生和次级代谢物进行鉴定,一共鉴定出693 种代谢物,其中氨基酸及其衍生物112 种、酚酸145 种、核苷酸及其衍生物42 种、有机酸91 种、脂质46 种、黄酮78 种、木质素和香豆素12 种、生物碱73 种、其他代谢物94 种。对样本进行PCA,了解样本间总体代谢差异及组内变异情况,PCA结果如图1a所示,添加GSH的样品主要分布在PC1的正半轴上,而对照组样品在PC1的负半轴上,表明这2 组样本在横坐标方向呈现分离,从总体上能反映出添加GSH组样本与对照组之间存在代谢物差异。根据OPLS-DA模型分析代谢组数据,绘制各分组的得分图,进一步展示各个分组之间的差异。如图1b所示,对照组和添加GSH组3 个重复数据点分别位于置信区间的左侧和右侧,表明这2 组样本能够被明显区分效果,组间存在代谢差异。对OPLS-DA模型进行验证,预测参数R2Y、Q2值大小分别为1、0.786,均大于0.5,模型具有良好的预测能力,也不存在过拟合现象。

图1 样品代谢组PCA(a)及OPLS-DA(b)图Fig.1 PCA (a) and OPLS-DA (b) plots of non-volatile metabolites in wine samples
2.2.2 差异代谢物筛选与分析
根据筛选标准VIP大于1.0和FC不小于1.4筛选不同的代谢物,总共筛选出33 种差异代谢物质,占总代谢物种类的5.48%,说明霞多丽葡萄酒发酵结束后在罐内储存期间,添加20 mg/L GSH对非挥发性代谢物的变化具有一定影响,但筛选出差异代谢物质的种类较少。有17 种代谢物在添加20 mg/L GSH后相对含量下降,包括黄酮4 种、酚酸类1 种、生物碱3 种、有机酸1 种、脂质3 种、氨基酸及其衍生物1 种、有机酸酯1 种、芪类1 种以及糖类物质2 种;共有16 种代谢物质相对含量增加,包括黄酮1 种、酚酸类5 种、香豆素1 种、生物碱5 种以及氨基酸及其衍生物4 种,其中黄酮类、脂质以及生物碱类化合物显著差异代谢物下调比例较高,酚酸类、生物碱类以及氨基酸及其衍生物差异代谢物上调比例较高(图2)。
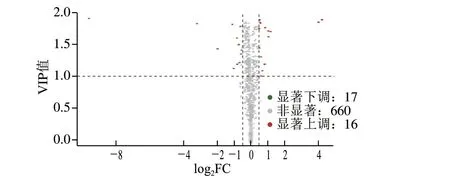
图2 差异代谢物火山图Fig.2 Volcano plot of significantly differential metabolites
VIP值大于1.5的物质中,按照VIP值从大到小排序依次为甘氨酰色氨酸、甲氧基吲哚乙酸、乳二糖、吲哚-3-乳酸、4’-羟基-5,7-二甲氧基黄烷酮、1-甲氧基-吲哚-3-乙酰胺、川陈皮素(5,6,7,8,3’,4’-六甲氧基黄酮)、L-吖啶-2-羧酸、氮杂环丁烷-2-羧酸、邻苯二甲酸二异丁酯、色醇、N-乙酰-β-丙氨酸、吲哚-2-甲酸、3-氨基甲酰-1-甲基氧化吡啶、γ-亚麻酸、橘皮素(4’,5,6,7,8-五甲氧基黄酮)、13-甲基十四烷酸、苄基水杨酸、没食子儿茶素,这19 种物质中,甘氨酰色氨酸属于氨基酸类物质,对整个模型的贡献率最大,其他物质依次递减。根据代谢物定量信息发生的差异倍数,筛选出差异倍数前20的代谢物,绘制柱状图,有10 种上调和10 种下调代谢物(图3)。

图3 差异代谢物柱状图Fig.3 Top 20 significantly differential metabolites
酚酸类化合物主要包括对羟基苯甲酸以及对羟基苯丙烯酸的衍生物,它可与糖、醇、有机酸等结合形成酯类化合物。羟基肉桂酸类物质又称羟基苯丙烯酸类酚酸,包括咖啡酸、香豆酸、阿魏酸等,它们是白葡萄酒中含量较多的酚酸类物质,容易发生氧化褐变,从而导致颜色和香气的丧失,降低白葡萄酒的质量[18]。白葡萄酒添加20 mg/L GSH,贮藏5 个月后,酚酸类物质中没食子酸丙酯(propyl gallate,PG)、苄基水杨酸、乙酸丁香酚酯等得到了积累,GSH保护这些酚酸类物质不被氧化,其中PG具有清除自由基、阻止生物膜多种不饱和脂肪酸过氧化以及保护抗氧化酶活性的作用,还对各种细胞如肺癌细胞等有抗增殖作用,PG的抗增殖作用与活性氧和谷胱甘肽水平有关[19]。白葡萄酒中咖啡酸、香豆酸和阿魏酸的相对含量没有明显差异,这与Panero[1]和Webber[7]等的研究结果一致。
黄酮类物质是葡萄酒中重要的一类酚类化合物,与葡萄酒的苦味和色泽密切相关[20-21]。有研究表明白葡萄酒陈酿过程中的褐变也可能与酒中存在的黄烷醇类化合物如儿茶素和表儿茶素有关[22]。Webber等[7]发现在起泡酒酿造的葡萄酒基酒中添加GSH后,儿茶素和表儿茶素的含量与对照组相比没有变化,颜色指数也没有变化。徐俊南[23]研究发现在苹果酒中添加GSH和接种GSH预培养的酿酒酵母能显著降低儿茶素的含量。在本研究中,黄烷-3-醇类物质如总儿茶素水平没有显著差异(P>0.05),没食子儿茶素、表儿茶素-4’-O-β-D-葡萄糖苷等相对含量下降。黄烷-3-醇类会在含有醛基物质的介导作用下参与聚合反应,如乙醛、乙醛酸等。乙醛、乙醛酸能通过异构和质子化形成半缩醛类物质,这种物质带有亲电性,能够攻击黄烷醇类C6或C8位的碳原子,然后脱水形成带黄烷醇的碳正离子,这些带正电的碳原子进一步攻击其他半缩醛分子的C6或C8位,形成聚合黄烷醇类或者花色苷类物质,聚合黄烷醇类可以通过脱水氧化形成呫吨鎓,此反应被认为是引起葡萄酒尤其是白葡萄酒发生颜色褐变的原因之一[24],添加20 mg/L GSH酒样中没食子儿茶素表达量下调,证明此物质很有可能与GSH防止白葡萄酒的氧化褐变有关。另外,黄酮类物质中川陈皮素、橘皮素、3,5,6,7,8,3’,4’-七甲氧基黄酮的相对含量下降,由于黄酮类物质属于有色多酚,这些物质含量的下降,也许与GSH能够延缓颜色褐变有关[25],其原理需要进一步的研究。
在检测到的46 种脂质代谢物包括游离脂肪酸、甘油酯、溶血磷脂酰胆碱和鞘酯中,3 种游离脂肪酸(γ-亚麻酸、13-甲基十四烷酸、顺-10-十五碳烯酸)明显下调。脂肪酸在芳香物质合成中起重要作用,游离脂肪酸的降低可能与酒中一些香气成分的形成有关[26-27]。氨基酸与葡萄酒的褐变密切相关,因为它参与美拉德反应,美拉德反应是氨基化合物(氨基酸或蛋白质)与还原糖反应形成棕色或者黑色的大分子物质,导致酒的非酶褐变。氨基酸负责葡萄酒中一些典型香气或陈年香气的产生,这与美拉德反应有关[28]。氨基酸中甘氨酰色氨酸、3,4-二羟基-L-苯丙氨酸、3-硝基-L-酪氨酸、3-氰基-L-丙氨酸发生上调,N-乙酰-β-丙氨酸下调,上调的比例显著高于下调的比例,说明GSH对酒中的氨基酸具有保护作用,因而可能会降低因氨基酸引起的非酶褐变。
2.3 GSH对霞多丽葡萄酒贮藏期间挥发性物质代谢物的影响
采用新型HS-SPME Arrow与气相色谱-质谱技术联用,对添加GSH前后酒的挥发性代谢物质进行鉴定及差异分析,一共检测到816 种代谢物,OPLS-DA模型得分图见图4,组间存在一定的代谢差异,对OPLS-DA模型进行验证,预测参数R2Y、Q2值分别为0.994、0.749,均大于0.5,表明模型具有良好的预测能力,也不存在过拟合现象。根据筛选标准VIP值大于1.0和FC不小于1.4筛选不同的代谢物,总共筛选出22 种差异代谢物质,只占代谢物总量的2.70%,说明添加20 mg/L GSH对霞多丽白葡萄酒在装瓶之前贮藏期间的挥发性物质总体影响不大。在这22 种差异代谢物中,有3 种物质下调,19 种物质上调,即有3 种挥发性物质添加20 mg/L GSH后相对含量下降,包括1 种酯类(顺式-6-壬烯-1-醇乙酸酯)、1 种醛类(棕榈醛)、1 种烃类物质(2,6-二甲基癸烷);共有19 种挥发性物质相对含量增加,包括4 种酯类(乙酸二乙氧基甲酯、1’-乙酰氧基茶酚乙酸酯、十五烷酸乙酯、邻苯二甲酸二甲酯)、5 种萜类(惕各酸香茅酯、[2R-(2α,4α,8αβ)]-1,2,3,4,4α,5,6,8α-八氢-α,α,4α,8-四甲基-2-萘甲醇、1-亚甲基-4-(1-甲基乙烯基)-环己烷、乙酸二氢香芹酯、(1R,4aR,7R,8αR)-7-(2-羟基丙烷-2-基)-1,4α-二甲基十氢萘-1-醇)、3 种芳烃类(苯乙烯、1,1’-[氧双(亚甲基)]双苯、α-甲基苯乙烯)、2 种酮类(1,2,3,5,6,7-六氢-1,1,2,3,3-五甲基-4H-茚满-4-酮、3-氯-2,4-戊二酮)、2 种烃类(3-乙基-2-甲基-1,3-己二烯、2,6-二甲基癸烷)、2 种酸类(对甲基苯乙酸、4-羟基-苯丙酸)以及1 种杂环类物质(苯并呋喃),与对照组相比,添加20 mg/L GSH白葡萄酒中差异挥发性物质上调的物质种类明显高于下调的物质种类,其中酯类、萜烯类和芳烃类为差异个数最多的3 类成分,表明添加20 mg/L GSH对白葡萄酒的挥发性物质如酯类、萜烯类、芳烃类等具有保护作用。之前的研究也表明在葡萄酒的陈酿过程中添加GSH对香气有保护作用,尤其是酯类、萜烯类以及挥发性硫醇类物质[29]。酯类物质是葡萄酒中主要的呈香物质,它们具有果香和花香,萜烯类物质赋予葡萄酒的品种香气,具有生理活性,对身体健康大有好处但萜烯类物质容易氧化。GSH能够保护葡萄酒的芳香物质,可能与它含有游离的—SH组分有关,—SH结构具有独特的氧化还原和亲核性质,还具有清除自由基和过氧化物的作用[30-31]。
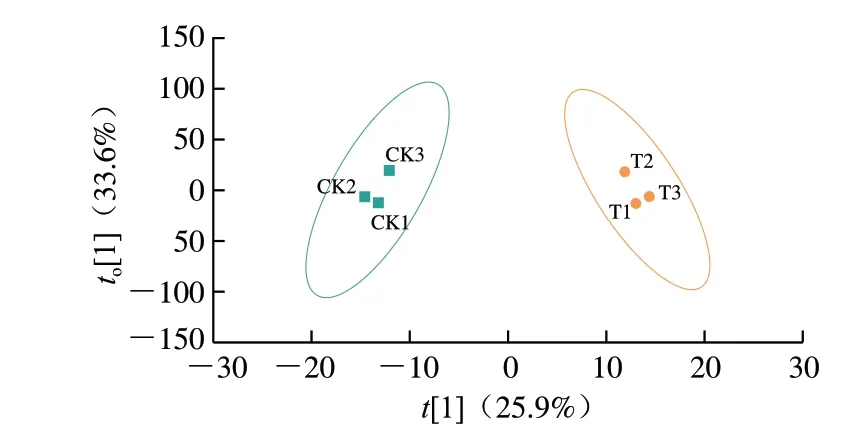
图4 样品代谢组OPLS-DA图Fig.4 OPLS-DA plot of volatile metabolites in wine samples
2.4 关键非挥发性代谢物对霞多丽葡萄酒挥发性代谢物的影响
葡萄酒中主要有非挥发性成分和挥发性成分,这些成分对其风味和香气起着重要的作用。非挥发性代谢物(多酚类化合物、氨基酸、脂肪酸、糖等)和挥发性代谢物(酯类、萜烯类、醇类等)之间的相互作用会影响葡萄酒的感官和化学性质。将33 种非挥发性差异代谢物进行KEGG注释和通路富集分析发现,有10 种被注释到14 条代谢途径中,如图5所示。添加20 mg/L GSH的酒样游离脂肪酸γ-亚麻酸参与不饱和脂肪酸的生物合成途径且在白葡萄酒中下调表达,另外2 种游离脂肪酸(13-甲基十四烷酸、顺-10-十五碳烯酸)相对含量降低。脂肪酸在脂氧合酶、氢过氧化物裂解酶和乙醇脱氢酶的催化作用下形成醛类和醇类,并且它们进一步转化形成相应的酯[26]。氨基酸类中的差异代谢物质N-乙酰-β-丙氨酸参与β-丙氨酸代谢通路且下调表达,这可能与酒中挥发性酯类和酸类的生成有关。一些酚酸类物质在葡萄酒中会抑制酯类物质的挥发,将香气化合物保留在葡萄酒基质中,从而有利于酒液中酯类物质的保留,使得酒体整体香气强度和品质提高[32-33]。添加20 mg/L GSH的酒样酚酸类物质的上调比例较高,其中PG、苄基水杨酸、乙酸丁香酚酯等得到了积累,这些酚酸类物质的对香气的作用还需进一步的研究验证。

图5 不同差异非挥发性代谢产物途径的富集分析Fig.5 Enrichment analysis of differential nonvolatile metabolite pathways
3 结 论
发酵结束后的霞多丽葡萄酒在贮藏期间,随着贮藏时间的延长,各组酒样挥发酸含量略有升高,总酚、类黄酮含量升高、颜色指数上升,总酸、游离SO2含量降低,pH值基本不变;添加GSH对葡萄酒挥发酸、总酸及pH值无显著影响,总酚、类黄酮含量发生变化。不同添加量GSH都能够延缓SO2含量的下降而且都有防止霞多丽葡萄酒氧化褐变的作用,添加20 mg/L GSH的酒样颜色指数最低,防止霞多丽葡萄酒氧化褐变效果最好。
采用广泛靶向代谢组学与挥发性代谢组学分析添加20 mg/L GSH前后霞多丽白葡萄酒非挥发性和挥发性代谢物的变化,一共检测出693 种非挥发性代谢物和816 种挥发性代谢物,分别筛选出33 种重要的非挥发性差异代谢物和22 种挥发性差异代谢物。GSH的添加使差异物质中酚酸类上调种类较多,黄酮类下调种类较多,脂肪酸类物质都下调、除N-乙酰-β-丙氨酸外,其他氨基酸类物质都发生上调。GSH对葡萄酒的酯类、萜烯类、芳烃类具有保护作用。进一步分析说明了葡萄酒中一些酚酸类、脂肪酸以及氨基酸类物质可能对酒的挥发性成分有着重要影响。本研究结果为GSH在白葡萄酒中的应用以及对代谢物的形成机制提供了新的理论依据。
