基于微生物菌群调控的枯草芽孢杆菌改善低盐发酵鱼露品质作用机制
2023-10-21李文静李春生杨大俏王悦齐陈胜军吴燕燕李来好
李 琰,李文静,李春生*,杨大俏,王悦齐,王 迪,陈胜军,吴燕燕,李来好*
(1.中国海洋大学食品科学与工程学院,山东 青岛 266003;2.中国水产科学研究院南海水产研究所,农业农村部水产品加工重点实验室,国家水产品加工技术研发中心,广东 广州 510300;3.三亚热带水产研究院,海南省深远海渔业资源高效利用与加工重点实验室,海南 三亚 572018)
鱼露是一种以低值海捕鱼类为主要原料,经长时间自然发酵制得的水产调味品[1]。鱼露风味独特,营养丰富,是东南亚地区和我国南方沿海一带最受欢迎的调味品之一。为抑制腐败微生物的生长和代谢,传统的鱼露发酵工艺通常采用高盐盐渍(加盐量为25%~30%)的发酵方式[2]。在传统发酵鱼露发酵过程中,耐盐微生物(主要是耐盐细菌)通过其复杂的生化代谢途径产生各种代谢产物,进而产生鱼露独特的风味。然而,由于高盐对微生物代谢的抑制作用,依靠自然发酵过程促使鱼露形成独特风味所需要的时间过长,通常需要1~3 a,而且品质易受发酵环境影响而不稳定,极大地限制了鱼露产业的发展[3]。因此,如何缩短鱼露发酵周期是目前我国鱼露产业亟待解决的难题。
低盐发酵是目前快速发酵鱼露常用的方式,而且低盐鱼露产品符合现代低盐健康饮食的理念。然而,由于加盐量较低,无法有效抑制腐败微生物的生长,鱼露容易腐败变质,因此需要添加合适的微生物发酵剂。目前鱼露微生物发酵剂多选用高产蛋白酶的菌株,主要包括枝芽孢杆菌属(Virgibacillus)[4-5]、动性球菌属(Planococcus)[6]、青霉菌属(Penicillium)[7]、嗜盐杆菌属(Halobacterium)[8]等。但是多数菌株产蛋白酶能力低,特别是在高盐环境下存在蛋白酶易失活等问题,限制了其在鱼露产业中的应用。此外,发酵菌株的添加能够改变发酵微环境,影响微生物菌群结构,但是目前大多研究集中在加菌发酵对鱼露品质的影响,而忽略了对发酵过程发酵菌株的监测以及加菌后对微生物菌群结构的影响[9-10],难以确定鱼露品质的改善机制。
课题组前期从传统发酵鱼露中筛选得到1 株高产蛋白酶的菌株枯草芽孢杆菌(Bacillus subtilis)B-2,该菌具有很强的耐盐性并在高盐条件下具有较稳定的产蛋白酶能力[11],具有改善低盐鱼露品质的应用潜力。因此,本研究以B.subtilisB-2为鱼露发酵剂,研究加菌发酵对低盐鱼露发酵过程中微生物菌群、生物胺和氨基酸态氮(amino acid nitrogen,AAN)的影响,通过构建相关性网络图,进一步阐述B.subtilisB-2加菌发酵对低盐发酵鱼露品质的影响机制,以期为我国传统发酵鱼露的提质增效提供重要理论依据和技术支撑。
1 材料与方法
1.1 材料与试剂
B.subtilisB-2为实验室保存菌株,分离自汕头鱼露厂有限公司的传统鱼露发酵液[11];冰鲜蓝圆鲹 广州市华润万家(客村店);FastDNA®Spin Kit for Soil试剂盒美国MP Biomedicals公司。
1.2 仪器与设备
809 Titrando型自动点位滴定仪 瑞士万通公司;L C-2 0 A D 高效液相色谱仪 日本岛津公司;NanoDrop2000超微量分光光度计 美国NanoDrop公司;3 K 3 0 台式高速冷冻离心机 德国S i g m a 公司;Mastercycler nexus型聚合酶链式反应(polymerase chain reaction,PCR)仪 德国艾本德公司。
1.3 方法
1.3.1 蓝圆鲹鱼露的制备
将冰鲜蓝圆鲹用绞肉机绞碎,按照18%(m/m)的比例加入食用盐,混匀后均分成两组备用。将菌株B.subtilisB-2培养3 d,于4 ℃、12 000×g离心10 min,用0.85%无菌生理盐水重悬,将菌体按106CFU/g的终浓度加入到其中一组原料中,搅拌均匀,作为低盐加菌发酵组(B)。向另一组原料中加入相同体积的无菌生理盐水用于鱼露的自然发酵,作为低盐自然发酵组(C)。将混匀的两组原料放入玻璃发酵罐中,用8 层纱布覆盖,每5 d搅拌一次,在35 ℃自然发酵45 d。发酵前取鱼糜(B0和C0)用于微生物菌群分析。在发酵5(B5和C5)、10(B10和C10)、15(B15和C15)、30(B30和C30)、45 d(B45和C45)后分别取鱼露发酵液,于4 ℃、12 000×g离心15 min,上清液用于AAN和生物胺的测定,下层菌体沉淀用于微生物菌群分析。
1.3.2 生物胺含量的测定
取1.0 g鱼露发酵上清液,加入3.0 mL的HCl溶液(0.1 mol/L)混匀,4 ℃、8 000 r/min离心10 min,取上清液定容到5.0 mL,制成生物胺提取液。取1.0 mL生物胺提取液,加入1.5 mL碳酸盐缓冲液(pH 11.0),加入1.0 mL DNS-Cl的丙酮溶液(10 g/L),在40 ℃水浴锅中避光反应1 h。加入0.20 mL脯氨酸溶液(100 g/L)混匀,室温反应1 h后,加入3.0 mL正庚烷混匀。待液体分层后取1.0 mL上层液,氮气吹干,用1.0 mL色谱级甲醇溶解,微滤(0.22 μm)后备用。利用LC-20AD高效液相色谱仪检测样品中生物胺含量,色谱柱为反相色谱柱ChromCoreTMC18(4.6 mm×250 mm,5 μm),柱温30 ℃,将55%甲醇溶液作为流动相平衡色谱柱,设置进样体积为20.0 μL。紫外检测波长254 nm,随后以0.8 mL/min的流速进行梯度洗脱,洗脱程序参考Zhao Yue等[12]的方法。根据8 种生物胺的保留时间和峰面积,对鱼露中的生物胺进行定量分析。
1.3.3 AAN的测定
参照文献[13]的电位滴定法并稍作修改。取1.0 mL鱼露发酵上清液,用超纯水定容至100 mL,混匀备用。使用809 Titrando型自动点位滴定仪测定AAN含量。设置电位滴定仪自动加甲醛5 mL,固定氨基的碱性,使羧基显示出酸性后,用NaOH滴定,根据碱液消耗量计算样品中AAN含量。
1.3.4 微生物群落分析
采用FastDNA®Spin Kit for Soil试剂盒,提取样品中微生物群落的DNA,利用NanoDrop2000超微量分光光度计检测D N A 的纯度。使用引物3 3 8 F(5’-ACTCCTACGGGAGGCAGCAG-3’)和806R(5’-GGACTACHVGGGTWTCTAAT-3’),通过PCR扩增细菌16S rRNA基因的V3~V4区域。扩增程序为:95 ℃预变性3 min;95 ℃变性30 s、55 ℃退火30 s、72 ℃延伸45 s,27 个循环;72 ℃稳定延伸10 min;最后在4 ℃保存。PCR产物经2%琼脂糖凝胶电泳鉴定后进行纯化,纯化的PCR扩增子在Illumina MiSeq PE300平台(Illumina,USA)上进行成对末端测序[14]。数据在Majorbio Cloud(Majorbio,China)在线平台上进行分析。通过Fastp v0.19.6对原始测序读数进行分解复用和质量过滤,然后用Flash v1.2.11进行合并。采用Mothur v1.30.2对微生物菌群的α多样性指数进行分析,基于主成分分析(principal component analysis,PCA)对微生物菌群的β多样性进行分析。
1.4 数据处理
2 结果与分析
2.1 加菌发酵对低盐鱼露发酵过程微生物菌群α多样性的影响
α多样性指数是分析微生物菌群丰富度和均匀度的重要指标,主要包括覆盖率、Sobs指数、Chao指数、ACE指数、Shannon指数和Simpson指数。覆盖率代表高通量测序结果的覆盖程度,该值越接近1,说明测得的微生物菌群结果越真实[16]。由图1可知,每个鱼露样品的覆盖率均在0.99以上,说明样品中绝大多数微生物都被检测到,测序准确性较好。Sobs指数表示观察到的OTU数[16],该指数可以直观表现样品中微生物菌群的丰富度。随着发酵的进行,低盐自然发酵组的Sobs指数均呈逐渐降低的趋势,表明微生物菌群的丰富度逐渐降低。加菌发酵后,微生物菌群在每个发酵时间的Sobs指数均显著降低。ACE指数和Chao指数同样用于评价鱼露样品中物种的丰富度[17]。与Sobs指数的变化趋势相似,随着发酵时间的延长,Chao指数和ACE指数在低盐自然发酵组中逐渐降低,且加菌发酵后显著降低,结果表明B.subtilisB-2加菌发酵可以显著降低微生物菌群的丰富度。Shannon指数和Simpson指数可以反映微生物群落的均匀度[18]。结果显示,低盐自然发酵组微生物菌群的Shannon指数明显高于低盐加菌发酵组,而Simpson指数则明显高于低盐加菌发酵组,表明B.subtilisB-2加菌发酵可以显著降低鱼露中微生物菌群的均匀度。综合上述α多样性指数,加菌发酵后鱼露中微生物群落的丰富度和均匀度都呈降低趋势,表明B.subtilisB-2加菌发酵后能够显著抑制鱼露发酵过程中大多数微生物菌群的生长。

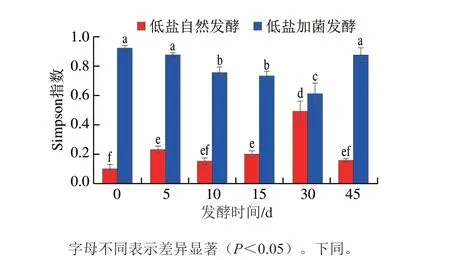
图1 不同发酵时间下低盐自然发酵鱼露和低盐加菌发酵鱼露中微生物菌群的α多样性指数变化Fig.1 Changes in α diversity indexes of microbial community in naturally fermented and B. subtilis B-2 fermented low-salt fish sauce at different fermentation times
2.2 加菌发酵对低盐鱼露发酵过程微生物菌群β多样性的影响
微生物菌群β多样性分析可以用于评价不同样品中微生物菌群结构的相似性[18]。基于PCA解析加菌发酵对低盐鱼露发酵过程微生物菌群β多样性的影响,结果如图2所示。可以看出,低盐加菌发酵组与低盐自然发酵组微生物菌群差异明显;低盐自然发酵组的微生物菌群在发酵前期(C0、C5、C10、C15)与后期(C30、C45)也显示出较明显的差异,而加菌发酵组的微生物菌群在整个发酵期间差异不明显。结果表明,低盐自然发酵鱼露样品中微生物群落组成不稳定,在发酵前期的优势微生物,在发酵后期逐渐被其他微生物菌属替代,导致微生物群落组成结构发生改变;而对于加菌发酵组,添加B.subtilisB-2后鱼露微生物群落组成更加稳定,在整个发酵过程中变化较小。
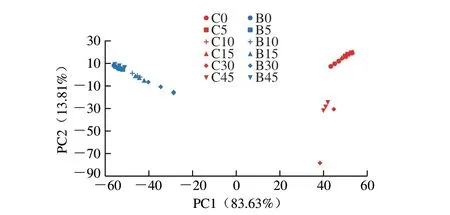
图2 不同发酵时间下低盐自然发酵鱼露和低盐加菌发酵鱼露中微生物菌群的β多样性分析Fig.2 β-Diversity analysis of microbial community in naturally fermented and B. subtilis B-2 fermented low-salt fish sauce at different fermentation times
2.3 加菌发酵对低盐鱼露发酵过程微生物群落组成的影响
微生物种类和比例对鱼露的品质和风味均有较大影响[19]。因此,本研究对鱼露发酵过程中的微生物种类进行监控,对鱼露品质的改善有重要作用。
由图3 A 可知,在低盐自然发酵组的鱼露样品中Proteobacteria和Cyanobacteria是主要的门类,且Proteobacteria的丰度随着发酵时间延长逐渐增加,在发酵后期相对丰度达到64.89%。由图3B可知,在属水平上,共监测到31 个主要的微生物属(相对丰度>0.1%),其中原料鱼中(C 0)丰度最高的为C y a n o b i u m、Pseudomonas、Synechococcus、Delftia。Cyanobium的丰度随发酵时间延长先上升后下降,发酵5 d相对丰度为44.90%,在发酵45 d下降至12.46%。Pseudomonas在发酵前期占比很小,在发酵至45 d代替Cyanobium,成为最主要的菌属,说明Pseudomonas可能更适合在低盐发酵鱼露环境中生长。在以鳀鱼为原料的韩国传统鱼露(Myeolchi-Aekjeot)中占绝对优势的是Halanaerobium和Lactobacillus[20],在以鳀鱼为原料的我国传统发酵鱼露中占绝对优势的是Halococcus、Halanaerobium、Halomonas和Tetragenococcus[21],而本研究以蓝圆鲹为原料的低盐发酵鱼露中上述菌属均不是核心菌属,这说明原料鱼体携带的和发酵环境中的微生物以及盐度对后续发酵过程中微生物种类的影响较大。
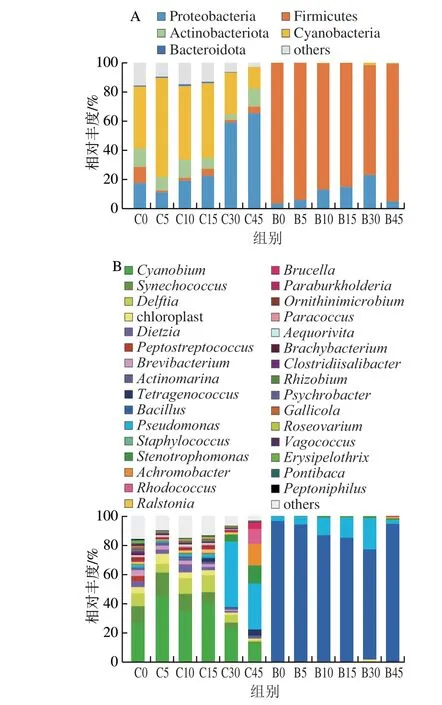
图3 不同发酵时间下低盐自然发酵鱼露和低盐加菌发酵鱼露中微生物菌群在门(A)和属(B)上相对丰度变化Fig.3 Change in relative abundance of microbial community in naturally fermented and B. subtilis B-2 fermented low-salt fish sauce at different fermentation times at the phylum (A) and genus (B) levels
由图3A可知,Firmicutes在加菌发酵鱼露整个发酵过程的相对丰度均超过75%,是发酵过程中的主要微生物门类。由图3B可知,在属水平上,仅检测到12 个主要的微生物属(相对丰度>0.1%),其中Bacillus始终占主导地位,发酵起始(B0)的相对丰度达到96.16%,随着发酵时间的延长先下降后上升,在发酵末期达到93.69%;其次是Pseudomonas和Stenotrophomonas。与低盐自然发酵组相比,加菌发酵后微生物多样性显著降低,表明B.subtilisB-2具有很强的生存能力,可以抑制低盐发酵环境中Cyanobium、Synechococcus、Achromobacter等腐败微生物的生长。
2.4 加菌发酵对低盐鱼露发酵过程生物胺含量的影响
生物胺广泛存在于发酵食品中,主要是由游离氨基酸在微生物产生的氨基酸脱羧酶催化下脱羧基形成的[22]。生物胺也是我国鱼露中重要的质量安全评价指标,控制生物胺对于提升鱼露的品质具有重要意义[23]。有研究发现,传统自然发酵鱼露中含有较高的组胺、酪胺、腐胺和尸胺[24]。在本研究发现相似的研究结果,组胺、腐胺、尸胺和酪胺是低盐自然发酵鱼露中的关键生物胺(图4)。在发酵5 d,鱼露样品中各生物胺含量都很低,随着发酵的进行,8 种生物胺含量均有所增加。在低盐自然发酵鱼露中,组胺、酪胺、苯乙胺、色胺、亚精胺和精胺的含量呈先增长后下降的趋势,而腐胺和尸胺的含量均在发酵末期达到最大。组胺和酪胺作为毒性最强的生物胺,过量摄入会导致血压异常、消化系统紊乱、头痛和神经中毒[25]。食品法典委员会规定,鱼露中的组胺不得超过400 mg/kg[22]。本研究中,低盐自然发酵鱼露中组胺和酪胺的含量均在发酵30 d达到最大,分别为289.2 mg/kg和271.56 mg/kg,在发酵末期组胺下降至275.16 mg/kg,酪胺下降至260.05 mg/kg,表明低盐自然发酵鱼露的安全性符合食品法典委员会的规定。虽然尸胺和腐胺本身没有毒性,但它们可以增加组胺的毒性[26]。高浓度的尸胺和腐胺可能会增加生物胺中毒的风险。研究发现,高盐发酵鱼露在发酵结束时(发酵12 个月)组胺、酪胺、腐胺、苯乙胺、色胺、亚精胺和尸胺含量分别为121.97、93.49、81.22、2.90、10.52、13.29 mg/kg和133.75 mg/kg[24]。结果表明,除了尸胺,发酵末期(45 d)低盐鱼露中其他生物胺的浓度明显高于高盐鱼露,特别是组胺、酪胺和腐胺。因此,未来对低盐鱼露的研究应着重于控制这些生物胺,以减少其潜在的毒性。在低盐加菌发酵鱼露中,多数生物胺含量的变化趋势与低盐自然发酵鱼露相似,但是大多数生物胺的含量显著下降,特别是组胺、腐胺、尸胺和酪胺等关键生物胺,其含量在发酵末期分别下降了25.9%、35.6%、23.6%和9.3%。结果表明,B.subtilisB-2加菌发酵的低盐鱼露具有更高的安全性。


图4 不同发酵时间下低盐自然发酵鱼露和低盐加菌发酵鱼露中生物胺和AAN含量变化Fig.4 Changes in concentrations of biogenic amines and amino acid nitrogen in naturally fermented and B. subtilis B-2 fermented low-salt fish sauce at different fermentation times
2.5 加菌发酵对低盐鱼露发酵过程AAN含量的影响
AAN含量是指以氨基酸形式存在的氮元素的含量,是鱼露最主要的品质指标之一,氨基酸含量越高,表明鱼露的品质越高、鲜味越好[27]。加菌对低盐鱼露发酵过程AAN含量的影响如图4所示。结果发现,随着发酵时间的延长,低盐自然发酵鱼露和低盐加菌发酵鱼露的AAN含量均呈显著增加的趋势。当发酵10 d,低盐自然发酵鱼露的AAN质量浓度达到0.73 g/100 mL,根据SB/T 10324—1999《鱼露》[13],达到二级鱼露的标准(>0.65 g/100 mL);发酵30 d,AAN质量浓度达到0.92 g/100 mL,达到国家一级鱼露标准(>0.9 g/100 mL)。袁树昆[28]对低盐鱼露(盐度为18%)发酵过程中的AAN进行了测定,结果显示,在发酵30 d,AAN超过1.2 g/100 mL,达到一级鱼露标准,与本研究结果相似。与传统发酵鱼露相比,降低盐浓度可以提高发酵速度,这可能是因为传统发酵鱼露的高盐环境抑制了微生物的生长和代谢[29],而在低盐环境下微生物生长和代谢较快,且微生物菌群更为丰富,鱼肉蛋白质的分解速度加快。因此,对于AAN指标来说,低盐发酵具有明显优势。与低盐自然发酵鱼露相比,加菌发酵鱼露的AAN含量明显增加,其中发酵15 d的AAN质量浓度可达到1.23 g/100 mL,超过一级鱼露的AAN含量标准,而此时自然发酵鱼露的AAN质量浓度仅为0.79 g/100 mL,为二级鱼露。在泰国传统发酵食品thua-nao[30]中也有相似的结果,添加B.subtilis可以提高AAN含量,发酵速率更高。这可能是因为B.subtilisB-2具有很高的耐盐性并且所产的蛋白酶在高盐条件下仍具有较强的活力[11],因此可以加速原料鱼蛋白分解为氨基酸,从而促进AAN的形成。结果表明,B.subtilisB-2加菌发酵可以有效缩短低盐鱼露发酵时间并且提升其品质。
2.6 低盐鱼露品质指标与微生物菌属间的相关性分析
微生物代谢在传统发酵食品品质形成上发挥着核心作用。为研究低盐自然发酵鱼露和加菌发酵鱼露品质形成机制,本研究首先利用P e a r s o n相关性检验研究主要微生物菌属、8 种生物胺、AAN、α多样性指数间的相关性。如图5A所示,在低盐自然发酵组中,3 1 个微生物菌属分成2 个明显的聚类,包括聚类1(Bacillus、Staphylococcus、Vagococcus、Rhizobium、Ralstonia、Paraburkholderia、Actinomarina、Peptoniphilus、Ornithinimicrobium、Pontibaca、Paracoccus、Aequorivita、Psychrobacter、Roseovarius、Clostridiisalibacter、Delftia、Gallicola、Peptostreptococcus、Dietzia、Brevibacterium、Brachybacterium、Cyanobium、Synechococcus、c h l o r o p l a s t)和聚类2(S t e n o t r o p h o m o n a s、Rhodococcus、Achromobacter、Brucella、Pseudomonas、Tetragenococcus、Erysipelothrix)。聚类1中的大部分微生物菌属与Sobs指数、Chao指数、ACE指数、Shannon指数、苯乙胺和色胺呈正相关,与Simpson指数、AAN、组胺、腐胺、尸胺、酪胺、亚精胺和精胺呈负相关,聚类2中的大部分微生物菌属则反之。结果表明,低盐自然鱼露发酵过程中微生物丰富度和均匀度的下降可能是由聚类1中微生物菌属丰度的下降引起,而发酵过程AAN和关键生物胺(组胺、腐胺、尸胺、酪胺)的增加主要可能是由聚类2中微生物菌属的代谢引起。如图5B所示,在加菌发酵组中,12 个微生物菌属分成3 个明显的聚类,包括聚类1(Bacillus、Synechococcus)、聚类2(Pseudomonas、chloroplast、Stenotrophomonas)和聚类3(Cyanobium、Achromobacter、Rhodococcus、Brucella、Tetragenococcus、Staphylococcus、Delftia)。聚类1中的微生物菌属与Sobs指数、Chao指数、ACE指数、Simpson指数的正相关性较高,聚类2中的微生物菌属与Shannon指数、苯乙胺、亚精胺、腐胺产生明显的正相关性,聚类3中的微生物菌属与AAN、组胺、尸胺、酪胺、色胺和精胺正相关性较高。

图5 微生物菌属与低盐鱼露品质指标间的相关性分析Fig.5 Correlation analysis between microbial genera and quality indexes in low-salt fish sauce
进一步根据Pearson相关系数构建了微生物菌属与生物胺、AAN、α多样性指数间的相关性网络图(|r|>0.6且P<0.05)。如图5C所示,在低盐自然发酵组中,与Sobs指数、Chao指数、ACE指数、Shannon指数显著正相关的菌属主要集中在Brevibacterium、Dietzia、Paracoccus、Aequorivita、Brachybacterium,表明这些微生物菌属丰度的下降是低盐自然发酵鱼露发酵末期微生物多样性下降的主要原因。Stenotrophomonas与大多数生物胺(4 种)呈显著正相关,其次是Pseudomonas、Ralstonia、Erysipelothrix(2 种)。Stenotrophomonas是与尸胺(r=0.8 1 9)、组胺(r=0.7 3 6)、腐胺(r=0.699)和酪胺(r=0.699)高度相关的主要菌属,有助于它们在发酵后期浓度增加。与色胺产生有关的菌属最多,包括Staphylococcus(r=0.622)、Delftia(r=0.882)、Ralstonia(r=0.679)、Paraburkholderia(r=0.695)、Ornithinimicrobium(r=0.784)、Paracoccus(r=0.769)、Aequorivita(r=0.781)、Brachybacterium(r=0.624)、Rhizobium(r=0.664)、Gallicola(r=0.749)、Roseovarius(r=0.752)、Pontibaca(r=0.670)。其次是与尸胺产生有关的菌属,包括Pseudomonas(r=0.735)、Stenotrophomonas(r=0.819)、Achromobacter(r=0.632)、Rhodococcus(r=0.642)和Brucella(r=0.636)。Pseudomonas和Stenotrophomonas是造成食品储存期间腐败的主要微生物菌属[31],且Pseudomonas被确定为水产品中产生生物胺的核心腐败菌[32-34]。在本研究中,应进一步控制低盐鱼露中的腐败微生物,特别是Pseudomonas和Stenotrophomonas,以抑制生物胺的产生。AAN与多个微生物菌属呈显著正相关,包括Tetragenococcus(r=0.707)、Stenotrophomonas(r=0.825)、Achromobacter(r=0.744)、Rhodococcus(r=0.752)、Brucella(r=0.748)、Erysipelothrix(r=0.654),说明这些菌属有可能产生蛋白酶,有利于鱼肉蛋白质的分解,从而导致AAN增加。
如图5D所示,在加菌发酵组中,与α多样性指数显著相关的菌属明显减少,其中与Shannon指数显著正相关的菌属主要包括Pseudomonas(r=0.951)、Stenotrophomonas(r=0.797)、chloroplast(r=0.756),说明这些菌属在维持加菌发酵鱼露微生物菌群均匀度方面发挥重要作用。Tetragenococcus(r=0.611)、Stenotrophomonas(r=0.707)、Delftia(r=0.667)与AAN呈显著正相关,表明这些菌属在鱼露发酵过程AAN变化中发挥着重要作用。微生物菌属与多种生物胺之间呈显著正相关,其中与组胺生成显著正相关的有Stenotrophomonas(r=0.769)、Delftia(r=0.699);与酪胺显著正相关的有Tetragenococcus(r=0.611)、Stenotrophomonas(r=0.649)、Delftia(r=0.638);与腐胺显著正相关的有Stenotrophomonas(r=0.724);与尸胺显著正相关的有Stenotrophomonas(r=0.612)、Delftia(r=0.628)。结果表明,Stenotrophomonas在加菌发酵鱼露中生物胺形成方面发挥着重要作用,这与自然发酵鱼露的结果一致。
2.7 加菌发酵改善低盐发酵鱼露品质的作用机制
为进一步揭示B.subtilisB-2加菌发酵改善低盐发酵鱼露品质的作用机制,将发酵末期低盐自然发酵鱼露和加菌发酵鱼露间的微生物菌属、生物胺、AAN、α多样性指数进行Pearson相关性分析,并进一步构建相关性网络图(|r|>0.6且P<0.05)。
如图6所示,仅有Bacillus和Staphylococcus与Sobs指数、Chao指数、ACE指数和Shannon指数呈显著正相关,而与Simpson指数呈显著负相关,而其他微生物菌属则正好相反。同时,只有Bacillus和Staphylococcus与AAN呈显著正相关,与组胺、腐胺、尸胺、酪胺等关键生物胺呈显著负相关。发酵食品中的核心菌群是指微生物菌属丰度占绝对丰度并能在其风味或品质起核心作用的菌群[3,12]。如图7所示,B.subtilisB-2加菌发酵后,Staphylococcus的相对丰度仅从0.05%增加到0.12%。因此虽然Staphylococcus与品质指标的改善起显著相关,但是在其中占比很小,并不是发酵食品品质改善的核心菌群。相反,B.subtilisB-2加菌发酵后,Bacillus在发酵末期的相对丰度从0.04%显著增加到93.63%,其在低盐鱼露品质改善上发挥着核心作用,是加菌发酵鱼露中的核心微生物菌群。结果表明,B.subtilisB-2加菌发酵后,腐败微生物种类和丰度的下降,AAN含量的提高,以及组胺、腐胺、尸胺、酪胺等关键生物胺含量的下降主要由Bacillus即所添加的发酵剂代谢引起的。本研究表明B.subtilisB-2作为发酵剂具有很好的改善低盐发酵鱼露品质的作用,具有在低盐发酵鱼露中应用的潜力。

图6 基于发酵末期低盐自然发酵鱼露和加菌发酵鱼露间的微生物菌属与品质指标的相关性网络图Fig.6 Correlation network map between microbial genera and quality indexes in naturally fermented and B. subtilis B-2 fermented low-salt fish sauce at the end of fermentation
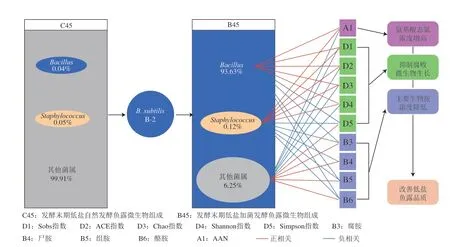
图7 B. subtilis B-2加菌发酵改善鱼露品质的作用机制图Fig.7 Mechanism for quality improvement of low-salt fish sauce by fermentation with B. subtilis B-2
3 结 论
B.subtilisB-2加菌发酵能够显著降低低盐鱼露发酵过程中微生物群落的丰富度和均匀度。在低盐自然发酵鱼露中共检测到31 种主要的微生物菌属(相对丰度>0.1%),其优势菌属从发酵初期的Cyanobium变为发酵末期的Pseudomonas;而加菌发酵后,微生物菌属减少至12 种,其中Bacillus始终占主导地位,在发酵末期的相对丰度达到93.69%,腐败微生物丰度显著降低。B.subtilisB-2加菌发酵能够显著抑制低盐鱼露中组胺、腐胺、尸胺和酪胺的生成,其含量在发酵末期较自然发酵鱼露分别下降了25.9%、35.6%、23.6%和9.3%。B.subtilisB-2加菌发酵可显著增加低盐鱼露的AAN含量,其中发酵15 d的AAN可达到1.23 g/100 mL,超过一级鱼露的AAN含量标准,而此时自然发酵鱼露的AAN仅为0.79 g/100 mL(仅达到二级鱼露)。相关性网络图分析结果显示,在低盐自然发酵组中,与Sobs指数、Chao指数、ACE指数、Shannon指数显著正相关的菌属主要集中在Brevibacterium、Dietzia、Paracoccus、Aequorivita、Brachybacterium,表明这些微生物菌属丰度的下降是低盐自然发酵鱼露发酵末期微生物多样性下降的主要原因;在低盐自然发酵鱼露和低盐加菌发酵鱼露中,Stenotrophomonas均与多种生物胺呈显著正相关,表明其在低盐鱼露生物胺产生中发挥核心作用;B.subtilisB-2加菌发酵后,腐败微生物种类和丰度的下降、AAN含量的提高以及关键生物胺含量的下降主要由Bacillus即所添加的发酵剂代谢引起。B.subtilisB-2作为发酵剂具有在改善低盐发酵鱼露品质中的应用潜力。
