沙棘籽粕蛋白肽的稳定性及分离纯化
2023-10-21相欢,崔春*
相 欢,崔 春*
(1.中国水产科学研究院南海水产研究所,广东 广州 500360;2.华南理工大学食品科学与工程学院,广东 广州 510640)
近年来肥胖症患者数量明显上升,预计2030年将超过33亿[1]。造成肥胖的原因是体内脂肪过多堆积、脂质代谢异常。胰脂肪酶(EC3.1.1.3)是人类脂质代谢的关键酶,可作为抗肥胖药物的特定靶点。奥利司他作为一种胰脂肪酶抑制剂,可抑制30%的胰脂肪酶发挥酶解功效,降低脂肪吸收,但因其副作用较大而不被广泛接受[2]。食品来源的胰脂肪酶抑制剂,如多酚[3]、多糖[4]、多肽[5]等不仅有效抑制胰脂肪酶的活性,而且安全性更高,是目前食品工业的研究热点。其中多肽作为胰脂肪酶抑制剂的研究逐渐增加,Stefanucci等[6]采用化学合成含精氨酸的碱性多肽(FRN、WRN、NRN、KRM),发现以上多肽可与胰脂肪酶活性位点结合,发挥抑制活性;Mudgil等[7]采用碱性蛋白酶酶解9 h制备骆驼奶蛋白肽,发现其能够抑制胰脂肪酶活性,IC50值为0.029 mg/mL;Fan Xiaodan等[8]采用胃蛋白酶酶解制备螺旋藻蛋白肽,研究表明3~5 kDa组分对胰脂肪酶有较好的抑制作用(72%)。沙棘籽粕作为加工副产物,具有蛋白含量高和氨基酸组成完全(精氨酸含量高)的特点,目前主要用于单胃动物的饲料补充,以改善单胃动物健康状态和生长效率[9]。目前关于沙棘籽粕蛋白肽的研究主要涉及抗氧化[10]、抑菌[11]、降血糖[12]、醒酒[13]等活性,王文娟[14]报道了沙棘籽粕蛋白可以有效降低糖尿病小鼠的体质量和体内甘油三酯的含量,因此,开发沙棘籽粕蛋白抗肥胖肽具有极大的市场前景。
活性肽是一类具有特殊生理功能的蛋白质片段,受到外界影响时,内部结构会发生变化,从而导致其性质发生改变[15]。高温、强酸、强碱、金属离子及光照等众多因素都会对多肽的活性产生影响。例如,张丽娜[16]研究发现核桃肽在高温(120 ℃)、强酸(pH 1.0)或强碱(pH 11.0)条件活性降低;彭金秀[17]在研究中发现,铜离子可显著提高抗菌肽(HMPI)对胰蛋白酶的稳定性;Xiao Chuqiao等[18]报道来源于鸡胸蛋白的乙醇脱氢酶激活肽能够在低浓度的金属离子下保持活性;Liu Kunlun等[19]报道不同光照会影响来源于硒化糙米水解蛋白中抗氧化肽SeMet-Pro-Ser的活性。
由于在多肽混合物中存在拮抗或协同作用,存在于蛋白质水解物中的单个多肽的生物活性可能与分离时差异明显,因此需要进行浓缩纯化验证生理活性。根据肽的电荷、大小、溶解度和亲水性(即化合物的疏水性和亲水性)的不同,可采用以下分离手段:沉淀、超滤、大孔树脂吸附、固相萃取、活性炭吸附等[20-21]。经过分离纯化之后的样品采用超高效液相色谱-串联质谱(ultrahigh performance liquid chromatography-tandem mass spectrometry,UPLC-MS/MS)进行鉴定,往往会得到数目较多的多肽序列,会因样品数目过多而增加实验成本。近年来,研究者们利用计算机模拟分析食物蛋白水解后释放的活性肽,进而利用生物信息学进行筛选,采用定量结构-活性关系和分子对接手段预测目标分子的活性,该方式的可信度已被多个研究证明[22-23]。
在前期研究的基础上,本实验首先探究了温度、pH值、金属离子、光照及氧气对沙棘籽粕蛋白胰脂肪酶肽抑制活性的影响。在此基础上,为获得具有更高活性的沙棘籽粕蛋白肽(seabuckthorn seed peptides from alcalase hydrolysates,SSPA),以猪胰脂肪酶(porcine pancreatic lipase,PPL)抑制率为指标,将沙棘籽粕蛋白酶解液依次通过超滤、大孔树脂进行分离,筛选出具有较强活性的多肽,利用分子对接分析活性肽与PPL之间的作用,化学合成活性肽对其活性进行评价,以期为产业化生产沙棘籽粕胰脂肪酶抑制肽提供理论基础。
1 材料与方法
1.1 材料与试剂
沙棘籽粕蛋白由实验室自制;PPL(30 000 U/g)Sigma上海生物科技有限公司;碱性蛋白酶(8 000 U/mL)诺维信中国有限公司;超滤膜包(10、3 kDa) 密理博中国有限公司;DA201C大孔树脂、D101大孔树脂、XAD16大孔树脂、HPD826大孔树脂 上海麦克林生化科技有限公司。
1.2 仪器与设备
BT100-1恒流泵 保定齐力恒流泵有限公司;U-3000液相色谱仪、Multiskan Sky酶标仪 美国赛默飞科技有限公司;1290超高压液相色谱-质谱仪 德国布鲁克科技有限公司。
1.3 方法
1.3.1 沙棘籽粕蛋白及SSPA的制备
称取100 g沙棘籽粕粉末,加入9 倍质量的水,调节pH值至11.0,37 ℃提取40 min,重复提取3 次,8 000×g离心25 min,收集上清液,将上清液的pH值调节至5.0,植酸酶添加量为0.2%(m/m),50 ℃反应3 h,8 000×g离心,收集沉淀,沉淀加水复溶,调节pH值至7.0,冷冻干燥后得到蛋白纯度为70.21%的沙棘籽粕蛋白。
称取沙棘籽粕蛋白(SSP,4 g)分散于100 mL蒸馏水中,1 mol/L NaOH溶液调节pH值至8.0,碱性蛋白酶添加量为0.25%(m/m,以蛋白质量计),50 ℃振荡酶解8 h后沸水浴灭酶处理10 min,用普通滤纸进行过滤得到上清液进行冻干,将其命名为SSPA。
1.3.2 PPL抑制率测定
参考周丽丽[24]的方法测定PPL抑制率。底物A:称取聚乙烯醇(polyvinyl alcohol,PVA)20 g,加入800 mL蒸馏水,在沸水中加热搅拌至全部溶解,冷却后定容至1 000 mL,得2% PVA溶液,过滤备用。底物B:量取底物A溶液150 mL与50 mL橄榄油混合均匀,采用高速剪切机以10 000 r/min剪切处理9 min,得到乳白色PVA溶液。在25 mL比色管中加入2 mL底物B及2.5 mL磷酸盐缓冲溶液(0.01 mol/L,pH 7.2),混匀后于恒温水浴锅(40 ℃)中反应20 min,迅速加入6 mL乙醇溶液(95%)和1 mL盐酸溶液(6 mol/L)中止反应,再加入3 mL异辛烷旋涡振荡90 s后,于60 ℃水浴锅中静置分层,室温冷却后取上层溶液1 mL于10 mL离心管中,再加入4 mL异辛烷及1 mL醋酸铜显色剂旋涡振荡90 s,静置分层后取上层有机相,在波长714 nm处测定吸光度。其中,空白实验不添加SSPA,其他操作相同。PPL抑制率按式(1)计算:
式中:Aa为不添加SSPA的吸光度;Ab为添加SSPA的吸光度。
1.3.3 SSPA稳定性分析
1.3.3.1 SSPA温度稳定性测定
称取1.3.1节中的SSPA(200 mg)溶解于100 mL超纯水中,溶液配制5 组,置于25~100 ℃恒温水浴锅中保温2 h,将溶液冷却至室温后,测定各组SSPA的PPL抑制率,将25 ℃时的PPL抑制率设为对照组(100%),其他组与之相比,得出PPL抑制活性保留率。
1.3.3.2 SSPA pH值稳定性测定
按照1.3.3.1 节的方法配制7 组S S P A,调节pH 3.0~12.0。室温保持2 h,之后将pH值调节为7.0,测定各组SSPA的PPL抑制率,以pH 7.0的PPL抑制率为对照组(100%),其他组与之相比,计算得出PPL抑制活性保留率。
1.3.3.3 SSPA金属离子稳定性测定
按照1.3.3.1节的方法配制8 组SSPA(其中一组为对照组),室温条件下(25 ℃),分别加入不同的金属离子(Na+、Ca2+、Mg2+、Zn2+、Mn2+、Al3+、Cu2+),金属离子最终质量分数为0.20%。2 h之后测定各组SSPA的PPL抑制率,以不加金属离子的PPL抑制率为对照(100%),其他组与之相比,计算PPL抑制活性保留率。
1.3.3.4 SSPA光照稳定性测定
按照1.3.3.1节方法配制3 组SSPA,室温条件下(25 ℃),分别将其放置于日光灯、紫外灯和黑暗环境中30 min,测定各组SSPA的PPL抑制率。
1.3.3.5 SSPA氧气条件稳定性测定
按照1.3.3.1节方法配制2 组SSPA,室温条件下(25 ℃),分别置于有氧和无氧条件下,放置24 h后测定各组SSPA的PPL抑制率。
1.3.4 SSPA的分离纯化
1.3.4.1 超滤分离SSPA
分别采用分子质量为10 kDa和3 kDa的超滤膜包对SSPA进行分离,收集各组分,分别定义为SSPAH(>10 kDa)、SSPAM(10~3 kDa)、SSPAL(<3 kDa),冷冻干燥后,测定蛋白含量、PPL抑制率,选出活性较高的组分进行后续实验分析。
1.3.4.2 大孔树脂分离SSPA
大孔树脂预处理:参考贺磊[25]的方法:将4 种树脂分别用过量乙醇溶液(95%)浸泡24 h,使其充分溶胀,之后用乙醇溶液(95%)继续清洗,至洗出液加等量的蒸馏水无白色浑浊为止,再用蒸馏水洗至澄清且没有乙醇味;浸泡过的树脂先用2~3 倍体积的稀盐酸(1 mol/L)处理3~5 h,再用蒸馏水洗脱至pH值为中性;最后用2~3 倍体积的NaOH溶液(1 mol/L)浸泡3~5 h,用蒸馏水洗脱至pH值为中性,烘干备用。
大孔树脂静态吸附:称取10 g树脂(记为m0)与50 mL SSPAL(C0)(15 mg/mL记为ρ0)混合,25 ℃、200 r/min振荡4 h。不同时间点(Vt)收集样品记为ρt,过滤得到吸附液(Ct),采用BCA试剂盒测定吸附液的蛋白质量浓度,吸附量和吸附率按式(2)、(3)计算:
大孔树脂解吸:将不同树脂(0.50 g,记为m0)与5 mL(15 mg/mL,记为ρ0)SSPAL混合,150 r/min振荡4 h(25 ℃)。过滤的吸附液测定蛋白质量浓度记为ρ1,将5 mL不同体积分数乙醇溶液(0%、20%、40%、60%、80%、100%)与树脂混合,25 ℃处理24 h,收集解吸液,记录体积(V2)和测定蛋白质量浓度(ρ2)解吸率按式(4)计算:
SSPAL的动态吸附研究:将SSPAL(50 mg/mL)与经过预处理的HPD826混合,装柱(2.5 cm×60 cm),静置吸附一段时间,40%乙醇溶液以5 mL/min的流速通过柱子,收集洗脱组分记为SSPAL-E,冷冻干燥测定其蛋白含量和PPL抑制率。
1.3.5 SSPA的鉴定
选择上述经分离纯化之后的组分SSPAL-E冻干备用。配制5%固形物含量的样品,使用UPLC-MS/MS鉴定SSPA,进样量为10 μL,流速为0.3 mL/min,流动相条件如表1所示。MS(一级质谱)和MS/MS(二级质谱)的扫描范围均为m/z50~3 000,使用Mascot软件搜索比对数据库,结合手动从头测序(de novo)的方法鉴定SSPA段。利用Peptide Ranker计算沙棘籽粕蛋白肽的生物活性概率。

表1 流动相条件Table 1 Mobile phase conditions
1.3.6 SSPA的筛选
首先采用ToxinPred分析SSPA的毒性,其次采用PepSite2计算SSPA与PPL的结合概率(以P值表示,P<0.05为有效值)。筛选之后,采用Auto-Dock进行对接分析,利用RCSB下载猪胰脂肪酶(PPL,1ETH)的X射线晶体结构,利用ChemBio3D绘制SSPA的结构,并将其进行能量最小化处理。在Pymol中去除PPL的所有水分子,在蛋白质晶体结构中加入极性氢原子进行对接,定义了一个尺寸为72 Å×29 Å×144 Å的网格盒,以0.375 Å的网格间距包围活性位点。采用Discovery Studio 2021 Client进行绘图分析。
1.3.7 SSPA的合成
基于UPLC-MS/MS鉴定筛选得到SSPA,委托试剂公司进行SSPA的定向合成,配制不同质量浓度的SSPA,测定其PPL抑制率,计算IC50值。
1.4 数据处理
2 结果与分析
2.1 SSPA稳定性分析
如图1所示,外界环境会影响SSPA的PPL抑制活性。热处理是食品加工中的一种重要方法,在60~90℃过程中,蛋白质可能会发生变性或聚集[26]。与常温条件下的SSPA相比,适当升高温度(45、65 ℃)对SSPA的PPL抑制活性不会产生显著影响(P<0.05),当温度升高到85 ℃,其PPL抑制活性显著降低,但仍保持在90%以上(图1A)。张丽娜[16]报道关于温度对核桃肽的影响与本研究结果相近。但Tao Mengliang等[27]研究发现来源于蚕蛹蛋白的血管紧张素转换酶(angiotensin converting enzyme,ACE)抑制肽GNPWM在40~80 ℃处理过程中,其ACE抑制活性无明显变化。
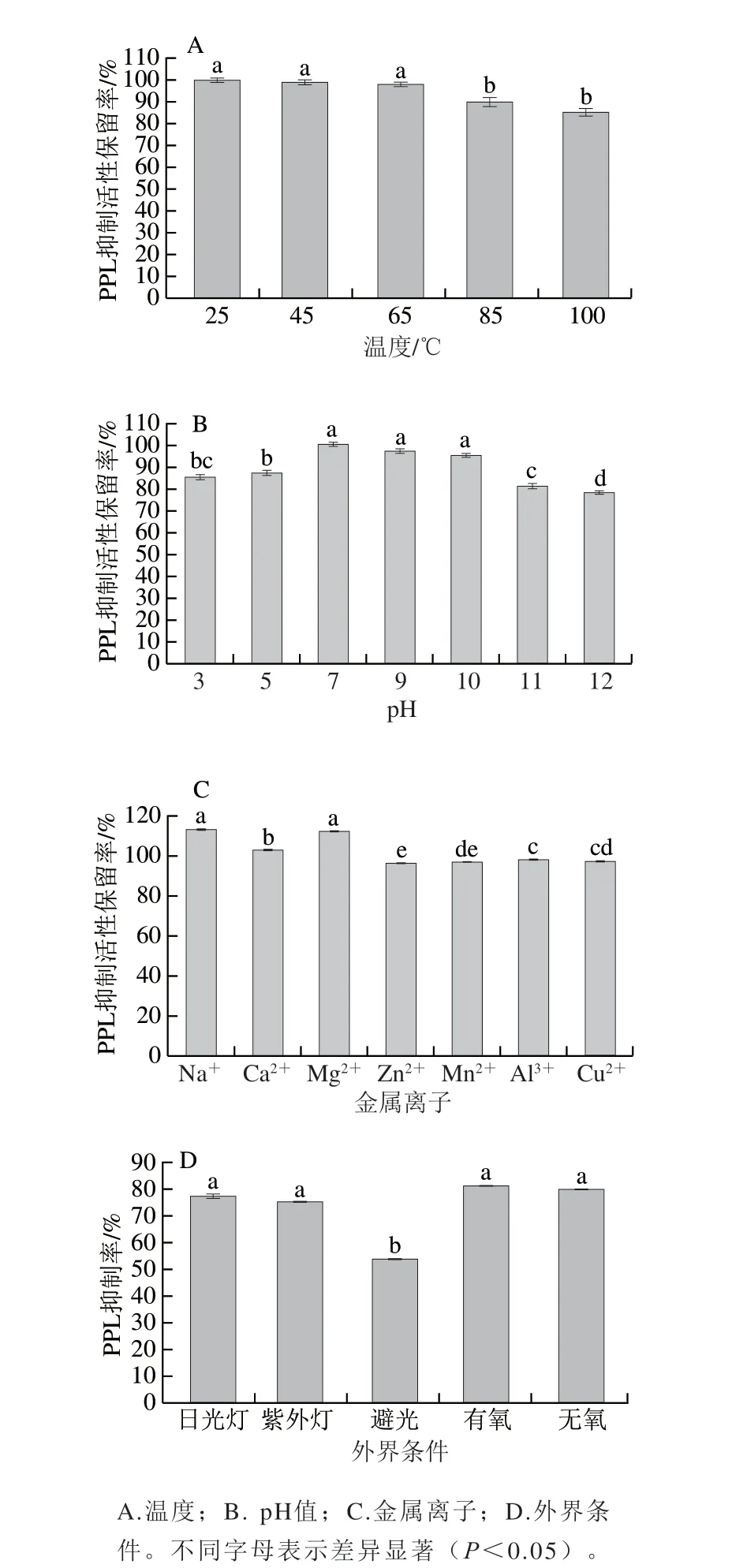
图1 不同因素对SSPA的PPL抑制率的影响Fig.1 Effects of different factors on PPL inhibitory activity of SSPA
SSPA对PPL抑制活性的保留率随pH值的变化呈现中间高两端低的特点,pH值过高或过低可能会对SSPA的结构造成影响从而影响其活性。但是整体而言,在整个pH值范围内(3.0~12.0)PPL抑制活性保持在80%左右,表明SSPA具有较广的应用范围(图1B)。Fu Yu等[28]报道来源于牛结缔组织的多肽在强碱性(pH 10.0)条件下,ACE抑制活性显著降低,在pH 2.0~6.0范围内,ACE抑制活性有轻微波动。Wu Wei等[29]报道了牛酪蛋白衍生肽的ACE抑制活性在强碱性条件下显著降低,其原因可能是部分活性肽在强碱性加热作用下被进一步降解为非活性片段。
金属离子是食品配方中常见成分,因此测定其对SSPA活性的影响十分必要。与未添加金属离子的SSPA相比,加入适量的Na+和Mg2+有助于提高SSPA的PPL抑制活性(图1C),而Ca2+的加入对于SSPA的PPL抑制活性无显著影响(P>0.05),其余几种离子(Na+、Mn2+、Al3+、Cu2+)的加入使SSPA的PPL抑制活性有所降低,但影响不显著(P>0.05)。
而对于其他因素如光照和氧气对SSPA活性的影响如图1D所示,在日光灯和紫外灯照射条件下,SSPA的PPL抑制率无显著变化(P>0.05),表明该产品在实际生产中可采用紫外灭菌。Liu Yuanyuan等[30]报道雄蚕丝多肽的抗氧化活性受光照的影响,高强度射线会影响多肽结构和生物活性。SSPA的PPL抑制活性在有氧和无氧条件下无显著差异,说明SSPA在短期贮藏的过程中不会因暴露于空气而影响其生物活性。
2.2 SSPA的分离纯化
2.2.1 超滤分离SSPA
如表2所示,SSPA及其超滤组分对PPL的IC50值不同,其中SSPA的IC50值最高(1 198 μg/mL),而经过超滤后其抑制效果明显增强,并且随着分子质量的降低呈现抑制增强的趋势,其中分子质量小于3 kDa的组分IC50为309.8 μg/mL,收集该组分并进行后续的分离鉴定。

表2 超滤分离SSPA对PPL的IC50值Table 2 IC50 values of SSPA and its ultrafiltration fractions
2.2.2 大孔树脂分离SSPAL
2.2.2.1 不同种树脂对SSPAL吸附、解吸特性的影响
4 种树脂对SSPAL吸附量和吸附率的影响如图2A、B所示,二者随着吸附时间的延长均显著增加,且最终达到吸附平衡(3~4 h),其中HPD826吸附效果最佳,其次是XAD16、DA201C、D101。最终达到吸附平衡时,其吸附量分别为89.66(HPD826)、71.17(XAD16)、61.82(D101)、54.32 mg/g(DA201C),吸附率分别为60.31%(HPD826)、47.88%(XAD16)、41.58%(D101)、36.54%(DA201C)。
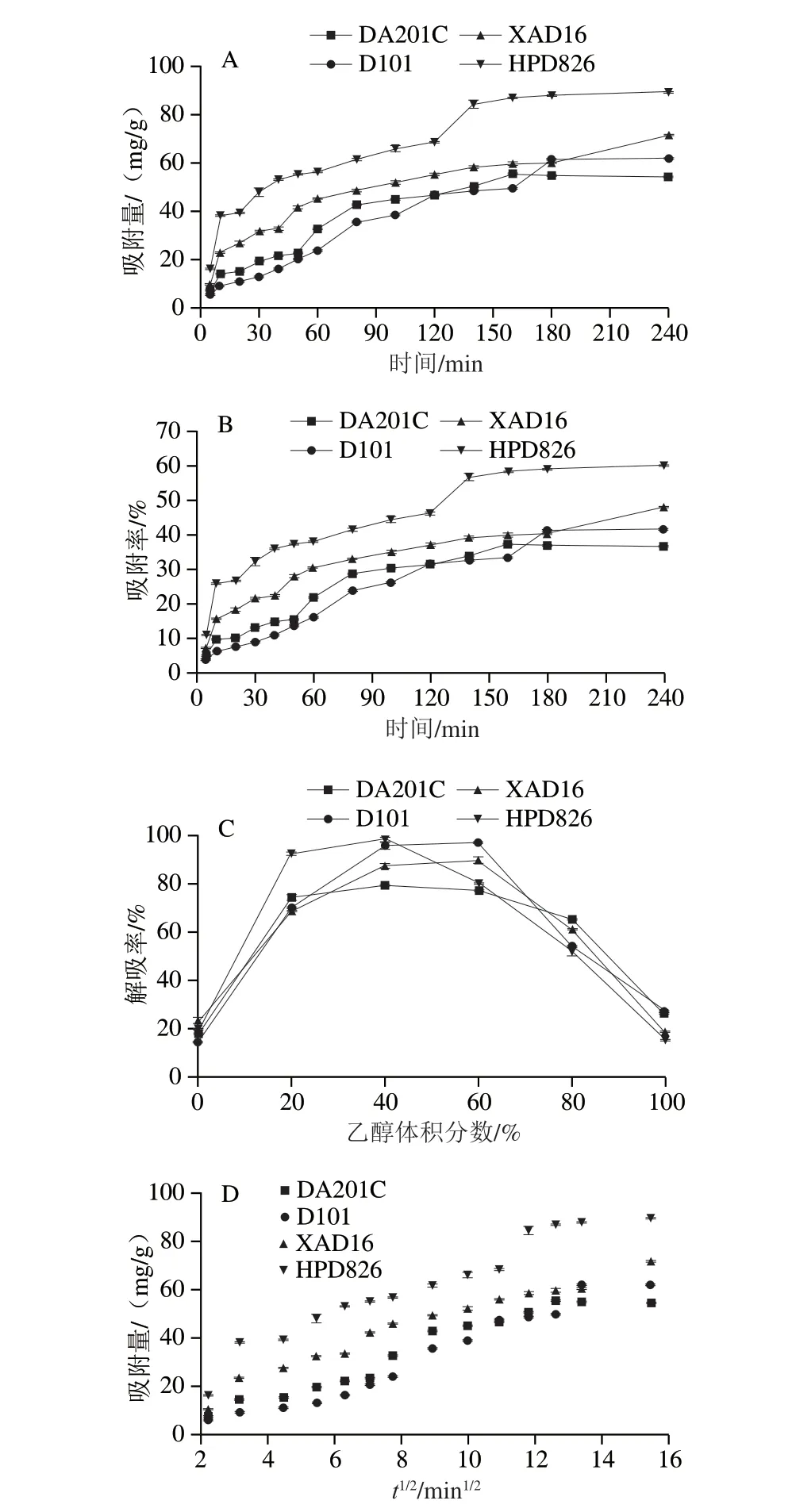
图2 不同树脂对SSPAL吸附和解吸特性的影响Fig.2 Adsorption and desorption capacity of different resins for SSPAL
如图2C所示,4 种树脂的解吸率显著不同,随着乙醇体积分数的增加,解吸率呈现先增长后降低的趋势,且当乙醇体积分数为40%时,4 种树脂的解吸率较高,HPD826(98.36%)>D101(95.58%)>XAD16(87.09%)>DA201C(79.16%),随着乙醇体积分数增加到60%时,解吸率无显著变化,当乙醇体积分数增加到80%时,其解吸率明显下降,其原因可能是乙醇体积分数较高,导致蛋白质变性。因此最终选择体积分数40%乙醇溶液进行洗脱。以上结果表明这4 种树脂的吸附和解吸速率完全不同,需要采用动力学方程进一步计算并分析树脂的吸附动力学。
如图2D所示,HPD826在0~4 min内快速扩散,之后从4~150 min缓慢吸附,最终在150~240 min内吸附饱和呈现平衡状态;其余3 种树脂同样保持3 个阶段的吸附,第1阶段为表面吸附(0~5 min),第2阶段为快速吸附扩散阶段(5~180 min),最后阶段为吸附缓慢最终饱和(180~240 min)。说明4 种树脂对SSPAL的吸附不同,且表现多重性质。
2.2.2.2 SSPAL的HPD826树脂分离结果
树脂的结构和材料对于大孔树脂的吸附和解吸具有显著影响。HPD826树脂在整个吸附过程中效果最佳。HPD826树脂具有相对理想的表面积(500~600 cm2),并且可以通过氢键与SSPAL中的侧链氨基酸相互作用,从而发挥更好的吸附和解吸能力,这与前人研究[31]一致。如表3所示,经HPD826大孔树脂分离之后,SSPAL的胰脂肪酶抑制率显著提高,IC50显著降低。

表3 SSPAL经HPD826分离前后对PPL的IC50Table 3 Decrease in IC50 of SSPAL after purification with resin HPD826
2.3 UPLC-MS/MS鉴定SSPA
利用UPLC-MS/MS对SSPAL-E组分进行检测。一级质谱图中得到多个母离子,进行分析后得到二级离子碎片的信息(表4)。SSPA中鉴定得到31 种多肽,其中含有2 个氨基酸的肽段有11 个,约占35.48%;含有3 个氨基酸的肽段有15 个。鉴定得到较多含精氨酸的多肽(19 个)。以Hippophae rhamnoides为关键词,在UniProt中进行搜索,发现大多数肽段来源于Protein TIC 214,包括NN、VR、LR/IR、DR、TR、FD、EF、FR、PSP、ELR/EIR、EER和NLLHR。另外还有部分肽段来源于Protein Ycf2,包括EDS、QLF、FL(I)R和WRN。根据质谱数据(峰面积)计算得到分离组分中多肽总量为28.08%,其中VR、FR、RDR、APYR、NLLHR和EEAASLR的肽含量较高,分别为2.90%、7.40%、1.10%、1.50%、1.40%和1.10%。VR、FR和NLLHR均源于Protein TIC 214,RDR来源于Ribulose bisphosphate carboxylase large chain,APYR来源于30S ribosomal protein S2, chloroplastic,EEAASLR来源于Photosystem I P700 chlorophylla apoprotein A2。使用Peptide Ranker可计算出多肽的生物活性潜力,SSPA的理论得分范围为0.036 7~0.997 1,说明其生物活性存在较大差异。据报道,预测得分超过0.5的多肽被认为具有较强的生理活性[32-33],表4中有20 个多肽得分大于0.5,可认为具有较高生物活性,根据ToxinPred分析,这20 种多肽均没有毒性,将对其进行后续分析。

表4 UPLC-MS/MS鉴定结果Table 4 Results of peptide identification by UPLC-MS/MS
2.4 SSPA的活性分析
2.4.1 分子模拟分析SSPA的活性
PepSite2通过P值分析多肽与受体的结合位点、多肽的反应残基及相互作用的受体残基,该方法被广泛应用于分析生物活性肽的结合机制[34-35]。采用PepSite2对Peptide Ranker大于0.5的SSPA进行初步分析,继续筛选出P<0.05的肽,分别是VR、FR、APYR、EEAASLR、RDR、NLLHR、QLF、ALPMDW、MLA和PSP。
分子对接被认为是探索配体与受体之间结合位点的计算辅助。采用Auto-Dock进行分子对接,使用带有MGL Tools 1.5.6软件包的AutoDock 4.2程序,对以上这些肽进行对接分析。结合质谱图(图3)中强度评分最终筛选出多肽序列。除PSP和MLA外,其余8 个肽的强度均高于500,多肽强度变化为:EEAASLR(16 000)>FR(8 000)>NLLHR(5 000)>APYR(2 000)=ALPMDW(2 000)>RDR(1 600)>QLF(1 000)>VR(600)。分子对接结合能顺序为:EEAASLR=QLF>FR=RDR>VR>APYR>ALPMDW>NLLHR,结合能越小说明抑制能力越强(表5)。据报道,含有精氨酸残基的多肽在3T3-L1、HepG2细胞和小鼠体内均有抗肥胖作用[36-37]。结合以上分析结果及多肽含量,选择VR(2.90%)、FR(7.40%)、RDR(1.10%)、APYR(1.50%)、NLLHR(1.40%)和EEAASLR(1.10%)进行合成分析。

图3 分离肽的二级结构质谱图Fig.3 Secondary mass spectra of the peptides

表5 分子对接结果Table 5 Results of molecular docking
2.4.2 SSPA与PPL结合位点分析
分子对接结果表明多肽与PPL之间至少有一种相互作用,这些相互作用(亲水作用、氢键、疏水作用、π-π相互作用/堆叠作用和范德华力)可以稳定肽-PPL复合物,并影响或改变PPL构象(图4)。氢键是抑制PPL的主要因素,以上肽段均提供了Arg(R)残基,精氨酸包含一个α-氨基、α-羧基和一个侧链胍基,因此能够通过氢键与带电残基相互作用,并通过其亚甲基与疏水残基相互作用。VR通过离子键(Asp 80)、氢键(Ser 153、Phe 78)、π-π共轭(Phe 216、Tyr 115)和疏水相互作用(Phe 216、Tyr 115)与PPL结合。FR主要通过氢键和π-π堆叠与PPL结合,其中氢键作用主要表现为NH:Phe 78(2.58 Å)、Arg 257(2.42 Å);OH:Gly 77(3.03 Å)、His 152(2.62 Å)。π-π堆叠主要表现为Phe的苯环与PPL中的Tyr 115、Phe 216和Pro 181残基的相互作用。RDR主要通过氢键与PPL结合,PPL中的His 152、Gly 77和Arg 257与RDR中的氧原子结合,形成OH键。另外PPL中的Phe 78和His 264通过CH键与RDR结合。PPL中的Phe 78与APYR中的R基团上的N原子形成氢键,而APYR中的Tyr上的苯环与PPL中Phe 216和Phe 78中的苯环形成π-π相互作用。NLLHR与PPL的结合位点较多,主要表现为与PPL上的Phe 78(2.58 Å)、Arg 257(2.42 Å)、His 152(2.62 Å)形成氢键,此外NLLHR与PPL上的ALA 179、Pro 181、Phe 216 和Ile 79通过烷基或π-烷基作用结合。EEAASLR与PPL中的Arg 257和Phe 78形成氢键,与Phe216形成π-π相互作用。
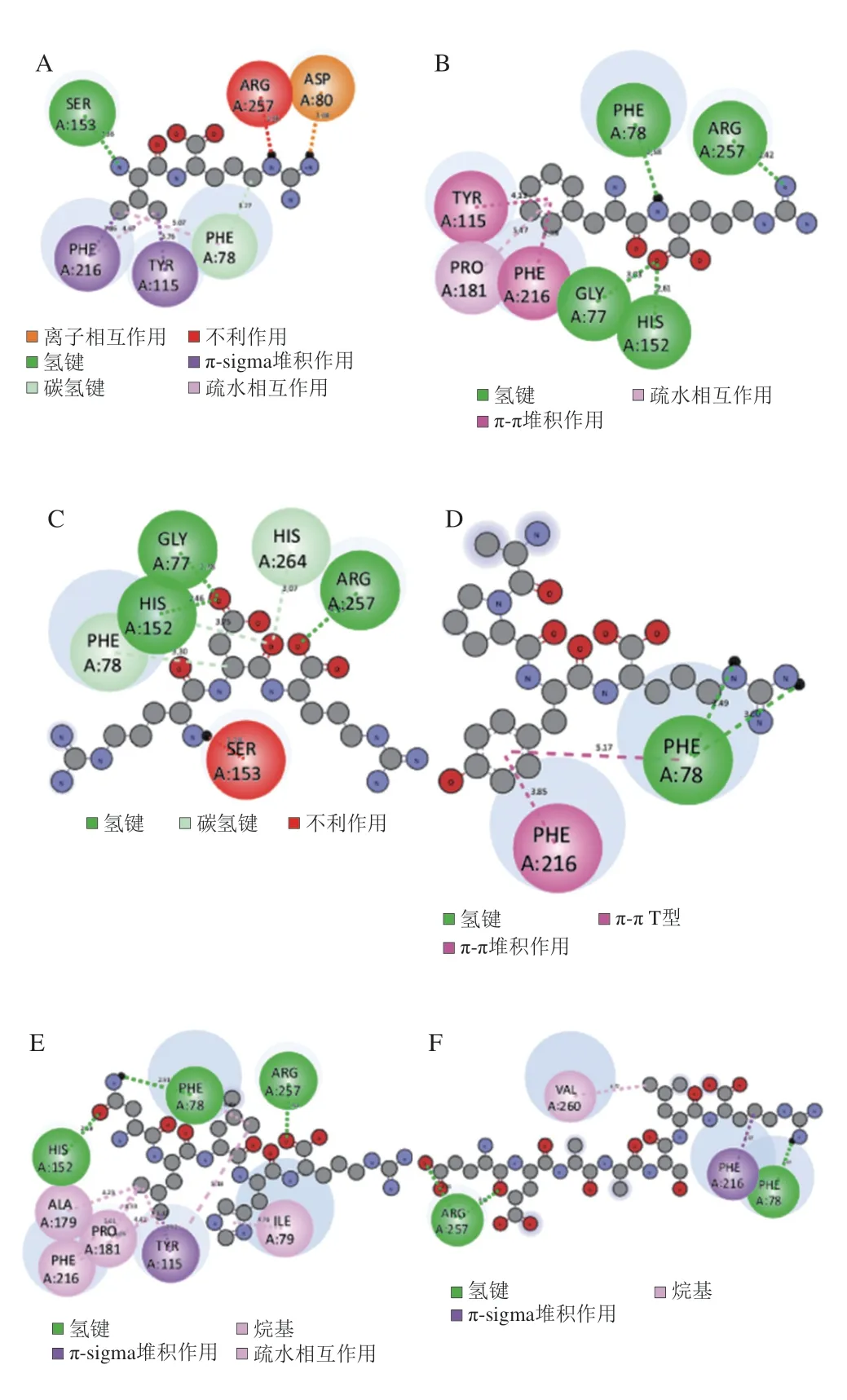
图4 SSPA与PPL相互作用分析Fig.4 Analysis of interaction between SSP and PPL
2.4.3 SSPA活性验证
如表6 所示,P P L 抑制效果最好的是N L L H R(220.70 μg/mL),其次是FR(243.07 μg/mL)、RDR(250.50 μg/mL)、VR(371.07 μg/mL)、APYR(350.41 μg/mL)和EEAASLR(510.55 μg/mL)。Pearson相关性分析发现,分子对接结合能大小与SSPA胰脂肪酶抑制率强弱之间存在正相关(r=0.865,P<0.05)。但是该结果与分离前相比,部分肽的活性反而低于分离前的混合物,表明混合物中可能含有其他影响PPL活性的物质。结合分子对接结果可知,FR、RDR和NLLHR与PPL之间具有更多的结合位点,发挥相应的功能活性。Stefanucci等[6]采用化学合成含精氨酸的碱性多肽(FRN、WRN、NRN、KRM),发现以上多肽可与胰脂肪酶活性位点相结合,发挥抑制活性,与本文研究结果相近,其共同点为肽段中含有精氨酸基团,精氨酸含有一个α-氨基、一个α-羧酸基和一个含胍基的侧链,能够通过氢键与两个带电残基相互作用,通过亚甲基疏水与疏水残基相互作用。

表6 合成肽的PPL抑制率Table 6 PPL inhibition rates of the synthesized peptides
3 结 论
研究影响SSPA活性稳定性的因素,采用系列分离步骤逐步纯化SSPA,在此基础上采用UPLC-MS/MS鉴定活性肽的氨基酸序列,筛选高活性肽段,结合分子对接手段分析抑制作用位点,具体结果如下:SSPA具有热稳定性和pH值稳定性,适量Na+和Mg2+可显著提高SSPA的PPL抑制活性,SSPA在短期贮藏过程中不会因暴露于空气而影响PPL抑制活性。超滤分离结果表明分子质量小于3 kDa的组分PPL抑制效果最好;在4 种大孔树脂中,HPD826效果最佳,其吸附量、吸附率和解吸率分别可以达到89.66 mg/g、60.31%和98.36%。UPLCMS/MS鉴定结合分子对接筛选得到6 个肽,IC50值分别为NLLHR(220.70 μg/mL)、FR(243.07 μg/mL)、RDR(250.50 μg/mL)、VR(371.07 μg/mL)、APYR(350.41 μg/mL)和EEAASLR(510.55 μg/mL)。以上6 个多肽通过氢键、π-π堆积与PPL结合。Pearson相关性分析表明,分子对接结合能高低与SSPA的PPL抑制率强弱之间存在正相关(R2=0.865,P<0.05)。
