氨基酸生物金属有机框架的构建及在生物领域的应用*
2023-10-21侯梦楠王柏文张姬晴刘圣楠张茂芳杨树凯崔培培
侯梦楠,王柏文,张姬晴,刘圣楠,张茂芳,杨树凯,崔培培
(德州学院 生命科学学院,山东 德州 253023)
1995年,Yaghi等首次提出金属有机框架(Metal-Organic Framework,简称MOF)概念,自此金属有机框架作为一种新型多孔材料得到了广泛深入的研究[1-3]。随着MOF与生命科学之间的交叉融合、相互渗透,人们不仅限于关注MOF的结构、追求大的比表面积和孔容量,而且更关注MOF与生物分子的相互作用,从活性位点、主客体作用等多个方面研究MOF与生物体相互作用的分子机制、热力学和动力学平衡等,从而产生新的研究方向。生物金属有机框架(Biological Metal-Organic Framework,简称BioMOF)应运而生。
BioMOF通常是指基于生物分子构筑的金属有机框架。从结构上分析,自然界中绝大多数生物分子均含有O或N等可以与金属离子配位的配位原子,理论上可以与金属离子形成配合物。金属离子的丰富性以及配位方式的多样性赋予了这种新型材料优异的物理性质和化学性质,在生物载药、药物缓释、荧光检测、分子探针等领域有着极大的应用前景[4-6]。目前,构筑BioMOF的生物分子主要有:氨基酸、核碱基、多肽、蛋白质等。本论文主要对以氨基酸为配体构筑的BioMOF进行综述,主要从配位模式及生物应用两个方面进行论述。
1 氨基酸
氨基酸是构成蛋白质的基本单位,赋予蛋白质特定的分子结构形态,使其具有生化活性。氨基酸分子结构中同时含有氨基(—NH2)和羧基(—COOH),并且氨基和羧基都直接连接在同一个—CH—结构上,可以与金属离子配位形成BioMOF。以简单的氨基酸为例,金属离子可以与氨基部分的N以及羧基部分的O分别或同时配位(图1)。羧基部分负电荷密度较大,与金属离子的配位能力较强,能够提供多样的配位模式。此外,羧基部分还可以与金属离子形成金属羧酸盐簇或桥梁结构,增加主体结构的稳定性和刚性。尤为重要的是,氨基和羧基还可以被当作氢键受体或氢键给体,为主客体结构构建的研究提供可能。
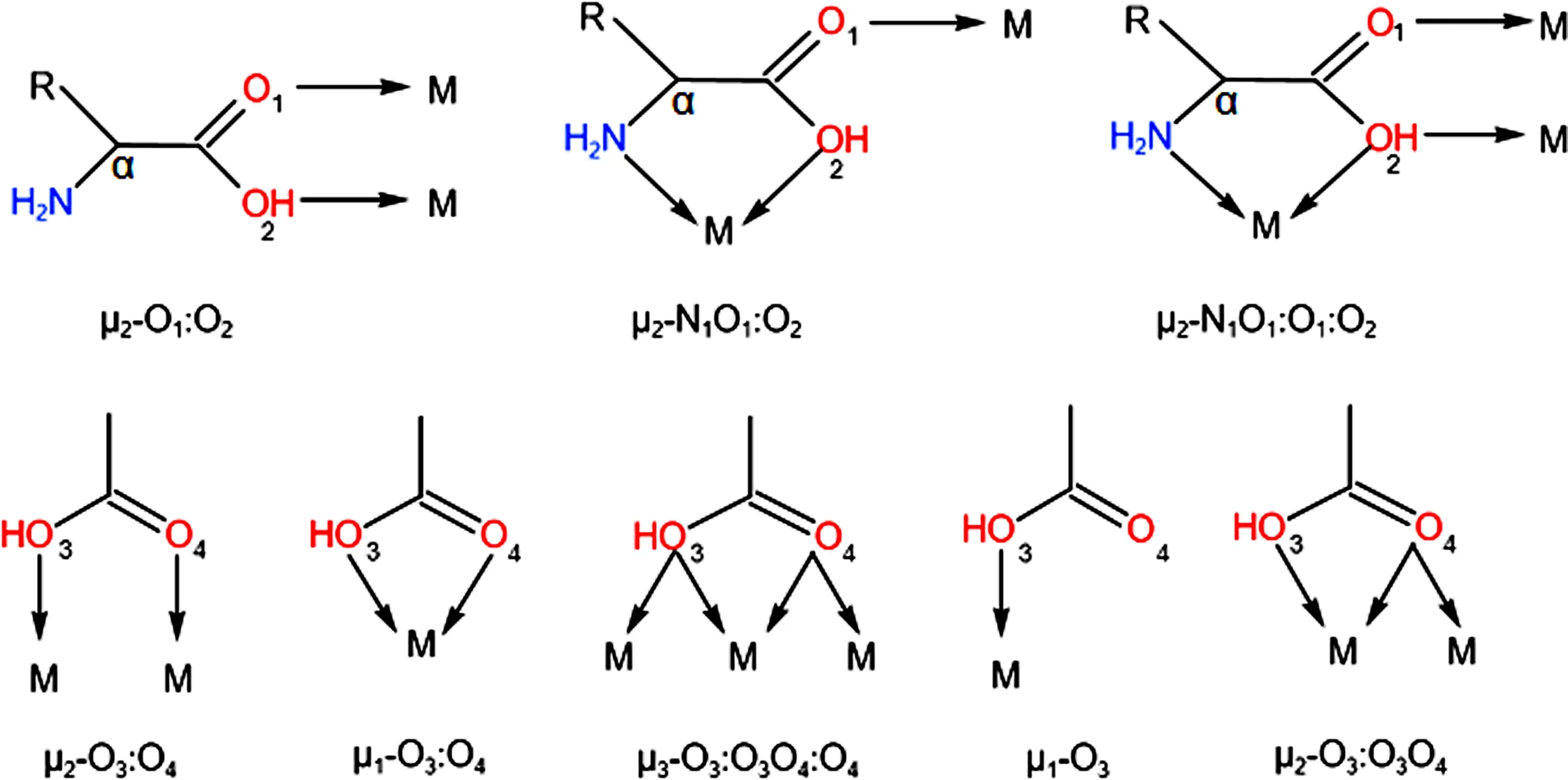
图1 氨基酸与金属离子潜在的配位模式
选用氨基酸为配体的优点还有很多,比如:①该类配体既具有羧酸配体与金属离子配位能力强的优点,又具有含N配体抑菌性强的潜力。②氨基酸作配体本身就具有很多生物活性,不仅参与人体的代谢,而且在医学上可用于治疗肝脏疾病、消化道疾病、心血管病、呼吸道疾病等;在农业上也可对作物的生长发育起到促进作用,配合物合成后有利于生物活性相关性质的拓展。③氨基酸种类多,简单易得,如天冬氨酸,赖氨酸,丙氨酸等;价格便宜,方便购买,也节约了合成配体的时间。④氨基酸是生物酶、蛋白质的结构组成单元,是一种无毒、无污染的生物配体,与稀土离子结合形成多样化状态的稀土氨基酸配合物[7-10]。
氨基酸及其衍生物在自然界中存在较多,经蛋白质水解后得到的氨基酸即α-氨基酸就有22种,如甘氨酸、丙氨酸、缬氨酸、亮氨酸、天冬氨酸、谷氨酸等,均可作为配体[11]。统计发现,就基本天然氨基酸而言,可与金属离子通过配位相互作用形成生物配位聚合物的有:丙氨酸(Ala)、丝氨酸(Ser)、半胱氨酸(Cys)、谷氨酸(Glu)、组氨酸(His)、甘氨酸(Gly)、酪氨酸(Tyr)等等。
1.1 丙氨酸
制备同手性MOF的最佳方法是选择手性配体作为主要连接体。Yang等[12]选用D-丙氨酸和L-丙氨酸作为连接体,与Ni2+离子一起合成了相同拓扑MOF。配体丙氨酸是对映体,产生的MOF为对映异构,一个Ni2+离子中心与4个D/L-丙氨酸分子连接,配位数为6,是以Ni2+离子为中心的[NiO4N2]八面体结构(图2)。其中,两个丙氨酸的羧基和氨基分别提供氧和氮原子与Ni2+离子形成一个平面,轴向位置的两个氧原子是由丙氨酸羧基提供。相邻的Ni2+离子中心通过丙氨酸配体的相互连接能够形成二维的丙氨酸-MOF网络。2019年,澳大利亚莫纳什大学王焕庭教授课题组[13]报道了一种用于高效手性分离的新型手性MOF聚合物混合基质膜。因此,这种手性MOF可以在手性分子传感和分离中找到应用。

对称性代码:(a)-x+2,y,-z+1;(b)-z+1/2,-x+3/2,-y+3/2;(c)-z+3/2,-x+3/2,y-1/2图2 Ni2+离子周围丙氨酸配体的配位模式
1.2 丝氨酸
丝氨酸是同时含有—OH、—COOH和—NH2基团的特殊分子,是典型的极性氨基酸之一。Tan等[14]以Zn(NO3)26H2O、L-丝氨酸、对苯二甲酸(H2bdc)和N,N-二甲基甲酰胺(DMF)为原料,在 120 ℃ 下合成了Zn4(L-Ser)2(bdc)6DMF。Zn2+离子采取5配位,具有扭曲的三角双金字塔几何结构。一个Zn2+离子分别与来自三个丝氨酸的羟基和羧基氧原子以及其中一个氨基氮原子结合,对苯二甲酸中的羧基氧原子也参与配位(图3)。目前,对基于丝氨酸的多孔三维MOF材料的探索甚少,市场上现有的对映纯丝氨酸构建的MOF在对映选择性催化和分离等同手性应用方面具有突出的优点。根据丝氨酸具有的极性基团,其参与构成的MOF材料可能为CO2捕获和选择性分离开辟新的途径。
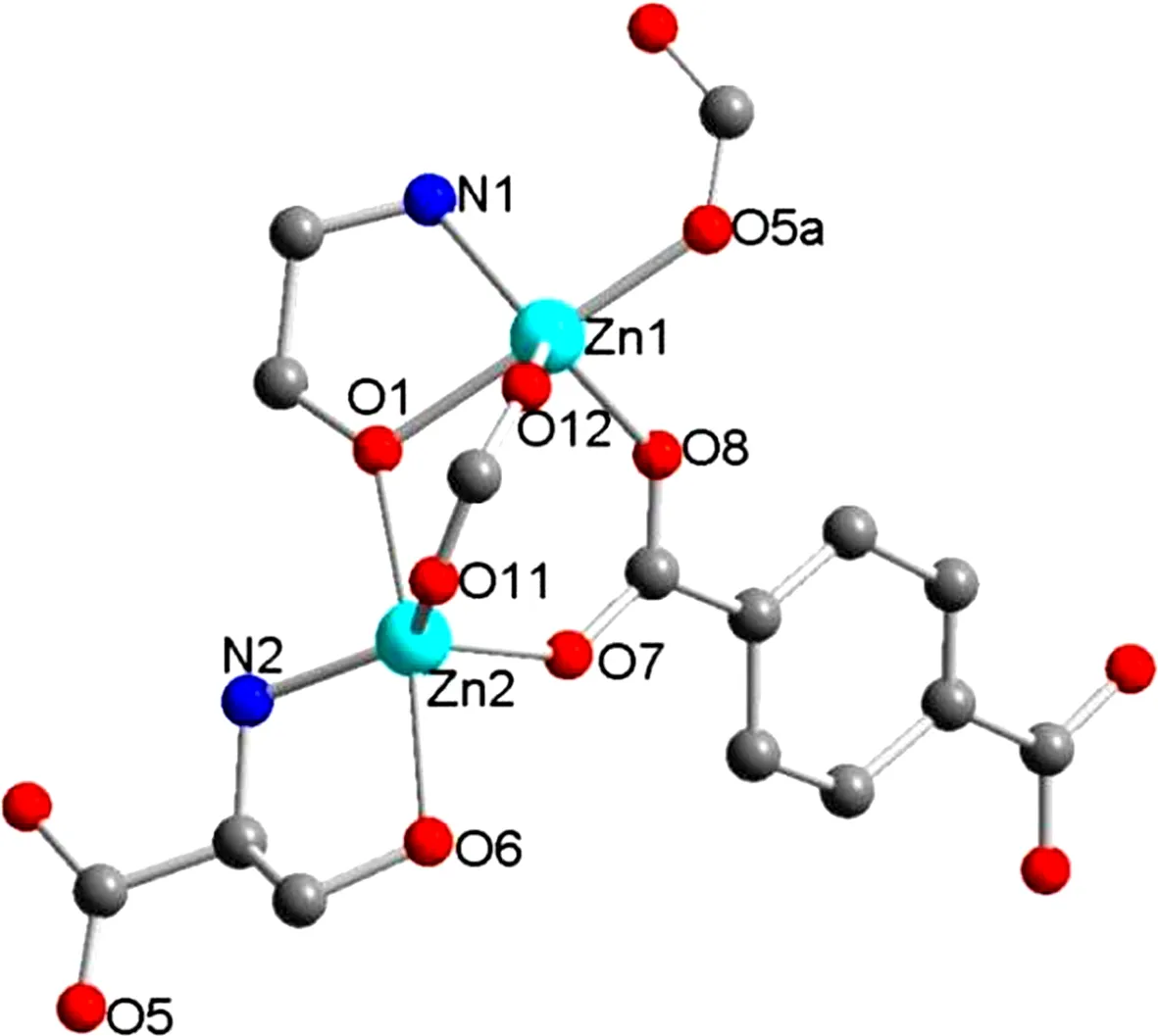
对称性代码:(a)x,y,z+1图3 Zn2+离子周围色氨酸配体的配位模式
1.3 半胱氨酸
半胱氨酸的两种对映体都用作螯合配体并形成金属配合物[15]。Ferrer等[16]将L-半胱氨酸(简称CYS)、ZnCO3的混合物在沸水中连续磁力搅拌,通过蒸发过饱和溶液制得Zn(CYS)2。Zn(CYS)2晶体结构的不对称单元以二硫化物键为中心,其链与两个锌离子相连。Zn2+离子采取6配位,八面体构型,与4个半胱氨酸结合,氨基的氮原子和羧基的一个氧原子与锌离子结合,另外一个氧原子由第二个氨基酸的羧基提供(图4)。胱氨酸的两半作为一个双齿配体与一个Zn2+离子配位,并作为一个单齿配体与另一个Zn2+离子结合。与氨基酸配体和金属离子之间形成的键相比,两个相邻氨基酸配体之间形成的键则是倾向于提高MOF的稳定性,且两个相邻L-半胱氨酸分子之间还具有二硫键(S—S),这使Zn(CYS)2具有更好的稳定性。这种MOF可以作为金属蛋白活性位点的模型,具有多种活性,如催化功能等。

对称性代码:(a)-x+2,y-1/2,-z+3/2;(b)x-1/2,-y+3/2,-z+1;(c)-x+3/2,-y+2,z-1/2图4 Zn2+离子周围半胱氨酸配体的配位模式
1.4 谷氨酸
谷氨酸因自身特有的官能团,能够为构建单元提供两个羧基和手性配位模式;谷氨酸也被作为一种多齿配体用于组装类似沸石的3D网络,且金属-谷氨酸复合物可用作研究金属-蛋白质相互作用的简单模型。Zhang等[17]以L-Glu、Co(ClO4)2·6H2O为原料在 60 ℃ 下合成[Co(L-Glu)(H2)·H2O]n,Co2+离子中心周围的几何结构是伪八面体,向三角棱柱形扭曲。Co2+离子采取6配位,与4个羧酸氧原子,一个氨基氮原子和一个水分子配位,它们属于三种不同的谷氨酸配体(图5)。谷氨酸可以通过氨基的氮原子和羧基的氧原子与Co2+离子形成伪矩形盒型结构,这些盒子沿着a轴和b轴通过顺反协调相互连接,形成波纹层,将单元连接成一个复杂但高度对称的三维阵列,这能够增强MOF的手性,也证明了其能形成强手性超分子聚集体的能力。

图5 Co2+离子周围谷氨酸配体的配位模式
1.5 组氨酸
L-组氨酸的咪唑基是一个很强的亲核基团,供出或接受质子的速度十分迅速,与许多金属离子中心一起形成复合单元[18];L-组氨酸是低分子量的配体,其带正电荷的咪唑侧链能够促进金属离子与蛋白质的结合。Ramos等[19]以NiCl2·6H2O、L-组氨酸为原料水热法得到双(L-组氨酸)镍(Ⅱ)一水合物MOF。Ni2+离子的配位数为6,是八面体构型的中心,单个Ni2+离子与两个L-组氨酸配体结合,L-组氨酸提供两个氮原子(分别来自咪唑基和氨基)和一个羧基氧原子,其他L-组氨酸遵循相同的配位模式(图6)。其中,组氨酸中咪唑基团的参与,增强了配体与金属离子的配位数并稳定了框架结构。该MOF具有手性和对映选择性,能优先吸附(S)-2-丁醇异构体,可用于手性药物的分离。
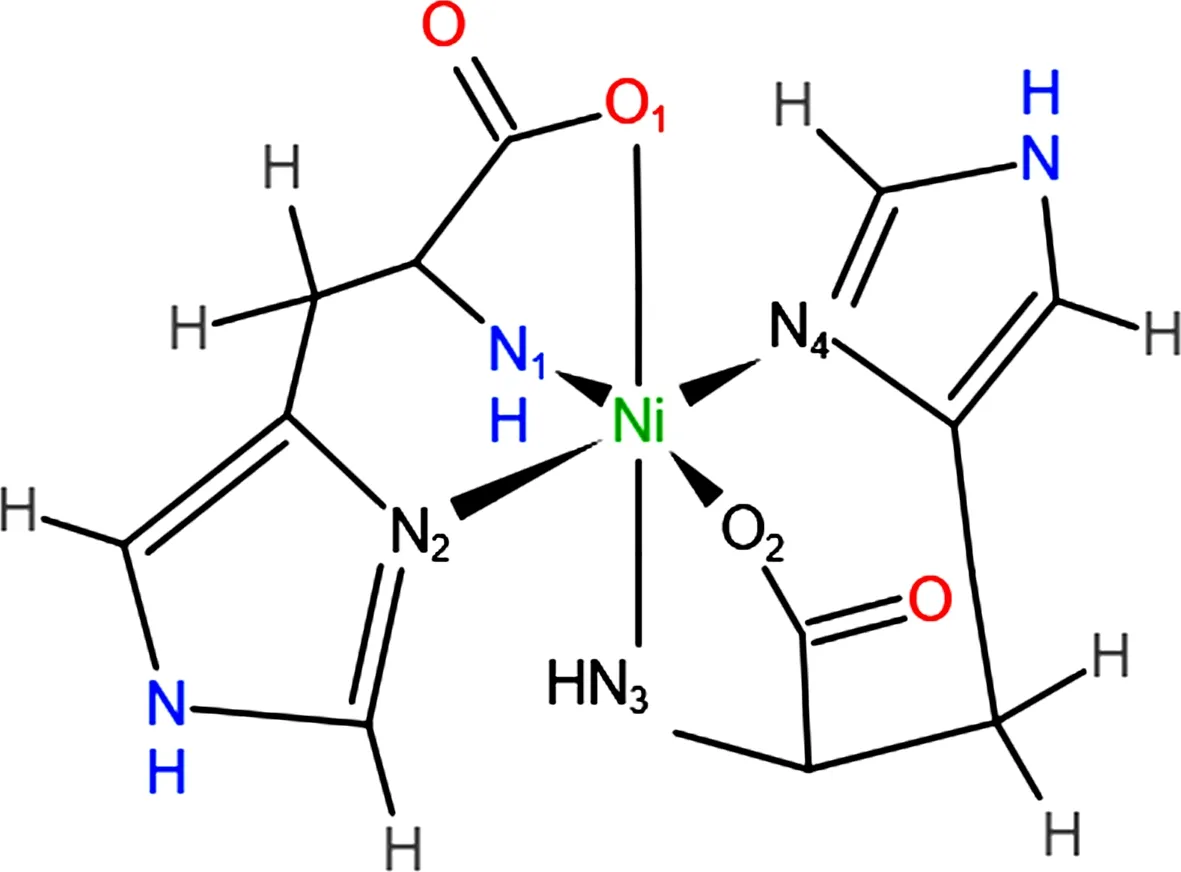
图6 Ni2+离子周围L-组氨酸配体的配位模式
1.6 甘氨酸
氮基配体的使用在构建MOF方面变得越来越重要,因为它们在气体和药物吸附方面具有更大的潜力。使用氨基酸作为连接分子也是开发此类框架的一种新策略。Sattar等[20]以甘氨酸和氯化铜为原料,水热法合成出[Cu(C2H4NO2)2(H2O)]n并命名为Bio-MOF-29。在每个不对称单元中,Cu2+离子与一个水分子和两个双齿甘氨酸配体配位。其中一种甘氨酸的氮原子和一个氧原子与Cu2+离子螯合,从而形成稳定的五元环。另一种甘氨酸配体通过氮和氧原子与铜在正方形平面中配位,由于另一种O原子的桥接模式,该配体也起到连接体的作用,从而完成Cu2+离子周围扭曲的八面体几何结构(图7)。Sattar利用盐酸特拉唑嗪、替米沙坦、格列美脲和瑞舒伐他汀这四种药物,对Bio-MOF-29进行了体外药物吸附研究。药物分子可以吸附在孔中且Bio-MOF-29在水中浸泡几天后也不会损失框架结晶度。Bio-MOF-29的体外药物吸附将为体内药物递送开辟新的途径。
1.7 酪氨酸
酪氨酸具有的芳香侧链基团会使生成的MOF具有稳定性。2012年,Zhou等[21]以L-酪氨酸和钴为原料,水热法合成了[Co(L-Tyr)]n,是一种具有三维结构的手性配位聚合物。在结构中有两个不同的L-Tyr片段以相同的方式协调金属原子(图8a),这两个片段通过羧酸氧原子、氨基氮原子和μ-苯氧基氧原子配位四个金属原子,因此每个L-Tyr具有5个配位键连接到4个金属原子,这是迄今为止记录的最高配位数。Co2+具有两种配位方式。Co2由两个羧酸氧原子、两个μ-苯氧基氧原子以扭曲的四面体几何配位,氧原子分别来自4个不同的酪氨酸配体;Co1在Co2的基础上多了两个氮原子参与配位,因此是扭曲的八面体几何中心(图8b)。[Co(L-Tyr)]n还具有很重要的磁性,因为它具有共享的四面体和八面体几何结构,这促进了铁磁交换相互作用,从而提高了L-tyrCo MOF的磁性能。
2 氨基酸生物金属有机框架的生物应用
BioMOF作为MOF的一个分支,表现出与其相似的性质。不仅在气体吸附、分离、纯化和传感方面具有实际应用,还具有一些有前途的生物应用,如生物载药、荧光传感、生物抑菌和手性分离等。
2.1 生物载药
由于高载药能力和优异的生物相容性,使BioMOF在生物医学应用中深受研究。以体外药物装载为例,2018年,Sattar等[22]报道了由赖氨酸和锰合成的纳米bio-MOF-7,以及由母体纳米bio-MOF-7和金属铜合成的Cu@纳米bio-MOF-7复合材料。纳米bio-MOF-7对盐酸曲美他嗪的体外药物吸附高达 0.073 g/g,且从材料中释放的时间可以达到 3 d;Cu@纳米bio-MOF-7复合材料的吸附量高达 0.195 g/g,药物的释放长达 5 d,且复合材料的性能优于母体纳米bio-MOF-7。虽然BioMOF在药物递送方面表现出优异的性能[23-24],但药物装载效率仍然不高。为了促进药物的渗透吸收,有效地提高药物的生物利用度和药物装载效率,对药物和BioMOF之间的相互作用机制是下一步需要研究的方向。
2.2 荧光传感
近年来,具有特定功能的BioMOF由于其多样的结构而显示出广泛的发光性能,又兼有结合位点多、低毒,以及生物相容性好等特点,引起了对生物传感器的极大兴趣。葛亚芳等[25]通过利用L-苯丙氨酸和L-丙氨酸修饰的手性芳香多羧酸有机配体合成的过渡金属配合物都具有强的荧光发射,且溶剂DMF、DMA、丙酮以及金属离子Fe3+离子对镉配合物的荧光有很强的猝灭效应,使该配合物在对DMF、DMA、丙酮和金属离子Fe3+离子实施荧光检测方面具有应用价值。叶繁衍等[26]以丝氨酸为有机配体和过渡金属Cu2+离子合成的新型BioMOF具有能够吸附核酸和淬灭荧光的性质,并利用Ser-Cu BioMOF纳米材料与荧光适配体构建了一种新型纳米适配体传感器,用于检测白菜中农药残留。该方法对水胺硫磷在0~0.8 μg/mL 范围内表现出良好的线性关系,且检测限为 82 ng/mL,这使纳米适配体传感器在食品安全检测中具有较强的实用性。由于BioMOF材料为新型材料,在各方面的应用还较少,为了更好的发挥BioMOF材料的价值,在未来应多开展基于生物荧光传感器的研究。
2.3 生物抑菌
随着当下疾病的蔓延,耐抗生素微生物的数量不断增加,开发具有高效抗菌特性的产品已势在必行。Aarthi等[27]以L-苯丙氨酸为添加剂,得到的亚稳态α和β晶体的L-谷氨酸多晶型晶体对分离的革兰氏阳性菌和革兰氏阴性菌具有显著的抗菌活性。Emam等[28]合成的Cu-BTC MOF对大肠杆菌、金黄色葡萄球菌和白色念珠菌表现出良好的生物活性,且Cu-BTC MOF的生长导致生物杀灭合成织物的生产且没有任何生态毒性影响。Wojciechowska等[29]以L-精氨酸和4,4′-联吡啶为配体合成的新型Cu BioMOF对革兰氏阳性和革兰氏阴性细菌菌株表现出很强的抗微生物活性,且Cu BioMOF比标准抗菌剂4,4′-联吡啶表现出更好的活性。导致这种现象的原因极有可能与分子配位复合物的生物活性有关,配位离子增加了化合物的亲脂性,增强了渗透微生物细胞膜的能力,这些特征也被认为是它们比母体配体活性高的原因。到目前为止,BioMOF的抑菌机制仍需深入研究并阐明。此外,如何进一步提高环境友好型BioMOF材料的抗菌活性是未来抑菌材料研究的努力方向。
2.4 手性分离
手性对映体的分离在医药和生命科学中有着重要的作用,但由于对映体具有相同的物理和化学性质,使其分离具有极大挑战。手性MOF具有各种手性连接体,可以更好地与手性分子相互作用,从而在对映体选择性吸附和分离方面具有很好的潜力[30]。Martí-Gastaldo等[31]制备了一种基于三肽(Gly-L-His-Gly)的手性三维铜基MOF材料—Cu(GHG),该框架的一维贯穿孔道中包含羧基、酰胺基、氨基和咪唑基,并且孔径尺寸大于 2 nm,能够允许客体分子扩散进入手性孔道。(-)-麻黄碱可与骨架中甘氨酸形成弱的氢键作用,(+)-麻黄碱可与骨架中组氨酸形成强的氢键作用,同时(±)-麻黄碱都与甘氨酸中氨基和羧基有一定作用,由此实现了对(+)-麻黄碱的优先吸附。王焕庭课题组[13]将氨基酸(L-His或L-Glu)通过共价修饰引入到MIL-53-NH2骨架上合成了两种手性MOF混合基质膜材料—MIL-53-NH-L-Glu和MIL-53-NH-L-His。将MIL-53-NH-L-His、MIL-53-NH-L-Glu与聚醚砜PES混合,并通过对混合基质膜的MOF负载量的调控,实现了对外消旋体1-苯基乙醇的高效手性拆分效果。
3 总结与展望
综上可知,根据特定氨基酸的配位性质选择合适的金属离子,可以较容易地获得特定应用所需的BioMOF。同时,多齿氨基酸配体可以增加MOF网络的维度。通过使用氨基酸作为配体来获得环境友好型BioMOF,也可与其他配体一起使用,以提高稳定性并加强结构。BioMOF作为MOF家族之一的重要成员,基于其特殊的结构和功能,在生物应用中已扩展到生物医学、生物传感器、抗菌应用等多个方面。然而,在未来应用研究中还有一些问题需要解决,如提高BioMOF的稳定性(热稳定性、化学稳定性和水稳定性),制备更多纳米尺寸的BioMOF,结合BioMOF来合成多功能材料,等等。相信通过生物化学、生物医药、化学等学科的交叉合作,进一步扩大对BioMOF的研究,有望使BioMOF在生物学领域中得到更广阔的应用。
