两个鸭茅品种根系响应淹水胁迫的比较代谢组学分析
2023-10-21沈秉娜尚盼盼曾兵学生李林祥杨兴云毕磊郑玉倩屈明好李文文周晓丽饶骏曾兵老师
沈秉娜,尚盼盼,曾兵(学生),李林祥,杨兴云,毕磊,郑玉倩,屈明好,李文文,周晓丽,饶骏,曾兵(老师),3*
(1. 西南大学动物科学技术学院,重庆 402460;2. 巴中市农林科学研究院,四川 巴中 636001;3. 重庆高校草食动物工程研究中心,重庆 400715)
鸭茅(Dactylis glomerata)是禾本科鸭茅属牧草,又被称为果园草,主要分布于欧亚大陆及非洲部分高海拔地区[1-2]。鸭茅是世界著名的优良冷季型牧草,家畜的适口性强,生长季节早,与多年生豆科牧草如紫花苜蓿(Medicago sativa)等混播时,既能提高牧草产量,又可提升牧草饲用价值,可供青饲、青贮或调制干草,也常被用于草地改良和石漠化治理,是多用途类型草种资源,具有重要生态应用价值和广阔的开发前景[3-5]。我国的鸭茅资源大部分分布在西南地区、新疆天山等地的灌草丛和山坡草地,在我国南方各地现已被大量地种植和推广应用,体现出了良好的生态和经济效益[6]。
气候变化加剧了全球环境风险,影响作物生长,危及全球畜牧业的生产和经济增长[7],在加剧的环境风险中,涝害是影响作物生产力最主要的非生物胁迫之一[8]。据政府间气候变化专门委员会(intergovernmental panel on climate change,IPCC)综合报道,21 世纪末高海拔地区和赤道太平洋地区年降水量呈增加趋势,低海拔大陆地区和湿热带地区的极端降水事件将更加频繁[9]。降水过度造成的淹水环境会抑制气体通过土壤孔隙扩散,导致土壤中厌氧呼吸增强,有害物质积累,使作物根际环境恶化[10-11],除此之外对作物表型性状、生物量、活性氧离子积累和糖含量变化等方面也会产生不良影响[12-14]。在我国鸭茅的主要种植区如四川、重庆、云南、江苏等南方地区,由于洪涝灾害频繁,严重影响鸭茅的生长发育、品质和产量。但目前对鸭茅非生物胁迫的研究主要是干旱胁迫处理后的形态和生理指标变化[12,15]、干旱胁迫下叶片转录组分子机制[16]、冷胁迫下的主要生态型和相关生理研究[17-19]、热胁迫方面主要集中在形态和生理指标[20-22]以及耐热性遗传机制[23]、淹水胁迫方面主要是转录组分子机制的研究与形态和生理指标方面[24-28]。对淹水胁迫后代谢组学的研究目前暂未见报道。因此探究鸭茅响应淹水胁迫的抗逆分子机制有重要意义。
代谢组以代谢物为代表,代谢物的重要性超越了基因组和蛋白质组,位于生命信息传递的末端,并作为最终的研究方向,最接近作物现实的生存状态[29]。代谢组学可以研究植物体内不同组织及其在不同逆境胁迫下产生的所有小分子代谢物,这些代谢物在植物抗逆过程中有重要作用。目前,代谢组学已被用来研究植物在淹水胁迫下的分子机制,Wang 等[30]在菊花(Chrysanthemum morifolium)花芽分化过程中进行淹水胁迫,检测其不同生长阶段的代谢产物,发现菊花不同生长阶段黄酮类化合物积累量不同,且大量的黄酮类化合物在淹水胁迫后两个阶段均显著增强。武绍龙[31]通过代谢组学技术探究淹水胁迫对马缨杜鹃(Rhododendron delavayi)幼苗根系代谢的影响,结果显示淹水胁迫处理后鉴定到的代谢物主要是脂类、酚酸类、黄酮、氨基酸及其衍生物和有机酸等。为探究涝渍胁迫下烟草(Nicotiana tabacum)代谢物的变化,吴栋等[32]利用质谱技术对水涝胁迫下的烟草代谢物进行检测,共发现22 种代谢产物,其中初生代谢产物含量增加的主要有谷氨酸、脯氨酸、组氨酸等,次生代谢产物含量增加的主要有阿魏酸、烟碱、儿茶酚等。Komatsu 等[33]从淹水2 d 的4 日龄大豆(Glycine max)幼苗的根部和下胚轴中提取线粒体组分,鉴定差异表达代谢物,发现γ-氨基丁酸(gamma-aminobutyric acid,GABA)相关代谢产物在淹水胁迫下积累较多,这些代谢产物在菊花抗淹水胁迫的机制中发挥重要作用。以上研究说明,代谢组作为一种目前常用的组学工具,能够让研究者对植物响应淹水胁迫的分子机制有一个更全面、更深刻的认识。
鉴于此,本研究以耐涝型和涝敏型鸭茅为试验材料,不淹水为对照,淹水胁迫处理8 和24 h 后,观察植株根系形态变化,并在不同时间点取样后进行代谢组学分析,以筛选鸭茅响应淹水胁迫的差异代谢物和相关代谢通路,旨在为解析鸭茅的淹水胁迫响应机制和遗传育种改良提供理论参考。
1 材料与方法
1.1 试验材料
本试验以课题组前期通过植株形态学、生理学和根部显微结构[25,27],于2021 年春季筛选出耐涝性存在显著差异的两个鸭茅品种,即耐涝型滇北(Dianbei,DB)和涝敏型安巴(Anba,AB)作为试验材料。选取均匀饱满的鸭茅种子置于铺好3 层湿润滤纸的培养皿中,22 ℃黑暗保湿条件下萌发7 d,再继续培养7 d 后,选择长势一致的鸭茅幼苗移栽至装有蛭石、营养土和珍珠岩(体积比为1∶3∶1)的花盆(口径15.0 cm,高13.5 cm),置于光照培养箱中培养,湿度70%~85%,温度22 ℃/15 ℃(昼/夜),光周期14 h/10 h(昼/夜),光照5000 lx,土壤相对含水量保持在50%左右,培养期间根据植株需要每2 周浇1 次1/2 霍格兰溶液。
1.2 试验方法
1.2.1 胁迫处理与代谢物提取 待鸭茅植株处于分蘖前期(生长30 d 左右)时开始淹水胁迫处理。将整体长势一致的鸭茅移入水箱(长80 cm×宽 57 cm×高 50 cm),使植株完全浸没于清水中,然后加水淹没至植株叶片最高处,并确保水始终淹没鸭茅最长叶片顶部。取样时间分别为0、8 和24 h,0 h 为空白对照(CK),不做淹水处理。按时于每个时间点采集鸭茅根系组织,采集时快速清洁根系,每个时间点均取6 个生物学重复,分别命名为DB01,2,3,4,5,6、DB81,2,3,4,5,6、DB241,2,3,4,5,6、AB01,2,3,4,5,6、AB81,2,3,4,5,6、AB241,2,3,4,5,6。每个样本取0.1000 g 经液氮研磨后置于离心管中,加入80%甲醇水溶液500 μL;旋涡振荡,冰浴静置5 min 后4 ℃离心(12000 r·min-1,20 min);取500 μL 上清液,加入质谱级水进行稀释,使甲醇含量为53%;再次4 ℃离心(12000 r·min-1,20 min)后收集全部的上清液,用于后续代谢组学检测分析。
1.2.2 非靶向代谢组学分析 本研究基于液质联用(LC-MS)技术进行非靶向代谢组学研究,代谢物的分离鉴定平台为超高效液相色谱(UHPLC)与高分辨质谱联用,即液质联用(LC-MS/MS),分析时每10 个样本插入一个QC(质量对照,quality control)样本以考察整个分析过程的重复性,色谱柱为C18(hypesilGoldcolumn,美国)。样品质谱信号采集采用正负离子扫描模式,电喷雾毛细管电压,MS/MS 二级扫描为数据依赖性扫描(datadependent scans)。将得到的原始数据导入CD 3.1(compound discoverer 3.1)软件,对得到的各代谢物进行荷质比(m/z)、保留时间参数筛选,再通过离子峰预测代谢物分子式;与数据库进行比对,利用空白样品去除相关干扰离子,最后对定量分析结果进行数据处理,最后获取代谢物数据和相对定量结果。分析对比模式为DB8hvs DB0h、DB24hvs DB0h、AB8hvs AB0h、AB24hvs AB0h、DB0hvs AB0h、DB8hvs AB8h、DB24hvs AB24h,为了更加准确地挖掘数据中重要的信息,运用主成分分析(principal component analysis,PCA)、偏最小二乘法判别分析(partial least squares discrimination analysis,PLS-DA)等多元统计方法进行分析。筛选PLS-DA 模型变量的变量权重值(variable important in projection,VIP)>1.0,差异倍数(fold change,FC)>1.2 或FC<0.833 且P-value<0.05 的差异代谢物,利用京都基因和基因组途径数据库百科全书(kyoto encyclopedia of genes and genomes,KEGG)、人类代谢组数据库(human metabolome database,HMDB)、脂质代谢途径研究计划(lipid metabolites and pathways strategy,LIPID MAPS)数据库对鉴定到的差异代谢物进行注释,富集结果以KEGG Pathway 为单位,应用超几何检验,借助超几何检验方法,得到通路富集的P-value 值,其中以P-value≤0.05 为阈值,满足此条件的KEGG 通路定义为在差异代谢物中显著富集的KEGG 通路。
2 结果与分析
2.1 淹水胁迫下鸭茅根系形态变化
DB 和AB 鸭茅幼苗经过淹水胁迫处理8 和24 h 后,与0 h 相比,两种鸭茅的根系长势变弱,地上部分有伸长生长的趋势(图1)。随着淹水胁迫处理时间的延长,DB 的根系有变短趋势,在24 h 时更加明显,同时在24 h 时茎基部产生了不定根(图1C),根系尖端逐渐变黑,但地上部分长势无明显变化。AB 根系逐渐减少,地上部分逐渐出现腐烂现象(图1F),二者由于耐涝性强弱差异而表现出不同程度的涝害症状。

图1 鸭茅幼苗在淹水胁迫下的形态特征Fig.1 Appearance characteristics of orchard grass seedlings under submergence stress
2.2 数据质量评估
样品的重复相关性是检验测序结果是否可靠以及样本的选择是否合理的重要判断依据,相关性分析可以评估组内样品之间的生物学重复,同时组内样品相对组间样品的相关系数越高,获得的差异代谢物越可靠。以斯皮尔曼等级相关系数(spearman rank correlation,r)作为生物学重复相关性的评估指标,r2越接近1,说明重复样品相关性越强。如图2 所示,2 个品种各3 个处理组6 个重复组间的相关系数均接近1,这表明组内样品的重复性较好,可以用于后续分析。
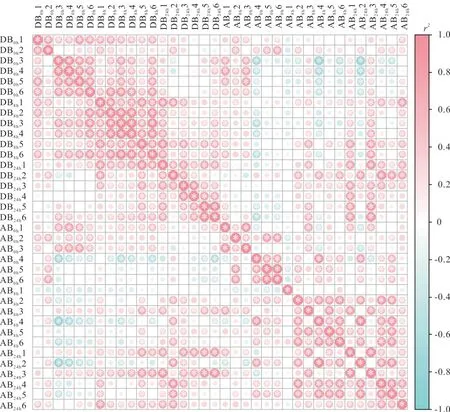
图2 样品间相关性图Fig.2 Correlation diagram between samples
对获得的各比较组之间的所有差异代谢物进行层次聚类分析(hierarchical clustering analysis,HCA),将差异代谢物相对定量值进行归一化转换并聚类分组,从而将表达模式相似的代谢物归类,归为同组的代谢物可能会具有相似的生物学功能或参与相同的代谢途径,可以在此基础上推测已知和未知代谢物的功能。如图3 所示,DB组和AB 组样本被明显的分为2 类:第一类是DB0h、DB8h、DB24h;第二类是AB0h、AB24h、AB8h。说明2 个品种在淹水胁迫下代谢物存在差异。综合来看,DB 组和AB 组在经过淹水胁迫处理后0、8 和24 h 时的代谢物均有不同程度的变化,每个组的不同时间点都存在着明确高表达和低表达的区域。

图3 差异代谢物聚类热图Fig.3 The clustering heat map of differential metabolites
2.3 PCA 和PLS-DA 分析
采用PCA 的方法,观察两组样本之间的总体分布趋势。如图4 所示,DB0h和DB8h组内,2 组组间样本被明显区分开,PC1 解释了总变量的20.64%,PC2 解释了总变量的16.48%;DB0h和DB24h组内重复样本之间距离较近,而组间样本明显分离,PC1 解释了总变量的24.65%,PC2 解释了总变量的17.80%;如图5 所示,AB0h和AB8h2 组组间样本可以区分开,PC1 解释了总变量的22.40%,PC2 解释了总变量的16.09%;AB0h和AB24h组间样本被明显分离,PC1 解释了总变量的23.54%,PC2 解释了总变量的17.11%;总体来看,不同淹水胁迫处理时间下,处理组间的代谢差异明显,代谢调控不同。PLS-DA 是一种有监督的判别分析统计方法,PLS-DA 通过建立差异表达代谢物与样本种类之间的关系模型来对样本类别进行预测。若R2和Q2越接近1,表明此模型越稳定且具有较高的可信度;如图6 和图7 所示,各组中R2和Q2分别为0.95 和0.71、0.93 和1.11、0.92 和0.87、0.94 和0.74,均比较接近1,结果表明建立的模型能反映样本的真实情况,模型的可靠性较高,试验误差小。
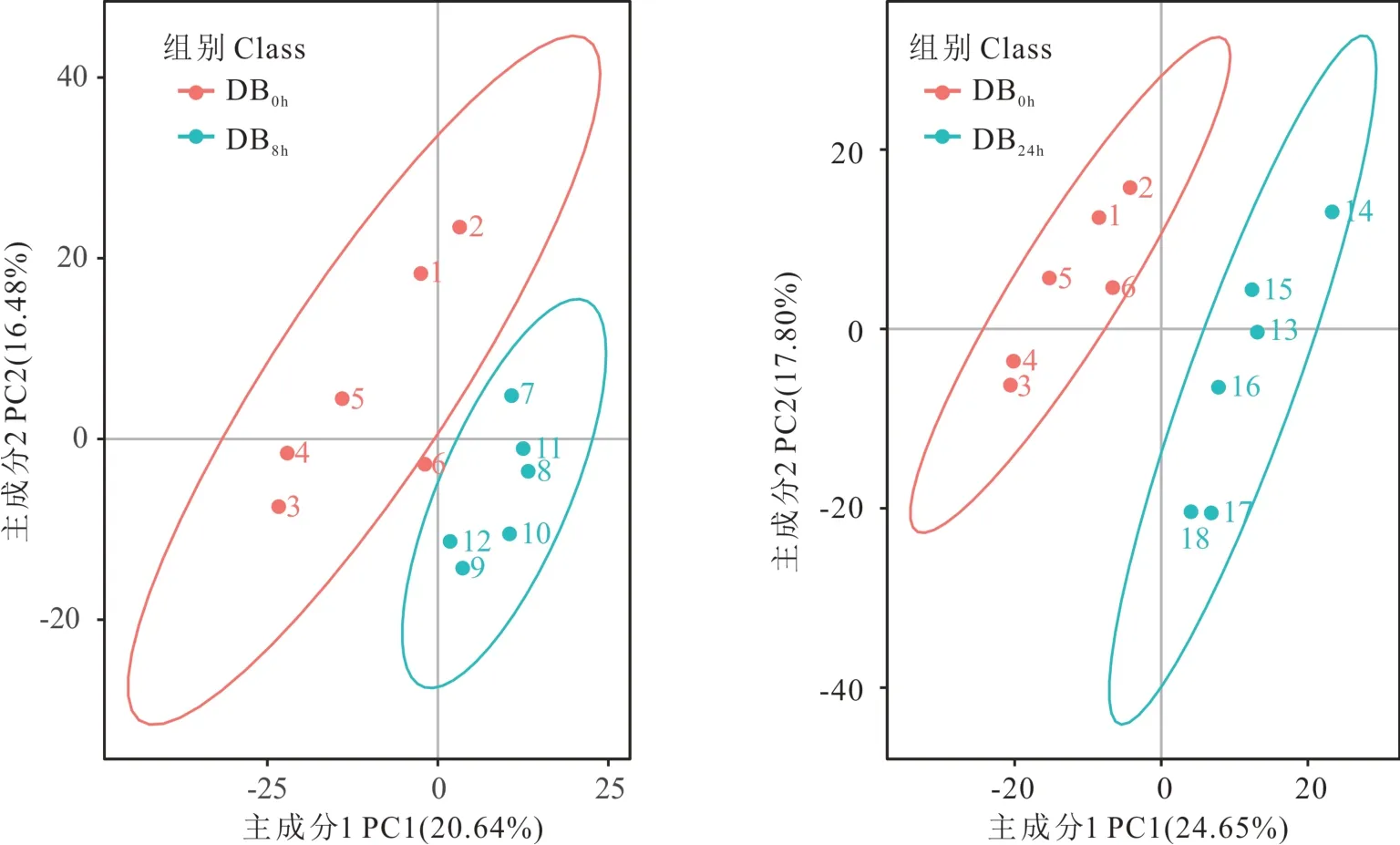
图4 DB 组主成分分析Fig.4 DB group principal component analysis
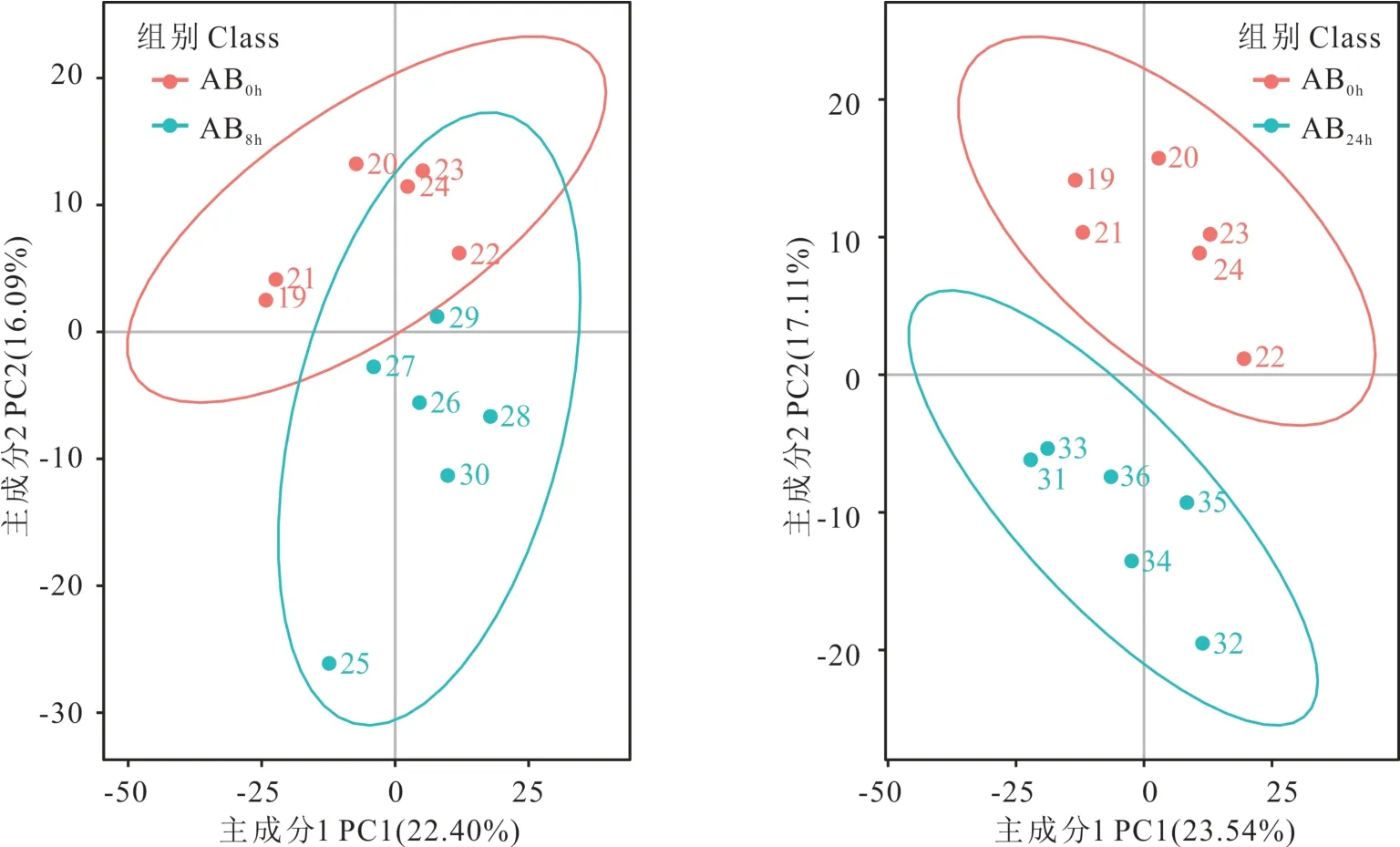
图5 AB 组主成分分析Fig.5 AB group principal component analysis

图6 DB 组PLS-DA 模型置换检验结果Fig.6 DB group PLS-DA model substitution test result

图7 AB 组PLS-DA 模型置换检验结果Fig.7 AB group PLS-DA model substitution test result
2.4 差异代谢物筛选及分析
用T检验(T-test)、偏最小二乘法判别方法的VIP(variable importance in the projection)值和差异倍数(fold change,FC)相结合的方法来筛选差异代谢物,表1 统计了筛选条件(VIP>1.0,FC>1.2 或FC<0.833 且Pvalue<0.05)下各处理组合的差异代谢物数目。淹水胁迫处理后DB8hvs DB0h组筛选出了120 个差异代谢物(64个上调,56 个下调);DB24hvs DB0h组筛选出155 个差异代谢物(60 个上调,95 个下调);AB8hvs AB0h组筛选出93 个显著差异代谢物(49 个上调,44 个下调);AB24hvs AB0h组筛选出118 个显著差异代谢物(60 个上调,58 个下调);DB0hvs AB0h组筛选出了80 个差异代谢物(23 个上调,57 个下调);DB8hvs AB8h组筛选出125 个差异代谢物(77 个上调,48 个下调);DB24hvs AB24h组筛选出48 个差异代谢物(19 个上调,29 个下调)。淹水胁迫处理不同时间后,DB 和AB 两个处理组间各自共有差异代谢物59 和42 个,而DB 和AB 两个处理组在同一时间点共有差异代谢物8 个(图8)。综合来看,DB 组的差异代谢物始终较AB 组多,随着淹水胁迫时间的延长,差异代谢物也逐渐增多。
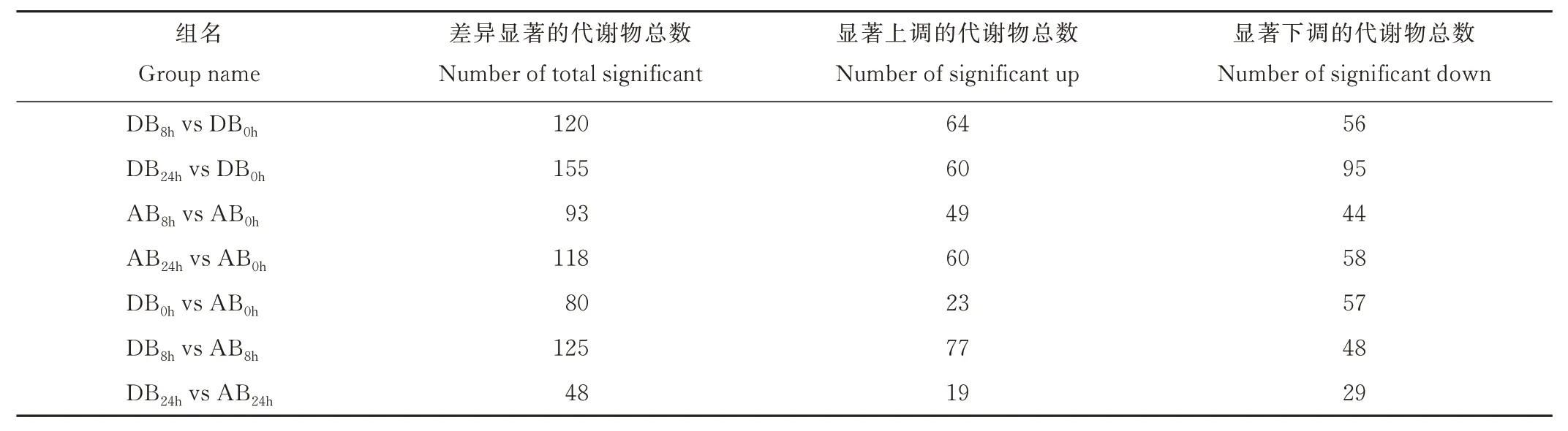
表1 代谢物数目统计Table 1 Statistical result of metabolites

图8 各对比组差异代谢物韦恩图Fig.8 Differences in metabolism among groups Venn diagram
图9 展示了各组P-value 值前20 的差异代谢物,DB8hvs DB0h组15 个差异代谢物上调,5 个差异代谢物下调;DB24hvs DB0h组14 个差异代谢物上调,6 个差异代谢物下调;AB8hvs AB0h组11 个差异代谢物上调,9 个差异代谢物下调;AB24hvs AB0h组11 个差异代谢物上调,9 个下调;DB0hvs AB0h组P-value 值前20 的差异代谢物均为下调;DB8hvs AB8h组16 个差异代谢物上调,4 个差异代谢物下调;DB24hvs AB24h组6 个差异代谢物上调,14 个差异代谢物下调。表2 对各组P-value 值前20 的差异代谢物进行了分类与统计,综合7 个组筛选出的物质较活跃的有4 类,即脂肪酸和缀合物、黄酮类化合物、氨基酸、多肽和类似物、糖及其衍生物,其中GABA 和茉莉酸(jasmonic acid,JA)等代谢物在前4 个处理组都存在,GABA 作为一种氨基酸参与鸭茅对淹水胁迫的响应,JA 是一种植物激素,在鸭茅遭遇淹水胁迫时其含量减少,淹水胁迫阻碍了JA 的合成,而在同一处理时间的种间比较组发现在淹水处理8 h 时上调差异代谢物相比24 和0 h 时数目最多,显然在淹水处理8 h 时DB 鸭茅做出了更为积极的响应。上述结果表明这些差异代谢物可能与鸭茅根系响应淹水胁迫的机制存在一定的相关性,这些差异代谢物参与到响应淹水胁迫过程中,并在其中发挥着重要的作用。

表2 各组差异代谢物数目分类统计Table 2 Statistical result of difference of metabolite number in each group

图9 各组差异代谢物统计Fig.9 Statistical result of metabolites between groups
2.5 差异代谢物KEGG 富集分析
通过KEGG 富集分析,能够识别参与差异代谢物过程的重要生化代谢和信号转导通路。富集结果分析发现,7 个比较组的差异代谢物主要富集在氨基酸代谢、碳水化合物代谢、辅助因子和维生素的代谢以及其他次生代谢产物生物合成这4 个代谢途径中(表3)。DB8hvs DB0h组注释到39 条代谢通路,DB24hvs DB0h组注释到45 条代谢通路;AB8hvs AB0h组注释到了48 条代谢通路;AB24hvs AB0h组注释到57 条代谢通路;DB0hvs AB0h组注释到22 条代谢通路;DB8hvs AB8h组注释到24 条代谢通路;DB24hvs AB24h组注释到14 条代谢通路。进一步将富集到的前10 条代谢物通路绘制为KEGG 富集气泡图(图10):DB8hvs DB0h组富集到的通路主要是泛酸盐和CoA 生物合成、色氨酸代谢、β-丙氨酸代谢和类黄酮生物合成以及苯丙氨酸、酪氨酸和色氨酸的生物合成;DB24hvs DB0h组富集到的通路主要是丙酸代谢、α-亚油酸代谢、类黄酮生物合成以及抗坏血酸和藻酸盐代谢;AB8hvs AB0h组富集到的通路主要是氨基糖和核苷酸糖代谢、氨酰-tRNA 生物合成、甘氨酸、丝氨酸和苏氨酸代谢以及硫代葡萄糖苷生物合成;AB24hvs AB0h组富集到的主要通路是苯丙氨酸、酪氨酸和色氨酸生物合成、色氨酸代谢、丙酸代谢以及硫代葡萄糖苷生物合成代谢途径;DB0hvs AB0h组富集到的主要通路是ABC 转运因子、β-丙氨酸代谢、淀粉和蔗糖代谢以及二萜生物合成代谢途径;DB8hvs AB8h组富集到的主要通路是ABC 转运因子、抗坏血酸和藻酸盐代谢以及淀粉和蔗糖代谢途径;DB24hvs AB24h组富集到的主要通路是淀粉和蔗糖代谢、核黄素代谢、类黄酮生物合成以及黄酮和黄酮醇的生物合成代谢途径。

表3 各组KEGG 通路统计Table 3 Statistical result of KEGG pathway for each group

图10 KEGG 富集气泡图Fig.10 KEGG enrichment bubble diagram
为了进一步挖掘与本研究相关的差异代谢物,在KEGG 富集分析后,将参与主要代谢通路的差异代谢物挑选出来,做进一步的分析(表4)。对各处理组富集的主要代谢通路分析发现,在DB 组中所涉及较多的差异代谢物是黄酮类化合物,分别是:橙皮素、甘草素、芹黄素、新橙皮苷、柚皮素和柚皮苷,参与的代谢途径是类黄酮生物合成途径;而在AB 组中所涉及较多的差异代谢物是氨基酸及其衍生物,分别是:O-磷酸-L-丝氨酸、L-谷氨酸、L-酪氨酸和色氨酸,参与的代谢途径是氨酰-tRNA 生物合成、甘氨酸、丝氨酸和苏氨酸代谢、硫代葡萄糖苷生物合成、苯丙氨酸、酪氨酸和色氨酸生物合成以及色氨酸代谢途径;在DB 和AB 对比组中发现DB 的特异性差异代谢物是碳水化合物、氨基酸及其衍生物和黄酮类化合物,分别是蔗糖、异麦芽糖、6-磷酸海藻糖、L-鸟氨酸、L-组氨酸、D-鸟氨酸和芹菜素,参与的代谢途径分别是ABC 转运因子、淀粉和蔗糖代谢、β-丙氨酸代谢、类黄酮生物合成以及黄酮和黄酮醇的生物合成代谢途径。上述代谢物可能在鸭茅响应淹水胁迫中发挥重要作用,而在2 个组中不同的差异代谢物可能也是DB 和AB 耐涝性存在差异的原因。

表4 各组主要KEGG 通路注释Table 4 Annotation of the main KEGG pathways for each group
3 讨论
3.1 淹水胁迫对鸭茅根系形态的影响
淹水胁迫下植物会出现生长损伤和表型的变化,且根系指标(长度、面积、生物量)比地上部指标(枝条高度和生物量)更容易受到影响[34],植物受淹后根系是第一个面临低氧胁迫的器官,根系细胞的有氧呼吸转变为无氧呼吸,一系列无氧呼吸产物如乙醇、乙醛和乳酸等大量积累,打破细胞代谢稳定,导致根系细胞死亡,黑根(水渍根)数量也会随之增加[35]。本研究中,随着淹水胁迫处理时间的延长,鸭茅根系逐渐减少,根系细胞也因为无氧呼吸产物的积累,导致根系尖端变黑,地上部分有伸长生长的趋势,但在淹水胁迫处理24 h 时,AB 地上部分逐渐萎蔫,而DB 则无明显变化,这可能是二者耐涝性强弱不同所致。淹水胁迫后在植株的茎基部会形成不定根以取代因缺氧而窒息死亡的初生根,从而提高植物的耐淹能力[36],在淹水胁迫24 h 时,耐涝型的DB 鸭茅在茎基部产生了不定根(adventitious roots,ARs),以代替初生根,缓解根尖的缺氧胁迫,而涝敏型的AB 鸭茅则没有明显的不定根产生,受到涝害没有得到很好的缓解,可见不同品种的鸭茅由于耐涝性强弱差异出现不同程度涝害症状。
3.2 淹水胁迫对鸭茅根系差异代谢物的影响
代谢组学可以解释生物系统与其环境之间的相互作用以及所有相关的变化,是研究植物抗逆机制的方法之一,代谢物对植物生物量和结构的影响是植物代谢中不可缺少的组成部分[37-38]。本研究利用LC-MS 方法对淹水胁迫下不同处理时间的两种鸭茅根部进行代谢组学分析。在前4 个处理组中,共获得486 个差异代谢物,DB 组275 个,AB 组211 个。其中DB 在淹水胁迫8 h 时有120 个差异代谢物,在24 h 时有155 个差异代谢物;AB 在淹水胁迫8 h 时有93 个差异代谢物,在24 h 时有118 个差异代谢物。随着淹水胁迫时间的延长,两种鸭茅的差异代谢物也随之增多,说明鸭茅对淹水胁迫做出了积极的响应。但相对耐涝品种DB 的差异代谢物始终比相对不耐涝的AB 多,在短期胁迫下,DB 的代谢更加旺盛,对淹水胁迫的响应也更加积极。有研究也发现涝敏型植物对淹水胁迫的响应没有耐涝型植物积极,代谢物也存在差异[39-40]。
新陈代谢是由生化反应网络组成的,这些反应在生物体内产生各种各样的有机化合物,植物的代谢可分为初级代谢和次级代谢,脂类和氨基酸途径等初级代谢产生的低分子量有机分子直接参与植物的基本生命功能,对植物的生长、发育和生存至关重要[41-42]。本研究中7 个组筛选出的差异代谢物较活跃的有4 类,即:脂肪酸和缀合物、黄酮类化合物、氨基酸、多肽和类似物和糖及其衍生物,且大量的氨基酸类、有机酸类和黄酮类上调。这些物质在鸭茅响应淹水胁迫的过程中发挥了重大的作用。时羽杰等[43]发现淹水胁迫下藜麦(Chenopodium quinoa)花期产生的差异代谢物主要是氨基酸类、有机酸类、脂肪酸类和糖类,其中苯丙氨酸、酪氨酸、丝氨酸、异亮氨酸、蛋氨酸、脯氨酸是抗淹水胁迫的关键代谢物质。吴栋等[32]分析水涝胁迫下烟草的代谢产物,发现产生的主要差异代谢物是氨基酸类和有机酸类。
GABA 是一种非蛋白质氨基酸,对提高植物的抗逆性具有重要作用[44],对缓解植物低氧胁迫损伤有重要作用。植物淹水胁迫的主要表现有低氧胁迫和缺氧胁迫2 个部分[45],吴晓蕾等[46]采用水培法研究外源GABA 对甜瓜(Cucumis melo)植株在低氧胁迫下活性氧代谢的影响,证实外源GABA 可通过提高植株体内抗氧化酶活性,从而促进甜瓜的耐低氧能力。章垚琪等[47]分析厌氧处理对黄茶(Camellia sinensiso)叶中GABA 以及其他活性成分的含量和功能的影响,发现厌氧处理后黄茶中GABA 的含量大幅升高,经代谢组学分析共筛选出218 种差异代谢物,包括氨基酸类、有机酸类、类黄酮和核苷酸等。当植物受到非生物胁迫时,GABA 会大量积累,GABA 通过调节细胞内pH 值、离子运输、激活抗氧化系统和清除活性氧,增强了植物对非生物胁迫的耐受性,GABA 已经成为提高植物非生物耐受性的有效化合物[48]。本研究中有4 个处理组在不同时间淹水胁迫处理下的差异代谢物中都出现了GABA,由此推测鸭茅可能通过积累GABA 来抵抗淹水胁迫。
植物次生代谢物可以改变根系微生物组成和功能[49],这些次生代谢物属于不同的类别,其中最突出的是黄酮类化合物[50]和JA[51]等物质,JA 参与非生物胁迫产生的防御反应[52],Xu 等[53]发现,在涝渍敏感黄瓜(Cucumissativus)品系Pepino 的下胚轴中JA 含量在淹水2 d 后约为对照组的2 倍,而耐涝品种‘Zaoer-N’的下胚轴JA 含量在淹水过程中显著降低,JA 含量与植物耐涝性可能呈负相关。淹水条件下,同一植物不同组织中JA 含量也会存在差异[36],例如柑橘(Comamonas testosteroni)叶片JA 含量在淹水条件下显著高于对照,但根系JA 含量却急剧下降[54]。本研究中,JA 在4 个处理组中都下调,这可能是由于在缺氧条件下抑制JA 合成途径的关键酶引起的。由此可以推测鸭茅在应对淹水胁迫时,也通过这些次生代谢物改变其根系的微生物组成和功能来适应逆境。
本研究在DB 组中8 和24 h 共同注释到的主要通路是类黄酮生物合成途径,类黄酮是植物重要的次生代谢物,具有抗氧化、自由基清除等功能,参与植物对环境胁迫的适应过程[55],非生物胁迫下植物细胞会产生大量活性氧物质(reactive oxygen species,ROS),从而对植物造成严重的氧化伤害。植物在长期进化中能合成多种酶促和非酶促ROS 清除剂,后者包括黄酮类化合物[56]。Ma 等[57]通过广泛靶向代谢组学分析淹水胁迫对菊花中黄酮类化合物合成的影响,发现淹水胁迫可以通过影响黄酮类合成途径中相应关键酶的表达来改变类黄酮的积累。姜百惠[58]对降香黄檀(Dalbergia odorifera)幼苗进行了淹水胁迫和盐胁迫,代谢组学分析发现淹水胁迫后产生的差异代谢物显著大幅度上调的为黄酮类化合物,注释到的KEGG 代谢通路主要是类黄酮生物合成途径、新陈代谢途径和次生代谢物的生物合成途径。在本研究中随着淹水胁迫时间的延长,DB 组始终通过类黄酮生物合成途径等其他代谢途径影响对胁迫的应答机制。而在AB 组中则没有注释到类黄酮生物合成途径,这或许是DB 比AB更耐涝的原因之一。在前4 个处理组中,富集到最多的代谢通路是氨基酸代谢途径,植物在遭遇逆境胁迫时,会通过对氨基酸的合成和降解,来减轻逆境胁迫所带来的危害,植物响应淹水胁迫的代谢调控方式包括氨基酸代谢、碳代谢和氮代谢等[59]。在淹水胁迫下,紫花苜蓿氨基酸代谢相关的基因和代谢物被激活[60],以调节维持正常的生理活动。Ma 等[57]研究发现黄条早竹(Phyllostachys praecox)的根部在缺氧胁迫下,磷脂和氨基酸是其主要代谢产物,脂质代谢和氨基酸代谢是机体响应缺氧应激的关键途径。在本研究中也发现鸭茅通过大量的氨基酸代谢途径来应对淹水胁迫。此外,在DB 对比AB 的3 个组中发现了较多的差异代谢物是碳水化合物、氨基酸及其衍生物和黄酮类化合物,分别是蔗糖、异麦芽糖、6-磷酸海藻糖、L-鸟氨酸、L-组氨酸、D-鸟氨酸和芹菜素,参与的代谢途径分别是ABC 转运因子、淀粉和蔗糖代谢、β-丙氨酸代谢、类黄酮生物合成以及黄酮和黄酮醇的生物合成代谢途径,推测这些差异代谢物是DB 比AB 更积极响应淹水胁迫的原因之一。在鸭茅应对淹水胁迫时,黄酮类化合物柚皮素、柚皮素查尔酮和芹黄素以及氨基酸及其衍生物γ-氨基丁酸、L-酪氨酸和色氨酸可能发挥着更重要的作用,在后续的研究中需要进一步验证。
4 结论
本研究对淹水胁迫不同时间后的两个品种鸭茅根系代谢物进行了分析。通过分析耐涝型和涝敏型鸭茅在不同胁迫处理时间下的差异代谢物和主要差异代谢物类型,发现随着淹水胁迫时间的延长DB 和AB 组的代谢物都发生了变化,筛选出的差异代谢物较活跃的有4 类物质,即脂肪酸和缀合物、黄酮类化合物、氨基酸、多肽和类似物和糖及其衍生物,且大量的氨基酸类(GABA、L-酪氨酸和色氨酸)和黄酮类(柚皮素、柚皮素查尔酮和芹黄素)上调,这些上调的代谢物可能是参与鸭茅抵御淹水胁迫的关键物质。本研究为进一步研究代谢物的基因调控作用以及全面解析鸭茅抵御淹水胁迫的代谢途径提供参考。在实际生产中,可以考虑通过添加外源GABA 来减轻鸭茅受到的淹水侵害,但要更加注意在苗期的水分管理,避免长期淹水导致鸭茅的产量和品质下降。
