Na-K协同作用对湿法脱硝NOx演化过程的影响机制
2023-10-20邵然磊韩世旺玄承博王鲁元张兴宇程星星王志强
邵然磊,韩世旺,玄承博,王鲁元,张兴宇,程星星,王志强
(1.齐鲁工业大学(山东科学院) 能源与动力工程学部,山东 济南 250014;2.山东大学 能源与动力工程学院,山东 济南 250061)
0 引 言
空气污染对人类健康和环境造成严重危害,国家对燃烧污染物排放的要求日趋严格,其中钢铁(球团、烧结)、冶金、焦化、化工等行业排放的NOx和SO2更是环保治理的重点[1-3]。为应对空气污染,中国制定了严格的NOx和SO2排放标准,其中,控制NOx排放的方法主要是选择性非催化还原(SNCR)、选择性催化还原(SCR)和溶液吸收。目前NH3选择性催化还原NOx(NH3-SCR)是脱硝领域应用最广泛、最有效的技术[4-5],而控制SO2排放主要通过石灰石-石膏湿法脱硫(WFGD)实现[6- 7]。值得注意的是,一方面,使用石灰石/石灰-石膏法去除SO2将产生大量石膏,大部分脱硫石膏未得到有效利用,被丢弃或填埋,造成资源浪费和环境污染[8];另一方面,联合脱硫脱硝系统在WFGD基础上加装SCR使系统复杂化,导致设备投资和运行成本增大,同时存在氨易泄漏和催化剂易中毒等问题[9-10]。20世纪80年代后,分离式脱硫脱硝技术存在设备复杂、占地面积大、投资和运行成本高等问题。而同时进行脱硫脱硝系统时,结构紧凑,投资和运行成本低,但采用固相脱除SO2与NOx过程中存在竞争,SO2与NH3结合能力远强于NOx,极易造成硫酸铵盐沉积,进而引起催化剂不可逆失活[11]。因此,开发一种能够实现同时脱硫脱硝,具有高效率、低成本的新工艺具有重要意义。各国对联合脱硫脱硝进行了大量研究,开发了70多种同时脱硫脱硝工艺,包括过渡金属离子催化法、络合吸附法、氧化法、杂多酸法、尿素法、电子束辐照法、脉冲电晕等离子体法、固相吸附再生法、光催化法和吸附剂喷洒方法等[12-14],由于设备复杂,试验条件苛刻,多数不具备商业运用价值。
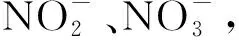
基于高锰酸钾(KMnO4)强氧化性、易获得等特性,采用0.1 mol/L高锰酸钾(KMnO4)溶液进行预氧化,NO预氧化后通入SO2,利用一定比例的NaOH/KOH作为吸收剂对混合SO2/NO去除系统进行测试。评估不同操作参数对鼓泡塔反应器NO去除效率的影响,确定了最佳试验条件,验证了二氧化硫和氮氧化物在液体中的协同作用,并对相关反应机理进行了假设。
1 材料和方法
1.1 试验装置和材料
主要化学试剂由麦克林集团化学有限公司提供。化学试剂有NaOH(≥96.0%,分析级)、KOH(≥96.0%,分析级)、KMnO4(≥96.0%,分析级)、Na2SO3(≥96.0%,分析级)。试验由4部分组成,分别为:烟气模拟系统、预氧化系统、吸收系统和气体取样分析系统,如图1所示。

图1 试验系统示意Fig.1 Diagram of experimental system
模拟烟气系统中使用的标准气体为N2(>99.99%)、O2(21%)、SO2/N2(体积分数2%的SO2)和NO/N2(体积分数2%的NO),所有气体均由鸿运达特种气体有限公司(中国济南)提供。模拟烟气中的SO2、NO和O2由质量流量计控制,分别为2.5、12.5和238.0 mL/min。
对于预氧化系统,考虑到气体停留时间及分散度对预氧化的直观作用,主要使用100 mL带石英砂芯的鼓泡反应器作为预氧化反应器,其中KMnO4添加量为50 mL,使反应器床层充分浸没,增加气相物种预氧化时间,增强氧化效果。
气体吸收系统与预氧化系统类似,需增加液相的湍流阻力,增加吸收的驱动力,降低传质阻力,提高湿法脱氮效率。因此,使用100 mL气体吸收瓶作为吸收反应器,使用碱液同时进行湿法脱硫脱硝。需要注意的是,为使反应温度保持恒温,使用水浴锅将反应器及预氧化器充分浸没,通过热电偶记录并控制水温。
气体取样分析系统中,反应物经预氧化、吸收后,通过Gasmat-4000测试尾气中气体成分,该分析仪包含红外传感器、预热器和过滤转装置,提供稳定信号、良好精度和良好重复性,测定空气中的NOx、SO2、N2O浓度。其转化率见式(1)、式(2):
(1)
(2)
式中,η(NOx)、η(SO2)分别为NOx、SO2的转化率,%;φ(NOx)in和φ(SO2)in分别为模拟烟气进口处NOx和SO2体积分数,10-6;φ(NOx)out和φ(SO2)out分别为处理后烟气中NOx和SO2体积分数,10-6。
1.2 色谱条件的确定
测试在IC-8618离子色谱仪上进行,该仪器配备全自动进样器以及淋洗液装置,LH-YA抑制型电导检测器,选用阴离子交换色谱柱。首先打开仪器主机以及工作站软件,预热5~10 min,并将流量设定为0.3 mL/min,开启色谱泵并将色谱柱接入流路。当压力稳定时,调节流量至0.6 mL/min,电导值稳定后进行采样。其中,淋洗液为1.7 mmol/L NaHCO3+1.8 mmol/L Na2CO3;流速1.0 mL/min;柱温30 ℃;抑制电流50 mA。
1.3 试验条件
1)预氧化剂的选择。分别采用高锰酸钾、亚氯酸钠、过氧化氢测定NO预氧化效果。
2)碱液吸收剂。研究不同吸收剂对同时脱除效率的影响,并与单纯去离子水吸收时的结果进行比较。
3)吸收剂浓度。测定了吸收剂浓度为0.010 0、0.002 0、0.003 0、和0.000 5 mol/L时脱硫脱硝效率,吸收液体积为80 mL。
4)气体组分。测定添加SO2以及Na2SO3对脱硝效率的影响。通过向气体组分中添加SO2以及向吸收剂中添加Na2SO3实现。
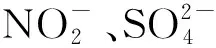
2 结果和讨论
2.1 去离子水、NaOH和KOH吸收剂对未预氧化NOx的吸收性能
NaOH、KOH对NOx吸收性能优异,是湿法烟气脱硫最常用的吸收剂,为比较去离子水、NaOH和KOH对未经预氧化NOx吸收性能,分别采用去离子水,0.01 mol/L NaOH,0.01 mol/L KOH及0.01 mol/L NaOH、KOH混合液(n(NaOH)∶n(KOH)=1∶2),0.01 mol/L NaOH、KOH混合液(n(NaOH)∶n(KOH)=2∶1)作为吸收剂在反应温度50 ℃下进行NO吸附性能测试(湿法脱硝工业应用温度为40~60 ℃,因此选择50 ℃为反应温度)。结果如图2所示,可知所有组分在初始时间内即出现断崖式下降,在10 min内转化率均降至0,这主要是由于NO难溶于水,吸收驱动力较差。其中,去离子水的吸收效果最差,基本不存在吸收效果[21],与之相比,在吸收液中添加NaOH、KOH后,NOx吸收效率略有改善,在5 min时吸收率可维持在10%左右,可以看出Na、K离子浓度不同所造成的微弱差异,即K离子浓度高的吸收剂吸收时间略长,而NO难溶于水,几乎不与碱液反应[12]。考虑到试验结果的差异性,这可能是由于Na、K离子的存在促进了NO氧化,或增加了NO溶解度,且K离子的促进作用强于Na离子。
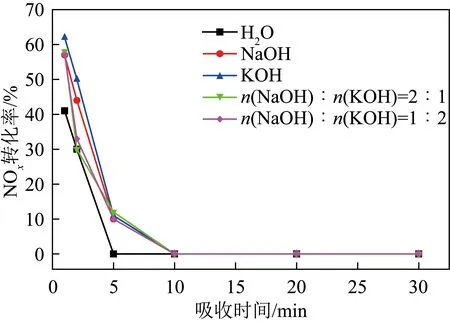
图2 去离子水、NaOH和KOH直接吸收法的脱硝效率Fig.2 Denitrification efficiency of direct absorption method using deionized water, NaOH and KOH
2.2 预氧化剂的选择
由第2.1节可知,在未经氧化的条件下,无论何种吸收剂对NO几乎没有吸收作用。因此,分别用浓度为0.1 mol/L的KMnO4、NaClO2以及H2O2进行对比试验,为排除其他离子影响,采用0.01 mol/L的NaOH作为吸收剂并在50 ℃进行测试。KMnO4、NaClO2、H2O2预氧化对NO转化率的影响如图3所示,显示了3种氧化剂预氧化对NO转化率随时间的变化关系。结果表明,经3种氧化剂处理后都能有效提高NO去除效率,并能长时间使脱除率保持在60%以上。通过图3对3种氧化剂综合评定,其去除能力KMnO4>H2O2≥NaClO2,30 min平均去除率分别为85.7%、82.3%、80.7%,以KMnO4为氧化剂的优势较明显,且图3表明,由于KMnO4存在持久氧化性,以KMnO4为预氧化剂的NO吸收效率曲线与其他2种相比较为稳定,随时间不断延长转化率存在缓慢下降趋势。总体来说,强氧化剂对NO去除效率的提高幅度大于弱氧化剂,因此,在后续试验中,优选0.1 mol/L的KMnO4作为预氧化氧化剂。然而,强氧化剂比弱氧化剂需要更高的成本[22-24],因此,在实际应用中,添加剂的种类和用量根据成本效益确定,需考虑污染物排放标准、附加成本以及安全和设备。

图3 KMnO4、NaClO2、H2O2预氧化对NO转化率的影响Fig.3 Effects of pre-oxidation with KMnO4, NaClO2 and H2O2 on the conversion rate of NO
2.3 不同种类吸收液对NOx吸收性能的影响

图4 0.01 mol/L NaOH、KOH、n(NaOH)∶n(KOH)=1∶2、n(NaOH)∶n(KOH)=2∶1吸收液对NO转化率的影响Fig.4 Effects of absorption solutions of 0.01 mol/L NaOH, KOH,n(NaOH)∶n(KOH)=1∶2,n(NaOH)∶n(KOH)=2∶1 on the conversion rate of NO
2.4 吸收液浓度对NOx吸收性能的影响
分别以浓度为0.010、0.020、0.030、0.005 mol/L的NaOH、KOH、n(NaOH)∶n(KOH)=1∶2、n(NaOH)∶n(KOH)=2∶1吸收液,测试不同浓度吸收液对吸收效率的影响,测试结果如图5所示。对比不同浓度的影响发现,吸收剂浓度较低时,其随时间变化不稳定。以NaOH为例,浓度为0.005 mol/L时,其初始效率为91.3%,随反应时间延长逐渐下降,测试30 min时,转化率仅为80%,其他成分吸收液与之类似。在所有浓度中,0.020 mol/L效果最佳,其中以KOH为吸收剂的样品30 min吸收率高达100%,随碱液浓度增加,吸收率未明显上升,部分样品略下降,说明OH-浓度达到一定值后,对NOx的吸收效果影响不大。这由于反应过程属于气液接触反应,继续增加浓度反而会降低气体的扩散系数和溶解度,直接影响NOx的溶解度[26-27]。由图5(b)可知,以KOH为吸收剂的样品受浓度影响小,高于0.010 mol/L后,均能表现出优异的吸收度,仅在低浓度下随测试时间下降。通过对比不同溶液中K离子浓度发现,图5(c)中n(NaOH)∶n(KOH)=1∶2比(NaOH)∶n(KOH)=2∶1中的K离子浓度高,NOx转化率更加稳定,图5(b)中KOH仍表现出最佳吸收活性,并随K离子比例下降而减弱,但仍保持高于60%的转化率。

图5 吸收液浓度对NOx的吸附效率的影响Fig.5 Influence of absorbent concentration on the NOx adsorption efficiency
2.5 添加SO2对脱硝效率的影响

2.6 添加Na2SO3对脱硝效率的影响
Na2SO3对SO2的吸收性能优异,是湿法烟气脱硫最常用的吸收剂。在传统的W-L工艺中,采用Na2SO3作为吸收剂,其优点是富集的SO2可通过吸收后的热气汽提或蒸发进行再生、分离、回收和再利用[30-31],主要发生以下反应:
(3)
(4)
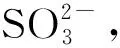
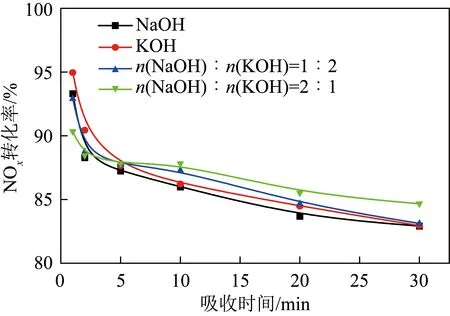
图7 添加Na2SO3对脱硝效率的影响Fig.7 Influence of Na2SO3 addition on the denitrification efficiency
(5)
(6)
(7)
(8)
(9)
(10)

(11)
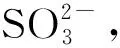
3 离子色谱测定吸收液中阴离子浓度
根据前期结果分析,优选0.02 mol/L吸收液进行离子色谱测定。
3.1 碱液中离子性质的变化

图 4为Ma∞=1.5时燃烧室内的流线、 声速线和当地Mach数分布图. 根据图 4(a)可见楔板后侧和凹腔内均出现较大范围回流区, 图 4(b)显示除喷流膨胀区和楔板后缘小部分区域外, 燃烧室整体为亚声速流动(Ma<1), 这是由于当Ma∞=1.5时, 燃烧室内发生高化学当量比的富油燃烧, 燃烧产生的巨大热量造成热壅塞, 使流动发生壅堵, 隔离段内产生正激波且被推至隔离段入口处(如图4(b)所示).
图8 单纯碱液吸收NO中不同组分阴离子随测试时间的变化Fig.8 Evolution of different component anions in the absorption of NO by pure alkaline solutions over time
(12)

3.2 添加SO2碱液中离子性质的变化
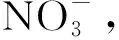

图9 添加2.5 mL/min SO2后吸收碱液中不同组分阴离子随测试时间的变化Fig.9 Evolution of different component anions in the alkaline absorption solution with the addition of 2.5 mL/min SO2 over time
(13)
3.3 添加Na2SO3碱液中离子性质的变化

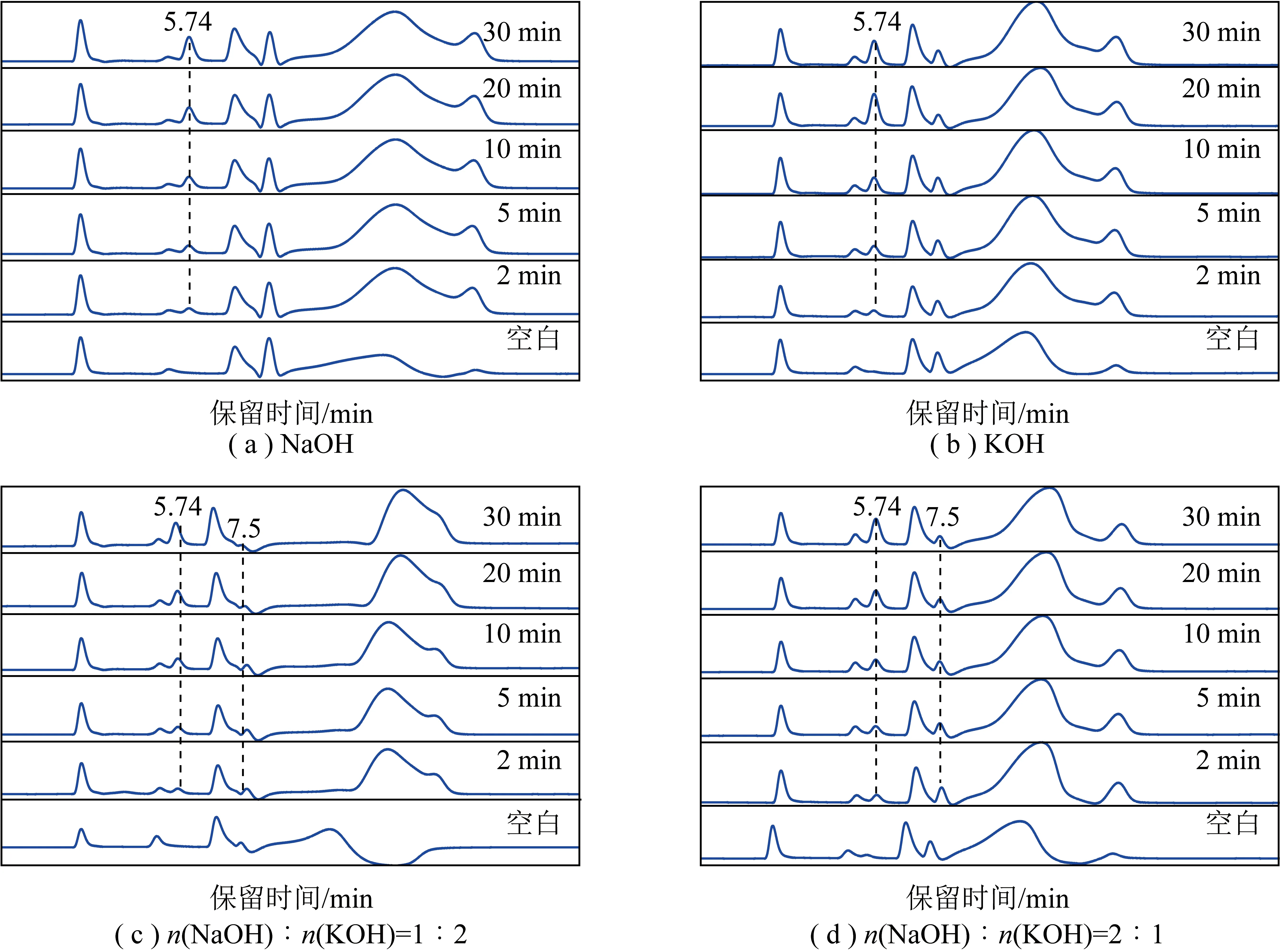
图10 添加0.001 mol/L Na2SO3后吸收碱液中不同组分阴离子随测试时间的变化Fig.10 Evolution of different component anions in the alkaline absorption solution with the addition of 0.001 mol/L Na2SO3 over time
3.4 吸收液脱硝反应机理探究及反应热计算

分子构型计算如图11所示。
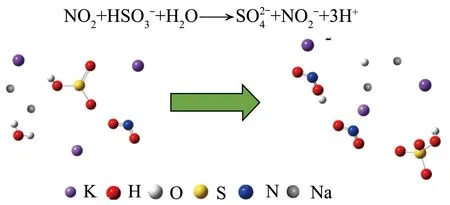
图11 分子构型计算Fig.11 Molecular configuration calculation diagram
首先,计算了NO2溶于不同碱液所构建体系热量的变化,如图12所示。由图12(a)可知,由于反应放热使反应体系趋于稳定[35],表明在不同碱液中反应均自发进行,与之产生明显差别的是,构建的反应模型中,吸收液为KOH的体系反应中存在更稳定反应构型,与之前的测试相印证。主要是由于K+离子半径大于Na+离子,在溶液中易形成游离态的OH-,而NO2溶于碱性溶液发生歧化反应,生成亚硝酸与硝酸,由于OH-更易解离,导致所产生的硝酸物种中H+更易释放成为游离态,进一步与碱液中OH-反应生成H2O,促进了反应正向进行。如前所述,当K+浓度过高时,由于液膜限制,并不会有效提高NO吸收率。

图12 反应过程中能量变化Fig.12 Comparison of energy changes during the reaction process

(14)
由于SO2在碱液中的溶解度比NO2高1个数级,使影响非常显著,NO2被新的氧化还原途径大量吸收转化,由此增加SO2和NO2气体与吸收液之间的化学反应环节,即增加反应级数可以强化脱硫脱硝效果。
最后,比较混合碱液与单一KOH吸收液反应中的能量变化,探究双金属离子(Na和K)共同催化作用下对促进的SO2和NOx协同湿法脱除的作用机制。在Na-K协同作用下反应模拟计算的分子构型(图11)中,双金属离子的协同作用加快了溶液中亚硫酸根离子以及水分子中H—O键的断裂,促进亚硝酸根的转化形成,H+游离在溶液中。由图12(c)可知,当吸收液仅为KOH时,NO2与SO2协同反应放出热量为243.5 kJ/moL,而将吸收液体系改变为同浓度的混合吸收液时,反应热为299.6 kJ/moL。混合碱液更有利于反应进行,可促进S-N物种的吸收与转化,这可能是双膜效应导致,即气相中的反应物NO2、SO2等由气相主体通过气膜扩散到气相与碱液相邻界面中,并由气相中的反应物由气液相界面扩散到液膜内,在液膜内与由液相主体扩散到液膜内的液相中的反应物进行化学反应。同时气相中的反应物继续向液相主体中扩散,在液膜中未反应的气相反应物进入到液相主体,并与液相主体中的反应物继续反应。而过高浓度的K离子可能抑制了两膜之间的扩散,从而抑制了反应物中间体之间的接触反应。当溶液中为Na、K溶液时,由于双金属离子的电荷传递效应,使气相反应物向液相传递时气膜迅速破裂,减少了气液两相的扩散时间,从而提高了反应效率,如前所述,SO2的加入增加了NO2氧化还原新途径,这使在Na、K离子驱动下,通过SO2的作用,表现出较高的转化率。

4 结 论
1)在单纯测试NO吸收率时,吸收剂为氢氧化钾碱液的组分性能明显高于氢氧化钠,归因于K离子存在更大的离子半径,更易解离OH-所致。

