污泥燃烧过程氮迁移转化机理
2023-10-20黄宝成薛永明
赵 亮,王 欣,黄宝成,孙 瑜,薛永明,张 海
(1.上海发电设备成套设计研究院有限责任公司,上海 200240;2.上海交通大学 机械与动力工程学院,上海 200240;3.苏州吴中综合能源有限公司,江苏 苏州 215124)
0 引 言
随着工业生产的发展,城市生活污泥排放量日益增多。污泥中含大量有害物质和可被利用的有机物质[1]。优化能源结构,充分利用太阳能、风能和污泥等新型能源是实现碳中和的重要选择[2-3]。目前无害化和资源化处理污泥,已成为一个世界性的环境难题[4]。
污泥的处理方法主要包括填埋、堆肥、建材利用、海洋倾倒以及焚烧等。其中填埋、堆肥、建材利用、海洋倾倒法会对环境造成一定污染,且不能利用污泥中的有机物[5-7]。而焚烧法与其他方法相比,处理速度快,减容率高[8],且焚烧还可杀灭致病微生物,同时可回收污泥本身能量。因此,污泥焚烧处理是最具发展前景和最彻底的污泥处置方法[9-13]。焚烧时的温度可达850 ℃以上,使污泥中可燃成分充分燃烧、有害成分充分分解,最终形成稳定的灰渣,可实现脱水污泥减量90%以上。然而该技术在处理污泥时会产生大量NOx、SOx和微细颗粒等污染物[14],一方面会带来二次污染,另一方面也会增加投资运行成本。国内外研究者针对煤、生物质等燃料燃烧的氮氧化物排放机理展开诸多研究[15-20],提出应用减少氮排放措施。污泥与其他燃料掺烧时氮氧化物排放的机理也引起学者们关注,但鲜有污泥独立焚烧时NOx生成与控制机理研究。污泥中氮的赋存形式与煤、生物质差异很大,煤中氮主要以吡啶氮、吡咯氮和季氮的形式存在[21],而污泥中的氮主要以蛋白质和氨基酸的形式存在,不同污泥中氮含量差异巨大,氨基酸种类复杂多变。基于煤、生物质等燃料燃烧过程氮氧化物生成机理的结论并不适用于污泥。污泥氮含量可达2.5%~9.0%[22],远高于煤中的0.5%~2.5%[23]。因此,探究污泥燃烧过程中氮的迁移转化是污泥资源化、无害化处理领域的前沿课题之一,对污泥燃烧技术的发展意义重大。
研究污泥燃烧反应机理时,多基于污泥氨基酸模型化合物开展研究工作[24-27]。这些模型化合物既保留了污泥主要结构和性质,具有一定化学成分,又简化了研究对象,为研究污泥性质提供了可靠途径。但目前的研究缺乏分子层面氮转化行为追踪,对于氮迁移的理解不够系统,难以用于指导实际的低氮燃烧技术开发。
近年来,随计算机技术的发展,通过量子化学手段研究燃烧化学反应引起了研究者的兴趣。如张蓓等[28]通过量子化学方法对Zigzag型含氮煤焦热解生成NOx前驱物的路径进行设计,2条反应路径分别为热解产生HCN和NH2。王子剑等[29]采用密度泛函理论计算研究了CO2氛围下焦炭异相还原NO的相关反应,并通过表征过渡态详细剖析了焦炭异相还原NO的反应路径和反应机理。路成刚等[30]采用量子化学方法研究了污泥中重金属如铅(Pb)、锡(Sn)和镉(Cd)与甲烷(CH4)在焚烧过程中的反应产物。YUE等[31]利用密度泛函理论重点研究了H2O及其产生自由基OH在NO形成和还原反应中的作用,计算了可能存在的过渡态和中间体,对比得到了NO生成路径。微观量子化学计算可用来指导实际的燃烧试验或数值模拟,进而实现控制燃烧污染物排放的目的。如ZHANG等[32]基于研究煤燃烧过程中一氧化氮与焦结合态氮非均相相互作用的热力学和动力学作用,进一步指导化学吸附,从而减少NO排放率。王翠苹等[33]通过分子动力学模拟发现升高热解温度和载氧体的存在均促进了污泥化学结构的热解,并通过分析氮迁移路径证明铁基载氧体可降低NOx生成,与实际污泥化学链燃烧过程相同。
笔者拟借助高精度量子化学计算方法,通过构建污泥典型含氮组分迁移转化多通道反应路径,进一步分析多通道反应路径的热力学过程参数,获得明确的含氮组分迁移转化反应机理,研究结果可为进一步降低污泥焚烧过程中NOx排放提供参考。
1 研究对象及研究方法
1.1 污泥中的典型含氮组分
污泥中富含蛋白质,氨基酸是蛋白质的基本单位,含有氮元素,焚烧处理时会产生一些污染气体,探索氨基酸的热解行为有助于理解污泥的燃烧机理。选择其中4种具有代表性的氨基酸:甘氨酸、谷氨酸、苯丙氨酸和色氨酸,作为典型的含氮分子模型化合物。甘氨酸(Gly)化学式为C2H5NO2,分子量为75.07,是人体非必须的一种氨基酸,亲水性很强,但属于非极性氨基酸。谷氨酸(Glu)化学式为C5H9NO4,分子量为147.13,是人体非必须的一种氨基酸。谷氨酸大量存在于谷类蛋白质中。谷氨酸在生物体内蛋白质代谢过程中占重要地位,参与动物、植物和微生物中的许多重要化学反应。苯丙氨酸(Phe)化学式为C9H11NO2,分子量为165.19,是人体必需的氨基酸之一,属芳香族氨基酸。色氨酸(Trp)化学式C11H12N2O2,分子量为204.23,是人体的必须氨基酸之一。色氨酸作为植物体内生长素生物合成重要的前体物质在高等植物中普遍存在,也是人体中重要的神经递质——5-羟色胺的前体。这些具有代表性的氨基酸作为含氮模型化合物已被广泛应用于污泥热解及燃烧机制研究[34-37]。
1.2 密度泛函理论
在分析分子结构与部分性质时,常用的方法有半经验算法、从头算法和密度泛函算法。采用密度泛函理论(DFT)的计算方法,其优势在于含有电子相关的作用。这使在相同时间内,某些体系DFT的计算精度较其他2种方法更高,而计算消耗不会明显提升。因此,密度泛函算法应用广泛,在小分子体系的研究中已取得成功,故密度泛函理论方法适宜用于氨基酸此类小分子的反应机理研究。采用混合泛函DFT/B3LYP方法,对4种典型含氮组分以及反应中产物的结构进行优化,再用频率分析确定其真实性,同时通过能量分析得到最佳的反应路径网络。
2 结果与讨论
2.1 同分异构体模型
首先,借助Gaussview软件,通过改变原子连接方式构造甘氨酸、谷氨酸、苯丙氨酸以及色氨酸3种同分异构体模型,如图1所示。
利用Gaussian16软件,采用密度泛函理论,对图1中12个含氮模型化合物优化计算,得到相应的分子结构。一般来说,分子结构键长和键能呈反比,成键越长,2原子间的键能越小,反之键长越短时键能越大[38]。
对于甘氨酸的3个同分异构体模型,优化后结构的键长从大到小的顺序为:1-5>5-8>1-3>1-2>5-6>5-7>8-10>8-9>3-4,其中键1-5、键5-8和键1-3的长度都大于0.13 nm,明显大于其他键,说明其对应键能较小,是甘氨酸热解时易断裂的3个键。
谷氨酸的分子结构相对甘氨酸更复杂,原子数目和成键数目也更多。谷氨酸中键8-11,5-8,3-5,11-13的键长超过了0.15 nm,键11-17的长度在0.14~0.15 nm,键1-3和键13-15的长度在0.13~0.14 nm。Glu-a、Glu-b中最长的键为8-11,Glu-c中最长的键为5-8。从键长角度看,键8-11、5-8、3-5、11-13和11-17相对其他键更易断裂,成为谷氨酸热解的引发键。
苯丙氨酸中含有一个苯环,苯环结构相对苯丙氨酸中的其他结构更稳定,不易断键。苯丙氨酸最长的5个键顺序为:15-17>4-12>15-21>17-18>17-20,其中键17-20在成键时为双键,键能一般大于单键。其余4个较长的键相对苯丙氨酸中的其他键更易断开。
色氨酸中含2个氮原子,且具有芳香含氮杂环,其中氮原子的迁移也相对其他3种氨基酸更复杂。比较除苯环外的其他键长,可发现长度大于0.15 nm的键包括16-19、19-21和11-16,长度在0.14~0.15 nm的键为键19-25和键3-11,键4-14,21-23和11-12的长度都在0.13~0.14 nm。以上较长的键都可能在色氨酸热解第1步发生断键。
对4种氨基酸构造的3个同分异构体进行优化计算后,得到不同氨基酸对应的相对吉布斯自由能,参数见表1。考虑到同分异构体中能量最低的结构是自然界中最可能存在的结构。Gly-c是甘氨酸最稳定的结构,Glu-c是谷氨酸最易存在的结构,Phe-c是苯丙氨酸最稳定的结构,Try-c是色氨酸最稳定的结构。
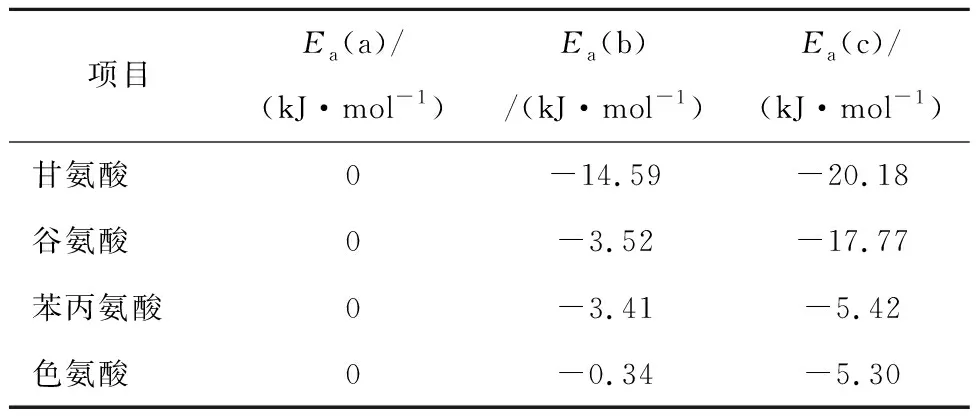
表1 4种氨基酸同分异构体的相对吉布斯自由能EaTable 1 Relative Gibbs free energies of the four amino acid isomers
2.2 4种含氮氨基酸的预测反应路径
图1中12个污泥模型化合物优化计算后,各个键的Mulliken布居数见表2~5,一般地,通过键的Mulliken布居数可判断裂解最可能发生的位点。孟韵等[39]用Mulliken布居数作为断键判据得出了与试验结果吻合的结论。本文同样以键的Mulliken布居数为依据,布居数小的键,说明这些原子间的电子分布相对较少,键能较弱,热解时会优先发生断裂。

表2 甘氨酸化学键的Mulliken布居数Table 2 Mulliken population of glycine chemical bonds

表4 苯丙氨酸化学键的Mulliken布居数Table 4 Mulliken population of phenylalanine chemical bonds
通过比较表2中甘氨酸的Mulliken布居数大小,可知其布居数大小顺序均为1-3<1-5<3-4<5-8<8-10<8-9<5-6<5-7<1-2,其中键1-3的布居数最小,是热解过程最易断裂的一个键。此外键1-5、键3-4和键5-8的布居数也较小,前文中也提到键1-5和键5-8键长较长,易断裂。在探索氮的迁移路径时,对甘氨酸预测了3种反应路径,其第1步断键对后面的路径预测非常重要,分别考虑断键1-3(—OH)、键1-5(—COOH)和键5-8(—NO2)。
对于谷氨酸,Glu-a中键3-5(0.125)的布居数最小,Glu-b中键13-15(0.110)的布居数最小,Glu-c中键1-3(0.155)的布居数最小。综合分析3个同分异构体的键布居数和键长的顺序,谷氨酸的第1步断键选择了键3-5(—COOH)、键11-13(—COOH)、键11-13和键15-16同时断开脱CO2、键5-8(—CH2COOH)、键11-17(—NH2),共设计5种不同的氮迁移路径。
对于含一个苯环的苯丙氨酸来说,其Mulliken布居数较小的4个键一致,包括键15-17、15-21、17-18和18-19。结合前文中关于键长分析,为苯丙氨酸的氮迁移设计了2条路径,考虑键15-17(—COOH)和键15-21(—NH2)是热解的引发键。
色氨酸的结构中除有一个苯环,还有一个五元含氮杂环,且含有2个氮原子,氮迁移的路径最复杂。根据表5中色氨酸键的Mulliken布居数发现,3个同分异构体中最小的5个键布居数相同且顺序一致,均为19-21<21-23<4-14<23-24<12-14,此外键16-19和键19-25的长度较长,布居数在所有键中也偏小。结合前文中关于键长的分析,综合考虑,最终预测了7个氮迁移路径。色氨酸第1步断键分别为断开键19-21(—COOH)、键4-14(五元杂氮环中C—N键)、键12-14(杂氮环中C—N键)、键19-25(—NH2)、键16-19(CHNH2COOH)、键11-16(CH2CHNH2COOH)以及键19-21和键23-24(CO2)。

表5 色氨酸化学键的Mulliken布居数Table 5 Mulliken population of tryptophan chemical bonds
选择吉布斯自由能最小的结构为最稳定结构,因此在分析氮组分的迁移路径时以Gly-c、Glu-c、Phe-c和Try-c为初始结构。反应路径的每一步都选择较弱的化学键断裂,逐步优化计算,直到分离出所有的一氧化氮(NO)。由于H、OH等自由基对NO的形成有促进作用[33],后续路径预测也涉及到相关基团。本文对甘氨酸预测的3条反应路径如图2所示,对谷氨酸预测的5条反应路径如图3所示,苯丙氨酸预测的2条反应路径如图4所示,色氨酸预测的7条反应路径如图5所示。由图2~5可知,不同的氨基酸在生成NO的过程中可能的中间体和最终结构以及每一步的能量变化。以初始反应物的能量为基准,当某一步反应的中间体比前一中间体能量基准线高,说明此步反应需要吸收能量,反之放热。

图4 苯丙氨酸(Phe)预测的热力学反应路径图(路径1~2)Fig.4 Thermodynamic reaction pathway diagram for Phe prediction (Path 1-2)
甘氨酸(Gly)路径1:甘氨酸先吸收热量,C—O键断裂,生成Gly IM1-1和OH基团。Gly IM1-1断开N—H键,生成Gly IM1-2和H自由基,在2个OH基团作用下分别生成H2O和Gly IM1-3。然后Gly IM1-3中C—N键断裂形成Gly IM1-4和NOH。NOH又生成NO和H自由基时,其中H自由基与Gly IM1-4中的C原子成键形成更稳定的生成物Gly P1。
甘氨酸(Gly)路径2:反应首先断裂C—C键,吸收热量并生成Gly IM2-1和1个COOH基团。Gly IM2-1在O基团的作用下生成Gly IM2-2,基团COOH也进一步断键和成键生成CO2和H基。Gly IM2-2易发生氢转移先生成Gly IM2-3,然后氢继续转移生成Gly IM2-4,并释放NO和CH4。
甘氨酸(Gly)路径3:第1步为C—N键断开,生成Gly IM3-1和NH2,Gly IM3-1易断键生成CO2和CH3。NH2基团则在2个O基团的作用下先生成Gly IM3-2,再生成Gly IM3-3。最终NO从Gly IM3-3释放出,并产生H2O。
谷氨酸(Glu)路径1:反应第1步为C—C键断开,生成Glu IM1-1和COOH。其中Glu IM1-1结构不稳定,H原子由N原子迁移到C原子,形成Glu IM1-2,同时COOH也通过断键形成CO2和H自由基。在O基团的作用下,N—H键断开,N和O形成N—O键,生成Glu IM1-3。最后释放出NO后形成生成物Glu P1。
谷氨酸(Glu)路径2:反应第1步为C—C键断裂形成Glu IM2-1,其中COOH基团易以CO2的形式释放,并生成Glu IM2-2。在O基团的作用下同样断键再成键生成Glu IM2-3,最后和路径1中NO释放类似,逐步生成产物Glu P2。
谷氨酸(Glu)路径3:谷氨酸的路径3首先断裂C—N键释放NH2(图3(a)),生成Glu IM3-1,COOH基团同样以CO2形式释放并生成Glu P3。NH2和O自由基分2步逐步生成NOHOH后释放NO并形成H2O。
谷氨酸(Glu)路径4:图3(b)谷氨酸结构示意中右侧的C—C键断开生成Glu IM4-1和COOH,H迁移形成结构更稳定的Glu IM4-2并产生CO2。Glu IM4-2和1个O原子结合形成Glu IM4-3,而后变为更稳定的Glu IM4-4结构。最终NO从Glu IM4-4中释放出来且生成产物Glu P4。
谷氨酸(Glu)路径5:图3(b)谷氨酸结构示意图中左侧的COOH基先以CO2形式释放出来并生成Glu IM5-1,右侧的COOH基再同样以CO2的形式释放出来生成Glu IM5-2。接下来N—H键断开,形成GluI M5-3和1个H基。在2个OH基团作用下,生成Glu IM5-4和H2O。GluI M5-4再和H原子结合释放出H2O和Glu IM5-5。在OH基团作用下,进一步形成Glu IM5-6,接着H原子迁移形成更稳定的Glu IM5-7。最终NO从Glu IM5-7中释放出来并得到生成物Glu P5。
苯丙氨酸(Phe)路径1:反应第1步为C—C键先断开,生成Phe IM1-1和1个COOH基团。中间体Phe IM1-1的结构并不稳定,H原子进一步迁移形成Phe IM1-2,COOH也进一步变化为CO2和H基。O自由基与Phe IM1-2中的N原子成键生成Phe IM1-3,最后NO从Phe IM1-3中逸出后生成产物Phe P1。
苯丙氨酸(Phe)路径2:苯丙氨酸的C—N键先断开,释放NH2,形成Phe IM2-1。其中COOH基断键释放CO2,H原子又与C原子成键生成最终反应物Phe P2。2个O原子逐步和NH2结合,最终生成NOHOH。接着NO从NOHOH中释放,剩余原子成键生成H2O,整个氮迁移路径结束。
色氨酸(Trp)路径1:反应路径1首先是C—C键断开,反应物被分成两部分,各含有1个N原子,生成中间体Trp IM1-1。五元环再断开C—C键,并与H自由基结合生成Trp IM1-2。Trp IM1-2两部分中的N原子分别与O基反应成键,生成Trp IM1-3。最终Trp IM1-3中的两部分各迁移出一个NO,形成生成物Trp P1。
色氨酸(Trp)路径2:首先断开C—C键,将色氨酸分为链式结构和环状结构,形成中间体Trp IM2-1。Trp IM2-1的链状结构不稳定,断键后再成键生成中间体Trp IM2-2,与2个O基分别作用生成Trp IM2-3。最后和反应路径1类似,2个NO从中间体Trp IM2-3中释放,生成反应物Trp P2。
色氨酸(Trp)路径3:色氨酸吸热C—C键断开,释放COOH基团,形成中间体Trp IM3-1。在H原子的作用下生成Trp IM3-2,同时COOH基团也生成CO2和H。2个O原子分别与Trp IM3-2中的2个N原子成键生成Trp IM3-3,最后释放NO脱离Trp IM33。
色氨酸(Trp)路径4:第1步为CO2从色氨酸中释放,形成中间体Trp IM4-1,在H自由基的作用下断开五元环形成Trp IM4-2。2个O原子和N原子成键形成Trp IM4-3,随后其中一个N原子以NO的形式释放,另一个N原子以NOH的形式释放,进一步生成NO和H,此时整个反应路径结束。
色氨酸(Trp)路径5:先断开靠近芳香苯环的C-N(4-14)键,生成中间体Trp IM5-1,2个O原子与N成键生成中间体Trp IM5-2。同样2个N原子分别以NO和NOH的形式逐步逸出,最终生成2个NO和产物。
色氨酸(Trp)路径6:第1步先断开五元杂环中C-N(12-14)键,C与H又成键生成Trp IM6-1,在2个O原子的作用下生成Trp IM6-2。接下来2个NO的释放与路径4类似,并生成产物。
色氨酸(Trp)路径7:反应先断开C—N键,逸出NH2后得到中间体Trp IM7-1,在H原子作用下,产生CO2和IM7-2。NH2与2个O原子结合得到N(OH)2,Trp IM7-2中的N原子也与O原子成键得到Trp IM7-3。最终2个NO分子分别从N(OH)2和Trp IM7-3中释放并得到产物Trp P7。
2.3 4种含氮氨基酸的最佳反应路径
比较图2中甘氨酸的3条路径图,3条路径的第1步均为吸热反应,路径1第1步反应吸收热量最多(408.61 kJ/mol)。路径1反应第2步和第4步仍需进一步吸热,从反应热的角度看此条路径最难发生。路径2和路径3在后面的几步反应均放出热量,可认为自发发生。由于路径3从外界吸收的热量小于路径2,因此从热力学角度来看甘氨酸的最佳反应路径为路径3,其反应过程如图6所示。

图6 甘氨酸的最优热力学反应路径Fig.6 Diagram of optimal thermodynamic reaction path for Gly
图3中对比谷氨酸的5条反应路径,路径1前2步共需吸热447.73 kJ/mol,路径2前2步共需要吸热304.92 kJ/mol,路径3仅在第1步反应时吸热317.75 kJ/mol,3个路径其余的步骤均为放热反应。路径4第1步吸收398.06 kJ/mol的热量,第2、3步共放出热量564.53 kJ/mol,虽然第4步由Glu IM4-3到Glu IM4-4为吸热反应,但吸热(30.21 kJ/mol)小于前面步骤放出的热量。路径5先吸热再放热,前3步共需从外界吸热409.40 kJ/mol。对比5条反应路径的热力学参数变化情况,路径2从外界吸收的热量最少,为谷氨酸的最佳反应路径,反应过程如图7所示。
比较图4中苯丙氨酸的路径1和路径2,路径1前2步反应共需要吸热433.40 kJ/mol,而路径2在吸收324.27 kJ/mol的热量后可自发反应,因此从热力学角度选择路径2为最佳反应路径,如图8所示。
图5展示了色氨酸氮迁移的7条预测路径,反应路径1~4和路径7均为先吸热后放热,而图中路径5、6均为先放出大量热再进行吸热反应,从热力学参数的角度看其前面步骤放出的热量可供后面步骤的吸热,不需从外界再吸热,因此可认为路径5、6能自发进行,相对其他5条路径更容易发生。路径5(吸热392.60 kJ/mol)从热力学角度更为有利,反应整体放热值略大于路径6(吸热393.19 kJ/mol),为色氨酸的最佳的反应路径,如图9所示。
从17条预测路径中选择出的4条最优的含氮组分迁移转化反应路径,如图6~9所示。甘氨酸、谷氨酸、苯丙氨酸和色氨酸,生成NO的路径需O自由基气氛作用,色氨酸还需H自由基气氛。后期工作根据路径图将量子化学与试验相结合,ZHANG等[40]通过DFT计算和试验结果相互验证,为NO的排放提供较完整的途径。
3 结论与展望
1)通过密度泛函理论方法计算并优化了甘氨酸、谷氨酸、苯丙氨酸和色氨酸4种典型含氮氨基酸的分子结构。以键长和Mulliken布居数为切入点,评估了热解反应的引发键。反应路径的每一步都选择较弱的化学键断裂,逐步优化计算,直到分离出所有的NO。为甘氨酸设计了3条氮迁移反应路径,为谷氨酸设计了5条氮迁移反应路径,苯丙氨酸设计了2条氮迁移反应路径,色氨酸总共设计了7条氮迁移反应路径。
2)从反应热力学角度汇总得出了4条主要生成物为NO的反应路径。其中甘氨酸反应吸热339.21 kJ/mol,谷氨酸反应吸热304.92 kJ/mol,苯丙氨酸吸热324.27 kJ/mol,色氨酸则为放热反应。因此,作为一种常见的污泥模型化合物,色氨酸最易发生热解产生NO。通过对反应过程参数的分析,可以提出更可靠的低氮控制策略,降低污泥焚烧对环境污染的风险。
3)仅对污泥的4种氨基酸模型化合物进行计算,未来将进一步探索其他含氮模型化合物的反应路径,并与计算结果进行比较,为明确污泥燃烧的氮转化机理提供更深层次的理论解释与依据。
