Septin蛋白功能的研究进展
2023-10-20王二龙张文婷综述宋嘉宁王娟审校
王二龙,张文婷综述,宋嘉宁,王娟审校
北京工业大学环境与生命学部,北京100124
Septin 家族蛋白是一系列与微管蛋白和肌动蛋白相互作用的高度保守的细胞骨架蛋白家族,对细胞形态和分裂至关重要,广泛存在于除高等植物以外的真核生物中[1]。作为许多形态发生和信号转导事件中不可或缺的参与者,Septin在细胞动力学机制的招募、质膜的组织和细胞极性的定向上具有非常重要的生物学意义。Septin 突变或其失调与许多疾病有关,尽管人们越来越认识到Septin 在细胞生物学和疾病等方面的重要性,但与其他细胞骨架蛋白相比,仍然相对缺乏对Septin的了解。
本文首先从Septin 家族蛋白的发现以及蛋白的结构特征、蛋白的组装与调控方面进行简要介绍和初步总结;其次,分别对Septin 蛋白作为细胞支架、扩散屏障、参与神经元信号转导及其在真菌和细菌感染等领域的功能性研究进展进行归纳和阐述;最后,对Septin 蛋白在人类疾病中的作用进行概括和整理。
1 Septin蛋白的概述
Septin 家族蛋白最早的报道是在酿酒酵母(Saccharomyces cerevisiae)中,HARTWELL[2]在温度敏感的细胞分裂周期缺陷突变体中,发现Saccharomyces cerevisiae在4 个基因(Cdc3、Cdc10、Cdc11和Cdc12)突变后会导致胞质不能正常分裂,产生细长的芽却无法与母体分离,进而使细胞出现多核现象。BYERS等[3]发现,Saccharomyces cerevisiae在出芽繁殖时,Septin蛋白会在子细胞与母细胞连接处的细胞膜内表面聚合形成1个10 nm 高度有序的颈环状结构,进而将子细胞和母细胞分隔开,而当分裂结束后,该颈环状结构自动消失,因此这种蛋白被命名为Septin。截至目前,在各类研究报道中,人们已在哺乳动物中发现13种Septin 家族基因,在Saccharomyces cerevisiae中发现7 种Septin 家族基因,在秀丽隐杆线虫中发现2 种Septin 家族基因,在黑腹果蝇中发现5 种Septin 家族基因。同时,也有研究报道,在非洲爪蟾、绿藻、褐藻及纤毛虫中也发现了Septin 同源蛋白的存在[4-7]。Septin 与细胞膜、微丝及微管存在多重联系,且形态上呈现丝状结构。因此,Septin被认为是继微丝(actin filaments)、微管(microtubule)和中间纤维(inte-rmediate filament)后真核生物细胞骨架的第4个组。对Septin蛋白功能的研究,主要是作为细胞骨架通过招募蛋白因子促进其相互作用参与调控细胞功能,并作为扩散屏障将特定膜蛋白区分隔到细胞的特定区域。除了在胞质分裂中的作用外,Septin在细胞骨架动力学、分泌和膜重塑中也起着重要作用,并与神经元发育异常以及致病侵染导致的多种人类疾病相关。见表1。
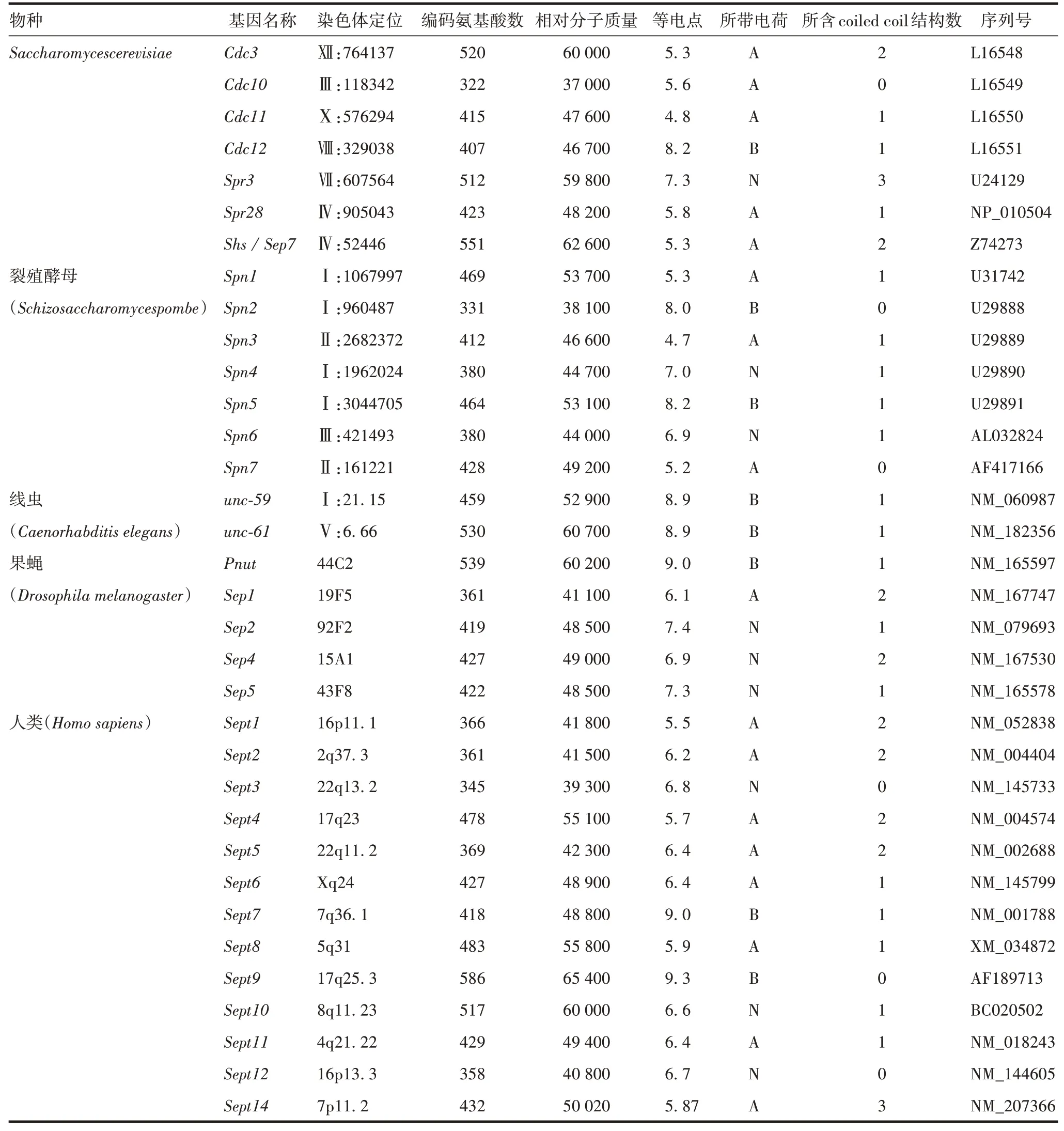
表1 不同物种中的SeptinTab.1 Septin in various species
2 Septin蛋白的结构、组装及调控
在生物体内,Septin家族基因编码的蛋白相对分子质量为30 000 ~65 000,多数Septin蛋白具有在GTP酶超家族成员中发现的1 组GTP 酶基序,即G-l、G-3和G-4。G1 功能域主要用于结合GTP 的磷酸基团,G3功能域为水解GTP所必需的基序,G4功能域可结合GTP 中鸟嘌呤碱基[8]。Septin 蛋白单体的核心结构域由以下几部分构成:富含脯氨酸的氨基末端(N-端)序列、能与磷酸肌醇结合的碱性氨基酸区、位于中心的具有高度保守性的GTP 酶结合域、含有1 个卷曲螺旋结构的羧基末端(C-端)区域以及Septin 独有原件(Septin unique element,SUE),多数SUE 由高度保守的53个氨基酸组成。在不同的Septin蛋白中,两端的序列在长度和组成上具有较大差异[9-10]。同时,来自不同亚群的Septin可通过GTP结合域或N-端区域与C-端区域相互结合形成G-G 接头或N-C 接头的复合物,进而相连形成丝状或环状高级结构来发挥相应的生物学功能[11]。见图1。

图1 Septin蛋白单体的结构域示意图Fig.1 SchematicdiagramofdomainofSeptinproteinmonomer
不同种属的Septin 蛋白单体可聚合成异源复合体,Septin 单体通过其GTP 结合域与N-端和C-端区域相互作用,形成可以端对端连接的异源复合体,见图2[12]。在Saccharomyces cerevisiae的7 种Septin 蛋白中,Cdc3、Cdc10、Cdc11和Cdc12被归类为4种核心Septin,它们被证明可组装成异源六聚体(Cdc11-Cdc12-Cdc13-Cdc12-Cdc11)和异源八聚体结构(Cdc11/Shs1-Cdc12-Cdc13-Cdc10-Cdc10-Cdc13-Cdc12-Cdc11/Shs1)。异源八聚体又可相互结合组装成纤维束、环状、网状或笼状等结构,与细胞骨架成分或细胞膜发生作用。其中,异源八聚体的结合方式有2 种,一种是异源八聚体两端的Cc11 蛋白通过N-端和C-端区域首尾相连;另一种是2 条平行的异源八聚体通过位于同一位置的Cdc3 和Cdcl2 蛋白的卷曲螺旋结构相互作用配对[13]。Septin 蛋白单体的组装方式是无极性的,因此Septin丝也无极性[14]。
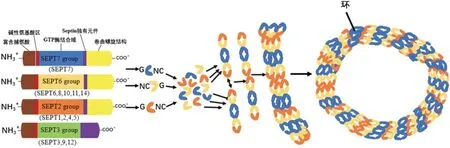
图2 Septin细胞骨架的组装Fig.2 Assembly of Septin cytoskeleton
研究表明,与大鼠肉瘤(rat sarcoma,Ras)蛋白相类似,Septin蛋白的GTP水解可通过诱导GTP结合域与N-端和C-端的接合界面的构象来调节Septin单体间的相互作用。核苷酸依赖的结构变化能够促进或阻碍单体间的相互作用。Septin蛋白的多种翻译后修饰,如磷酸化、类泛素蛋白修饰分子(small ubiquitin-like modifier,SUMO)化和乙酰化等,它们能够影响Septin单体或其同源/异源复合体间的相互作用,从而调控Septin蛋白组装。Septin蛋白磷酸化修饰是目前广泛研究的翻译后修饰。如TANG等[15]证明了Saccharomyces cerevisiae中的Septin蛋白Cdc3是周期蛋白依赖性激酶(cyclin-dependent kinase,Cdk)Cdc28 的底物,Cdc3 的C-端附近的2个丝氨酸以Cdc28依赖性方式磷酸化。研究还发现,在细胞周期G1末期,Cdc28激酶通过促进分解上一细胞周期保留下的Septin环来诱导新的细胞周期,进而启动Cdc3的磷酸化。另外,LIN等[16]总结了Sept12磷酸化在哺乳动物精子生理学中的生物学意义和调节。在哺乳动物精子发生过程中,Ser198残基上Sept12 的磷酸化对调节哺乳动物的环结构非常重要。Sept12类磷基因敲除小鼠由于精子活力弱和精子环丢失表现出生育能力显著下降。Sept12通过蛋白激酶A(protein kinase A,PKA)磷酸化,干扰Sept12 聚合成复合物。Sept12的磷酸化状态对其调节哺乳动物精子生理功能至关重要。综上,Septin蛋白的磷酸化修饰具有非常重要的生物学意义。在一项最新的研究中,WANG等[17]发现,PKA在Thr197位点磷酸化Sept7,从而破坏Septin丝动力学和纤毛发生。Sept7是PKA磷酸化位点,其Thr197残基在不同物种中是保守的。用环磷酸腺苷(cyclic adenosine monophosphate,cAMP)或过表达PKA 催化亚单位(PKACA2)处理可诱导Sept7磷酸化,随后破坏Septin丝的形成。Sept7在Thr197的组成性磷酸化减少了Sept7-Sept7相互作用,但不影响Sept7-Sept6-Sept2或Sept4相互作用。此外,研究者还注意到Sept7通过其GTP结合域与PKA CA2相互作用。表明PKA介导的Sept7磷酸化破坏了初级纤毛的形成。
3 Septin的功能
3.1Septin蛋白作为细胞支架的功能 在支架模型中,Septin 被假定可在皮层区域(如Saccharomyces cerevisiae的母芽颈部)形成支架,以指导参与不同生命活动的蛋白质的定位。在Saccharomyces cerevisiae中,Septin蛋白在胞质分裂、出芽位置选择和几丁质沉积中的作用是Septin发挥其支架功能的明确证据。Saccharomyces cerevisiae中的胞质分裂是由肌动球蛋白收缩环的协调作用和初级隔膜的形成完成的,缺乏肌动球蛋白收缩环的细胞中的胞质分裂受到明显影响[18]。同时,初级隔膜的形成主要涉及几丁质合成酶Ⅱ(chitin synthaseⅡ,CSⅡ)复合物的功能,对细胞分裂也很重要。Saccharomyces cerevisiae中唯一的Ⅱ型肌球蛋白Myo1p 和CSⅡ的定位取决于Septin 蛋白的具体定位,因此,Septin 蛋白在酵母胞质分裂中的重要作用不言而喻[19]。同时,在包括果蝇和哺乳动物细胞在内的其他生物体中,胞质分裂也需要Septin蛋白,这可能涉及与肌动蛋白的相互作用(可能通过接头蛋白介导)[20-21]。但目前尚不清楚高级真核生物胞质分裂中的Septin 功能是否涉及到与肌动球蛋白收缩环和/或分泌机制的相互作用。有研究报道,在细胞周期早期,Septin似乎也起到支架作用,Septin可将几丁质合成酶Ⅲ(CSⅢ)复合物定位到特定位点进而将几丁质沉积在细胞壁中,这种限制性几丁质沉积方式是以Septin依赖的方式发生的[22]。
3.2Septin蛋白作为扩散-屏障的功能 近年来,多项研究发现了Septin 蛋白新的功能。如在细胞周期的G2-M 转换前,整合膜蛋白Ist2p——有丝分裂退出途径(mitotic exit network,MEN,有丝分裂结束时使Cdk失活所需的激酶级联途径)的调节器、Lte1p 和皮质肌动蛋白专一或优先定位于子细胞[23]。这些蛋白质的不对称定位依赖于特定定位的Septin 蛋白,表明Septin 蛋白可起到扩散屏障的作用。但Septin 如何锚定在质膜上仍不清楚,即Septin介导的扩散屏障是如何产生的尚未可知。似乎高阶Septin结构和Septin与质膜的直接或间接相互作用在Septin 作为扩散屏障的功能中均很重要。同时,Septin还在纺锤体定向、细胞周期检查点和细胞分泌等其他过程中发挥作用。在这些过程中的作用可用支架模型、扩散-屏障模型或两者结合来解释。除此之外,Septin突出的脂质结合能力使其成为细胞内囊泡运输的重要调节因子。Sept2、Sept6 和Sept7 通过调节其从早期内体到晚期内体的转运以及向溶酶体的输送,对内化液体货物的细胞内运输至关重要[24]。
3.3Septin参与神经元细胞信号转导 Septin蛋白在神经发育中起关键作用,Septin蛋白是驱动神经元复杂形态分化和区隔化机制的关键角色,而神经元分化和区隔化是神经元功能的基础。以下综述了Septin蛋白介导的神经元分化过程的最新进展,以期揭示神经元与酵母极性程序间的相似性和差异。
在一项关于果蝇鬃毛感觉器官的祖细胞的研究中,发现感觉器官祖细胞(sensory organ progenitor,SOP)通过平面分裂产生2个祖细胞,即plla和pllb。pllb垂直于上皮细胞分裂,进而产生第3 个祖细胞plllb,plllb随后分化成1个神经元和1个片状细胞。但Septin的缺失会导致SOP 平面分裂的细胞分裂失败,相反,其对pllb垂直分裂的影响较轻,仅表现为细胞分裂的延迟。因此,推测在平面分裂的背景下,Septin提供了一种收缩力,克服了来自邻接细胞的黏连接头介导的机械限制,这是完成细胞分裂所必需的[25]。
酵母出芽是一种有价值的细胞极化模型,神经元在形态、功能和分子上均是极化的。轴突-树突过程的出现将神经元细分成不同的形态分区,随着神经元的成熟,进而获得不同的形态和功能。有研究指出,Septin 有助于维持轴突-树突的极性,这对神经元的功能至关重要[26]。Sept9 选择性地聚集在树突近端域,控制选择性囊泡运输。Sept9 识别树突特异性的驱动蛋白家族成员1A(kinesin family member 1A,KIF1A)马达,以促进其在树突MT 上的附着,同时也减少了使用驱动蛋白家族成员5(kinesin family motor protein 5,KIF5)马达的轴突货物的运输。同时,有研究发现,在体外细胞培养中,大脑皮层和海马神经元最初形成几个神经突起,当某一个神经突起募集特定的分子后加速生长成为轴突,其他神经突起则分化成树突[27]。Septin 与控制轴突特异性的关键分子通路有关,如cdc42调节Septin定位及PAR3(partitioning defective protein 3)与Septin的互作[28]。然而,体外培养的锥体神经元在缺乏Sept4、Sept14或Sept7的情况下成功形成1 个轴突和几个树突[29]。就细胞分裂而言,Septin对神经元极性的贡献可能与环境类型和细胞类型有关。
Septin 还被证明可控制神经元伸长。轴突的生长和定向是由高度动态的远端尖端(称为生长锥)驱动的。有研究发现,在神经突起和生长锥中有几种Septin 富集。在培养的脊髓背根神经节(dorsal root ganglion,DRG)和锥体神经元中,Sept4、Sept5、Sept6、Sept7 和Sept14 始终促进轴突生长及锥体神经元树突延伸[30-31]。除伸长功能外,Septin 还可能影响轴突生长的导向性。有研究指出,在秀丽隐杆线虫胚胎中,在没有细胞质分裂失败的情况下,任何一个Septin的突变经常会导致新孵化的幼虫的不协调。突变幼虫的运动神经元在轴突迁移和引导的多个方面表现出缺陷,这可能是导致运动行为缺陷的原因。Septin蛋白也在迁移的末端细胞中表达,这些细胞是性腺臂伸展的先导。Septin突变体影响末端细胞的形态,以及它们在性腺发生过程中的迁移和引导。表明在发育迁移和寻路过程中可能需要Septin[32]。
Sept3、Sept5、Sept6、Sept7 等也分布在突触前区,在出芽过程中,母细胞和子细胞一定程度相互隔离,在母芽颈处积累的Septin 蛋白则控制芽的形状和独立性[33]。Sept5 位于听性脑干未成熟巨型突触的活动区(active zone,AZ),通过阻止突触囊泡(synaptic vesicle,SV)对接而减少突触输出。与成熟突触相比,Sept5 在突触的活动区中缺失,对SV 释放无更多影响[34]。尽管Septin 的存在和结合控制SV 释放的蛋白质的能力已得到充分证明,但它们在突触前区室的成熟和功能中的作用仍基本未知。因此,在突触中,Septin在获得神经元功能的基本形态特化中起关键作用。
3.4Septin 蛋白在细菌感染中的功能 哺乳动物细胞与感染性病原体的接触是对宿主细胞的一个重大挑战。细胞对感染的反应涉及宿主体内的许多系统,细胞骨架系统通常是较易受到影响的系统。鉴于Septin 蛋白与肌动蛋白在细胞骨架中密切相互作用,推测在发生肌动蛋白重排的情况下,Septin 蛋白或参与胞内肌动蛋白的重排。
目前已有研究报道,Septin蛋白可能调节细菌入侵[12]。涉及Septin 的反应也是对胞内细菌存在的反应,细菌通过内吞作用进入细胞时,微丝在细胞膜内陷区域的周围形成,促进内吞作用。细菌从内吞泡逃逸进入细胞质后,通过微丝组装成的尾巴在宿主细胞内运动。此时Septin 环可围绕在细菌周围组装成笼状结构,阻止微丝尾巴的形成,限制细菌运动,使得靶向病原体更易被细胞的自吞噬作用清除,经研究发现,针对细菌的自噬可通过泛素依赖和泛素不依赖2 种信号通路进行[12]。进入宿主细胞并在宿主细胞内存活是感染哺乳动物宿主病原体的一种生存策略。许多细菌、真菌和寄生虫均依靠该种生存策略。对于这些病原体来说,进入胞内的生活方式独具优势。如作为专性胞内细菌的衣原体门细菌,这个细菌门包括寄生在进化树不同分支的宿主细胞、人类细胞以及变形虫上的细菌[35],它们不能在这个生态位之外生长。某些真菌和原生动物寄生虫也是如此,它们可能更喜欢进入哺乳动物宿主细胞,尽管原则上也可在宿主细胞外复制。如沙门菌(Salmonella)、军团菌(Legionella)、念珠菌(Candida albicans,C.albicans)及弓形虫(Toxoplasma gondii)和利什曼原虫(Leishmania)。病原体进入人类细胞需要自身Septin 蛋白,如植物病原子囊菌[36]。这些生物体更喜欢生存于人体细胞内部。但在人类细胞内环境也并非完全友好,细胞质中含有专门识别入侵病原体和产生免疫反应的受体,这些受体因细胞类型而异[37]。这种兼性胞内生物可被分为2 类,一类自由生活在细胞质中,另一类在宿主细胞的细胞质中形成一个特殊的、被膜包围的液泡。在液泡内部,微生物必须面对额外挑战,即通过额外的膜获取所有营养物质和生存能量物质,并维持液泡生长。但对于一些微生物病原体来说,其优势似乎超过了这些问题。这些病原体已经获得了定制其液泡的能力,以至于外来的液泡室有时被称为细胞的额外细胞器[38]。截至目前,对Septin 蛋白在液泡生物细胞内生活中的作用的了解较少,最详细的报告可能是测试Septin 蛋白在沙眼衣原体发展中的作用[39]。综上所述,Septin蛋白在细菌感染中发挥了重要的功能和作用。
3.5Septin蛋白在真菌感染中的功能 Septin蛋白在模式生物Saccharomyces cerevisiae中所起的作用已进行了充分研究,另外Septin 蛋白在致病真菌中也发挥重要作用。近年来,宿主细胞中的Septin 蛋白与细菌的进入和运动有关,但宿主Septin 蛋白在真菌组织入侵中的作用在尚未进行深入探索[40-41]。MOSTOWY 等[42]的一项开创性研究揭示了宿主Septin 蛋白于内皮细胞在白色C.albicans内吞中的作用,这种作用发生在血源性传播感染中。在C.albicans入侵过程中,人Sept7被发现与肌动蛋白和N-钙黏蛋白共同定位,N-钙黏蛋白是C.albicans入侵素结合内化的细胞表面受体。研究发现,宿主Septin 蛋白以依赖肌动蛋白的方式与N-钙黏蛋白相互作用,且N-钙黏蛋白被敲除后,减少了对C.albican内吞部位的Septin蛋白招募。同样,Sept7敲除被发现减少了N-钙黏蛋白在C.albicans内吞部位的积累,并显著降低了内皮细胞内化C.albicans的能力[43]。该项工作表明,Septin蛋白可能对多种细胞内真菌病原体的宿主渗透起重要作用,这种可能性值得进一步探索。此外,哪些宿主Septin 蛋白对真菌细胞的进入以及其在内部化过程中各自的行为方式均有必要进行研究。尽管对肌动蛋白在细胞内病原体入侵的背景下进行了详细的研究,但对感染中宿主隔膜蛋白的研究却相对滞后。至今为止,在病原体入侵方面进行的工作推动了对Septin蛋白、N-钙黏蛋白和肌动蛋白之间相互作用的机制细节的进一步研究。
真菌病原体中的Septin 蛋白不仅与其在发病机制中的作用相关,还因为它们是在Septin 蛋白生物学的不同系统中起作用。与Saccharomyces cerevisiae不同,Septin蛋白在真菌病原体中表现出一定程度的独立性,哺乳动物系统中有更多不同的个体Septin蛋白共存于一个细胞中的环境。如在玉米真菌病原体(U.maydis)中,Cdc3 在沿着微管到达细胞顶端的内体上被翻译[44]。研究表明,这是Septin 蛋白丝尖端定位的基础,但这是否也参与隔膜蛋白复合物的形成以及这些过程在人类神经元中保守到何种程度等问题却尚不清楚。综上,在真菌病原体中继续进行机理试验,对普遍了解Septin 蛋白的功能非常重要。这些不同的真菌系统往往面临与Saccharomyces cerevisiae细胞不同的问题,因此Septin 细胞骨架具有独特的用途。可操作性与复杂的Septin 蛋白生物学的结合使真菌病原体成为未来研究Septin 蛋白的关键模型。
4 Septin蛋白与疾病
自21 世纪初,哺乳动物的Septin 蛋白开始作为一个新的研究领域出现以来,对Septin 蛋白细胞功能的认识取得了重大进展。与此同时,越来越多的证据表明,Septin在多种癌症中的表达水平发生了改变,这些改变与肿瘤发生之间的因果关系尚未确定[45-47]。Septin 参与促进癌症特征的机制,如持续增殖、抗细胞死亡、血管生成、细胞迁移和侵袭等。此外,Septin 还与染色体不稳定性、抗肿瘤药物耐药性以及癌症相关微环境诱导肿瘤生长有关。本文将通过Septin 的支架作用、在膜区隔化中的功能或通过其对蛋白质降解的保护功能重点关注Septin 聚合物组成的重要性,以及与质膜、肌动蛋白或微管在参与癌症和抗肿瘤治疗的细胞功能中的关联。近年来,Septin与细胞信号介质之间的相互作用越来越多,表明Septin 可能成为抗癌治疗或限制耐药性的治疗策略中的新靶点。
Septin 通过扩散驱动在质膜上退火而自组装成丝状物和高阶结构[45]。其与质膜稳定互作的大型隔膜蛋白丝阵列可能通过施加膜曲率来改变皮质的形态发生,并影响迁移细胞的皮质刚性,从而促进肿瘤转移[46-47]。除在膜分区中的作用外,Septin还与参与癌症进展的生长因子受体的错误调节有关。Septin可聚集和稳定浆膜蛋白,包括受体酪氨酸激酶[48]。膜相关的Sept9 阻止CIN85 与泛素连接酶Cbl 结合,导致泛素依赖的表皮生长因子受体(epidermal growth factor receptor,EGFR)降解减少[49]。另外,Septin 通过减少泛素化和降解参与了ErbB2 在癌细胞质膜上的异常持久性[50]。有研究显示,c-Met原癌基因的表面分布被Sept2 和Sept11 以相反的方式调节,但两者均参与其与配体的相互作用和锚定在肌动蛋白细胞骨架上[51],表明了Septin 蛋白丝的亚单位组成对控制其生物功能的重要性。Septin 还可与其他膜结合的细胞器相关联,Sept2 和Sept7 通过与动力相关蛋白1(dynamin-related protein 1,DRP1)相互作用,将其集中在线粒体收缩部位,并促进其分裂[52]。此外,有研究报道,Septin涉及酵母营养剥夺时的自噬体形成[53]。这些研究为理解Septin 蛋白在癌症发生以及适应肿瘤环境中的作用提供了新线索。
在许多细胞类型中,Septin丝在皮质下区域或沿着应力纤维与肌动蛋白结合[53]。肌动蛋白丢失导致隔膜蛋白形成游离的细胞质环[54]。相反,Sept2 缺失会减弱肌动蛋白的捆绑,并破坏应力纤维[55]。敲除Sept6 和Sept7 会导致类似的肌动蛋白束丢失以及细胞极性的破坏[56]。这些效应可能涉及Septin 结合伴侣,将Septin 与BORG2(binder of Rho GTPases)和BORG5 等肌动蛋白交联,后者是BORG 家族5 种Cdc42效应蛋白中的2种[57-58]。应激纤维破坏也可能涉及直接调节肌动蛋白(如蛋白Wdpcp)的Septin 伴侣[59]。肿瘤发生发展还需新生血管参与,这意味着肿瘤微环境中的先导细胞迁移,而Septin 蛋白参与了这2 个过程。CUI 等[60]提出ECM 通过整合素信号控制内皮细胞的Sept9 表达,并调节细胞增殖和肌动蛋白组装的外周分布。关于肿瘤相关的成纤维细胞迁移,YEH 等[61]表明,由于交联蛋白BORG2 的表达增加,肌动蛋白纤维和隔膜蛋白之间的黏合力增加。反过来会导致基质重塑,有利于激活高度收缩的癌相关成纤维细胞,并促进癌细胞侵袭、血管生成和肿瘤生长。
5 结语
目前对Septin的研究工作取得了很多成果。Septin蛋白在胞质分裂、细胞膜重塑和细胞区隔化中起重要作用。本文综述了已知的关于Septin 蛋白在体内及常见疾病中的功能。Septin 蛋白可能通过其形成的多种结构在广泛的细胞过程中发挥作用。Septin蛋白作为参与细胞发生和进展的一个重要家族,通过其表达的改变及蛋白修饰调节细胞内的一系列生化反应。随着对Septin 蛋白功能了解的不断扩大,Septin 蛋白表达异常对细胞内环境稳定和人类健康产生重大影响的现象越来越明显,但目前针对其具体作用机制的研究较少。Septin 蛋白在细胞生物学中是一个新兴的研究主题,但许多方面仍不了解。未来的研究有望系统探索和阐明Septin 蛋白与更多疾病的关系及其作用,揭示更多关于Septin 蛋白与膜相互作用机理,并研究Septin 聚合动力学,以解决Septin 领域的一些开放性、实际性问题。综上,对Septin 结构和特征的进一步探讨,将会为其生理和病理功能的研究奠定基础。对Septin 的生物学功能及生物学功能涉及的具体分子机制的研究,将会为Septin相关疾病的诊断和治疗提供理论依据。
