基于细胞外囊泡疗法的非临床评价策略
2023-10-20李嫚琪魏丽萍李英奇陶巧玉许瀚林何伟伟汤纳平汪溪洁综述王庆利常艳审校
李嫚琪,魏丽萍,李英奇,陶巧玉,许瀚林,3,何伟伟,汤纳平,汪溪洁 综述,王庆利,常艳 审校
1.中国医药工业研究总院上海益诺思生物技术股份有限公司,上海 201203;2.安徽中医药大学药学院,安徽合肥 230012;3.上海工程技术大学化学化工学院,上海 201620;4.国家药品监督管理局药品审评中心,北京100022
细胞外囊泡(extracellular vesicles,EV)指由细胞主动释放到细胞外环境的,选择性包裹蛋白质、DNA片段、RNA、脂质和代谢物等各种分子的脂质双层囊泡[1]。EV 不含功能核,不能增殖和分化[2]。根据其生物发生机制、大小和生物物理学特性的不同,EV可大致分为3 类:外泌体(exosomes)、微囊泡(microvesicles,MV)、凋亡小体(apoptotic bodies,AB),目前绝大多数研究为外泌体相关研究。EV 在生理和病理过程中的功能取决于其与受体细胞相互作用以传递其蛋白质、脂质和RNA 等内容物的能力[3]。EV 表面蛋白信号分子可识别并靶向受体细胞,一旦连接上靶细胞,可通过受体-配体相互作用诱导信号传递,或通过胞吞作用内化,也可直接与靶细胞的膜融合,将其内容物传递至靶细胞的胞浆中[4]。当EV 内容物进入细胞内,即可通过信使RNA(messenger RNA,mRNA)的翻译、微小RNA(microRNA,miRNA)的基因沉默及生物活性脂质的作用引发蛋白质组学、基因组学及表观遗传学的改变[5],从而改变受体细胞的生理状态。EV 最初仅被视为细胞向外分泌的废弃物,但近年来,研究者发现,EV 作为细胞间重要的运载体,是细胞间通讯的重要方式[6],可作为一种无细胞治疗手段进行临床治疗,同时还具有作为天然药物递送载体的潜在能力。本文就基于EV 疗法的研发概况、特点,监管要求及非临床评价策略作一综述。
1 基于EV疗法的研发概况
近10年来,EV相关的各项研究大量涌现。目前尚无获得批准的基于EV 治疗的上市药物,但已有较多产品进入临床研究阶段。截至2022 年3 月,clinicaltrials.gov 平台中有34 项EV 作为治疗药物的临床试验,有10 项EV 作为载体的临床试验。截至2022年5 月,clinicaltrials.gov 平台(https://clinicaltrials.gov)中EV 作为治疗药物的临床试验见表1,EV 作为载体的临床试验见表2。其中适应证涉及炎症、癌症、眼部疾病和呼吸系统疾病等多个领域,EV 的来源多为间充质干细胞,也有少数来源为肿瘤细胞,给药方式多为局部用药,系统用药相对较少。
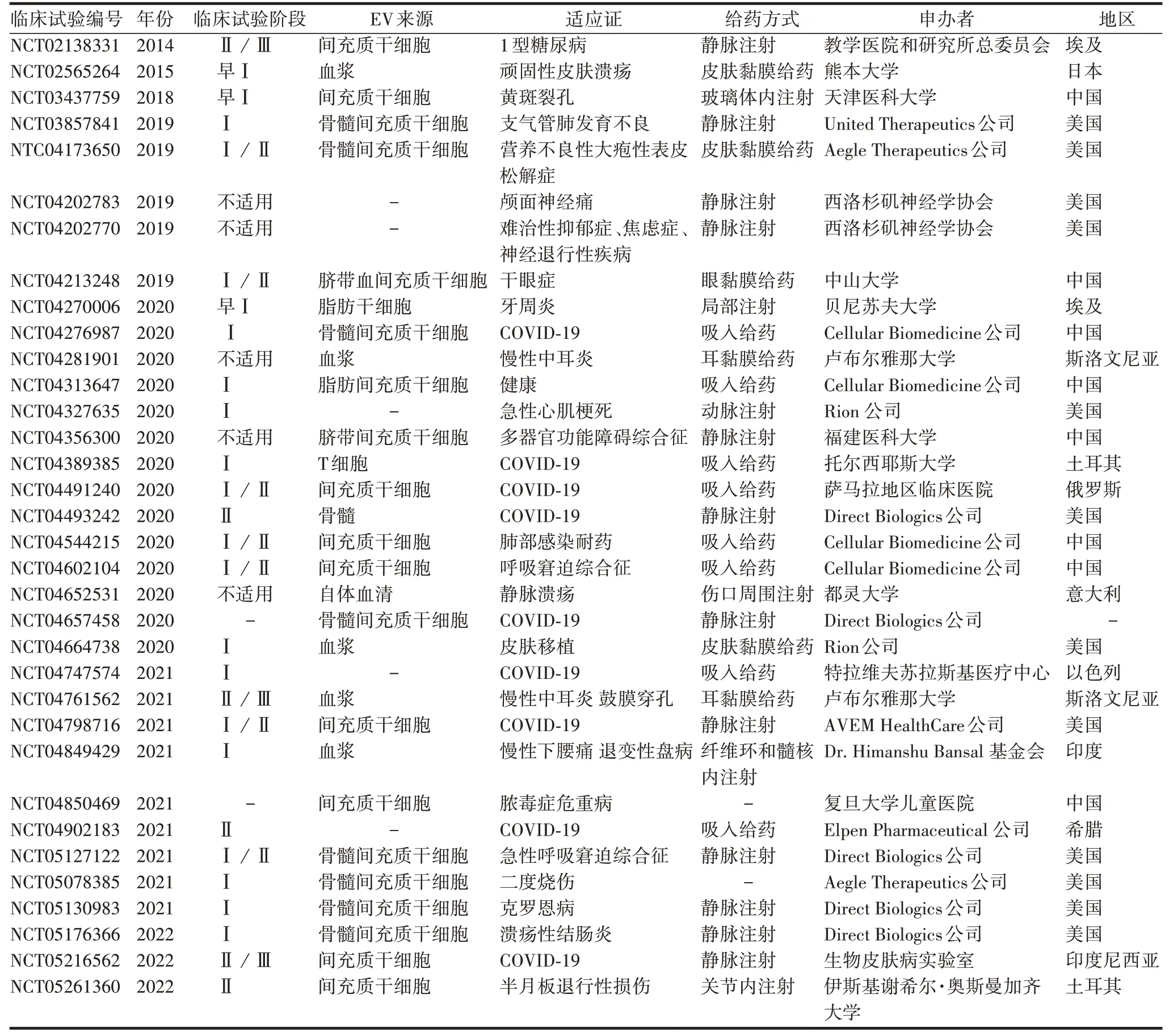
表1 EV作为治疗药物的临床试验Tab.1 Clinical trials of EV as therapeutic drugs
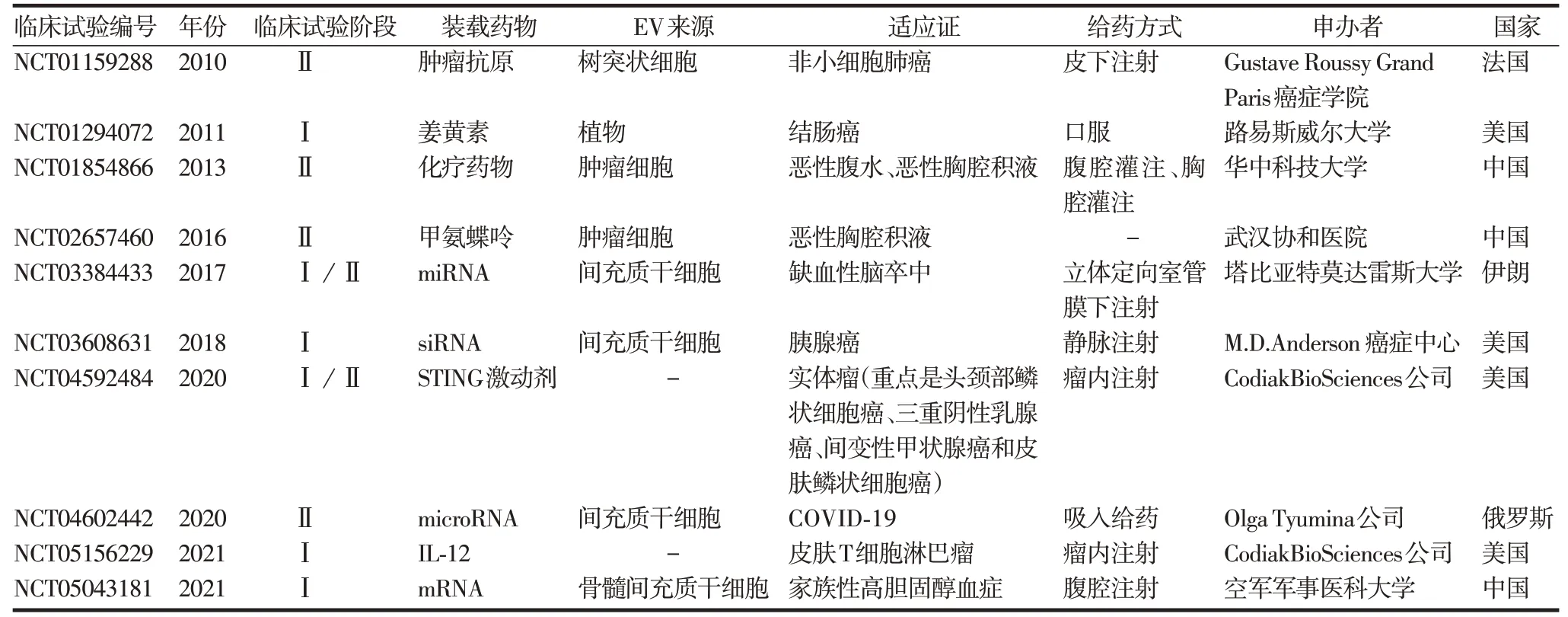
表2 EV作为载体的临床试验Tab.2 Clinical trials of EV as vectors
1.1EV 作为治疗药物 内源性释放的EV 可参与许多病理和生理学过程,在免疫调节和组织再生中具有重要作用[7],其本身就具有治疗潜力。其中应用最广泛是来自间充质干细胞的EV,已有大量基础实验证明,EV 在软骨、骨、皮肤、血管、味蕾、神经组织、牙、骨骼肌、心肌、肝、肾和肺等组织再生方面具有巨大的应用潜能。此外,免疫细胞分泌的EV 可通过促进调节反应或调节周围细胞,减少炎症来直接控制外周免疫功能[8]。EV 还能抑制自身免疫。调节性T细胞(regulatory cell,Treg)的主要功能是通过促进免疫系统的自我耐受来预防自身免疫,Treg 利用EV 抑制其他免疫细胞的活性。有研究表明,Treg 衍生的EV 包含多个miRNA 和miRNA 前体[9-11],树突状细胞摄取含有miR-142-3p 和miR-150-5p 的EV 会导致促炎性细胞因子白细胞介素-6 表达降低,并导致免疫抑制性细胞因子白细胞介素-10 表达升高[9]。这些miRNA 干扰树突状细胞中的抗原加工和呈递,从而抑制了免疫激活[8]。自COVID-19疫情暴发以来,EV也为治疗COVID-19提供了新的思路。
1.2EV 作为药物载体 EV 作为介导细胞间通讯的媒介,可被用作有效递送载体,装载基因类、蛋白类和小分子药物等,已成为目前最为关注的EV 研究方向。目前研究多集中于EV 包载RNA 或小分子药物的抗肿瘤研究。EV的生化特性可用于靶向递送药物至某些细胞群[12],实现选择性递送,由于EV是由细胞产生的,具有跨膜蛋白和表面受体等特异性蛋白,可避免或促进靶细胞的识别和相互作用。EV的装载方式分为主动装载和被动装载两种。主动装载包括:电穿孔、化学转染(转染EV 或转染EV 亲本细胞)、物理转染(超声法、挤出法、反复冻融法)、点击化学;被动装载指孵育(EV 或EV 的亲本细胞与药物孵育)。不同细胞来源的EV 成分不同,其潜在的生物功能也有较大差异:肿瘤细胞分泌的EV 作为药物载体时,可较好地归巢至肿瘤部位;巨噬细胞分泌的EV 具有良好的炎症趋向作用,且可跨越血脑屏障用于脑部疾病的治疗;树突状细胞分泌的EV 则具有良好的免疫效应。此外,EV与核酸分子有更好的亲和性,能显著提高包封效率。EV 结构具有可改造性,膜修饰方式多样,如基因修饰EV 表面功能化蛋白,增强靶向性,提高EV递送效率。EV还可与病毒载体结合使用,如外泌体与腺相关病毒(adeno-associa-ted virus,AAV)杂交可显著降低免疫原性[12]。天然EV进行工程改造可提高质粒的效率和容量,如外泌体与脂质体杂交可包裹和递送CRISPR-Cas9,并减轻脂质体的毒性[13]。大多数注射的EV会优先聚集在肝、肾和脾,被迅速清除,从而限制了外源性EV在靶组织中的浓度[14]。有研究通过基因修饰或结合靶向配体、抗体、刺激因子或免疫逃逸因子进行EV改造[15-16],如在EV表面修饰能与肿瘤组织特异性结合的多肽,增加抗肿瘤药物的运送效率和疗效。同时,药物在EV 内的运输可产生不同于游离药物的药理学特征,保护传统药物免受肿瘤微环境的影响,从而增强药效和改变脱靶效应。
2 基于EV疗法的研发特点
2.1基于EV 疗法的优势 EV 来源广泛,无生命但具有生物活性,由于其生物相容性、稳定性、靶向性、归巢性和可扩展性[8],并且可反映细胞起源,是药物开发和递送的理想候选者。
相比于传统药物治疗和细胞治疗,EV 作为一种无细胞疗法具有独特的优势。EV 富含黏附分子和信号分子,能够识别靶细胞并刺激摄取,比游离型药物具有更强的细胞靶向性和摄取性[17]。与更易被免疫清除的游离型药物和细胞疗法相比,跨膜CD47的存在允许EV 通过CD47-Sirpα 发出“不要吃我”的信号来避免免疫排斥反应[18],有助于延长EV在体内的循环时间,延长半衰期[8]。EV的膜结构可提供保护,防止其被分子组成中的酶和非酶物质降解。此外,与细胞疗法相比,EV 比亲本细胞更小、更简单、更稳定,相对容易修改和制造,来源丰富且产量高,能够适应专业化和规模化生产,比细胞更适合长期储存,功能损失较小。有研究表明,给因实验性心脏病发作而导致心肌受损的幼年猪注射人诱导性多能干细胞(human induced pluripotent stem cells,hiPSC)产生的心脏细胞(hiPSC-CC)或hiPSC-CC 细胞来源的外泌体后,药效学作用未见明显差异,但外泌体治疗并未增加心律失常的频率,具有更好的安全性[19]。与传统的细胞移植相比,EV 作为一种简单的微小囊泡结构,不含细胞核,不能异常增殖和分化[20],致瘤性和免疫原性风险较低,具有更高的治疗安全性。
EV 作为载体,能够保护包载的药物在人体复杂的环境中不被降解,随后通过膜融合将药物直接运输至细胞质中,使药物摄取量更大、循环时间更久、药物释放更加持续。相比于逆转录病毒、慢病毒、腺病毒、AAV 等病毒载体,EV 毒性低,无整合及致畸致瘤风险。与合成纳米载体相比,EV 输送系统在靶向性和药代动力学方面具有显著优势。内源性纳米载体具有更好的体内生物相容性,清除率低。纳米尺度的EV 可通过包括血脑屏障在内的绝大多数生物屏障系统,其表面存在一些特殊的蛋白,能避免网状内皮系统的捕获,逃脱单核吞噬细胞系统的快速清除,引起的有害免疫反应极低,纳米级分子的EV 可利用增强渗透滞留效应渗入到肿瘤内发挥作用。EV 也可迁移至无血液供应的组织或区域,如致密的软骨基质[21]。此外,可通过改造EV的表面蛋白实现多种目的,例可将靶向细胞或组织的肽附加在EV 表面,以实现针对特定组织的选择性靶向,避免在其他器官中不必要的积累,从而降低全身毒性[14]。
2.2基于EV 疗法的存在的问题 EV 的临床转化受到大规模生产、纯化、修饰和储存的挑战,且EV 亚群之间的异质性对于生产制造和临床转化的质量控制提出了要求。EV 作为载体也面临着许多问题,如载药效率较低、封装率低;残留的转染试剂可能会影响封装过程和改变EV 的细胞功能;电穿孔法易引起EV 聚集,对药物和EV 的完整性会产生影响等。肿瘤细胞分泌的EV 存在促进肿瘤生长及免疫抑制的风险,含有的肿瘤相关抗原和免疫抑制分子能够下调免疫系统的应答,还能传递某些抑制信号,在机体免疫应答过程中起负性调节作用,诱导肿瘤细胞形成免疫耐受。促进肿瘤转移的蛋白质和RNA 也可利用EV 作为逃逸载体而免受机体的免疫应答作用。此外,基因修饰后的EV 是否会引起机体免疫反应、是否保持原有功能尚不确定。目前,人们对EV 的了解尚不足,天然外泌体难以体内示踪,其在人和动物体内的生物分布仍有待阐明。
3 EV的监管
EV 领域相对较新,其来源广、种类繁杂,难以统一归类并研究,相关知识涉及多个领域和学科。目前的技术手段对于EV 这样纳米级的非细胞结构的操作尚存在一定困难。不同的操作人员、仪器、实验系统以及生物标本来源均会引起实验结果的差异[22]。明确分类、规范实验方法、保证实验的严谨性和可重复性成为行业内亟需了解并亟待解决的问题。
2011年,国际细胞外囊泡协会(International Society for Extracellular Vesicles,ISEV)成立,并与欧盟欧洲科技合作组织(European Cooperation in Science and Technology,COST)组成了欧洲健康与疾病微囊和外泌体网络(European Network on Microvesicles and Exosomes in Health and Disease,ME-HaD)[23]。ISEV 和ME-HaD的成立旨在规范EV领域的研究,促进学术、临床转化及工业化生产之间的交流,以加强对EV 的基本理解和临床转化潜力。ISEV 和ME-HaD 发表了多份立场声明和文件,为EV 的基础研究和临床转化提供了信息,并提出基本指导要求。美国FDA 明确将外泌体纳入动物细胞、组织以及基于细胞和组织的产品(Animal Cells,Tissues,and Cell-and Tissue-Based Products,ACTPs)。
3.1ISEV和ME-HaD立场声明及文件 为了提高实验结果的可靠性和可重复性,ISEV 于2014 年发表了一篇立场声明MISEV2014[22],内容是“细胞外囊泡研究的最低实验要求”,包括EV 的分离、鉴定和功能研究。2015 年,ME-HaD 与ISEV 联合发表立场声明[7],重点介绍了EV 生产和临床应用必须考虑的安全和监管要求。随着研究者对EV 的研究不断深入,EV领域的知识不断演变,ISVE 在2017年[24]和2018年[2]分别对MISEV2014 中的内容进行了更新和补充,MISEV2018 还增加了规范EV 命名的建议。MISEV作为业内研究者的共识,是目前国际公认的EV 指导要求。
此外,ISEV在2013年发表立场文件[25],指出了EV样品采集、分离和分析方法标准化建议;2013年[26]和2017 年[27]发表的立场文件中概述了EV RNA 领域的知识现状,讨论了EV RNA 分析和生物信息学;2019年发表了关于EV生物膜的立场文件[28],列举了EV生物膜的生物发生、稳定性、摄取、内容物转移、研究技术和功能分析;2021年5月,最新发表了关于尿液EV的立场文件[29],介绍了EV的生物学信息以及当前收集、分离、表征尿液EV 的技术手段,分析了基于尿液EV 临床应用分析中的发展趋势和挑战,并提出在尿液EV研究中标准化,提高严谨性和可重复性的建议。
3.2ISEV建议分类及基于EV疗法的监管建议 由于当前对于EV的了解尚不够深入,目前尚无专门针对基于EV 疗法的相关政策和法规出台。EV 可归类为生物制品,基于EV 的疗法受到欧盟、美国、澳大利亚、日本和中国有关生物制品的监管。ISEV 建议对基于EV的疗法进行分类[10]:①来自未经基因修饰的细胞的天然EV;②来自基因修饰的细胞的非转基因天然EV;③来自基因修饰的细胞的转基因天然EV,分类属于生物制品中的基因治疗产品;④EV 作为化学药物或其他分子成分的药物递送系统,属于生物和化学联合治疗,归类为生物药物。必须确定EV 是否为有效成分,若不是有效成分,则被视为“赋形剂”。
由于EV 的特殊性,可能需要专门针对基于EV疗法的指导原则[10]。EV 领域发展迅速,建议各国药监部门对EV 类产品引起重视、及时跟进,希望通过出台技术指导文件来规范和指导EV 产品的研发上市,促进EV产业的发展。
4 EV的非临床评价策略
随着EV 临床试验的大量开展,基于EV 疗法的安全性和有效性是关注重点。EV 多来源于细胞,在复杂性、组成和生物学作用方面可能与其来源材料有许多相似之处,基于EV 的治疗药物将与基于细胞治疗产品密切相关。与细胞治疗产品相同,传统的非临床评价方法及标准在EV 的评价上具有一定的局限性。因此,在EV 的非临床研究中,研究者应设计合理的试验,证明其有效性并观察潜在毒性,为临床试验提供更多参考依据。EV 的非临床研究可能包括体内外药效研究、药代动力学研究以及非临床安全性研究。
4.1非临床研究的一般原则 EV 非临床研究尚无特定指导原则,临床前评价经验较少,结合ME-HaD对基于EV 疗法安全性研究的建议,应按照“product by product”的原则进行试验设计。需重视概念验证(proof of concept,POC)试验,并通过POC研究初步验证药效、作用机制及靶点,探索量效关系,优化给药途径和方案,为临床试验提供可行性和有效性的非临床证据。进行非临床研究应关注EV 是否修饰。受试物需尽量采用具有临床代表性的产品进行非临床研究。动物模型的选择上应明确疾病特异性和物种特异性,根据研究目的来选择适当的动物种属[12]。所选择的动物生物反应与预期人体反应相似,必要时可考虑选择疾病模型动物进行安全性研究。在合适的情况下,其药理学、药代动力学、毒理学试验可考虑联合开展。给药方式应能最大程度模拟临床拟用给药方式。此外还应关注系统给药或局部给药的毒性风险,以及给药方式的潜在风险。应用同种异体EV 时,必须考虑组织相容性的潜在影响[10]。此外,有研究结果显示,脂肪组织来源和心脏来源的EV比骨髓来源的EV 显示出更强的血管生成能力[30-31]。骨髓来源的EV 的产生能力和分泌谱高于脂肪来源的EV[32],表明不同组织来源的EV 具有不同的活性。但目前尚未研究比较不同物种的EV。基于EV 疗法的非临床研究必须考虑到不同物种及不同来源(自体、同种异体、异体、异种)的EV的生物学差异。
4.2药学研究 EV 的生产使用活细胞,制备过程中的微小变化可能会对EV 的产品特性产生深远影响。在评估产品的整体风险时,应考虑各种因素对产品风险的影响,如细胞的来源、操作程度、培养时间、存活情况和代次,EV 的储存条件,物理性及化学性处理或基因修饰/改造对EV 特性的改变程度,使用方式以及预处理等多方面因素。
对于EV 的质量控制,需定义关键质量属性。评估这些属性的方法可包括评估亲代细胞特性(如评估生存力和表面标记表达以评估表型)、EV 特征(如评估数量、大小、表面标记表达和内容物)、微生物污染(如检测内毒素和支原体)和功能活性[33]。对于批间差异性的评估,可引入生物类似药研究中的概念,即受试物的分析特性应与参照药高度相似[34]。
EV 的表征是安全性、有效性的先决条件。目前尚无特定的指导原则用于指导EV 制剂的表征,参考国家药品监督管理局2008 年颁布的《多组分生化药注射剂基本技术要求(试行)》执行,应尽可能对所含组分进行特征性鉴别,如组成过于复杂,应至少明确所含的起药效的主要成分。MISEV2018 中指出了EV 表征的最低实验要求和检测技术,包括量化、整体和单个特征描述及拓扑结构的表征要求(表3)[2]。MISEV2018 中虽未提及对EV 作为载体时的包封率要求,但EV作为药品仍需关注包封率。
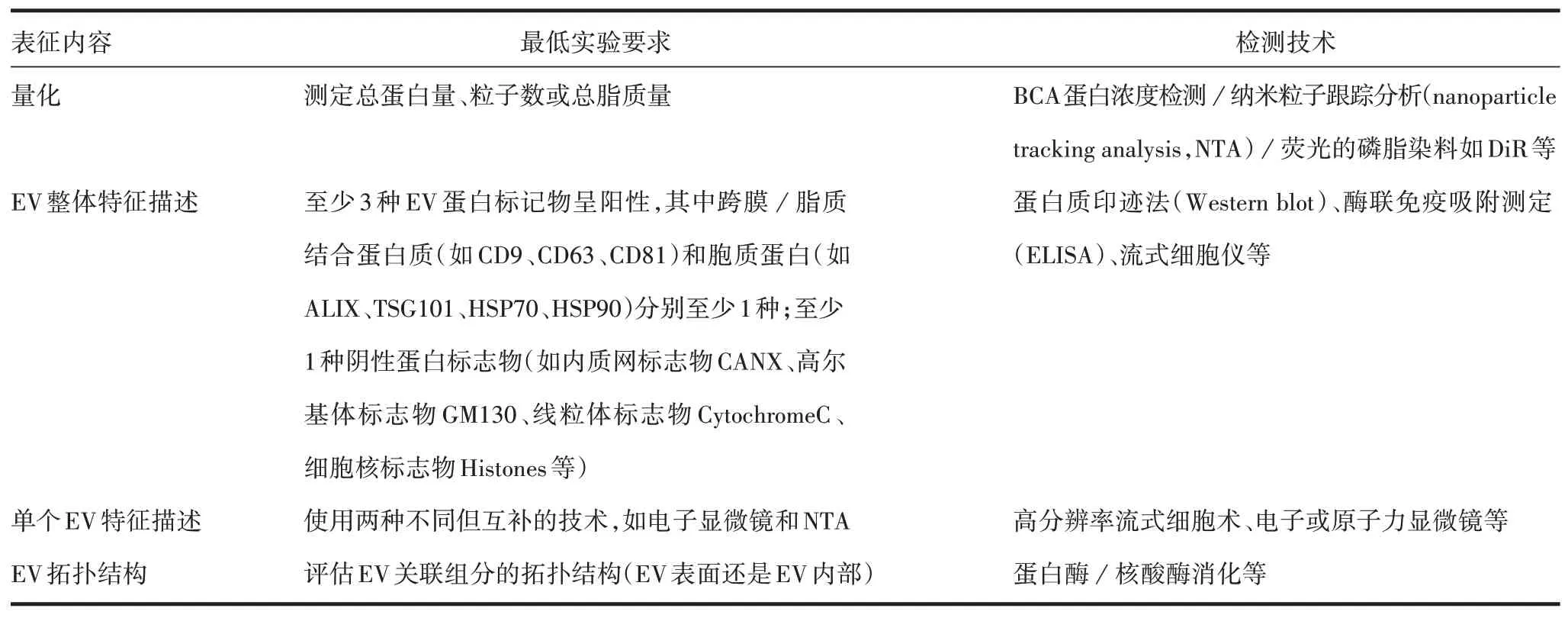
表3 MISEV2018中对EV表征的最低实验要求Tab.3 Minimum experimental requirements for characterization of EV in MISEV 2018
4.3药效学和药代动力学研究 大多数EV 是在体外获得,其在体内的分泌、转移和蓄积部位并不清楚[35],EV 可在递送部位和周围被细胞相对较快地内化,通常进入非特定的细胞类型和全身循环。结合生物分布实验,可以研究EV 的半衰期和降解情况,监测周期应设合适的时间间隔,来显示“EV 命运”。若EV 表面设计了靶向的工程改造,关注靶组织和非靶组织分布特点有利于进一步研究该产品的有效性和安全性。但EV 中生物活性成分的多样性使得临床前药效和药代动力学研究更为复杂。因此,需找出可量化的方式来进行EV 的生物分布研究,目前已研究通过采用放射性同位素标记成像技术[36]、活体成像技术[37]、聚合酶链反应分析[37-38]以及流式细胞术[39-40]等方式开展相关研究。若对EV 标记进行体内示踪,则必须考虑染料等标记方式对EV 组分功能的影响[7],且需排除游离染料本身信号的风险[37],可综合运用一种或多种合适的细胞追踪方法,并进行必要的验证。
当采用EV 作为药物载体时,参考国家药品监督管理局2021 年8 月颁布的《纳米药物非临床药代动力学研究技术指导原则(试行)》和2008 年颁布的《化学药品注射剂基本技术要求(试行)》中特殊注射制剂(如脂质体、微球、微乳等)的要求,尽量解析载药粒子和装载药物等多种形态成分在体内的相互关系。如为改良型生物制品,建议进行普通注射剂型和EV 载体药物的比较药代动力学研究,根据研究结果确定如何开展进一步的毒理研究。
4.4非临床安全性研究 目前国内尚无EV 相关产品的非临床研究指导性文件,但因EV 主要来源于细胞,当EV 作为治疗药物时,临床前试验设计需参考细胞治疗产品相关指导原则要求[41-42],若同时存在基因编辑操作,则兼具了基因治疗产品特点,还需参考基因治疗产品相关指导原则[43-45]进行临床前研究设计。当EV 作为药物载体时,除EV 本身关注因素外,还需参考化学药或生物制品相关指导原则,针对包载药物本身的特点制定基于包载药物的临床前研究策略,可参考国家药品监督管理局2021 年8 月颁布的《纳米药物非临床安全性研究技术指导原则(试行)》。
与细胞和基因治疗产品相同,EV 的非临床安全性研究同样应尽量遵从《药物非临床研究质量管规范》(GLP)。对于某些在非GLP 状况下开展的研究或检测,应予说明并评估非GLP 对试验结果可靠性、完整性及对产品总体安全性评价的影响。
非临床安全性研究主要包括一般毒性研究(以常规毒理学检测终点为主要观察指标的单次给药和/或多次给药毒性研究),以心血管、呼吸和中枢神经系统为主的安全药理研究,制剂安全性研究,以及遗传和生殖毒性研究等。
一般毒性研究选择毒理学终点时,除应包含常规毒理学评价终点外,还需关注免疫原性和免疫毒性风险。虽然在EV 治疗中尚未研究或观察到潜在致命反应细胞因子释放综合征(cytokine release syndrome,CRS),但在基于EV的癌症免疫治疗中,CRS应被考虑在内。EV 携带的蛋白质和脂质等组分也可能引入免疫原性和免疫毒性风险,在临床前研究阶段同样需适当关注。建议在非临床研究阶段重点观察相关的免疫指标,包括血液学(含白细胞分类)、免疫细胞表型分型、血清球蛋白水平、详细的免疫器官组织病理学检查和淋巴器官称重等。若上述研究发现明显异常,还应考虑进行进一步的免疫功能试验以明确其作用的机理,为临床研究方案的设计提供重要参考。此外,不同于亲本细胞,EV 本身不能在体内增殖分化,但可能携带了较为复杂的亲本细胞的遗传信息,可能具有潜在的致瘤风险,除需关注亲本细胞本身的成瘤/致瘤性风险外,还需在EV 安全性评价中重点关注体内试验中异常/异位增生性病变(如增生、肿瘤)发生情况,初步评估其致瘤性风险。如目前备受关注的环状RNA(circRNA)已被证明广泛存在于EV[46],circRNA具有独立于亲本mRNA的生理和病理功能,其治疗机制为体内目标circRNA分子的过表达或敲低[47]。基于EV 的治疗需关注circRNA 过表达产生潜在的错误剪接副产物(包括同源线性RNA)的风险,以及通过RNA 干扰(RNA interference,RNAi)方法敲除circRNA 对线性同源基因或其他基因的影响[47]。
5 小结与展望
EV 应用前景十分广阔,未来的发展应集中在辅助现有治疗方法上,完善现有疗法的不足。最近,实时和高分辨率显微镜技术结合创新的EV 标记策略和报告系统,为在体内生理环境和单囊泡水平研究EV 提供了新工具[48]。目前基于EV 的治疗作为药物或医疗技术的研发进程尚处于起步阶段,距离工业化生产并成功应用于临床尚有很长一段距离。开发和完善EV 的表征和表型检测技术,研究外泌体结构和组成,优化生产工艺,减少组成的异质性,将有利于其在疾病诊断和治疗中的应用。基于目前技术水平的限制及对EV 认识的不足,EV 在研究、监管、生产、非临床研究和临床试验等方面均还需标准化的规则。尤其是临床前研究,尚需各项体内和体外试验来阐明EV 各种生物学功能的机制,加快推进EV的临床转化。相信随着各项技术的快速发展,EV 作为无细胞治疗方式和新型载药系统,将具有更广阔的应用前景。
