TMCO1在泛癌中的表达模式及其与预后、免疫浸润的相关性分析
2023-10-20李佳璐张晓莉
董 媛,李佳璐,王 宇,张晓莉
跨膜和螺旋结构域1(transmembrane and coiled-coil domains 1,TMCO1)是一种高度保守的跨膜蛋白,位于内质网中。作为一种钙离子选择性阳离子通道,TMCO1被发现能够防止内质网中细胞内钙库过度充盈,并维持钙稳态[1]。TMCO1与脑面胸骨骼发育和青光眼有关[2,3]。文献[4]表明,TMCO1在结肠癌中是一种新型的肿瘤促进因子,iASPP-TMCO1 轴抑制促进细胞溶质钙离子超载诱导的凋亡细胞死亡,减少体外和体内肿瘤的生长。TMCO1与肺腺癌(lung adenocarcinoma,LUAD)治疗有潜在相关性,抑制 TMCO1 表达水平可负调控肺腺癌细胞A549的凋亡和迁移[5]。此外,TMCO1被发现能够维持颗粒细胞内质网的钙离子稳态,TMCO1的破坏能够导致内质网应激介导的细胞凋亡和活性氧(reactive oxygen species,ROS)水平增加,从而导致卵巢的卵泡发育受损[6]。本研究综合利用多种数据库分析泛癌组织中TMCO1的表达水平差异,初步探讨其对肿瘤预后的预测价值及其与肿瘤相关免疫反应的关联,为明确潜在的肿瘤免疫治疗靶点提供理论依据。
1 材料与方法
1.1 TMCO1基因表达量 TIMER2.0(http://timer.cistrome.org/)是分析不同癌症类型的免疫浸润及基因差异表达的网站[7],可以分析33种肿瘤中TMCO1的表达。GEPIA(http://gepia.cancer-pku.cn/)是基于TCGA和GTEx数据库的一个新开发和交互式网络服务器,能够获取不同分子在正常样本和癌症样本中的差异表达情况[8]。GEPIA用于补充TIMER的数据。
1.2 与预后指标相关性 在GEPIA数据库(http://gepia.cancer-pku. cn/)中获取临床资料,将样本以基因表达中位数分为高低表达组,并分析TMCO1与肿瘤总生存期(overall survival,OS)和无复发生存期(relapse free survival,RFS)相关性,同时计算log-rankP值、95%置信区间(CI)和风险比率(HRs)。从UCSC(https://xenabrowser.net/)数据库中下载经统一标准化的泛癌数据集:TCGA TARGET GTEx (PANCAN,N=19131,G=60499),进一步从中提取TMCO1基因在各个样本中的表达数据,对每一个表达值进行log2(x+0.001)变换,剔除样本数小于10个的癌种后进行可视化和统计学分析。
1.3 与免疫细胞浸润及免疫检查点基因表达相关性 通过sangerbox数据库(http://sangerbox.com/Tool)探索TMCO1表达与肿瘤微环境(tumor microenvironment,TME)中免疫检查点基因(immune checkpoint,ICP)相关性。根据先前研究选择免疫检查点基因[9]。本研究通过TIMER2.0数据库下载38种癌症的6种免疫细胞的评分数据,分析其与TMCO1表达的免疫细胞评分相关性,使用R软件包psych(version 2.1.6)的corr.test函数计算各个肿瘤中基因与免疫细胞浸润评分的相关性并进行可视化。
1.4 在肿瘤相关基因的功能富集分析 在String蛋白网络平台(https://string-db.org/)收集蛋白质-蛋白质相互作用信息,包括TMCO1经实验评估的40个结合蛋白。从GEPIA数据库(http://gepia.cancer-pku.cn/)中收集并分析100个TMCO1共表达基因,最终展示6个与TMCO1相关性最强的分子,结果以散点图和热图表示。通过基因本体论数据库(gene ontology,GO)和京都基因与基因组数据库(kyoto encyclopedia of gene and genomes,KEGG)将上文得到的140个TMCO1的潜在相关分子进行富集分析。二者分析均通过R语言实现。
2 结 果
2.1 泛癌中TMCO1的mRNA和蛋白差异表达 结果显示,在33种肿瘤中,TMCO1 mRNA表达量在膀胱尿路上皮癌、乳腺浸润癌、胆管癌、食管癌、头颈鳞状细胞癌、肝细胞肝癌、肺腺癌、肺鳞癌和胃癌中表达较正常组织显著升高(图1A)。GEPIA数据库为TIMER2.0数据库中没有配对的正常组织癌症的补充结果。结果显示,TMCO1 mRNA在弥漫性大B细胞淋巴瘤、脑低级别胶质瘤、卵巢浆液性囊腺癌、皮肤黑色素瘤、胸腺癌中表达显著升高(图1B)。
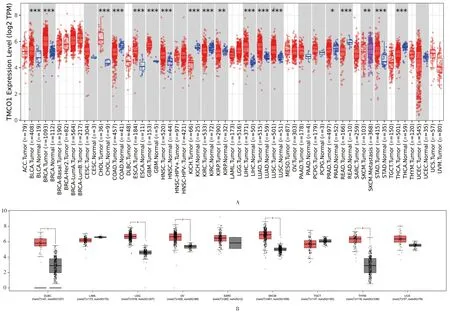
图1 TMCO1在泛癌中的表达差异
2.2 泛癌中TMCO1预后价值 GEPIA数据库分析了基因表达与肿瘤的预后关系,其中TMCO1高表达与宫颈鳞癌、腺癌和肺腺癌的OS和RFS均相关(图2A);TMCO1高表达与头颈鳞状细胞癌和脑低级别胶质瘤的肿瘤OS相关,TMCO1低表达与肾透明细胞癌的OS相关。TMCO1高表达与膀胱尿路上皮癌和肾乳头状细胞癌的RFS相关(图2B)。单因素Cox回归分析函数分析基因表达与每个肿瘤的预后关系,结果显示在胶质瘤、脑低级别胶质瘤、急性髓细胞样白血病、乳腺浸润癌、宫颈鳞癌和腺癌、肾乳头状细胞癌、头颈鳞状细胞癌、肝细胞肝癌、神经母细胞瘤、葡萄膜黑色素瘤、白血病、嗜铬细胞瘤和副神经节瘤、肾上腺皮质癌中,TMCO1高表达提示较差预后;在肾透明细胞癌中,TMCO1低表达提示较差预后。森林图结果与GEPIA结果趋势相同(图3)。
2.3 与人类癌症的免疫检查点基因、免疫浸润细胞的相关性 免疫检查点基因(ICPA)对免疫细胞浸润和免疫治疗有较大影响[10]。本研究发现TMCO1表达密切相关的多种癌症类型,如葡萄膜黑色素瘤、卵巢浆液性囊腺癌、混合肾癌、睾丸癌、乳腺浸润癌、肺腺癌、胸腺癌、肾乳头状细胞癌、子宫内膜癌、头颈鳞状细胞癌、肝细胞肝癌、黑色素瘤、肾透明细胞癌、前列腺癌、甲状腺癌、胶质瘤、脑低级别胶质瘤、结肠癌、结直肠癌和膀胱尿路上皮癌。其中,TMCO1表达与葡萄膜黑色素瘤、卵巢浆液性囊腺癌、混合肾癌、脑低级别胶质瘤、胶质瘤的免疫检查点呈正相关。以葡萄膜黑色素瘤为例,TMCO1与其50个免疫检查点相关。TMCO1表达与睾丸癌和肺腺癌的免疫检查点呈负相关(图4)。以上表明TMCO1可能在不同的信号转导途径中协调ICP基因活性,并有可能成为免疫治疗靶点。TMCO1高表达可能预示着针对ICP基因的免疫疗法取得更好的治疗效果。本研究通过sangerbox网站(http://sangerbox.com/Tool)探索了TMCO1表达与人类癌症TME中6种免疫细胞的相关性,最终获得38个肿瘤的6种免疫细胞浸润评分,发现TMCO1与34个癌种存在显著相关。TMCO1与21种肿瘤的B细胞、19种肿瘤的CD4+细胞、19种肿瘤的CD8+细胞、22种肿瘤的中性粒细胞、17种肿瘤的巨噬细胞和20种肿瘤的树突状细胞有较强关联性(图5)。
2.4 共表达网络与免疫反应相关 用String获得TMCO1结合蛋白并做成互作网络图(图6A),通过GEPIA获得100个TMCO1相关基因,并进行相关性分析。其中6个代表性靶基因在TMCO1表达中与多种肿瘤呈正相关(图6B、C)。使用GO和KEGG对TMCO1结合与共表达基因进行富集分析。结果显示,TMCO1共表达基因与霍乱弧菌感染、蛋白质输出、核糖体等信号通路相关,TMCO1共表达基因与内质网靶向蛋白、SRP-依赖的靶向膜的共翻译蛋白、内质网蛋白质定位的建立等密切相关(图6D)。
A.TMCO1在宫颈癌和肺腺癌中的生存曲线;B.TMCO1在头颈鳞癌、脑低级别胶质瘤和肾透明细胞癌的OS曲线,在膀胱尿路上皮癌和肾乳头状细胞癌的RFS曲线。
3 讨 论
TMCO1是一种内质网跨膜蛋白,其作用于内质网,防止细胞内钙库过度充盈,维持钙稳态。近年研究发现,TMCO1可通过多种途径影响肿瘤的发生发展。本文研究了TMCO1在泛癌表达、预后、免疫检查点和免疫细胞浸润方面的相关性,收集其共表达基因及相关蛋白并进行富集分析,发现TMCO1可能与肿瘤免疫调节有关,或因此成为潜在的预后预测因子。
本研究首先使用GEPIA数据库及TIMER2.0数据库分析TMCO1在泛癌中的表达水平。TIMER2.0数据库结果表明,TMCO1在膀胱尿路上皮癌、乳腺浸润癌、胆管癌、食管癌、头颈鳞状细胞癌、肺腺癌、肺鳞癌和胃癌中表达较正常组织显著升高。GEPIA补充了没有配对正常组织的癌症的差异结果。结果显示,TMCO1在弥漫性大B细胞淋巴瘤、脑低级别胶质瘤、卵巢浆液性囊腺癌、皮肤黑色素瘤和胸腺癌中表达显著升高。预后分析显示,TMCO1高表达与宫颈鳞癌、腺癌和肺腺癌的OS和RFS相关,与头颈鳞状细胞癌和脑低级别胶质瘤的OS相关,与膀胱尿路上皮癌和肾乳头状细胞癌的RFS相关;TMCO1低表达与肾透明细胞癌的OS相关。综合各类数据库分析结果,TMCO1在肺腺癌、宫颈鳞癌和腺癌、头颈鳞状细胞癌、脑低级别胶质瘤、膀胱尿路上皮癌和肾乳头细胞癌中高表达预后较差,TMCO1在肾透明细胞癌中高表达预后好。基于上述结果我们推测TMCO1表达量可能与肿瘤预后有一定相关性。

图5 TMCO1表达与免疫浸润相关性
与传统的化疗和靶向治疗相比,免疫检查点抑制剂(immune checkpoint inhibitors,ICIs)可以阻断免疫检查点基因,缓解肿瘤细胞对免疫细胞的抑制作用,并在增强对癌细胞的免疫反应方面具有持久的效果和疗效。常见的ICIs如PD-1/PD-L1的疗效已在多种肿瘤中被验证[11]。本文研究了TMCO1表达与免疫检查点基因表达的相关性,结果提示TMCO1可能通过调节特定免疫检查点基因表达来调节肿瘤免疫模式。TMCO1在葡萄膜黑色素瘤中上调,高表达的TMCO1与免疫检查点基因HMGB1、TNFSF4、BTN3A1、CXCL10的表达正相关;TMCO1在OV中上调,高表达的TMCO1与免疫检查点基因HMGB1、ENTPD1、BTN3A1、BTN3A2等表达正相关;TMCO1在DLBC中上调,高表达的TMCO1与免疫检查点基因TLR4、BTN3A1、ENTPD1、TNFSF4等表达正相关。这提示高表达TMCO1的肿瘤中,阻断特定免疫检查点或为免疫治疗提供新思路。
肿瘤微环境被认为是影响肿瘤预后的重要因素,并为肿瘤免疫治疗提供指导帮助[12]。癌细胞与各种肿瘤浸润淋巴细胞之间的相互作用是肿瘤微环境重要组成部分,通过促进肿瘤免疫逃逸来促进肿瘤进展[13]。本文研究了TMCO1与免疫细胞的相关性发现TMCO1与34个癌种存在显著相关。其中,TMCO1与21种肿瘤B细胞、19种肿瘤CD4+细胞、19种肿瘤CD8+细胞、22种肿瘤中性粒细胞、17种肿瘤巨噬细胞和20种肿瘤的树突状细胞有较强相关性。该结果提示,TMCO1与中性粒细胞为主的免疫细胞浸润有关,其可能成为泛癌预后生物标志物。作为抵御病原体的首道防线,中性粒细胞可能与先天和适应性免疫系统的组成部分互相作用,参与肿瘤的发生发展[14,15]。肿瘤相关中性粒细胞(tumor associated neutrophils,TANs)是一组依赖于肿瘤的、不同种类的中性粒细胞,其对肿瘤发展有双重作用[16]。在结直肠癌、肺癌、乳腺癌、胰腺癌、胆管癌、肝细胞癌和宫颈癌等癌种中发现,其对肿瘤发生发展有促进作用[17-22],这与高表达TMCO1预测较差肿瘤预后的肿瘤结果部分重合。因此推测TMCO1与中性粒细胞作用显著相关潜在机制可能与TANs有关,这能够为靶向免疫治疗提供新思路。

图6 TMCO1表达与人类癌症共表达网络相关性
内质网应激出现于内质网功能受损时,其具体表现为错误折叠、未折叠的蛋白质(UPR)在内质网小室内积聚和细胞内钙离子紊乱[23]。UPR已被证实能够介导肿瘤与非肿瘤之间的串扰[24]。TMCO1已确定为内质网钙离子泄露通道,丢失后可能导致内质网钙储存钙超载和细胞内游离钙增加[25]。TMCO1在肿瘤中与激活转录因子6(ATF6)、染色体1开放阅读框43(C1orf43)、SCY1 样假激酶 3(SCYL3)、琥珀酸脱氢酶复合亚基C(SDHC)、TOR 信号通路调节因子样蛋白(TIPRL)、U2 相关因子同源基序激酶 1(UHMK1)的表达呈显著正相关关系。ATF6是一种II型跨膜糖蛋白,它能够通过减少对内质网的压力来保护胰腺β细胞[26],是参与内质网应激的重要成员之一。此外,ATF6介导的内质网应激已经导致多种癌症的发生[27,28]。提示了TMCO1发挥作用可能与内质网应激有关。SDHC被报道在乳腺癌中成为药物开发有吸引力的靶标[29]。这为研究TMCO1在肿瘤中差异表达的机制提供了可能方向。TMCO1表达在多肿瘤中与内质网靶向蛋白、SRP依赖的靶向膜的共翻译蛋白、内质网蛋白的定位建立等密切相关,并与内质网靶向蛋白、内质网蛋白质定位的建立相关[30,31],说明其可能参与了内质网应激过程。目前TMCO1与SRP依赖的靶向膜的共翻译蛋白关联尚未有报道,其调控机制有待于进一步阐明。
综上所述,笔者认为TMCO1在肿瘤发生发展中发挥免疫调节因子作用,该过程可能与中性粒细胞有关,TMCO1可能成为未来的肿瘤预后预测因子。
