传统酸粥中乳酸菌的分离筛选及其体外抗氧化能力分析
2023-10-19林瑛兰常学东
林瑛兰,张 悦,李 阔,丁 敏,常学东,邹 静
(河北科技师范学院食品科技学院,河北秦皇岛 066000)
酸粥是我国山西河曲和内蒙古等地具有地方特色且口感独特的传统美食,它是一种用糜米作为主要原料经过微生物自然发酵而形成的发酵食品[1]。目前酸粥相关研究的焦点汇聚于酸粥的营养成分分析及其微生物群落结构,例如郭璞等[2]通过比较分析发酵的小米酸粥和普通小米粥二者的营养成分,发现发酵小米酸粥中的多酚物质和蛋白含量显著高于未经发酵的小米粥,而淀粉含量则显著降低,说明经过发酵的小米酸粥与未经发酵的小米粥相比营养价值更高;乌有娜等[3]对酸粥发酵过程中不同阶段的微生物群落结构进行研究,并进一步探索不同发酵阶段的微生物群落与理化指标的变化关联性。尽管酸粥的营养价值高,但是目前没有形成成熟的大规模工业化生产,基本是家庭作坊式的自然发酵的生产方式[4]。由于自然发酵的生产环境相对开放,加之生产工艺、地理环境和气候条件等因素差异,容易造成酸粥中微生物类群结构、酸粥品质及其营养成分出现参差不齐的情况[5]。因此,为保证酸粥稳定高效的生产,应打破传统自然发酵的局限,采用纯种发酵以确保酸粥品质的稳定,从而实现酸粥工业化生产。
乳酸菌是一类可以利用碳水化合物产生大量乳酸的革兰氏阳性细菌的总称。乳酸菌是一种益生菌,被公认为“Generally Recognized as Safe(GRAS)”等级的食品微生物[6]。研究表明,乳酸菌具有抗氧化[7]、降高血压[8]、降胆固醇[9]和防治乳糖不耐症[10]等益生功能,以其优异的益生特性被广泛应用于果蔬深加工、乳制品和肉制品等食品的生产中[11]。以乳酸菌作为发酵剂生产的谷物食品,其加工特性、功能特性和营养成分均会得到良好的改善;风味和口感变得更加柔和,也更利于消费者接受。因此,本文以传统开放式发酵的酸粥为载体分离筛选乳酸菌,以耐受能力为进一步筛选指标选出性状优良的乳酸菌,并对其进行种属鉴定,同时对菌株的自凝能力以及体外抗氧化能力进行分析,为纯种发酵制备酸粥提供优良菌株,也为酸粥优良发酵菌株的筛选提供一定参考依据和基础。
1 材料与方法
1.1 材料与仪器
酸粥 市售;胃蛋白酶(3000 U/g)、胰蛋白酶(250 U/g)、牛胆盐 上海源叶生物科技有限公司;DPPH(2,2-联苯基-1-苦基肼基,纯度≥97%)、邻苯三酚 分析纯,上海阿拉丁生化科技股份有限公司;30%过氧化氢、硫酸亚铁、邻菲罗啉 分析纯,天津市致远化学试剂有限公司;盐酸、氢氧化钠 分析纯,天津化学试剂有限公司。
800 电动离心机 上海梅香仪器有限公司;UV 2600A 紫外可见分光光度计 尤尼柯(上海)仪器有限公司;SPX-250B-Z 生化培养箱 上海博迅实业有限公司;SQ510C 立式压力蒸汽灭菌器 重庆雅马拓科技有限公司。
1.2.1 乳酸菌的分离纯化 取1 mL 酸粥样品于9 mL 无菌生理盐水中振荡均匀,梯度稀释后吸取100 μL 涂布在1% CaCO3-MRS 固体培养基上,放在37 ℃培养箱中培养48 h。挑选在CaCO3-MRS固体培养基上形成溶钙圈的菌落于MRS 固体培养基上反复划线进行纯化,直到菌株的菌落形态一致并进行革兰氏染色实验,所得革兰氏阳性菌被初步判定为乳酸菌。将纯化的乳酸菌接种于MRS 斜面培养基于4 ℃保存,并将菌株与20%甘油接入冻存管中,混合均匀后于-80 ℃保藏[12]。
1.2.2 菌悬液的制备 将菌株从MRS 斜面培养基接入MRS 液体培养基中,在37 ℃培养18 h 得到发酵液后,在4000 r/min 的条件下离心10 min,弃去上清液得到菌体,随后加入与液体培养基等量的无菌生理盐水离心洗涤菌体,重复洗涤3 次后重悬,将悬液浓度调整为1.0×108CFU/mL 即得菌悬液[13]。
1.2.3 乳酸菌产酸能力的鉴定 将溶钙圈较大的菌株菌悬液以2%(v/v)的接种量接入MRS 液体培养基中,在37 ℃培养24 h 后得到发酵液,发酵液用无CO2蒸馏水稀释10 倍并滴入两滴酚酞指示剂,用标定好的0.1 mol/L 氢氧化钠溶液滴定至粉红色且30 s不褪色作为滴定终点,记录所消耗的氢氧化钠溶液体积,作为空白对照的是没有接种乳酸菌的MRS 液体培养基[14]。按照公式(1)计算乳酸菌的产酸量。
式中:X 表示乳酸菌产酸量,g/100 mL;V1表示样液消耗氢氧化钠溶液体积,mL;V2表示空白培养基消耗氢氧化钠溶液体积,mL;C 表示标定好的氢氧化钠溶液浓度,mol/L;M 表示发酵液体积,mL;F 表示发酵液稀释倍数;0.09 表示乳酸的换算系数。
1.2 实验方法
1.2.4 乳酸菌的复筛
1.2.4.1 耐酸能力测定 将菌株菌悬液以2%(v/v)的接种量分别接种于pH 为3.0 的MRS 液体培养基中,在37 ℃下培养3 h,分别在0 h 和3 h 取样,稀释涂布于MRS 固体培养基上,在37 ℃培养48 h 后进行平板计数[15]。按照公式(2)计算乳酸菌耐酸能力。
式中:N3表示培养3 h 的活菌数,CFU/mL;N0表示培养0 h 的活菌数,CFU/mL。
1.2.4.2 耐胆盐能力测定 将菌株菌悬液以3%(v/v)的接种量分别接种于含有0.3%牛胆盐和未添加牛胆盐的MRS 液体培养基中,在37 ℃培养24 h 后测定OD600nm值[16]。按照公式(3)计算乳酸菌耐胆盐能力。
式中:A1表示在含有0.3%牛胆盐的MRS 培养基中培养24 h 的OD600nm值;A0表示在不添加牛胆盐的MRS 培养基中培养24 h 的OD600nm值。
1.2.4.3 人工模拟胃肠液耐受能力测定 人工模拟胃液:0.35 g 胃蛋白酶溶于100 mL 0.2%的无菌生理盐水中,用盐酸调节pH 至3.0 后过滤除菌[17]。人工模拟肠液:1 g/L 的胰蛋白酶和3 g/L 的胆盐溶解在0.85%生理盐水中,用氢氧化钠调节pH 至8.0 后过滤除菌[18]。
将1 mL 菌株菌悬液分别加到9 mL 的人工模拟胃液中,充分混合均匀后在37 ℃下培养3 h,分别在0 h 和3 h 取样进行平板计数,计算各菌株对人工模拟胃液的耐受能力。在9 mL 人工模拟肠液中加入1 mL 经过人工模拟胃液处理3 h 的菌液,37 ℃下培养8 h,分别在4 h 和8 h 取样稀释涂布,在37 ℃培养48 h 后进行平板计数,计算各菌株对人工模拟肠液的耐受能力[19]。按照公式(4)计算乳酸菌对人工模拟胃肠液的耐受能力。
式中:N 表示经过人工模拟胃肠液处理后的活菌数,CFU/mL;N0表示未经过人工模拟胃肠液处理的活菌数,CFU/mL。
1.2.5 菌株的自凝集力 调整菌株菌悬液的OD600nm值约为1.0,将其在室温条件下静置,分别测定静置3、6、9 h 后的上层溶液OD600nm值。按照公式(5)计算自凝集率[20]。
式中:A2表示静置后的OD600nm值;A0表示静置前的OD600nm值。
1.2.6 菌株的过氧化氢耐受能力 将三株乳酸菌菌悬液以2%(v/v)的接种量分别接种在含有浓度为0.4、0.7 和1.0 mmol/L H2O2的MRS 液体培养基中,在37 ℃培养24 h 后进行平板计数,作为空白对照的是未添加H2O2的MRS 液体培养基[21]。
1.2.7 菌株的抗氧化能力
1.2.7.1 发酵上清液和完整细胞悬液的制备 将菌株接入MRS 液体培养基中,在37 ℃培养24 h 后,将发酵液在4000 r/min 条件下离心10 min,所得上清液即为发酵上清液;用PBS 缓冲溶液(pH7.4)离心洗涤菌体2 次后重悬即为完整细胞悬液[22]。
1.2.7.2 DPPH 自由基清除能力测定 取2 mL 待测样品与2 mL 的0.2 mmol/L DPPH-无水乙醇溶液充分混匀,避光反应30 min,于517 nm 处测定吸光度[23]。按公式(6)计算DPPH 自由基清除能力。
式中:Ar表示样品+DPPH-无水乙醇溶液的吸光度;As表示样品+无水乙醇的吸光度;At表示蒸馏水+DPPH-无水乙醇的吸光度。
1.2.7.3 羟自由基清除能力测定 在试管中加入1 mL 的待测样品,再逐次加入1 mL 的2.5 mmol/L邻菲罗啉、PBS 缓冲液、2.5 mmol/L FeSO4溶液和20 mmol/L H2O2,将其充分混匀后在37 ℃反应90 min,于536 nm 处测定吸光度[24]。按公式(7)计算羟自由基清除能力。
式中:Ak表示样品的吸光度;Aj表示蒸馏水代替样品和H2O2的吸光度;Ai表示蒸馏水代替样品的吸光度。
1.2.7.4 超氧阴离子清除能力测定 在试管中加入0.1 mL 待测样品和4.5 mL 的50 mmol/L Tris-HCl缓冲溶液(pH8.0),将其振荡均匀之后在25 ℃下水浴20 min,接着加入0.4 mL 的25 mmol/L 邻苯三酚溶液继续水浴5 min,然后迅速滴加两滴8 mmol/L的HCl 溶液以终止反应,于320 nm 处测定吸光度[25]。按公式(8)计算超氧阴离子清除能力。
式中:Am表示样品的吸光度;A 表示蒸馏水代替样品的吸光度。
1.2.8 菌株的生理生化试验及分子生物学鉴定
1.2.8.1 菌株的生理生化试验 以《乳酸细菌分类鉴定及实验方法》[26]作为筛选出的三菌株生理生化鉴定试验的参考依据。
1.2.8.2 菌株的分子生物学鉴定 将菌株L10、W10和Y3 送往华大基因进行16S rDNA 和看家基因pheS的扩增与测序,16S rDNA 基因的PCR 扩增引物采用通用引物27F(5'-AGAGTTTGATCCTGGCT CAG-3')和1492R(5'-TACGGCTACCTTGTTACGA CTT-3'),pheS基因的PCR扩增引物采用引物p-F(5'-CCGTGAAGAACTGGAACA-3')和p-R(5'-CC TAACCCAAAGGCAAAA-3')[27],将得到的测序结果在NCBI 数据库中进行BLAST比对分析,使用MEGA5 软件进行菌株系统发育树的构建。
1.3 数据处理
每项实验重复三次,采用SPSS 23.0 软件中的单因素方差分析和Duncan 多重比较法进行数据间的分析,显著性水平设定为0.05,采用Origin 2021 软件进行绘图。
2 结果与分析
2.1 40 株乳酸菌产酸能力分析
乳酸菌的产酸能力是其重要的益生特性之一,因为代谢产生的有机酸可以降低肠道pH 和提高胃肠道消化酶活性,因此高产酸乳酸菌的应用价值更高[28]。从传统酸粥中分离出68 株具有溶钙圈且革兰氏染色为阳性的菌株被初步判定为乳酸菌。挑选溶钙圈较大的40 株乳酸菌进行产酸能力的测定,每株菌具体的产酸量见表1。从表1 可以看出,菌株Y14产酸量最大为13.41 g/100 mL,菌株L12 产酸量最小为5.67 g/100 mL。
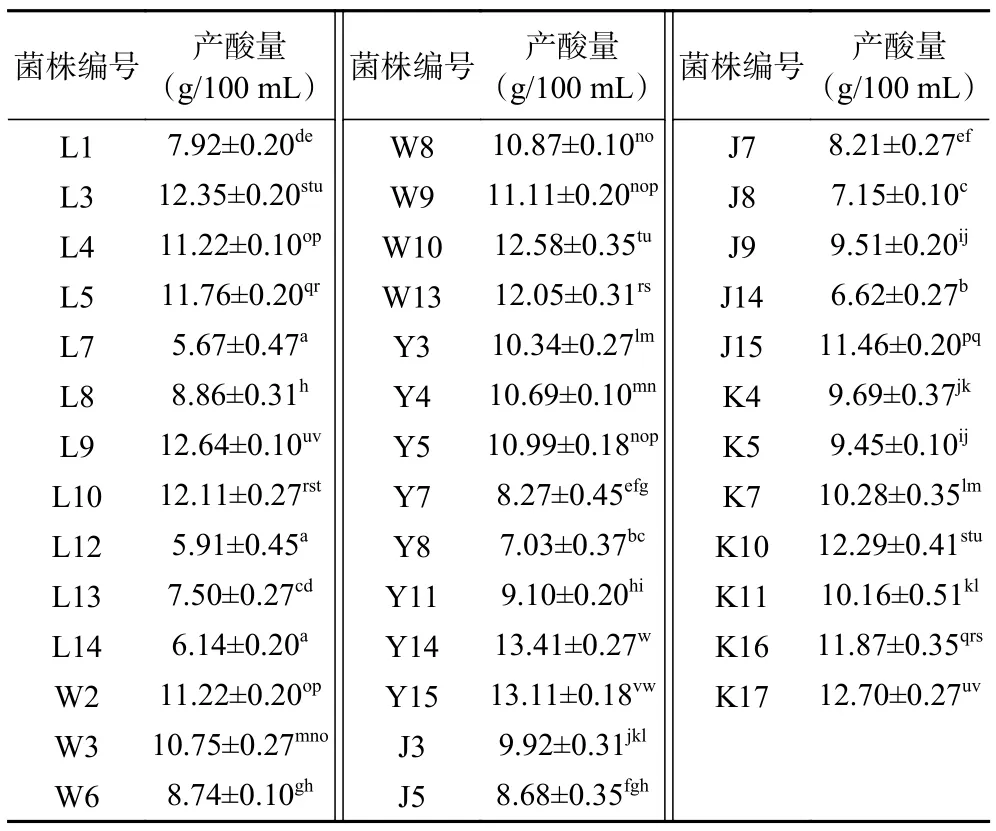
表1 40 株乳酸菌产酸能力比较Table 1 Comparison the acid production capability of the 40 strains of lactic acid bacteria
2.2 乳酸菌的复筛
2.2.1 耐酸乳酸菌的筛选 胃部进食之后pH 会在2.5~3.5 的范围内波动,食物通常在胃部停留3 h 左右,故本文将初步筛选的40 株乳酸菌接入pH 为3.0 的MRS 液体培养基中培养3 h,以此筛选出具有高耐酸能力的乳酸菌,结果见表2。结果显示,40 株乳酸菌的耐酸能力均在70%以上,其中有12 株耐酸能力≥95%。乳酸菌在低pH 条件下的耐受能力即耐酸能力是衡量乳酸菌益生特性的标准之一[29],因此,选择耐酸能力≥83%的25 株乳酸菌进行下一步实验。

表2 40 株乳酸菌耐酸能力比较Table 2 Comparison the acid tolerance of the 40 strains of lactic acid bacteria
2.2.2 耐胆盐乳酸菌的筛选 乳酸菌能够在肠道中存活并定殖是发挥其益生特性的前提,这就要求乳酸菌对胆盐具有较强耐受力[30]。肠道中胆盐的浓度波动范围一般在0.03%~0.3%,因此将乳酸菌接入胆盐浓度为0.3%的液体培养基中培养24 h,考察其胆盐耐受能力,结果见表3。结果显示,共有10 株乳酸菌对0.3%浓度的胆盐耐受能力≥50%,其中最高为62.39%±0.49%,因此,选择这10 株胆盐耐受能力较强的乳酸菌进行下一步实验。
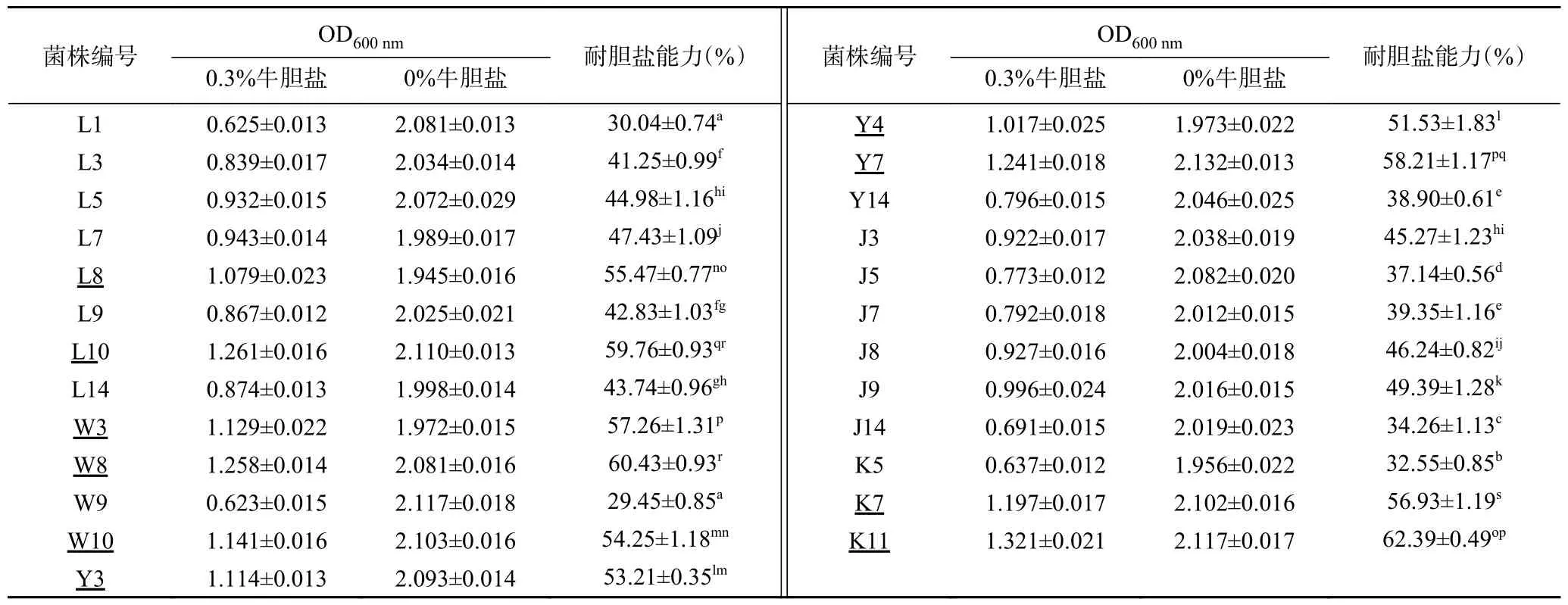
表3 25 株乳酸菌耐胆盐能力比较Table 3 Comparison the bile resistance of the 25 strains of lactic acid bacteria
2.2.3 耐人工模拟胃肠液乳酸菌的筛选 虽然耐酸耐胆盐实验通过高酸和较高胆盐浓度来模拟了人体肠胃环境,但是真正的人体肠胃环境中存在的胃蛋白酶和胰蛋白酶会水解微生物的菌体蛋白质,甚至是抑制或杀死微生物[31]。因此,对10 株乳酸菌人工模拟胃肠液耐受能力进行了分析,结果见表4。10 株乳酸菌经过人工模拟胃液处理3 h 后活菌数均有下降,菌株L8 活菌数下降了1.3 lg CFU/mL,菌株W10 和K11 下降了0.5~1.0 lg CFU/mL,其余的菌株活菌数下降均小于0.5 lg CFU/mL。在人工模拟肠液处理阶段,各菌株的耐受能力呈现出不同程度的持续下降,经人工模拟肠液处理4 h 后,菌株L10、W10 和Y3 耐受能力下降范围在13%~15%,其余菌株的耐受能力下降范围在20%~31%。经过人工模拟肠液处理8 h 之后,菌株Y3 的耐受能力最高为77.57%±0.73%,菌株L10 和W10 的耐受能力分别为76.16%±0.21%和72.86%±0.46%,其他菌株的耐受能力均低于70%。最终筛选出在人工模拟胃肠液环境中耐受能力好的3 株乳酸菌分别为菌株L10、W10 和Y3。
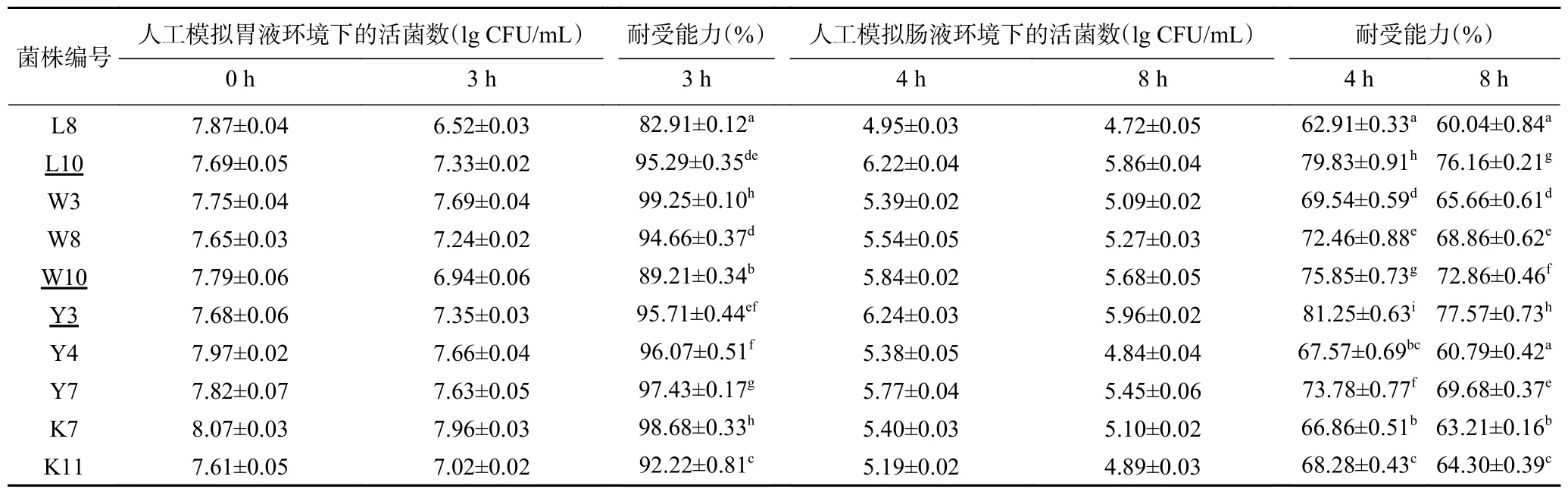
表4 10 株乳酸菌人工模拟胃肠液环境下的耐受能力分析Table 4 Analysis the tolerance of the 10 strains of lactic acid bacteria in simulated gastrointestinal fluid
2.3 三株乳酸菌自凝性及抗氧化能力分析
2.3.1 三株乳酸菌自凝集能力分析 一般情况下乳酸菌的自凝集能力越强,其对肠道上皮细胞的黏附能力越强,从而易形成遏制致病菌定殖和侵害的屏障[32]。本文将这三株乳酸菌分别静置3、6 和9 h 后对其自凝集能力进行测定,结果见表5。
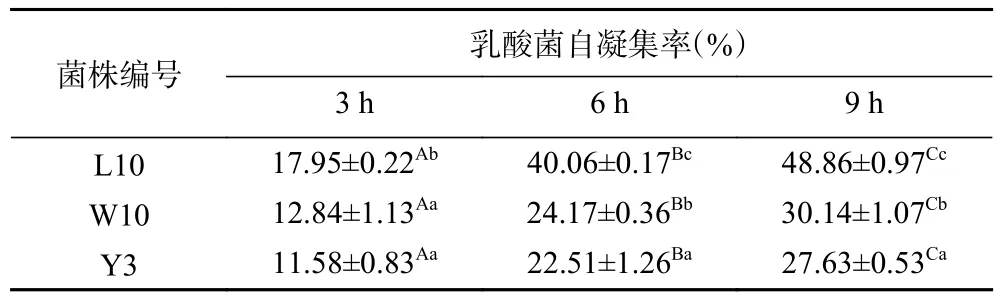
表5 三株乳酸菌自凝集力比较Table 5 Comparison the self-agglutination ability of the three strains of lactic acid bacteria
由表5 可知,每株菌的自凝集率均表现为随着静置时间的延长呈现不同幅度的升高,菌株L10 升高的幅度最大。静置3 h 后,菌株L10 的自凝集率最高为17.95%±0.22%,菌株W10 和Y3 的自凝集率差异不显著(P>0.05)。在静置6 h 和9 h 后,菌株L10 相较于菌株W10 和Y3 表现出更优异的自凝集能力,自凝集率分别为40.06%±0.17%和48.86%±0.97%,而菌株Y3 的自凝集率最低分别为22.51%±1.26%和27.63%±0.53%。因此,菌株L10 与另外两株菌相比,在肠道中可能表现出更强的黏附能力。
2.3.2 三株乳酸菌对过氧化氢耐受能力分析 当乳酸菌遭受氧化剂H2O2的胁迫时,可激发氧化防御系统产生各种酶以此来减轻氧化损伤,因此H2O2耐受能力可以作为乳酸菌抗氧化活性的一个衡量指标[33]。本研究将三株乳酸菌分别接种在含有不同浓度H2O2的MRS 液体培养基中,考察这三株乳酸菌对H2O2的耐受能力,其活菌数结果见表6。

表6 三株乳酸菌对过氧化氢耐受能力比较Table 6 Comparison the ability to survive the hydrogen peroxide of the three strains of lactic acid bacteria
由表6 可知,三株菌在含有浓度为0.4、0.7、1.0 mmol/L H2O2的MRS 液体培养基中的活菌数与在未添加H2O2的培养基中的活菌数没有显著差异(P>0.05),可以看出三株菌在含有H2O2的MRS 液体培养基中的生长状况良好,说明这三株菌对H2O2均具有一定的耐受能力。
2.3.3 三株乳酸菌株抗氧化能力分析 当人体新陈代谢产生的自由基超出机体所能承受的范围时会出现氧化应激现象,造成人体衰老和引发多种与年龄相关的疾病[34-35]。因此本文对这三株乳酸菌的DPPH自由基、羟自由基以及超氧阴离子自由基清除能力进行测定,结果见图1。
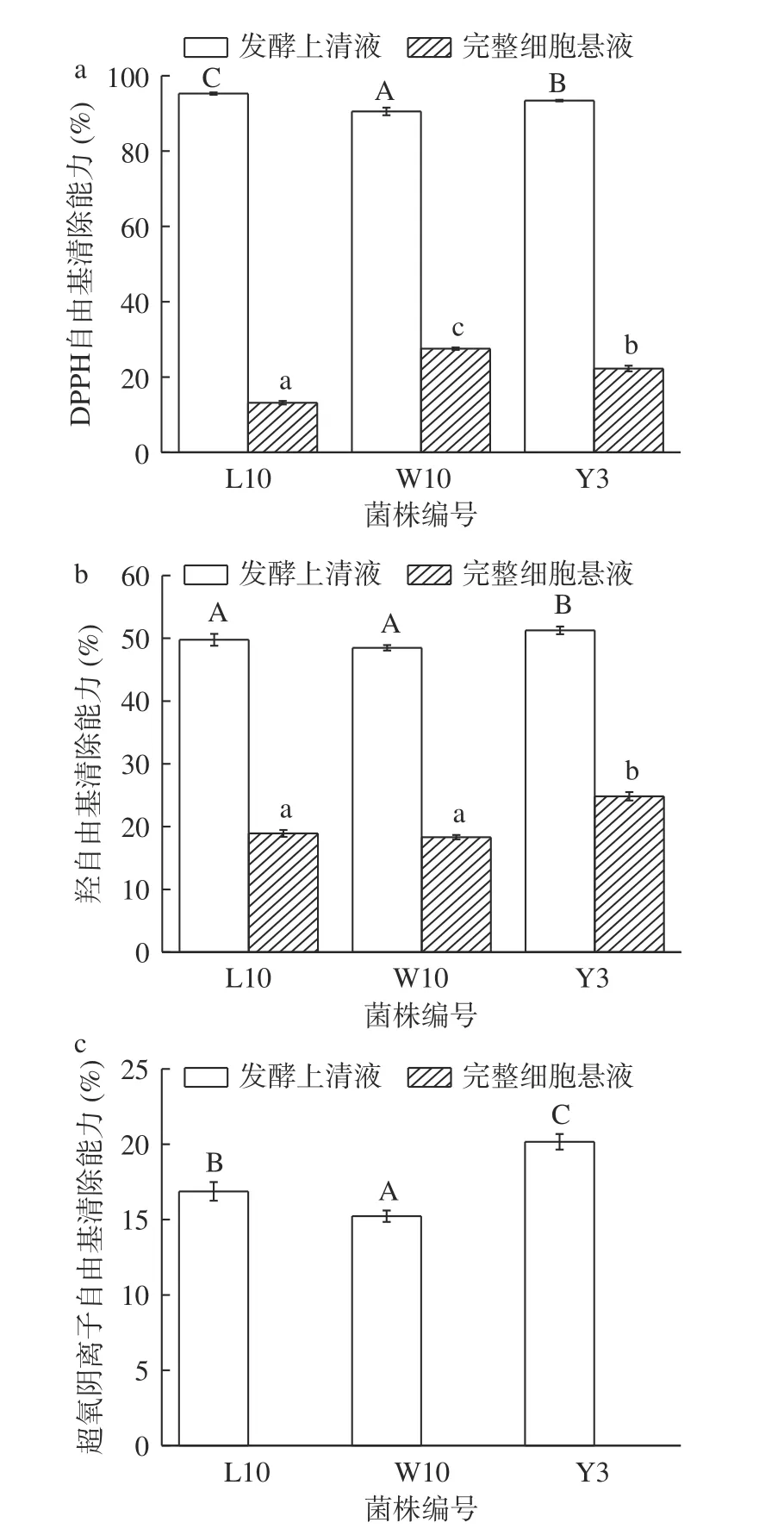
图1 三株乳酸菌DPPH 自由基(a)、羟自由基(b)和超氧阴离子自由基(c)清除能力比较Fig.1 Comparison the scavenging ability of DPPH free radical(a),hydroxyl free radical (b) and superoxide anion (c) of the three strains of lactic acid bacteria.
由图1 可知,每株菌均表现出发酵上清液与完整细胞悬液清除能力的不同,即发酵上清液清除能力高于完整细胞悬液的清除能力。菌株发酵上清液的DPPH 自由基清除率均在90%以上,菌株L10的DPPH 自由基清除率最高为95.27%±0.33%;完整细胞悬液中菌株W10 的DPPH 自由基清除率最高为27.53%±0.34%。李潇等[36]对牦牛酸奶中分离得到的乳酸菌进行抗氧化能力测定也发现菌株发酵上清液的DPPH 自由基清除能力高于完整细胞悬液。菌株Y3 发酵上清液和完整细胞悬液的羟自由基清除能力均最高,分别为51.26%±0.62%和24.83%±0.67%,菌株L10 和W10 完整细胞悬液的羟自由基清除能力差异不显著(P>0.05),可以看出同样是发酵上清液的羟自由基清除能力高于完整细胞悬液,这可能是乳酸菌的代谢分泌物中含有更多清除羟自由基的物质[37]。菌株Y3 发酵上清液的超氧阴离子自由基清除能力最高为20.16%±0.51%,且与另外两株菌差异显著(P<0.05),王曦等[38]对不同乳酸菌超氧阴离子清除能力的研究中有7 株乳酸菌的清除能力在14%~20%之间,这与本实验结果相近。
2.4 菌株的生理生化试验及分子生物学鉴定结果
2.4.1 菌株的生理生化试验结果 为进一步鉴别筛选出来的菌株L10、W10 和Y3,参照《乳酸细菌分类鉴定及实验方法》进行生理生化试验,具体试验结果见表7。
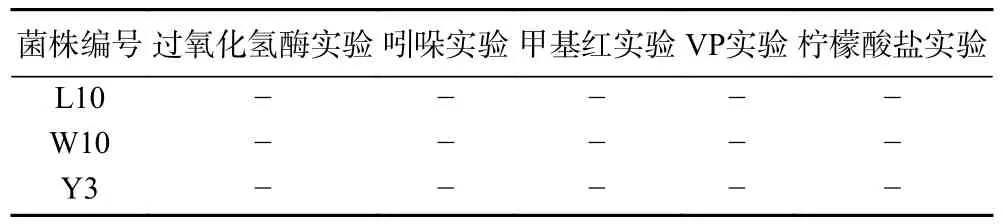
表7 三株乳酸菌的生理生化实验结果Table 7 Physiological and biochemical results of three strains of lactic acid bacteria
由表7 可知,三株菌的过氧化氢酶实验、吲哚实验、甲基红实验、VP 实验以及柠檬酸盐实验均为阴性,从中可以看出这三株菌均具有乳酸菌应有的生理生化特性,因此进一步证明这三株微生物为乳酸菌。
2.4.2 菌株的16S rDNA 和pheS基因序列比对分析
为了明确这三株乳酸菌具体的种属分类,提取三株菌的基因组DNA,利用PCR 扩增技术得到PCR 产物,纯化后进行16S rDNA 测序,并在NCBI 数据库中进行三株乳酸菌16S rDNA 序列比对分析,发现菌株L10、W10 和Y3 与植物乳植杆菌(Lactiplantibacillus plantarum)聚于一支,亲缘关系更近,因此可以初步鉴定为植物乳植杆菌(图2a)。但由于植物乳植杆菌(L.plantarum)与L.pentosus、L.argentoratensis和L.paraplantarum亲缘关系极为接近,仅通过16S rDNA 序列比对分析并不能有效区分植物乳植杆菌(L.plantarum)及近缘种,因此,又对三株菌的看家基因pheS进行了扩增并在NCBI 中进行比对分析以进一步确定这三株菌具体的分类学地位,结果如图2b。通过比对发现,菌株L10、W10 和Y3 仍与L.plantarum单独构成一个分支,亲缘关系最近,因此结合16S rDNA 和pheS序列的比对结果确认菌株L10、W10 和Y3 为植物乳植杆菌(L.plantarum)。研究表明植物乳植杆菌(L.plantarum)具有改善机体免疫力、抑制肠道致病菌和维持肠道菌群平衡等益生功能,因其高度认可的安全性和益生特性,广泛应用于食品工业化生产以提升产品品质[39-40]。
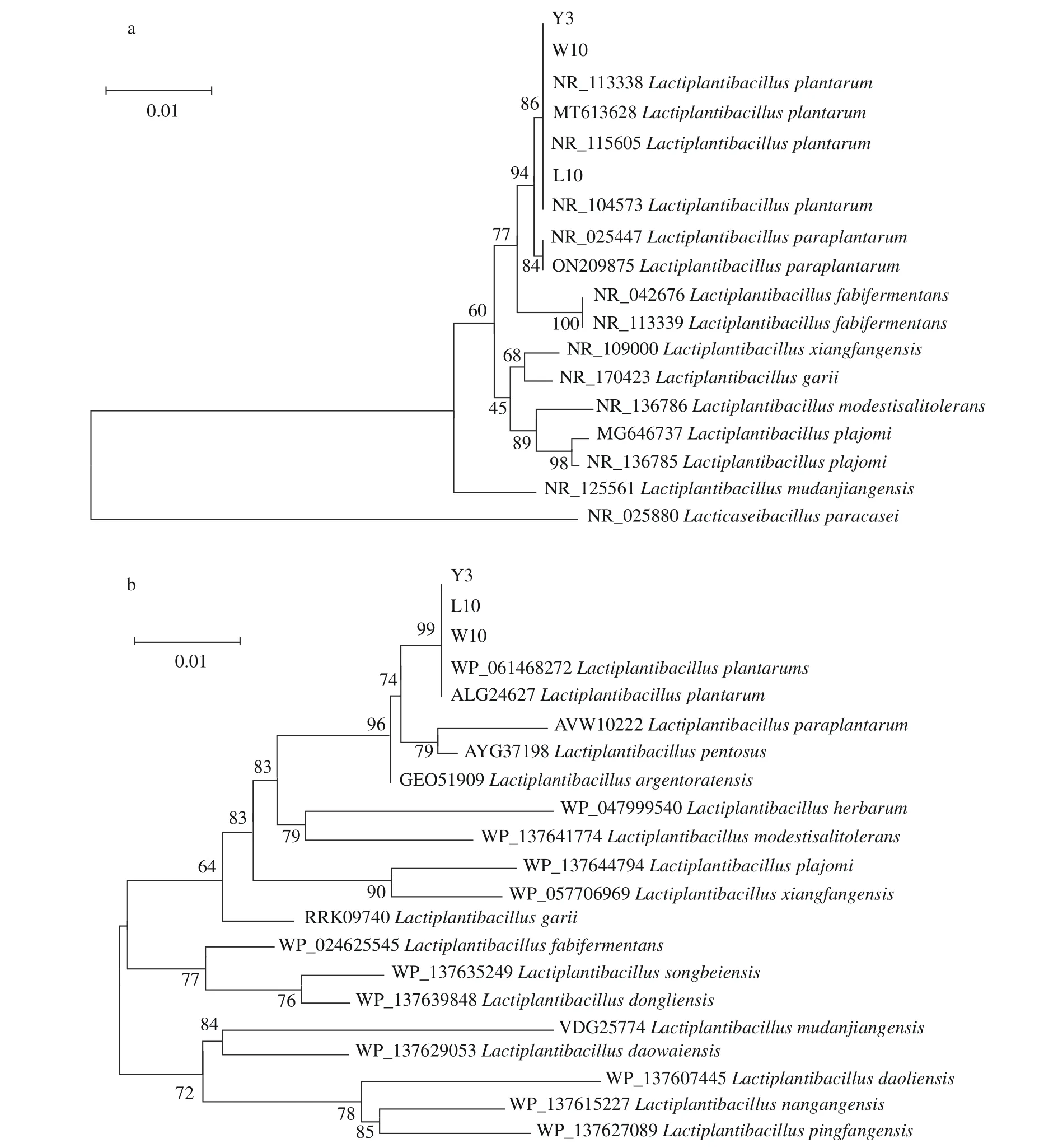
图2 菌株L10、W10 和Y3 的16S rDNA 基因序列系统发育树(a)和pheS 基因序列系统发育树(b)Fig.2 16S rDNA-based phylogenetic tree (a) and pheS-based phylogenetic tree (b) of the strains L10,W10 and Y3
3 结论
本研究从传统酸粥中分离纯化得到68 株乳酸菌,通过耐酸耐胆盐以及人工模拟胃肠液耐受试验,最终筛选得到三株性状优良的乳酸菌,并通过16S rDNA 和pheS序列比对鉴定为植物乳杆菌(L.plantarum)。菌株L10、W10 和Y3 的产酸量分别为12.11、12.58 和10.34 g/100 mL;在人工模拟胃肠液环境中的耐受能力分别为76.16%、72.86%和77.57%,相较于其他菌株表现出优良的耐受能力;对1.0 mmol/L 过氧化氢均具有耐受能力;静置9 h 后自凝集力分别为48.86%、30.14%和27.63%;同时还具备清除DPPH 自由基、羟自由基以及超氧阴离子自由基的能力。研究结果表明,菌株L10、W10 和Y3 具有产酸能力高、耐受能力强和抗氧化能力强的优良特性,因此本实验从传统酸粥中筛选得到的三株乳酸菌可作为酸粥纯种发酵的潜在益生菌。本研究未进一步探索三株乳酸菌对酸粥营养成分、风味的影响以及酸粥品质的提升,接下来应研究纯种发酵酸粥与自然发酵酸粥二者营养成分和风味的差异,并筛选其他性状优良的种属微生物与之复配以全面提升酸粥品质,也更利于酸粥的工业化生产。
